1 Introduction
Les complexes de SnX4 (X = Cl, Br et I) ont été largement étudiés par spectroscopies infrarouge, Raman et Mössbauer [1–10]. Des renseignements très précieux peuvent être déduits de l'interprétation des données spectroscopiques, notamment la connaissance de l'isomère qui s'est formé (cis ou trans) et aussi l'atome liant des ligands ambidentates. Tudela et al. [11] ont proposé des intervalles pour les valeurs du déplacement isomérique suivant l'atome donneur dans les complexes du type SnX4·2L (L étant un ligand O-, N- ou S-donneur). Le ligand SCN− est souvent N-donneur dans les complexes de métaux de la première série d'éléments de transition (Cr, Mn, Fe, Co, Ni, Cu et Zn) et S-donneur dans ceux des métaux de la deuxième et de la troisième séries d'éléments de transition (Rh, Pd, Ag, Cd, Ir, Pt, Au et Hg) [12]. D'autres facteurs, tels que l'état d'oxydation du métal, la nature des autres ligands dans le complexe et les effets stériques, influencent aussi le mode de coordination du thiocyanate [13]. Nous avons déjà étudié et publié les complexes (Me4N)2SeO4·3Me4NSnCl5 [7] (Me4N)2C2O4·2Me4NSnCl5 [8], ainsi que plusieurs complexes de SnX4 avec des oxoanions [6,9,10], et montré que l'environnement autour de l'étain était octaédrique. L'obtention de composés hybrides organiques–inorganiques a été pendant longtemps un challenge, du fait de leur structure bidimensionnelle, mais aussi à cause de leurs importantes propriétés magnétiques et électroniques [14–18]. Nous proposons dans ce qui suit l'étude par spectroscopies infrarouge, Raman et Mössbauer de quelques complexes de SnCl4 et de [SnCl5]−. Nous décrirons en plus la structure de [C6H5COCH2NH3]2[SnCl6] déterminée par diffraction des rayons X.
2 Partie expérimentale
2.1 Synthèse des complexes
Les spectres infrarouge ont été enregistrés sous forme de poudre en suspension dans le nujol, au moyen d'un spectromètre PerkinElmer 580, dans la région s'étendant de 4000 à 200 cm−1 et d'un spectromètre FTIR-Nicolet (650–50 cm−1). Les faces utilisées sont en iodure de césium ou en polyéthylène. Les spectres Raman ont été enregistrés à l'université de Saint-Jacques-de-Compostelle (Espagne) à l'aide d'un spectrophotomètre Dilors Omars 89. Les spectres Mössbauer ont été enregistrés dans un cryostat à azote liquide à la température de 80 K à l'université de Padoue (Italie). La source Ca119SnO3 est maintenue à la température ambiante et à une accélération constante. Un logiciel adéquat a été utilisé pour affiner les spectres. Les analyses élémentaires ont été effectuées au Service central d'analyses du CNRS (Vernaison, France) et à l'École de chimie de l'université de Bath (Royaume-Uni).
Tous les produits chimiques utilisés sont d'origine Merck. Les complexes (Et4N)2SnCl4(SCN)2 A, (Et4N)2SnCl5(SCN) B, (Me4N)2SnCl5(SCN) C, (Ph4P)2SnCl5Br D, (Ph4P)SnCl5OAsPh3 E et (Me4N)2SnCl5Br F sont obtenus en faisant réagir SnCl4 dissous dans le benzène avec Ph3PO, Ph3AsO et R4ZX (R = Me, Et, Ph ; Z = N, P ; X = Cl, Br, SCN) (dissous dans l'éthanol). Si on note L et L' ces bases, les équations des réactions pourront s'écrire :
| (L + L′) + SnCl4 → LSnCl4L′ |
(Et4N)2SnCl4(SCN)2 (A) [Et4NSCN (4,99 mmol) + SnCl4 (2,49 mmol)]. Analyses élémentaires : C = 33,90(33,64) H = 6,27(6,25) N = 8,79(8,76) S = 10,04(10,09) Cl = 22,29(22,69) Sn = 18,63(18,71). (Et4N)2SnCl5(SCN) (B) : [Et4NCl (1,60 mmol) + Et4NSCN (1,60 mmol)] + SnCl4 (1,60 mmol). Analyses élémentaires C = 33,13(33,47) H = 6,50(6,32) N = 6,83(6,82) Cl = 28,88(28,78) Sn = 19,31(19,44). (Me4N)2SnCl5(SCN) (C) : Me4NSCN (1,08 mmol) + SnCl4 (0,54 mmol). Analyses élémentaires : C = 21,53(21,31) H = 4,78(4,85) N = 5,58(5,65) S = 6,38(6,25) Cl = 35,39(35,44) Sn = 23,66(23,54). (Ph4P)2SnCl5Br (D) : [Ph4PBr (1,89 mmol) + Ph4PCl (1,89 mmol)] + SnCl4 (1,89 mmol). Analyses élémentaires : C = 54,64(54,75) H = 3,79(3,80) Cl = 16,84(16,98) Br = 7,59(7,46) Sn = 11,27(11,27). (Ph4P)SnCl5OAsPh3 (E) : [Ph4PCl (3,16 mmol) + OAsPh3 (3,16 mmol)] + SnCl4 (3,16 mmol). Analyses élémentaires : C = 51,84(51,58) H = 3,60(3,63) Cl = 18,25(18,33) Sn = 12,20(12,26). (Me4N)2SnCl5Br (F) : [Me4NCl (5,77 mmol) + Me4NBr (5,77 mmol)] + SnCl4 (5,77 mmol]. Analyses élémentaires : C = 18,32(18,83) H = 4,46(4,46) N = 5,54(5,45) Cl = 33,87(33,76) Br = 15,26(15,19) Sn = 22,65(22,77).[C6H5COCH2NH3]2[SnCl6] (G) : [5 mmol de C6H5COCH2NH2·HC + 5 mmol de SnCl2]. Analyses élémentaires : C = (31,92)31,80 H = (3,31) 3,31 N = (4,62) 4,63.
2.2 Diffraction des rayons X
2.2.1 Collecte des données cristallographiques
Les données cristallographiques sont reportées sur le Tableau 1. La collecte des intensités a été effectuée à la température de 150(2) K. Les intensités de diffraction ont été mesurées sur un diffractomètre Nonius Kappa CCD, équipé d'un système de refroidissement Oxford Cryostream, en utilisant la radiation Kα du molybdène. Les intensités ont été corrigées des facteurs de Lorentz, de polarisation et d'absorption. La structure a été résolue en utilisant la méthode directe (SHELXS-90) [19] et affinée par la méthode des moindres carrées basée sur F2, en utilisant le programme SHELXL-97 [20].
Données cristallographiques et méthode d'affinement
| Formule empirique | C16H20Cl6N2O2Sn |
| Poids moléculaire | 603,73 |
| Taille du cristal (mm) | 0,30 × 0,30 × 0,25 |
| Longueur d'onde (Å) | 0,71073 |
| Système cristallin | triclinique |
| Groupe d'espace | P |
| a (Å) | 7,3780(1) |
| b (Å) | 7,4480(1) |
| c (Å) | 11,5170(2) |
| α | 97,624(1) |
| β (°) | 91,481(1) |
| γ | 117,389(1) |
| V (Å3) | 554,243(14) |
| Z | 1 |
| Intervalle de thêta (°) | 3,85 à 24,97 |
| Réfections collectées/uniques | 8539/1909 [R(int) = 0,0270] |
| Facteur de confiance final [I > 2 σ(I)] | R1 = 0,0154, wR2 = 0,0388 |
| Facteur de confiance R indices (toutes les données) | R1 = 0,0156, wR2 = 0,0390 |
| Densité électronique restante (e Å−3) | 0,285 et −0,702 |
| Numéro de déposition cristallographique | 600587 |
3 Résultats et discussion
3.1 Étude par spectroscopie infrarouge et Raman
Les attributions des principales bandes des spectres infrarouge et Raman des complexes A–F sont reportées dans le Tableau 2.
Principales bandes des spectres infrarouge et Raman des complexes A–F, en cm−1
| Attributions | A | B | C | D | E | F | |
| νCN | IR | 2050 tF | 2056 tF | 2058tF | |||
| Raman | 2044 m | 2045 m | 2058 m | ||||
| νCS | IR | 787 m | 788 m | – | |||
| Raman | 785 f | 786 | 753 m | ||||
| δCN | IR | 478 f | 476 f | 480 f | |||
| νSnClna | IR | 320 tF | 320 tF | 309 tF | 283 tF | 321 F | 299 tF |
| 283 tF | 277 m | ||||||
| Raman | 315 tF | 309 tF | 307 tF | 298 tF | 313 tF | 303 tF |
a n = 4 dans A et 5 dans les complexes B–F. Abréviation : tF = très forte, m = moyenne et f = faible.
Dans le cas des complexes A, B et C, le problème est de déterminer l'atome liant du ligand SCN−. Mitchell et al. [21] ont montré que, dans les complexes du thiocyanate, νCN apparaît, généralement, vers 2050 cm−1 lorsque le ligand est N-donneur et au-dessus de 2100 cm−1 lorsqu'il est S-donneur. D'autres auteurs [22–24] ont aussi considéré la fréquence de la vibration νCS dans ces complexes pour déterminer l'atome liant du thiocyanate : 860–780 cm−1 (N-donneur) et 720–690 cm−1 (S-donneur) ; cependant, la bande correspondante est souvent faible ou recouverte par d'autres. La valeur de δNCS peut aussi être utilisée pour voir si le thiocyanate est N- ou S-donneur ; la bande correspondante apparaît vers 408 cm−1 (N-donneur) et vers 420 cm−1 (S-donneur) [23,24]. Il existe aussi d'autres travaux sur cette question [25–28], mais il est clair qu'une combinaison des différentes propositions permet d'aboutir à des conclusions plus fiables. Dans le cas des complexes que nous étudions, les valeurs de νCN (2050 cm−1 (A), 2056 cm−1 (B) et 2058 cm−1 (C)), de νCS (787 cm−1 (A) et 788 cm−1 (B)) et δCN (478 cm−1 (A), 476 cm−1 (B) et 480 cm−1 (C)) montrent que le thiocyanate est N-donneur si on s'appuie sur les travaux cités ci-dessus.
Dans le cas du complexe (Et4N)2SnCl4(SCN)2 (A), l'apparition d'une bande forte à 315 cm−1 sur le spectre Raman de A, due à la vibration de valence d'espèce A1 de SnCl4, montre que ce groupement est cis-coordiné (dans le cas d'une trans-coordination, les deux vibrations d'espèce A1g et B1g sont toutes actives en Raman) [6]. Dans les complexes B–F νSnCl5− apparaît sous la forme d'une ou de plusieurs bandes, le groupe ponctuel de symétrie du groupement SnCl5− est C4v, tandis que l'environnement autour de l'étain dans ces complexes est octaédrique.
3.2 Étude par spectroscopie Mössbauer
Les spectres Mössbauer de tous les complexes présentent un singulet. Les principaux paramètres Mössbauer des composés A–G sont reportés sur le Tableau 3. Dans ces complexes, comme dans beaucoup de complexes de SnX4, on note une absence d'éclatement quadripolaire [29,30]. Dans le cas du complexe A, l'absence d'éclatement quadripolaire permet de conclure à une cis-coordination des groupements SnX4 (si on se réfère aux travaux de Tudela [31]), ce qui est conforme aux résultats des spectroscopies infrarouge et Raman.
Principaux paramètres Mössbauer des complexes A–G, en mm−1
| Composés | IS | QS | Γ | A% |
| A | 0,27 | – | 0,86 | 100 |
| B | 0,35 | – | 0,87 | 100 |
| C | 0,36 | – | 0,85 | 100 |
| D | 0,63 | – | 0,92 | 100 |
| E | 0,41 | – | 0,82 | 100 |
| F | 0,57 | – | 0,92 | 100 |
| G | 0,49 | – | 0,88 | 100 |
Les valeurs du déplacement isomérique de l'anion [SnCl6]2− (stabilisé par différents cations) varient entre 0,48 et 0,52 mm s−1 [29]. Les valeurs du déplacement isomérique dans les complexes A, B et C (0,27, 0,35 et 0,36 mm s−1, respectivement) sont en accord avec celles proposées par Tudela et col. [11] dans le cas des complexes de SnCl4 avec des ligands N-donneur. La diminution du déplacement isomérique dans A, B et C par rapport à ceux des complexes de [SnCl6]2− s'explique par le fait qu'un atome de chlore de SnCl62− est substitué par un ligand SCN− électroattracteur, ce qui entraîne nécessairement une diminution du déplacement isomérique.
Dans le cas du complexe E, pour des raisons similaires, on note une diminution du déplacement isomérique. En revanche, l'augmentation du déplacement isomérique dans les complexes D et F s'explique par une substitution d'un chlore de [SnCl6]2− par un atome de brome moins électronégatif. Les structures que nous proposons pour ces complexes et qui rendent comptent des données infrarouge, Raman et Mössbauer sont représentées sur les Fig. 1

Structures des complexes A–F.
3.3 Étude cristallographique du complexe [C6H5COCH2NH3]2[SnCl6] (G).
La structure de [C6H5COCH2NH3]2[SnCl6] et le schéma de numérotation cristallographique utilisé dans le texte et les tables sont représentés sur la Fig. 2. Les principaux angles et distances interatomiques sont reportés sur le Tableau 4. L'unité asymétrique contient deux cations [C6H5COCH2NH3]+ et un anion [SnCl6]2−. Cette structure est constituée d'ions hexachlorostannate connectés par le biais de liaisons hydrogène. Les liaisons Sn–Cl sont deux à deux identiques [Sn–Cl(1) = Sn–Cl(1)#1 = 2,4386(4) Å; Sn–Cl(2) = Sn–Cl(2)#1 = 2,4467(4) Å; Sn–Cl(3) = Sn–Cl(3)#1 = 2,4107(4) Å]. Les angles de liaison sont de l'ordre de 180° entre les liaisons axiales : [Cl(1)#1–Sn–Cl(1) 180,00(3)° ; Cl(2)#1–Sn–Cl(2) 180,000(19)° ; Cl(3)#1–Sn–Cl(3) 180,000(11)°] et 90° entre les liaisons équatoriales successives, et aussi entre une liaison équatoriale et une liaison axiale – parmi de tels angles, on peut citer : Cl(1)–Sn–Cl(2) 91,071(12) ; Cl(1)–Sn–Cl(3) 89,722(13) ; Cl(2)–Sn–Cl(3) 89,970(13).
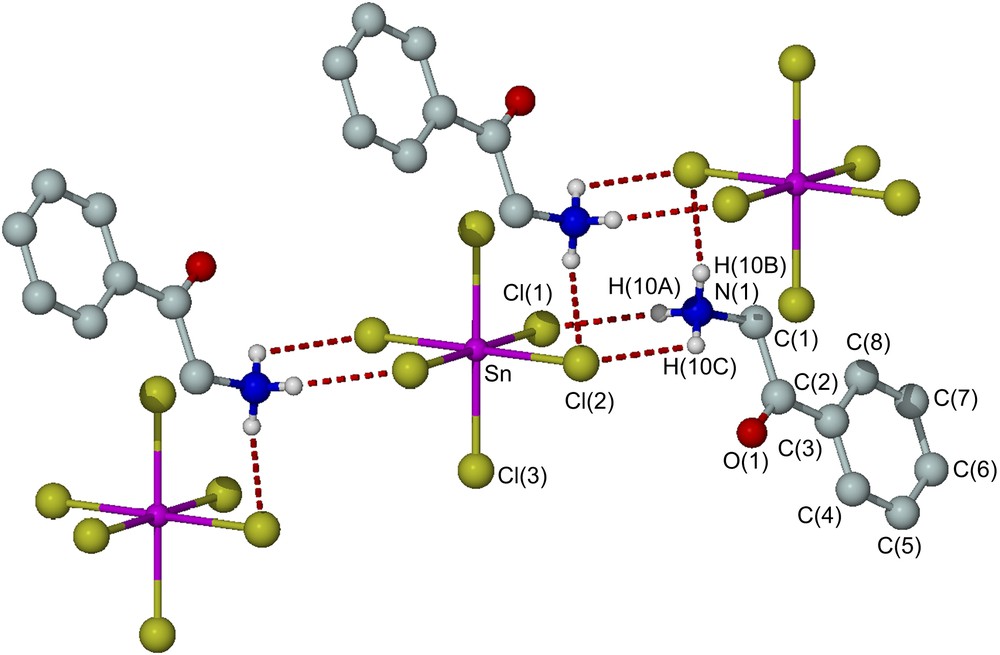
Structure de [C6H5COCH2NH3]2[SnCl6], montrant le schéma de numérotation utilisé dans le texte et les tables.
Longueur de liaison et angles dans [C6H5COCH2NH3]2[SnCl6]
| Longueur de liaison (Å) | Angles (°) |
| Sn–Cl(3)#1 2,4107(4) | Cl(3)#1–Sn–Cl(3) 180,000(11) |
| Sn–Cl(3) 2,4107(4) | Cl(3)#1–Sn–Cl(1)#1 89,722(13) |
| Sn–Cl(1)#1 2,4386(4) | Cl(3)–Sn–Cl(1)#1 90,278(13) |
| Sn–Cl(1) 2,4386(4) | Cl(3)#1–Sn–Cl(1) 90,278(13) |
| Sn–Cl(2) 2,4467(4) | Cl(3)–Sn–Cl(1) 89,722(13) |
| Sn–Cl(2)#1 2,4467(4) | Cl(1)#1–Sn–Cl(1) 180,00(3) |
| O(1)–C(2) 1,215(2) | Cl(3)#1–Sn–Cl(2) 90,030(13) |
| N(1)–C(1) 1,483(2) | Cl(3)–Sn–Cl(2) 89,970(13) |
| N(1)–H(10A) 0,83(3) | Cl(1)#1–Sn–Cl(2) 88,929(13) |
| N(1)–H(10B) 0,86(3) | Cl(1)–Sn–Cl(2) 91,071(12) |
| N(1)–H(10C) 0,87(3) | Cl(3)#1–Sn–Cl(2)#1 89,970(13) |
| C(1)–C(2) 1,524(2) | Cl(3)–Sn–Cl(2)#1 90,030(13) |
| C(2)–C(3) 1,478(2) | Cl(1)#1–Sn–Cl(2)#1 91,071(13) |
| C(3)–C(8) 1,394(2) | Cl(1)–Sn–Cl(2)#1 88,929(13) |
| C(3)–C(4) 1,399(2) | Cl(2)–Sn–Cl(2)#1 180,000(19) |
| C(4)–C(5) 1,381(2) | |
| C(5)–C(6) 1,386(2) | |
| C(6)–C(7) 1,388(2) | |
| C(7)–C(8) 1,386(2) |
Les quatre atomes de chlore coplanaires de l'ion [SnCl6]2−, à savoir Cl(1), Cl(1)#1, Cl(2) et Cl(2)#1, sont liés par de très fortes liaisons hydrogène, et les valeurs des distances Cl⋯H sont : [Cl(1)–H(10A) = Cl(1)#1–H(10A) = 2,486 Å et Cl(2)–H(10B) = Cl(2)#1–H(10B) = 2,486 Å]. L'atome d'oxygène de l'ion [C6H5COCH2NH3]+ n'est pas coordiné à l'atome d'étain ; cependant, on peut considérer qu'il est lié par liaison hydrogène à H(10C) [O(1)–H(10C) = 2,093 Å]. Les différents motifs constitués de molécules de [C6H5COCH2NH3]2[SnCl6] sont liés par un pont hydrogène de type N–H(10C)⋯Cl(2), la distance entre H(10C) et Cl(2)) étant de 2,730 Å, ce qui permet de dire que la structure globale de la molécule est constituée de molécules de [C6H5COCH2NH3]2[SnCl6] connectées entre elles par des ponts hydrogène.
4 Conclusion
Cette étude a permis de synthétiser de nouveaux complexes de SnCl4, SnCl5− et de SnCl62−avec des bases de Lewis ambidentates ayant deux sites donneurs (azote et soufre) et, sur la base des spectroscopies infrarouge, Raman et Mössbauer, nous avons pu montrer que l'atome donneur de la base de Lewis SCN− est l'azote. Nous avons, en outre, déterminé par diffraction des rayons X la structure de [C6H5COCH2NH3]2[SnCl6] et avons montré qu'elle est une bande infinie contenant des anions SnCl62− octaédriques liés entre eux par des liaisons hydrogène entre le chlore et l'hydrogène de l'ion ammonium stabilisateur.
Remerciements
Nous remercions le Pr. M. Vidali (université de Padoue, Italie) pour avoir enregistré pour nous les spectres infrarouge.


