1 Introduction
Les molécules renfermant le motif « oxadiazolidinone » représentent une famille de composés hétérocycliques doués d'activités biologiques [1–4]. Les oxadiazolidin-5-ones 1 sont connues depuis 1890, à la suite des travaux de E. Beckmann [5], qui a décrit la synthèse du premier exemple de ce type d'hétérocycle en faisant réagir un oxyde d'imine avec l'isocyanate de phényle. L'examen de la littérature [6–8] nous a permis de constater que la méthode mise au point par Beckmann est la plus utilisée pour accéder aux oxadiazolidin-5-ones. La deuxième méthode de synthèse de ces composés, signalée dans la littérature, est celle d'Agawa et al., [9] utilisant les oxaziridines comme précurseurs.
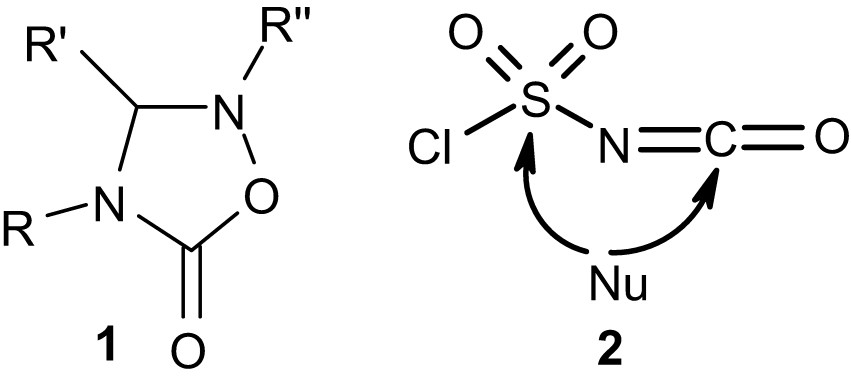
Dans ce travail, nous décrivons la réaction des N-oxydes de 2-hydroxybenzylidènealkylamines avec le CSI, qui conduit à la formation de nouveaux composés hétérocycliques renfermant le motif « oxadiazolidinone ».
2 Resultats et discussion
Dans un premier temps, nous avons préparé une série d'imines du type 3 dérivant d'aldéhydes salicyliques, par condensation de ces derniers avec des amines primaires. L'oxydation des imines 3 par l'intermédiaire du système benzonitrile–eau oxygénée (50% en masse) conduit aux N-oxydes d'imines correspondantes 4 (Schéma 1). Ce système oxydant a été utilisé pour convertir les imines en oxaziridines [13,14], mais il s'est avéré que l'oxydation des N-arylidènealkylamines ayant un groupement hydroxyle en ortho du cycle benzénique par le système PhCN / H2O2 aboutit à la formation des nitrones correspondant. Au cours de cette oxydation, nous n'avons pas observé de formation d'oxaziridines. D'après la littérature [15], l'oxydation de la 2-hydroxybenzylidènetertiobutylamine 3a par l'acide méta-chloroperbenzoïque conduit à la formation de la nitrone correspondante avec un rendement de 40%, après passage par un intermédiaire oxaziridine instable. Par conséquent, nous pensons que la formation des nitrones 4 peut être attribuée à la possibilité d'une liaison hydrogène intramoléculaire dans les oxaziridines intermédiaires (contrôle cinétique) ou dans les hydroxy-nitrones 4a–e (contrôle thermodynamique).
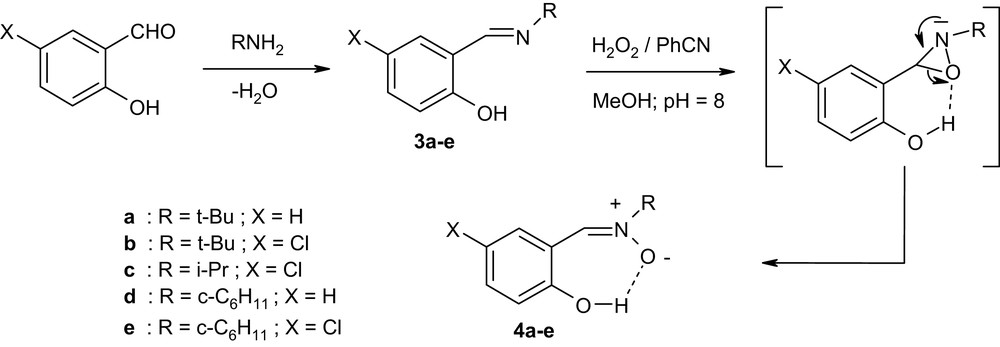
Synthèse des imines et des nitrones.
Au cours de ce travail, les nitrones 4a–e ont été obtenues avec des rendements compris entre 42 et 56%. Nous avons constaté que l'utilisation d'une solution de H2O2 moins concentrée (30% en masse) conduit à la formation des nitrones correspondantes, avec des rendements faibles (10–35%).
Dans un second temps, nous avons fait réagir les oxydes d'imines 4a–e avec le CSI. Au cours de la réaction, il y a condensation du groupement hydroxyle avec le groupement chlorosulfonyle et cycloaddition du dipôle 1,3 de l'oxyde d'imine avec la double liaison CN de l'hétérocumulène, aboutissant à la formation d'un nouveau système hétérocyclique renfermant le motif « oxadiazolidinone » : les 5,5-dioxydes de 1-alkyl-1,10b-dihydro[1,2,4]oxadiazolo[4,3-c][1,2,3]benzoxathiazin-3-ones 5a–e (Schéma 2). Les rendements de cette réaction sont compris entre 39 et 52%.
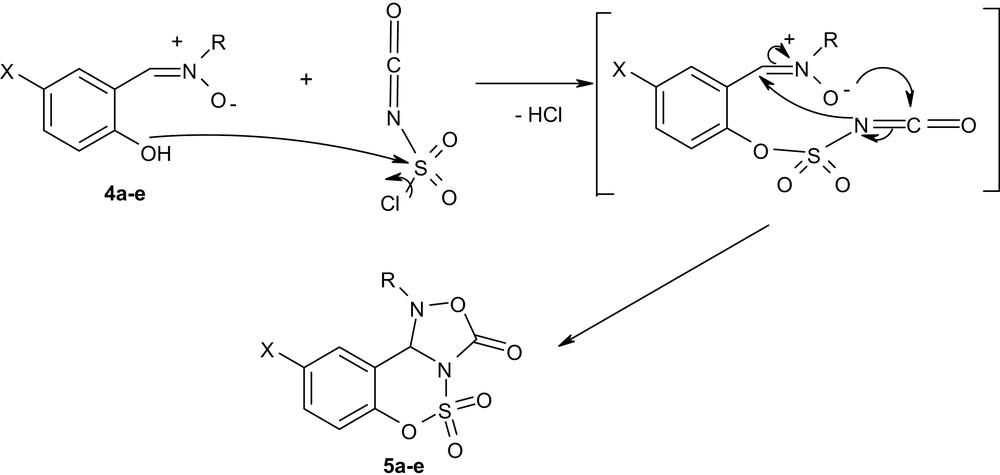
Réaction du CSI avec les nitrones 4a–e dérivant d'aldéhydes salicyliques.
Au cours de la réaction, l'addition du CSI sur l'oxyde d'imine est réalisée à une température supérieure à 100 °C, afin d'éviter la formation de carboxysulfonamide (carbamate), susceptible de survenir par cette réaction à la température ambiante (Schéma 3) [11,16]. Les produits 5a–e sont obtenus avec des rendements compris entre 39 et 52%, après purification par recristallisation dans un mélange toluène/éther de pétrole (40:60). Nous avons constaté que ces nouveaux composés hétérocycliques sont relativement instables à l'air libre et à la température ambiante. En effet, une dégradation de ces composés a été observée après une semaine dans les conditions citées ci-dessus. Ces produits peuvent être conservés à froid (+4 °C) sous atmosphère d'argon pendant quelques mois.
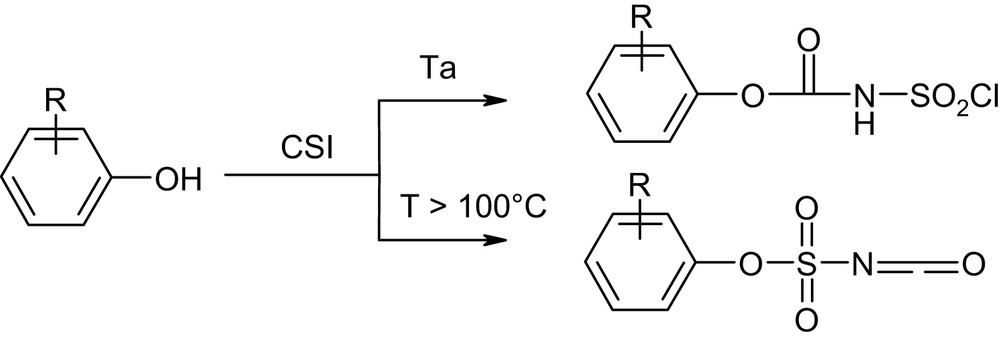
Réactivité du CSI avec les phénols [16].
3 Conclusion
Au cours de ce travail, nous avons étudié l'action de l'isocyanate de chlorosulfonyle sur les N-oxydes des 2-hydroxybenzylidènealkylamines. La réaction conduit à la formation d'un nouveau système hétérocyclique renfermant le motif « oxadiazolidinone ». Les structures proposées ont été confirmées par RMN 1H et 13C, par IR, par spectrométrie de masse et par analyse élémentaire. Dans ce travail, les nouveaux hétérocycles 5a–e sont préparés sous forme de mélanges racémiques. Comme suite logique de ce travail, nous comptons, d'une part, effectuer des essais de dédoublement de ces mélanges racémiques en utilisant des acides chiraux et, d'autre part, réaliser des synthèses asymétriques d'oxadiazolidinones au départ de substrats optiquement purs.
4 Partie experimentale
Les points de fusion ont été déterminés, en capillaire, sur un appareil Büchi SMP-20. Les spectres RMN en été enregistrés sur un appareil Bruker AC-300 (1H à 300 MHz et 13C à 75 MHz). Les spectres IR ont été enregistrés sur un appareil BIO-RAD FTS-6000 dans le KBr ou en solution dans CCl4. Les spectres de masse ont été enregistrés sur un appareil Hewlett Packard 5897, en mode ionisation chimique avec l'ammoniac (DCI). Les analyses éléméntaire ont été effectuées par le service de microanalyse de l'Institut national de recherche et d'analyses physico-chimiques de Tunis. Les imines 3a–e et la nitrone 4a ont été décrit dans la littérature : 3a [15], 3b,c [17], 3d [18], 3e [19], 4a [15].
4.1 Synthèse des nitrones
Dans un ballon monocol de 100 mL, on introduit 50 mL de méthanol, 10 mmol de 2-hydroxybenzylidènealkylamine, 20 mmol de benzonitrile, 1 g de NaHCO3. On ajoute ensuite goutte à goutte 30 mmol de H2O2 (50% en masse). Le mélange est agité à la température ambiante pendant 48 h, puis lavé avec 500 mL d'eau, et extrait avec 3 × 50 mL de chloroforme. Les phases organiques réunies sont séchées sur MgSO4 anhydre, filtrées sur papier filtre, et le chloroforme est chassé à l'évaporateur rotatif. Le résidu obtenu est purifié par chromatographie sur colonne de silice (éluant : cyclohexane/acétate d'éthyle, 70:30).
4.1.1 N-Oxyde de 5-chloro-2-hydroxybenzylidènetertiobutylamine : 4b
Cristaux jaunes. Rdt = 55%. P.F. 72–74 °C (éther de pétrole). RMN 1H (300 MHz, CDCl3) : δ (ppm) : 1,64 (s, t-Bu), 6,92 (d, 1H, Ar, J = 9,0 Hz), 7,09 (d, 1H, Ar, J = 2,4 Hz), 7,30 (dd, 1H, Ar), 7,73 (s, 1H, CHN), 12,38 (s, 1H, OH). RMN 13C (75 MHz, CDCl3) : δ (ppm) : 28,69, 71,03, 118,66, 122,08, 123,82, 131,24, 133,46, 136,29 (C–OH), 158,74 (CHN(O)). Analyse élémentaire du C11H14ClNO2 (227.69) : % calculé C 58.03 ; H 6.20 ; N 6.15 ; % exp. C 57.87 ; H 6.10 ; N 6.12.
4.1.2 N-Oxyde de 5-chloro-2-hdroxybenzylidèneisopropylamine : 4c
Cristaux jaunes. Rdt = 42%. P.F. 101–103 °C (éther de pétrole). RMN 1H (300 MHz, CDCl3) : δ (ppm) : 1,51 (d, 6H, 2CH3 i-Pr, J = 6.6 Hz), 4.29 (h, 1H, CH i-Pr), 6,88 (d, 1H, Ar, J = 8.7 Hz), 7,03 (d, 1H, Ar, J = 2.7 Hz), 7,28 (m, 1H, Ar), 7,53 (s, 1H, CHN(O)), 12,31 (s, 1H, OH). RMN 13C (75 MHz, CDCl3) : δ (ppm) : 21.34, 67.14, 118.32, 121.95, 123.91, 131.05, 133.83, 137.66 (C–OH), 158.62 (CHN(O)). Analyse élémentaire du C10H12ClNO2 (213.67) : % calculé C 56.21 ; H 5.66 ; N 6.56 ; % exp. C 56.12 ; H 5.61 ; N 6.59.
4.1.3 N-Oxyde de 2-hydroxybenzylidènecyclohexylamine : 4d
Cristaux jaunes. Rdt = 43%. P.F. 89–91 °C (éther de pétrole). RMN 1H (300 MHz, CDCl3) : δ (ppm) : 1,20–2,20 (m, 10H,CH2 cyclohexyle), 3,87–3,98 (m, 1H, CH cyclohexyle), 6,81–6,89 (m, 1H, Ar,), 6,97 (d, 1H, Ar, J = 8,1 Hz), 7,08 (d, 1H, Ar, J = 7,0 Hz), 7,34–7,43 (m, 1H, Ar), 7,59 (s, 1H, CHN(O)), 12,49 (s, 1H, C–OH). RMN 13C (75 MHz, CDCl3) : δ (ppm) : 24,82, 31,15, 73,71, 116,76, 118,73, 120,00, 131,87, 133,55, 138,60 (C–OH), 159,66 (CHN(O)). Analyse élémentaire du C13H17NO2 (219.29) : % calculé C 71.21 ; H 7.81 ; N 6.39 ; % exp. C 71.13 ; H 7.87 ; N 6.43.
4.1.4 N-Oxyde de 5-chloro-2-hydroxybenzylidènecyclohexylamine : 4e
Cristaux jaunes. Rdt = 45%. P.F. 110–112 °C (éther de pétrole). RMN 1H (300 MHz, CDCl3) : δ (ppm) : 1,20–2,24 (m, 10H,CH2 cyclohexyle), 3,85–3,97 (m, 1H, CH cyclohexyle), 6,97 (d, 1H, Ar, J = 8,7 Hz), 7,20 (d, 1H, Ar, J = 2,4 Hz), 7,37 (m, 1H, Ar), 7,82 (s, 1H, CHN), 12,35 (s, 1H, C–OH). RMN 13C (75 MHz, CDCl3) : δ (ppm) : 24,85, 32,06, 74,70, 116.98, 120.94, 123.50, 131.33, 133.83, 138.12 (C–OH), 159.06 (CHN(O)). Analyse élémentaire du C13H16ClNO2 (253.73) : % calculé C 61.54 ; H 6.36 ; N 5.52 ; % exp. C 61.16 ; H 6.25 ; N 5.31.
4.3 Synthèse des 5,5-dioxydes de 1-alkyl-1,10b-dihydro [1,2,4]oxadiazolo[4,3-c]benzoxathiazin-3-ones
Dans un ballon bicol de 50 mL, surmonté d'un réfrigérant et d'une ampoule à brome et placé sous argon, sont dissoutes 5 mmol d'oxyde de 2-hydroxybenzylidènealkylamine dans 20 mL de toluène anhydre, fraîchement distillé sur sodium. Le mélange est porté au reflux du toluène tout en agitant, et une solution de 5 mmol de CSI dans 5 mL de toluène est ajoutée goutte à goutte via l'ampoule à brome. Après une heure, le mélange est refroidi jusqu'à la température ambiante et le produit est cristallisé à 0 °C après addition de 50 mL d'éther de pétrole. Le produit solide obtenu est filtré sur verre fritté puis recristallisé dans un mélange éther de pétrole/toluène (60:40).
4.2.1 5,5-Dioxyde de 1-tert-butyl-1,10b-dihydro[1,2,4]oxadiazolo[4,3-c]benzoxathiazin-3-one : 5a
Cristaux blancs. Rdt = 44%. P.F. 136–139 °C (éther de pétrole/toluène, 60:40). RMN 1H (300 MHz, CDCl3) : δ (ppm) : 1,40 (s, 9H), 6,29 (s, 1H), 7,15 (d, 1H, Ar, J = 8,3 Hz), 7,35–7,54 (m, 3H, Ar). RMN 13C (75 MHz, CDCl3) : δ (ppm) : 25,33, 62,51, 75,11, 118,62, 119,33, 126,64, 127,52, 131,57, 150,06, 150,74. IR (KBr, cm−1) : νCO = 1802. SM (DCI / NH3) : m/z = 316 (M + NH4+), 299 (M + H+). Analyse élémentaire du C13H16N2O4S (296.35) : % calculé C 52.69 ; H 5.44 ; N 9.45 ; % exp. C 52.25 ; H 5.32 ; N 9.22.
4.2.2 5,5-Dioxyde de 9-chloro-1-tertiobutyl-1,10b-dihydro [1,2,4]oxadiazolo[4,3-c]benzoxathiazin-3-one : 5b
Cristaux blancs. Rdt = 39%. P.F. 113–116 °C (éther de pétrole/toluène, 60 : 40). RMN 1H (300 MHz, CDCl3) : δ (ppm) : 1,34 (s, 9H), 6,18 (s, 1H), 6,95 (d, 1H, Ar, J = 8,7 Hz), 7,12 (d, 1H, H-e, J = 2,4 Hz), 7,29–7,33 (dd, 1H, Ar). RMN 13C (75 MHz, CDCl3) : δ (ppm) : 25,81, 63,21, 75,22, 120,61, 121,39, 127,93, 130,34, 132,25, 148,97, 150,88. IR (KBr, cm−1) : νCO = 1795. SM (DCI/NH3) : m/z = 350 (M + NH4+), 333 (M + H+). Analyse élémentaire du C13H15ClN2O4S (330.79) : % calculé C 47.20 ; H 4.57 ; N 8.47 ; % exp. C 46.72 ; H 4.66 ; N 8.62.
4.2.3 5,5-Dioxyde de 9-chloro-1-isopropyl-1,10b-dihydro [1,2,4]oxadiazolo[4,3-c]benzoxathiazin-3-one : 5c
Cristaux blancs. Rdt = 39%. P.F. 120–122 °C (éther de pétrole/toluène, 60:40). RMN 1H (300 MHz, CDCl3) : δ (ppm) : 1,14 (d, 3H, J = 6,4 Hz), 1,27 (d, 3H, J = 6,4 Hz), 3.42 (h, 1H, H-c, J = 6,4 Hz), 6.07 (s, 1H), 6,90 (d, 1H, Ar, J = 8,7 Hz), 7,10 (d, 1H, H-e, J = 2,4 Hz), 7,23–7,29 (dd, 1H, Ar). RMN 13C (75 MHz, CDCl3) : δ (ppm) : 17.87, 18.32, 57.60, 74,35, 117,87, 120,38, 125,73, 130,42, 133,10, 147,43, 150,11. IR (KBr, cm−1) : νCO = 1783. SM (DCI/NH3) : m/z = 336 (M + NH4+), 319 (M + H+). Analyse élémentaire du C12H13ClN2O4S (316.77) : % calculé C 45.50 ; H 4.14 ; N 8.84 ; % exp. C 45.63 ; H 4.22 ; N 8.57.
4.2.4 5,5-Dioxyde de 1-cyclohexyl-1,10b-dihydro [1,2,4]oxadiazolo[4,3-c]benzoxathiazin-3-one : 5d
Cristaux blancs. Rdt = 52%. P.F. 141–143 °C (éther de pétrole/toluène, 60:40). RMN 1H (300 MHz, CDCl3) : δ (ppm) : 1,20–2,20 (m, 10H, cyclohexyle), 3,26–3,36 (m, 1H), 6,28 (s, 1H,), 7,15 (d, 1H, Ar, J = 8,1 Hz), 7,37–7,55 (m, 3H, Ar). RMN 13C (75 MHz, CDCl3) : δ (ppm) : 23,92, 24,08, 29,15, 29,73, 30,79, 65,06, 77,23, 118,62, 118,72, 126,60, 127,53, 131,66, 150,17, 150,65. IR (KBr, cm−1) : νCO = 1787. SM (DCI/NH3) : m/z = 342 (M + NH4+), 325 (M + H+). Analyse élémentaire du C15H18N2O4S (322.39) : % calculé C 55.89 ; H 5.63 ; N 8.69 ; % exp. C 56.02 ; H 5.69 ; N 8.48.
4.2.5 5,5-Dioxyde de 9-chloro-1-cyclohexyl-1,10b-dihydro [1,2,4]oxadiazolo[4,3-c]benzoxathiazin-3-one : 5e
Cristaux blancs. Rdt = 50%. P.F. 121–124 °C (éther de pétrole/toluène, 60:40). RMN 1H (300 MHz, CDCl3) : δ (ppm) : 1,20–2,24 (m, 10H, cyclohexyle), 3,28–3,35 (m, 1H), 6,32 (s, 1H,), 7,01 (d, 1H, Ar, J = 8,8 Hz), 7,10 (d, 1H, Ar, J = 2,4 Hz), 7,25–7,38 (dd, 1H, Ar). RMN 13C (75 MHz, CDCl3) : δ (ppm) : 24,18 24,36, 29,14, 29,69, 31,90, 64,78, 76,33, 119,24, 121,06, 127,80, 129,91, 132,00, 149,27, 150,98. IR (KBr, cm−1) : νCO = 1790. SM (DCI/NH3) : m/z = 376 (M + NH4+), 359 (M + H+). Analyse élémentaire du C15H17ClN2O4S (356.83) : % calculé C 50.49 ; H 4.80 ; N 7.85 ; % exp. C 49.85 ; H 4.38 ; N 7.71.
Remerciements
Les auteurs remercient la DGRSRT (direction générale de la Recherche scientifique et de la Rénovation technologique) de Tunisie pour son soutien et son aide.


