1 Introduction
L’intérêt des 1,5-benzodiazépines, qui constituent une classe hétérocyclique importante, se retrouve non seulement dans leurs actions thérapeutiques en tant que drogues, anti-anxiété, antidépressive, sédative, analgésique et hypnotique [1–4] mais ces composés sont aussi utilisés comme pigments dans les industries des fibres acryliques [5]. De plus, l’association de motifs multiples par voie synthétique tels que : oxadiazolo-, oxazino- et furano-benzodiazépine [6–9] les laissent toujours d’actualité dans des domaines d’applications aussi différents que variés. Il est important de préciser que la méthode générale de préparation des 1,5-benzodiazépines consiste en une condensation des 1,2-phénylènediamines sur des molécules carbonylées : α,β-insaturées ou β-halogéno-cétones [10].
Dans nos travaux antérieurs, l’acide déhydroacétique (DHA) nous a permis d’accéder aux structures 1,4- et 1,5-benzodiazépines [11–15].
Cet article présente la synthèse de quelques dérivés benzodiazépines originaux 4 à partir du DHA hydrogéné en C5-C6 2 [11], des 1,2-phénylènediamines et d’aldéhydes aromatiques.
Sur la base de ce résultat, nous avons interprété l’effet électronique de l’hydrogénation du DHA en C5-C6, un précurseur potentiel de nouvelles structures hétérocycliques dont une structure énaminone originale 5 que nous avons réussi à isoler.
2 Résultats et discussions
L’action des 1,2-diamines aromatiques substituées sur le DHA hydrogéné en C5-C6 2 forme l’imine correspondante 3. Cette lactone 2, peu citée dans la littérature, est obtenue par hydrogénation catalytique du DHA 1, produit commercial à bon marché.
L’intermédiaire 3, en présence d’aldéhydes aromatiques et d’une quantité catalytique d’acide sulfurique concentrée, dans l’éthanol donne plus ou moins facilement les benzodiazépines de structure 4 (Fig. 1).

L’évolution de ces réactions a été suivie par chromatographie sur couche mince.
Cette réaction d’hétérocyclisation est intéressante car elle donne lieu, dans chacun des cas étudiés, à des rendements satisfaisants qui varient selon la nature électronique des substituants. Les différentes conditions opératoires sont rapportées dans la partie expérimentale.
Les résultats expérimentaux obtenus et confirmés par les différentes techniques de caractérisation s’interprètent, en particulier, par l’influence des effets électroniques des différents groupements existant dans les intermédiaires réactionnels.
Les spectres de RMN1H et de RMN13C relatifs aux produits obtenus ont permis de confirmer la structure proposée 4 sur la base du bon accord des valeurs des déplacements chimiques des différents protons et des atomes de carbone. On peut notamment faire les remarques suivantes :
- • absence, sur les spectres de RMN du proton, du signal attribuable aux protons de méthyle CH3 de l’acétimine habituellement observé, aux environs de 2,65 ppm, dans la structure imine 3 ;
- • apparition d’un signal attribuable au proton de la fonction amine NH en position 1 dans 4 ;
- • la présence de deux nouveaux signaux aux environs de 4,5 ppm et de 3,8 ppm sous forme de multiplets attribuables respectivement aux protons du carbone asymétrique CH en 2 et de CH2 en 3 du cycle benzodiazépine ;
- • en RMN13C, la disparition du pic affecté au carbone de CH3 de l’imine caractérisant les structures di-imines et l’apparition d’un nouveau pic compatible avec le carbone de CH2 en position 3 du cycle heptagonal, diazépine.
Par ailleurs, la structure 4 se présente sous la forme de deux couples de diastéréo-isomères. Cette constatation est faite sans équivoque sur les spectres de RMN1H particulièrement dans la zone des déplacements chimiques des CH3 et CH en position 6 et 2 successivement dans les cycles pyronique et diazépine, pour lesquels on observe les pics caractéristiques dans un rapport d’intégration 90/10.
L’étude par spectrométrie de masse des composés 4 conforte les résultats de RMN1H et RMN13C et confirme les conclusions des études de fragmentations des benzodiazépines et diazépines [16].
Les spectres de masse nous ont permis d’observer le pic de l’ion moléculaire M+ (impact électronique) ou le pic moléculaire M + 18 dû à l’adduit (M + NH4)+, dans le cas de l’ionisation chimique.
Les protons du groupement CH3 de l’acétimine présent dans la structure 3 sont mobiles par hyperconjugaison. Ce qui permet d’envisager une cyclisation sur ce site.
Par conséquent, la présence des deux di-imines dans 3* permet de prévoir un mécanisme de cyclisation qui se fait par interaction entre l’imine de l’aldéhyde, d’une part, et l’énamine, d’autre part.
La catalyse acide mise en jeu, favorise la protonation de l’imine qui va subir une hétérocyclisation intramoléculaire avec l’énamine en formant ainsi la structure benzodiazépine 4 (Fig. 2).
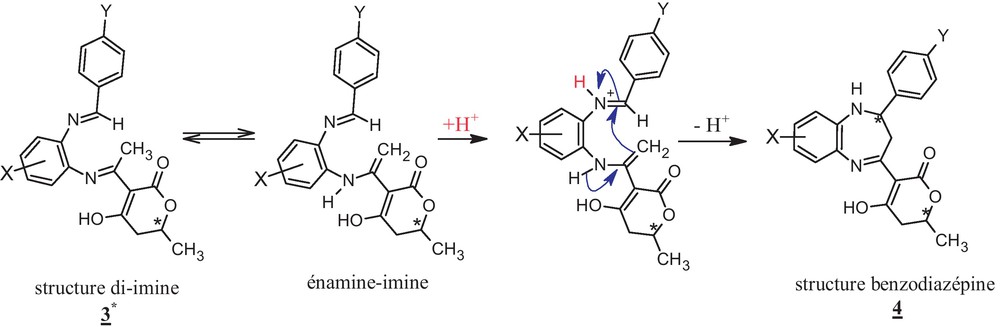
La structure du DHA hydrogénée en C5-C6 permet de prévoir des formes tautomères qui vont ralentir la cyclisation des di-imines 3* en structure benzodiazépines 4 (Fig. 3).

La vitesse de réaction dépend de la facilité d’approche du carbone nucléophile de l’énamine vers le site électrophile de l’imine d’aldéhyde.
Dans le but de confirmer la prédominance de la mobilité des protons du méthyle de l’acétyle en position 3 dans la structure 2, nous l’avons condensé avec un aldéhyde masqué, diméthylacétale diméthylformamide.
Cela nous a permis d’accéder à une nouvelle structure énaminone originale 5 (Fig. 4).

La structure 5 est caractérisée en particulier par la présence, sur le spectre RMN1H dans CDCl3 à 300 MHz, de deux pics à 3,02 et 3,22 ppm en bon rapport d’intégration, attribuables aux deux méthyles du groupement amine. Cette non-équivalence peut s’expliquer par la lenteur de la rotation de la liaison (CH3)2N-C(=C-C = O) du fait de la contribution de la forme de résonance (CH3)2N+=C(-C = C-O−).
Les deux signaux à 6,58 ppm (large) et 7,96 ppm (deux pics d’intensité 1H) sont facilement attribuables aux deux protons éthyléniques. Ces derniers sont faiblement couplés de type AX. Le composé 5 est obtenu sous la forme de deux couples diastéréo-isomères comme l’atteste la présence de deux pics sous forme de deux doublets, attribuables au CH3 du carbone asymétrique en 6 du cycle pyrone dans un rapport d’intensité 95/5 et deux pics sous forme de deux singulets, attribuables au CH éthylénique dans un rapport d’intensité 52/48.
3 Conclusion
Nous avons décrit une voie de synthèse simple et efficace donnant accès à des molécules originales de structure pyrano-1,5-benzodiazépine fonctionnalisée à partir du DHA hydrogéné en C5-C6, des diamines aromatiques et d’aldéhydes substituées.
Les couples diastéréo-isomères n’ont pas été séparés et les tests d’activité pharmacologique sont effectués sur les mélanges de diastéréo-isomères.
Nous pouvons dire que l’hydrogénation du DHA en C5-C6 ne diminue pas la nucléophilie du méthyle de l’acétyle en 3 de la pyrone mais elle ralentit la vitesse de la réaction d’hétérocyclisation, par comparaison avec nos résultats antérieurs [14].
Par ailleurs, cela nous a permis d’accéder à une molécule originale de structure énaminone qui peut être un précurseur potentiel à de nouveaux composés hétérocycliques.
4 Partie expérimentale
Les spectres RMN1H à 300 MHz ont été réalisés sur spectromètre Brüker AC300. Les déplacements chimiques sont donnés en ppm par rapport au TMS (δ = 0). Les multiplicités de spin sont données comme suit : s = singulet ; d = doublet ; t = triplet ; q = quadruplet ; qui = quintuplet ; m = multiplet. Les valeurs signalées par l’astérisque (*) correspondent aux couples diastéréo-isomères. Les spectres RMN13C (300 MHz) ont été effectués en mode J modulé sur spectromètre Brüker AC300. Les spectres de masse ont été réalisés sur un spectromètre Nermag R10-10C avec le mode d’ionisation par impact électronique à 70 eV et par ionisation chimique. Les points de fusion ont été pris sur un appareil Büchi 512. Le suivi des réactions est effectué par chromatographie sur couche mince, sur plaque de gel de silice 60F254. Les plaques ont été révélées sous une lampe UV 254.
4.1 4-hydroxy-6-méthyl-3-[2-(4-méthyl-phényl)-8-méthyl-4-(2,3-dihydro-1H-1,5-benzodiazépinyl)]-5,6-dihydro-2-pyrone 4a
Deux grammes (5 × 10−3 moles) de 3 et 0,6 g (5 × 10−3 moles) de para-méthylbenzaldéhyde sont placés dans 40 mL d’éthanol en présence de quelques gouttes d’acide sulfurique concentré. La solution est portée à reflux sous agitation magnétique pendant 15 heures.
La réaction est suivie par chromatographie sur couche mince. Le résidu de l’évaporation sous vide est traité à l’éther, pour donner un solide marron.
Rendement = 73 % ; Pf = 161–163 °C.
RMN1H (DMSOd6), δ (ppm) : 1,20*–1,30 (d, 3H, J = 6,1 Hz, CH3(6)), 2,27 (s,3H, CH3 arôm.), 2,32 (s,3H, CH3 arôm.), 2,70 (m, 2H, CH2(5)), 3,90 (m, 2H, CH2(3)), 4,35*–4,45 (m, 1H, CH(2)), 4,85 (m, 1H, CH(6)), 6,30–8,20 (m, 7H, H arôm.), 8,86 (s, 1H, NH), 15,01 (s, 1H, OH). RMN13C (DMSO), δ (ppm) : 21,2 (CH3(6)), 24,7 (CH3, arôm.), 25,3 (CH3, arôm.), 38 (C(3)), 40 (C(5)), 63*–65 (C(2)), 68,7 (C(6)), 97 (C(3)), 122–150 (C arôm.), 164 (C = N), 173 (C = O), 194 (C(4)). S.M (I.E) 70 eV, m/z (int. rel) : 376 (13 %), 361 (23 %), 332 (60 %), 249 (15 %), 132 (27 %). SM (IC) : [MH+] = 377, [M + NH4]+ = 394.
4.2 4-hydroxy-6-méthyl-3-[2-(4-chloro-phényl)-8-méthyl-4-(2,3-dihydro-1H-1,5-benzodiazépinyl)]-5,6-dihydro-2-pyrone 4b
Ce composé est obtenu, selon le même protocole que 4a, après un reflux de 14 heures.
Rendement = 72 % ; Pf = 160–162 °C.
RMN1H (DMSO), δ (ppm) : 1,25*–1,30 (d, 3H, J = 6,2 Hz, CH3(6)), 2,29 (s,3H, CH3, arôm.), 2,69 (m, 2H, CH2(5)), 3,75 (m, 2H, CH2(3)), 4,50 (m, 1H, CH(6)), 4,95*–5,20 (m, 1H, CH(2)), 6,40–8,00 (m, 7H, H arôm.), 8,79 (s, 1H, NH), 15,03 (s, 1H, OH). RMN13C (DMSO), δ (ppm) : 21,2 (CH3(6)), 24,9 (CH3, arôm.), 38,5 (C(3)), 39 (C(5)), 64*–65 (C(2)), 71,5 (C(6)), 97 (C(3)), 121–150 (C arôm.), 156 (C = N), 175 (C = O), 192 (C(4)). S.M (I.C) : [MH+] = 397, [M + NH4]+ = 414.
4.3 4-hydroxy-6-méthyl-3-[2-(4-hydroxy-phényl)-8-méthyl-4-(2,3-dihydro-1H-1,5-benzodiazépinyl)]-5,6-dihydro-2-pyrone 4c
Ce composé est obtenu, selon le même protocole que 4a, avec un temps de reflux de 13 heures.
Rendement = 77 %, Pf = 170–172 °C.
RMN1H (DMSO), δ (ppm) : 1,25*–1,35 (d, 3H, J = 6 Hz, CH3(6)), 2,28 (s,3H, CH3, arôm.), 2,70 (m, 2H, CH2(5)), 3,90 (m, 2H, CH2(3)), 4,23 (s, 1H, OH, arôm.), 4,50 (m, 1H, CH(6)), 4,80*–5,00 (m, 1H, CH(2)), 6,40–7,70 (m, 7H, Harôm), 8,65 (s, 1H, NH), 15,02 (s, 1H, OH). RMN13C (DMSO), δ (ppm) : 21,6 (CH3(6)), 24,7 (CH3, arôm.), 37 (C(3)), 40 (C(5)), 62.*–63 (C(2)), 72 (C(6)), 96 (C(3)), 117–157 (C arôm.), 160 (C = N), 172 (C = O), 192 (C(4)). S.M (I.C) : [MH+] = 379, [M + NH4]+ = 396.
4.4 4-hydroxy-6-méthyl-3-[2-(4-bromo-phényl)-8-méthyl-4-(2,3-dihydro-1H-1,5-benzodiazépinyl)]-5,6-dihydro-2-pyrone 4d
Ce composé est obtenu, selon le même protocole que 4a, avec un temps de reflux de 12 heures.
Rendement = 75 % ; Pf = 177–179 °C.
RMN1H (DMSO), δ (ppm) : 1,20*–1,30 (d, 3H, J = 6,3 Hz, CH3(6)), 2,27 (s,3H, CH3, arôm.), 2,69 (m, 2H, CH2(5)), 3,85 (m, 2H, CH2(3)), 4,95*–5,15 (m, 1H, CH(2)), 4,47 (m, 1H, CH(6)), 6,20–7,70 (m, 7H, H arôm.), 8,70 (s, 1H, NH), 15,01 (s, 1H, OH). RMN13C (DMSO), δ (ppm) : 21,5 (CH3(6)), 24,5 (CH3, arôm.), 38 (C(3)), 41 (C(5)), 57.*–59 (C(2)), 73 (C(6)), 97 (C(3)), 120–149 (C arôm), 158 (C = N), 171 (C = O), 192 (C(4)).
S.M (I.C) : [MH+] = 441, [M + NH4]+ = 458.
4.5 4-hydroxy-6-méthyl-3-[2-(4-méthyl-phényl)-8-nitro-4-(2,3-dihydro-1H-1,5-benzodiazépinyl)]-5,6-dihydro-2-pyrone 4e
Ce composé est obtenu, selon le même protocole que 4a, avec un temps de reflux de 20 heures.
Rendement = 65 % ; Pf = 199–201 °C.
RMN1H (DMSO), δ (ppm) : 1,26*–1,38 (d, 3H, J = 6 Hz, CH3(6)), 2,34 (s, 3H, CH3, arôm.), 2,51 (m, 2H, CH2(5)), 3,87 (m, 2H, CH2(3)), 4,27*–4,35 (m, 1H, CH(2)), 4,71 (m, 1H, CH(6)), 6,30–8,20 (m, 7H, H arôm.), 8,85 (s, 1H, NH), 15,03 (s, 1H, OH). RMN13C (DMSO), δ (ppm) : 21,2 (CH3(6)), 24,7 (CH3, arôm.), 37,5 (C(3)), 41,2 (C(5)), 63,5*–65,8 (C(2)), 69,7 (C(6)), 96,7 (C(3)), 122–150 (C arôm.), 164 (C = N), 173 (C = O), 193 (C(4)). S.M (I.E) 70 eV, m/z (int. rel) : 407 (9 %), 392 (17 %), 363 (49 %), 280 (35 %), 163 (7 %). S.M (I.C) : [MH+] = 408, [M + NH4]+ = 425.
4.6 4-hydroxy-6-méthyl-3-[2-(4-chloro-phényl)-8-nitro-4-(2,3-dihydro-1H-1,5-benzodiazépinyl)]-5,6-dihydro-2-pyrone 4f
Ce composé est obtenu, selon le même protocole que 4a, avec un temps de reflux de 24 heures.
Rendement = 59 % ; Pf = 207–209 °C.
RMN1H (DMSO), δ (ppm) : 1,24*–1,37 (d, 3H, J = 6,3 Hz, CH3(6)), 2,50 (m, 2H, CH2(5)), 3,89 (m, 2H, CH2(3)), 4,29*–4. 37 (m, 1H, CH(2)), 4,68 (m, 1H, CH(6)), 7,05–8,23 (m, 7H, H arôm.), 9,15 (s, 1H, NH), 15,12 (s, 1H, OH). RMN13C (DMSO), δ (ppm) : 20,1 (CH3(6)), 36,9 (C(3)), 41,1 (C(5)), 62,3*–64,6 (C(2)), 69,1 (C(6)), 96,5 (C(3)), 121–152 (C arôm), 164 (C = N), 173 (C = O), 194 (C(4)). S.M (I.C) : [MH+] = 428, [M + NH4]+ = 445.
4.7 4-hydroxy-6-méthyl-3-[2-(4-hydroxy-phényl)-8-nitro-4-(2,3-dihydro-1H-1,5-benzodiazépinyl)]-5,6-dihydro-2-pyrone 4g
Ce composé est obtenu, selon le même protocole que 4a, avec un temps de reflux de 24 heures.
Rendement = 61 % ; Pf = 213–216 °C.
RMN1H (DMSO), δ (ppm) : 1,25*–1,36 (d, 3H, J = 6,1 Hz, CH3(6)), 2,49 (m, 2H, CH2(5)), 3,92 (m, 2H, CH2(3)), 4,17 (s, 1H, OH arôm.), 4,27*–4. 31 (m, 1H, CH(2)), 4,67 (m, 1H, CH(6)), 6,65–8,21 (m, 7H, H arom.), 9,12 (s, 1H, NH), 15,09 (s, 1H, OH). RMN13C (DMSO), δ (ppm) : 21,2 (CH3(6)), 37,3 (C(3)), 41,5 (C(5)), 61,8*–64,1 (C(2)), 69,9 (CH(6)), 96,1 (C(3)), 119–154 (C arôm.), 165 (C = N), 174 (C = O), 193 (C(4)).
S.M (I.C) : [MH+] = 409, [M + NH4]+ = 427.
4.8 4-hydroxy-6-méthyl-3-[2-(4-bromo-phényl)-8-nitro-4-(2,3-dihydro-1H-1,5-benzodiazépinyl)]-5,6-dihydro-2-pyrone 4h
Ce composé est obtenu, selon le même protocole que 4a, avec un temps de reflux de 24 heures.
Rendement = 55 % ; Pf = 218–220 °C.
RMN1H (DMSO), δ (ppm) : 1,25*–1,37 (d, 3H, J = 6,1 Hz, CH3(6)), 2,47 (m, 2H, CH2(5)), 3,89 (m, 2H, CH2(3)), 4,23*–4,29 (m, 1H, CH(2)), 4,65 (m, 1H, CH(6)), 7,05 - 8,22 (m, 7H, Ha arôm.), 9,11 (s, 1H, NH), 15,04 (s, 1H, OH). RMN13C (DMSO), δ (ppm) : 21,4 (CH3(6)), 37,9 (C(3)), 41,7 (C(5)), 61,5*–63,9 (C(2)), 70,1 (C(6)), 96,3 (C(3)), 116–152 (C arôm.), 165 (C = N), 173 (C = O), 193 (C(4)). S.M (I.C) : [MH+] = 472, [M + NH4]+ = 489.
4.9 3-[3-(diméthylamino)prop-2-enoyl]-4-hydroxy-6-méthyl-5,6-dihydro-2H-dihydro-pyran-2-one 5
1,70 g (10−2 moles) de 2 sont dissous dans 30 mL d’éthanol en présence de quelques gouttes de triéthylamine et de 1,78 g (1,5 × 10−2 moles) de diméthylacétal diméthylformamide (DMF-DMA). La solution est portée à reflux et sous agitation magnétique pendant 6 heures.
La réaction est suivie par chromatographie sur couche mince. Le résidu de l’évaporation sous vide est traité à l’éther, pour donner une poudre blanche.
Rendement = 58 % ; Pf = 149–151 °C.
RMN1H (CDCl3), δ (ppm) : 1,40*–1,42 (d, 3H, J = 6 Hz, CH3(6)), 2,49 (m, 2H, CH2(5)), 3,02 (s, 3H, N-CH3), 3,22 (s, 3H, N-CH3), 4,41 (m, 1H, H(6)), 6,58 (s, 1H, =CH), 7,95*–7,99 (s, 1H, =CH). RMN13C (CDCl3), δ (ppm) : 23,2 (CH3(6)), 38,7 (N-CH3), 39,4 (N-CH3), 42,1 (C(5)), 71,5 (C(6)), 93,6 (C = H), 98,3 (C(3)), 159 (C = H), 173 (C = O), 184 (C = O), 193 (C(4)). S.M (I.E) 70 eV, m/z (int. rel) : 225 (17 %), 210 (5 %), 181 (31 %), 127 (53 %). S.M (I.C) : [MH+] = 226, [M + NH4]+ = 243.


