1 Introduction
Dans le cadre de nos recherches sur la mise au point de nouvelles voies de synthèse de composés polyhétérocycliques 〚1–3〛, nous rapportons dans ce mémoire la préparation de nouveaux produits associant le benzimidazole aux triazolopyrimidines. Le choix de ces deux noyaux repose principalement sur leurs propriétés pharmacologiques 〚4–6〛 et agrochimiques 〚7–9〛, ainsi que sur leur implication environnementale par la complexation des métaux lourds 〚10–12〛. Pour la préparation des triazolopyrimidines et dans le but de poursuivre nos recherches sur l’utilisation des 4-hydroxy-2-pyrones en synthèse hétérocyclique 〚13–16〛, nous avons examiné l’action du 3-amino-1,2,4-triazole sur la 4-hydroxy-6-méthyl pyran-2-one.
2 Résultats et discussion
2.1 Réaction du 3-amino-1,2,4-triazole 1 avec la 4-hydroxy-6-méthyl pyran-2-one 2
La réaction du 3-amino-1,2,4-triazole 1 avec la 4-hydroxy-6-méthyl pyran-2-one 2 a été conduite à reflux dans différents alcools pendant des durées variées (Fig. 1).
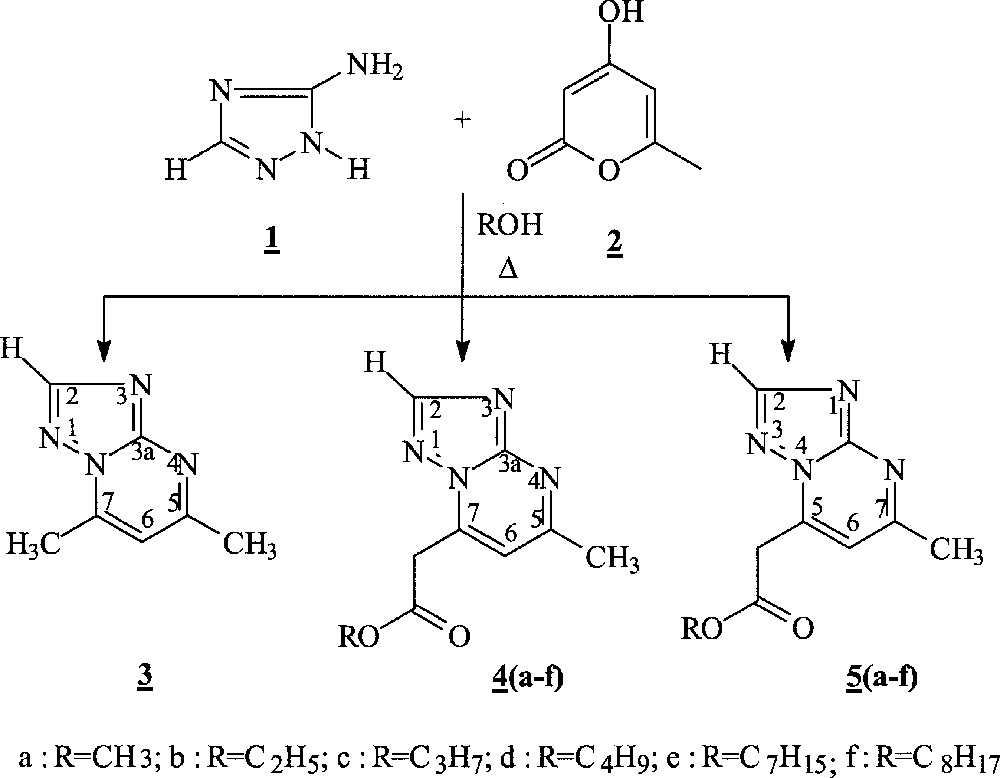
Réaction du 3-amino-1,2,4-triazole 1 avec la 4-hydroxy-6-méthyl pyran-2-one 2.
Dans chaque cas, il nous a été possible d’isoler trois produits : la 5,7-diméthyl-1,2,4-triazolo〚1,5-a〛pyrimidine 3, les 7-alkoxycarbonylméthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛pyrimidines 4 et leurs isomères les 5-alkoxycarbonylméthyl-7-méthyl-1,2,4-triazolo〚4,3-a〛pyrimidines 5, résultant de deux voies de cyclisation compétitives. Les proportions relatives en produits 3, 4 et 5 sont rapportées dans le Tableau 1.
Proportions relatives en produits 3, 4 et 5.
| Produits | ||||
| Réaction | Solvant | 3 (%) | 4 (%) | 5 (%) |
| 1 + 2 | MeOH | 8 | 4a (68) | 5a (24) |
| EtOH | 11 | 4b (66) | 5b (23) | |
| n-C3H7OH | 14 | 4c (64) | 5c (22) | |
| n-C4H9OH | 28 | 4d (52) | 5d (20) | |
| n-C7H15OH | 33 | 4e (50) | 5e (17) | |
| n-C8H17OH | 41 | 4f (43) | 5f (16) |
Les structures des composés 4 et 5 ont été établies sur la base des données spectrales RMN 1H, RMN 13C, masse et rayons X.
2.2 Identifications des composés 5 (a–f)
Les spectres de masse montrent que les composés obtenus appartiennent à deux séries de 1,2,4-triazolopyrimidines isomères.
Pour différencier les deux isomères 4b et 5b, nous avons adopté une méthode chimique. Ainsi, la réaction de décarboxylation du composé 4b en milieu alcalin conduit à la 5,7-diméthyl-1,2,4-triazolo〚1,5-a〛pyrimidine 3, dont les caractéristiques physiques et spectrales sont identiques à celles d’un échantillon de référence 〚17, 18〛. Ce résultat est corroboré par une étude cristallographique réalisée sur le composé 4b 〚19〛 (Fig. 2).
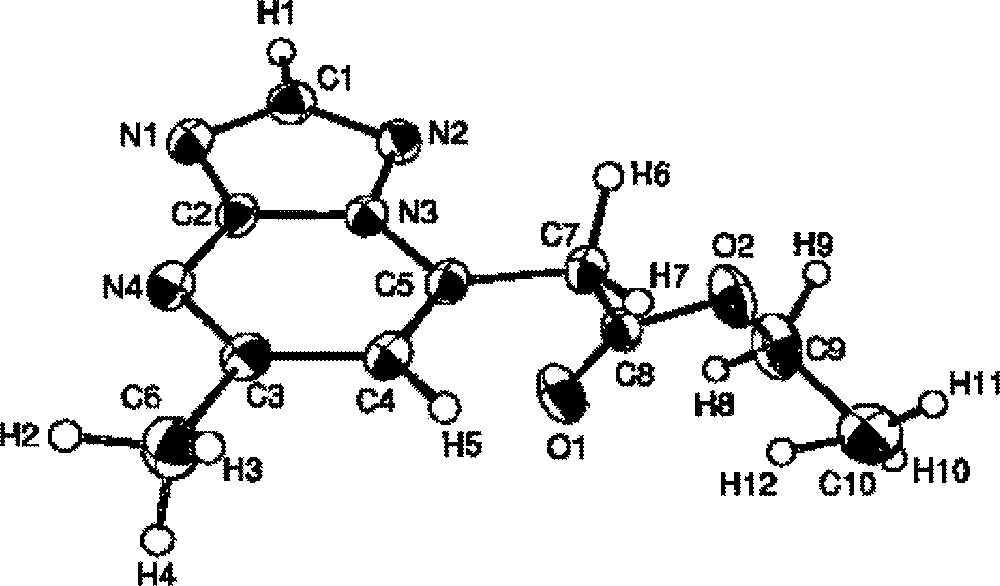
Dessin Ortep de 4b.
Les spectres de RMN des composés 4b et 5b montrent que le signal du proton triazolique de 4b, de structure triazolo 〚1,5-a〛 pyrimidine, est plus blindé que celui du proton triazolique de 5b, de structure triazolo〚4,3-a〛 pyrimidine. Ces résultats permettent de déduire, sans ambiguïté, les structures des autres isomères 4a,c–f et 5a,c-f, en se basant sur les valeurs des déplacements chimiques des protons triazoliques, qui sont plus importantes dans le cas des isomères 5a,c–f.
Il est à noter que les 1,2,4-triazolopyrimidines obtenues proviennent de réactions compétitives. En effet, ces produits, chauffés dans les différents alcools utilisés, restent inaltérés. Les 1,2,4-triazolo〚1,5-a〛pyrimidines ne sont pas donc obtenues à partir de leurs isomères de jonctions〚4,3-a〛 selon une réaction de Dimroth 〚20, 21〛.
Par ailleurs, les rendements des réactions étudiées dépendent de la nature du solvant utilisé ainsi que de la nucléophilie des atomes d’azote N2 et N4 du noyau triazolique. Les triazolo〚1,5-a〛pyrimidines constituent, dans tous les cas, les produits majoritaires de la réaction, dont la formation est due à l’intervention, dans la réaction de cyclisation, de l’atome d’azote le plus nucléophile : l’azote hydrazinique N2. On note également que, plus la température d’ébullition du solvant de la réaction est élevée, plus le rendement de la réaction de décarboxylation augmente.
Les résultats obtenus à l’issue de cette étude nous ont permis de proposer un mécanisme de formation des composés 3–5 (Fig. 3). Il est à noter que la 4-hydroxy-6-méthyl pyran-2-one 2, chauffée à reflux dans différents alcools pendant 24 h, reste inaltérée. Par conséquent, la formation des 1,2,4-triazolopyrimidines 3–5 peut être expliquée par une attaque initiale de l’atome d’azote du groupe amino de l’amitrole 2 sur le carbone C6 de la 4-hydroxy-6-méthyl pyran-2-one1. L’intermédiaire 〚A〛 ainsi formé par ouverture du cycle pyranique évolue respectivement, selon deux réactions compétitives de décarboxylation et d’estérification, vers les intermédiaires 〚B〛 et 〚C〛. La cyclisation intramoléculaire de l’intermédiaire 〚B〛 mettant en jeu l’azote hydrazinique N2 conduit, après perte d’une molécule d’eau, au composé 3. Les cyclisations compétitives de l’intermédiaire 〚C〛 mettant en jeu les azotes endocycliques N2 et N4 conduisent respectivement aux composés 4 et 5.
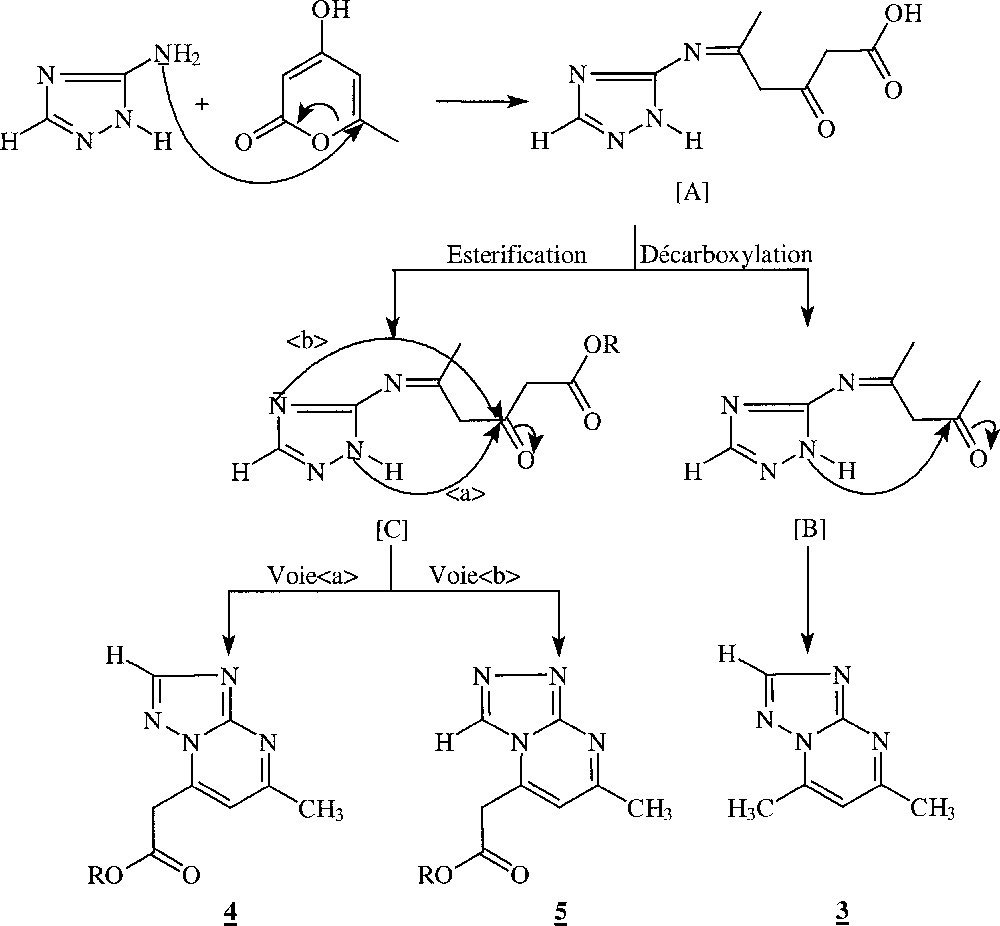
Mécanisme de formation des composés 3–5 proposé.
2.3 Synthèse des 7(5)-〚benzimidazol-2-yl〛méthyl-1,2,4- triazolopyrimidines 9(10)
Ces composés ont été préparés selon deux méthodes : soit par condensation des o-phénylènediamines avec les esters 4(5), au reflux du xylène, pendant 48 h, soit par action des o-phénylènediamines 8a–d sur les hydrazides 6(7) à fusion des réactifs. Ces derniers sont obtenus par action de l’hydrazine sur les esters 4(5) (Fig. 4). Notons que l’utilisation des hydrazides permet de réduire la durée des réactions étudiées.
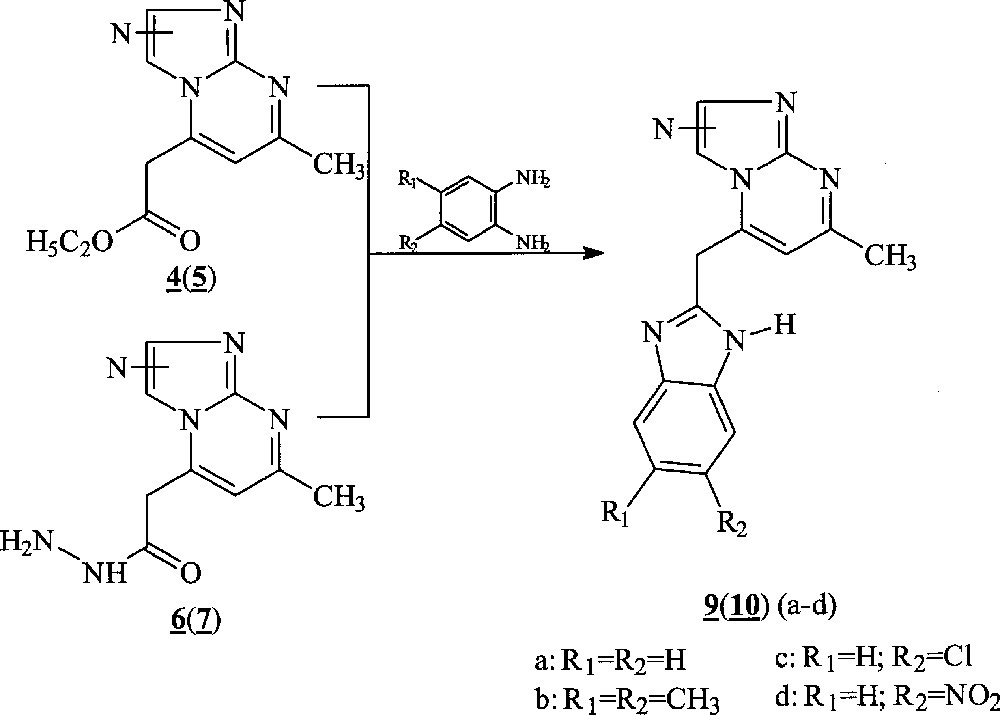
Obtention de 6(7) par action de l’hydrazine sur les esters 4(5).
Dans les deux cas, les benzimidazoles sont obtenus avec de bons rendements. Les structures des composés formés ont été établies sur la base des données spectrales RMN 1H, RMN 13C, IR et masse.
Ainsi, au cours de ce travail, il nous a été possible de préparer, à partir de la 4-hydroxy-6-méthyl pyran-2-one, de nouveaux systèmes polyhétérocycliques associant les noyaux benzimidazole et triazolopyrimidine susceptibles de présenter des propriétés biologiques intéressantes.
3 Partie expérimentale
3.1 Généralités
Les points de fusion ne sont pas corrigés. Les spectres de RMN 1H, 13C ont été enregistrés sur un appareil Bruker AC à 250 MHz. Les spectres de masse ont été effectués avec un Varian MAT 311A. Les spectres IR ont été réalisés sur un spectromètre Perkin Elmer 1760 X.
3.2 Synthèse des 1,2,4-triazolopyrimidines 3–5
On porte à reflux, dans différents alcools, 0,05 mol de 4-hydroxy-6-méthyl pyran-2-one 2 〚22〛 et 0,05 mol de 3-amino-1,2,4-triazole 1, pendant des durées variées (10 à 28 h). Après évaporation du solvant de la réaction sous pression réduite, une grande partie du produit majoritaire se dépose dans l’éthanol. Après filtration du précipité, on évapore le solvant à sec et le résidu est chromatographié sur colonne de gel de silice (éluant : hexane/acétate d’éthyle).
3.3 Caractéristiques physico-chimiques des produits obtenus
3.3.1 5,7-Diméthyl-1,2,4-triazol〚1,5-a〛pyrimidine 3
Rdt : 8–40% ; F (°C) : 135–136 (EtOH) 〚17, 18〛
RMN 1H (CDCl3) δ (ppm) : 8,27 (s,1H,H-2) ; 7,62 (s,1H,H-6) ; 2,66 (s,3H,CH3) ; 2,52 (s,3H,CH3).
RMN 13C (CDCl3) δ (ppm) : 164,53 (C-5) ; 155,06 et 154,96 (C-2 et C-5) ; 146,49 (C-7) ; 110,54 (C-6) ; 24,74 (CH3-5) ; 6,74 (CH3–7).
Masse (IE) : m/z 148 〚M+〛.
Éluant : hexane–acétate d’éthyle (40:60).
3.3.2 7-Méthoxycarbonyméthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛pyrimidine 4a
Rdt : 68% ; F (°C) : 145–147 (EtOH)
RMN 1H (CDCl3) δ (ppm) : 8,15 (s,1H,H-2) ; 6,85 (s,1H,H-6) ; 2,45 (s,3H,CH3-5) ; 4,07 (s,2H,CH2-7) ; 3,40 (s,3H,CH3–O).
RMN 13C (CDCl3) δppm : 166,59 (C=O) ; 164,71 (C-5) ; 154,74 (C-2 et C-3a) ; 142,12 (C-7) ; 111,37 (C-6) ; 51,65 (CH3–O) ; 35,62 (CH2-7) ; 24,69 (CH3-5).
IR (KBr) : 1719 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (40:60).
3.3.3 7-Éthoxycarbonylméthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛pyrimidine4b
Rdt : 66% ; F (°C) : 134–136 (EtOH).
RMN 1H (CDCl3) δ (ppm) : 8,15 (s,1H, H-2) ; 6,86 (s,1H,H-6) ; 2,46 (s,3H,CH3-5) ; 4,39 (s,2H,CH2-7) ; 3,98 (s,2H,CH2–O) ; 1,02 (t,3H,CH2–CH3).
RMN 13C (CDCl3) δ (ppm) : 166,60 (C=O) ; 164,71 (C-5) ; 154,84 et 154,74 (C-2 et C-3a) ; 142,12 (C-7) ; 111,38 (C-6) ; 61,50 (CH2–O) ; 35,71 (CH2-7) ; 13,63 (CH3–CH2).
Masse (IE) : m/z 220 〚M+〛.
IR (KBr) : 1722 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (45:55).
3.3.4 5-Méthyl-7-propoxycarbonylméthyl-1,2,4-triazolo〚1,5-a〛pyrimidine 4c
Rdt : 63% ; F (°C) : 118–119 (EtOH).
RMN 1H (CDCl3) δ (ppm) : 8,32 (s,1H,H-2) ; 6,92 (s,1H,H-6) ; 4,15 (s,2H,CH2-7) ; 4,09 (s,2H,CH2–O) ; 2,64 (s,3H,CH3-5) ; 1,55 (m,2H,CH2–CH3) ; 0,85 (t,3H,CH3–CH2).
RMN 13C(CDCl3) δ (ppm) : 166,67 (C=O) ; 164,72 (C-5) ; 154,88 (C-2 et C-3a) ; 142,21 (C-7) ; 111,37 (C-6) ; 67,03 (CH2–O) ; 35,79 (CH2-7) ; 24,81 (CH3-5) ; 21,39 (CH2–CH3) ; 9,81 (CH3–CH2).
IR (KBr) : 1720 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (50:50).
3.3.5 7-Butoxycarbonylméthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛pyrimidine 4d
Rdt : 52% ; F (°C) : 113–114 (EtOH).
RMN 1H (CDCl3) δ (ppm) 8,20 (s,1H,H-2) ; 6,89 (s,1H,H-6) ; 4,05 (s,2H,CH2-7) ; 3,96 (t,2H,CH2–O) ; 2,50 (s,3H,CH3-5) ; 1,39 et1,10 (m ,4H, (CH2)2–CH3).
RMN 13C (CDCl3) δ (ppm) 166,98 (C=O) ; 165,08 (C-5) ; 155,12 (C-2 et C-3a) ; 142,49 (C-7) ; 111,70 (C-6) ; 65,64 (CH2–O) ; 36,07 (CH2–7) ; 30,26 et 16,26 (CH2)2–CH3) ; 13,46 (CH3–CH2).
IR (KBr) ; 1738,5 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (40:60).
3.3.6 7-Heptoxycarbonylméthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛pyrimidine 4c
Rdt : 50% ; F (°C) : 79–80 (éther).
RMN 1H (CDCl3) δ (ppm) : 8,32 (s,1H,H-2) ; 7,00 (s,1H,H-6) ; 4,26 (s,2H,CH2-7); 4,06 (m,2H,CH2–O) ; 2,77 (s ,3H,CH3–5) ; 1,51et 0,87 (m,13H,C6H13).
RMN 13C (CDCl3) δ (ppm) : 166,92 (C=O) ; 165,27 (C-5) ; 155,47 (C-2et C-3a) ; 142,56 (C-7) ; 112,07 (C-6) ; 66,23 (CH2–O) ; 36,29 (CH2-7) ; 31,74 ; 28,88 et 22,62 et14,35 (C6H13).
IR (KBr) : 1730 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (40:60).
3.3.7 5-Méthyl-7-octoxycarbonylméthyl-1,2,4-triazolo〚1,5-a〛pyrimidine 4f
Rdt : 43% ; F (°C) : 70°C (éther).
RMN 1H (CDCl3) δ (ppm) : 8,30 (s,1H,H-2) ; 6,93 (s ;1H,H-6) ; 4,44 (s ,2H,CH2-7) ; 4,13 (m,2H,CH2–O) ; 1,50 et 0,36 (m,15H,C7H15).
RMN 13C (CDCl3) δ (ppm) : 166,70 (C=O) ; 164,68 (C-5) ; 155,23 (C-2 et C-3a) ; 142–34 (C-7) ; 111,52 (C-6) ; 66,00 (CH2–O) ; 36,05 (CH2–7) ; 31,57, 28,96, 28,23, 22,46 et13,95 (C7H15).
IR (KBr) : 1737 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (40:60).
3.3.8 5-Méthoxycarbonylméthyl-7-méthyl-1,2,4-triazolo〚4,3-a〛pyrimidine 5a
Rdt : 24% ; F (°C) : 80–82 (éther).
RMN 1H (CDCl3) δ (ppm) : 8,34 (s,1H,H-3) ; 6,91 (s,1H,H-6) ; 3,91 (s,2H,CH2-7) ; 3,40 (s,3H,CH3–O) ; 3,91 (s,2H,CH2-7).
RMN 13C (CDCl3) δ (ppm) : 168,80 (C=O) ; 159,78 (C-5) ; 155,11 (C-3 et C-8a) ; 147,23 (C-7) ; 110,53 (C-6) ; 51,81 (CH3–O) ; 43,68 (CH2–5) ; 16,89 (CH3–7).
IR (KBr) : 1715 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (40:60).
3.3.9 5-Éthoxycarbonylméthyl-7-méthyl-1,2,4-triazolo〚4,3-a〛pyrimidine 5b
Rdt : 23% ; F (°C) : 76–77 (éther).
RMN 1H (CDCl3) δ (ppm) : 8,36 (s,1H,H-3) ; 6,95 (s,1H,H-6) ; 4,12 (s,2H,CH2–O) ; 3,86 (s,2H,CH2–5) ; 2,74 (s,3H,CH3–7) ; 1,17 (t,3H,CH3–CH2).
RMN 13C (CDCl3) δ (ppm) : 168–83 (C=O) ; 159,88, 155,34 (C-5) ; 154,63 (C-3 et C-8a) ; 147,25 (C-7) ; 110,55 (C-6) ; 61,23 (CH2–O) ; 43,69 (CH2-5) ; 16,91 (CH3-7) ; 13,85 (C2H5).
Masse (IE) : m/z 220 (M+).
IR (KBr) : 1709 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (45:55).
3.3.10 7-Méthyl-5-propoxycarbonylméthyl-4,2,4-triazolo〚4,3-a〛pyrimidine 5c
Rdt : 22% ; F (°C) : 86–87 (éther).
RMN 1H (CDCl3) δ (ppm) : 8,40 (s,1H,H-3) ; 7,00 (s,1H,6) ; 4,05 (,2H,CH2–O) ; 3,90 (s,2H,CH2-5) ; 2,75 (s,1H,CH3-7) ;1,65 (m,2H,CH2–CH-3) ; 0,85 (m,3H,CH3–CH2).
RMN 13C (CDCl3) δ (ppm) : 169,10 (C=O) ; 160,04 (C-5) ; 155,62 et 154,98 (C-3 et C-8a) ; 147,93 (C-7) ; 110,65 (C-6) ; 67,02 (CH2–O) ; 43,87 (CH2–5) ; 21,77 et 10,21 (C2H5).
IR (KBr) : 1724 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (60:40).
3.3.11 5-Butoxycarbonylméthyl-7-méthyl-1,2,4-triazolo〚4,3-a〛pyrimidine 5d
Rdt : 20% ; F (°C) : 70–72 (éther).
RMN 1H (CDCl3) δ (ppm) : 8,45 (s,1H,H-3) ; 6,96 (s,1H,H-6) ; 4,04 (t,2H,CH2–O) ; 3,87 (s,2H,CH2-5) ; 2,74 (s,3H,CH3-7) ; 1,52 et 1,28 (m,4H,(CH2)2) ; 0,67 (t,3H,CH3–CH2).
RMN 13C (CDCl3) δ (ppm) : 167,22 (C=O) ; 160,13 (C-5) ; 155,67 et154,98 (C-3 et C-8a) ; 147,47 (C-7) ; 110,76 (C-6) ; 65,40 (CH2–O) ; 43,94 (CH2-5) ; 30,46 et19,01 ((CH2)2) ; 17,17 (CH3-7) ; 13,62 (CH3–CH2).
IR (KBr) : 1729cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (70:30).
3.3.12 5-Heptoxycarbonylméthyl-7-méthyl-1,2,4-triazolo〚4,3-a〛pyrimidine 5e
Rdt : 17% ; F (°C) : 51–53 (éther).
RMN 1H (CDCl3) δ (ppm) : 8,47 (s,1H,H-3) ; 7,07 (s,1H,H-6) ; 4,16 (t,2H,CH2–O) ; 3,98 (s,2H,CH2-5) ; 2,88 (s,3H,CH3-7) ; 1,49 et 0,87 (m,13H,C5H13).
RMN 13C (CDCl3) δ (ppm) : 169,21 (C=O) ; 160,19 (C-5) ; 155,71 et154,99 (C-3et C-8) ; 147,44 (C-7) ; 65,73 (CH2–O) ; 43,99 (CH2-5) ; 31,66, 28,82, 25,77 et 22,53 (CH2)5 ; 17,23 (CH3-7) ; 14,05 (CH3–CH2).
IR (KBr) : 1732 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (80:20).
3.3.13 5-Méthyl-7-octoxycarbonylméthyl-1,2,4-triazol〚4,3-a〛pyrimidine 5f
Rdt : 16% ; F (°C) : 61–62 (éther).
RMN 1H (CDCl3) δ (ppm) : 8,46 (s,1H,H-3) ; 7,03 (s,1H,H-6) ; 4,15 (t, 2H,CH2–O) ; 3,95 (s,2H,CH2–5) ; 2,83 (s,3H,CH3–7) ; 1,47 et 0,85 (m,15H,C7H15).
RMN 13C (CDCl3) δ (ppm) : 168,99 (C=O) ; 159,89 (C-5) ; 155,41 (C-3et C-8a) ; 147,22 (C-6) ; 110,22 (C-6) ; 65,50 (CH2–O) ; 43,75 (CH2-5) ; 31,90, 28,90, 28,24 , 25,60 et 22,38 ((CH2)6) ; 16,99 (CH3-7) ; 13,65 (CH3–CH2).
IR (KBr) : 1731 cm–1 (νC=O).
Éluant : hexane/acétate d’éthyle (80:20).
3.4 Décarboxylation du composé 4b
À 1 g de l’ester 4b dans 10 ml de méthanol sont ajoutés 3,87 g d’hydroxyde de sodium aqueux (25%). Le mélange est porté à reflux pendant 1 h. On neutralise, on extrait au chloroforme, on filtre et on évapore à sec. Le produit obtenu 3 est recristallisé dans l’éthanol. Le rendement est de 80%.
3.5 Synthèse des 7 (ou 5)-hydrazinocarbonyl-5 (ou 7)-méthyl-1,2,4-triazolo〚1,5-a〛(〚4,3-a〛) pyridines 6 (ou 7)
À une solution de 5 × 10–3 mol de l’ester 4(5) dans 25 ml d’éthanol sont ajoutés 2,5 équiv d’hydrate d’hydrazine. Le mélange est porté à reflux sous agitation pendant 2 h ; le produit obtenu est recristallisé dans l’éthanol.
3.5.1 7-Hydrazinocarbonylméthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛pyrimidine 6
Rdt : 90% ; F (°C) : 210–211 (EtOH).
RMN 1H (DMSOd6) δ (ppm) : 9,48 (s, 1H,NH) ; 8,61 (s,1H,H-2) ; 2,68 (s,3H,CH3-5).
RMN 13C (DMSOd6) δ (ppm) : 167,62 (C=O) ; 165,88 (C-5) ; 156,15 et 155,76 (C-2 et C-3a) ; 145,81 (C-7) ; 113,52 (CH2-7) ; 25,77 (CH3-5).
3.5.2 5-Hydrazinocarbonylméthyl-7-méthyl-1,2,4-triazolo〚4,3-a〛pyrimidine
Rdt : 90% ; F (°C) : 139–141 (EtOH).
RMN 1H (DMSOd6) δ (ppm) : 9,50 (s,1H,NH) ; 8,70 (s,1H,H-3) ; 7,36 (s,1H,H-6) ; 4,20 (s,2H,CH-5) ; 4,12 (s,2H,NH2) ; 2,80 (s,3H,CH3-7).
RMN 13C (DMSOd6) δ (ppm) : 167,73 (C=O) ; 160,89 (C-5) ; 154,54 et 155,57 (C-3 et C-8a) ; 148,01 (C-7) 111,26 (CH-6) ; 43,37 (CH2-5) ; 16,53 (CH3-7).
3.6 Synthèse des 7(5)-〚benzimidazol-2-yl〛méthyl-5(7)-méthyl-1,2,4-triazolo〚1,5-a〛(〚4,3-a〛) pyrimidines 9(10)
Mode opératoire A : on porte à reflux du xylène un mélange de 5 × 10–3 mol de l’ester 4(5) et 6 × 10–3 mol d’o-phénylènedianine 8 pendant 48 h ; après élimination du xylène, le produit formé est extrait à l’acétate d’éthyle et recristallisé dans le mélange méthanol/eau.
Mode opératoire B : 28 × 10–3 mol d’o-phénylènediamine 8 est portée à fusion à 240 °C avec 7 × 10–3 mol d’hydrazide 6(7) jusqu’à ce que le dégagement gazeux cesse et que le mélange se solidifie ; le produit 9(10) obtenu est lavé à l’éther et au chloroforme pour éliminer l’excès de la diamine et recristallisé dans le mélange méthanol/eau.
3.6.1 7-〚Benzimidazol-2-yl〛méthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛pyrimidine 9a
Rdt : 80% (méthode A) ; 85% (méthode B) ; F (°C) > 268 (méthanol/eau).
RMN 1H (DMSOd6) δ (ppm) : 8,54 (s,1H,H-2) ; 5,72 (s,1H,H-6) ; 7,31 (2m,4H,H-ar) ; 4,80 (s,2H,CH2-7) ; 2,57 (s,3H,CH3-5).
RMN 13C (DMSOd6) δ (ppm) : 156,34 et 155,98 (C-2 et C-3a) ; 166,28 (C-5) ; 112,70, 116,04, 122,98 (CH-6,CH-5’et CH-4’) ; 146,62 et 149,89 (C-7et C-2’) ; 139,15 (C-3’a) ; 31,47 (CH2-2’) ; 25,87 (CH3-5).
3.6.2 7-〚5,6-Diméthyl benzimidizol-2-yl〛méthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛 pyrimidine 9b
Rdt : 80% (méthode A) ; 85% (méthode B) ; F (°C) : 259–260 (méthanol/eau).
RMN 1H (DMSOd6) δ (ppm) : 8,58 (s,1H,H-2) ; 7,20 (s,1H,H-6) ; 7,30 (s,1H,H-ar) ; 4,76 (s,2H,CH2-7) ; 2,62 (s,3H,CH3-5) ; 2,29 (s,6H,CH3-ar).
RMN 13C (DMSOd6) δ (ppm) : 145,96 et 154,82 (C-2 et C-3a) ; 166,11 (C-5) ; 137,22, 130,18, 111,39 et 114,97 (C-5’,C-4’,C-3a’) ; 147,63 et 147,63 (C-7 et C-2’) ; 30,22 (CH2-2) ; 20,00 (CH3-5’) ; 24,72 (CH3-5).
3.6.3 7-〚5-Chloro benzimidazol-2-yl〛méthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛 pyrimidine 9c
Rdt : 60% (méthode A) ; 70% (méthode B) ; F (°C) >268 (méthanol/eau).
RMN 1H (DMSOd6) δ (ppm) : 8,50 (s ;1H,H-2) ; 6,83 (s,1H,H-6) ; 7,80 (m,3H,H-ar) ; 4,80 (s,2H,CH2-7’) ; 2,54 (s,3H,CH3-5).
Masse(IE) : m/z 298 (M+).
3.6.4 7-〚5-nitrobenzimidazol-2-yl〛méthyl-5-méthyl-1,2,4-triazolo〚1,5-a〛 pyrimidine 9d
Rdt : 50% (méthode A) ; 65% (Méthode B) ; F (°C) : 270–271 (méthanol/eau).
RMN 1H (DMSOd6) δ (ppm) : 8,55 (s,1H,H-6) ; 7,65 (m,3H,H-ar) ; 4,70 (s,2H,CH2-7) ; 265 (s,2H,CH3-5).
Masse (IE) : m/z 293 (M+).
3.6.5 5-〚Benzimidazol-2-yl〛méthyl-7-méthyl-1,2,4-triazolo〚4,3-a〛pyrimidine 10a
Rdt : 75% (méthode A) ; 80% (méthode B) ; F (°C) : 236–237 (méthanol/eau).
RMN 1H (DMSOd6) δ (ppm) : 8,55 (s,1H,H-3) ; 6,49 (s,1H,H-6) ; 7,25 (2m,4H,H-ar) ; 4,85 (s,2H,CH2-5) ; 2,66 (s,3H,CH3-7).
3.6.6 5-〚5,6-Diméthylbenzimidazol-2-yl〛méthyl-7-méthyl-1,2,4-triazolo〚4,3a〛pyramidine 10b
Rdt : 75% (méthode A) ; 85% (méthode B) ; F (°C) : 220–221 (méthanol/eau).
RMN 1H (DMSOd6) δppm : 8,60 (s,1H,H-3) ; 6,98 (s,1H,H-6) ; 7,20 (s,2H,H-ar) ; 4,79 (s, 2H,CH2–5) ; 2,70 (s,3H,CH3–7) ; 2,40 (s, 6H,CH3-ar).



