1 Introduction
Dérivant des sondes utilisées en RMN du solide, les sondes RMN haute résolution avec rotation à l'angle magique (HR-MAS : High-Resolution Magic Angle Spinning) ont été développées, dans un premier temps, pour assurer le suivi des réactions de synthèse et permettre l'étude structurale des semi-solides (gels) [1–3]. Leur utilisation a été, par la suite, étendue à l'analyse de tissus biologiques d'origine animale et végétale (cf. [4,5] et ci-dessous). Les avantages attribués à cette technique, en combinaison avec les nouveaux outils de la bioinformatique, ont fortement motivé son utilisation dans les études de métabolomique, en particulier sur les tissus pathologiques d'origine humaine [6–8]. La détection dans un échantillon de tissu intact de l'ensemble des métabolites hydro- et organo-solubles, l'amélioration de la résolution des spectres et une excellente sensibilité sont les arguments qui ont amené de nombreuses équipes à réaliser l'acquisition de sondes HR-MAS. Cependant, les avantages de la technique HR-MAS méritent d'être mis en perspective (i) à la lumière de la pratique expérimentale acquise à ce jour, (ii) en fonction de la nature et de l'origine de l'échantillon analysé et (iii) selon l'objectif expérimental fixé. Par exemple, en ce qui concerne les applications médicales, l'analyse par HR-MAS des biopsies humaines plutôt que celle des extraits de ces biopsies par RMN liquide conventionnelle relève d'un choix expérimental stratégique dont il convient de mesurer les conséquences et les implications pour des études qui doivent se poursuivre sur plusieurs années. Le but de cet article est de présenter une étude critique de la technique HR-MAS appliquée à l'étude des tissus biologiques. Cette technique a été évaluée sur un large éventail expérimental allant de l'étude in situ d'animaux introduits vivants (ver, larve), à l'analyse de biopsies d'organes ou à la caractérisation d'espèce de végétaux.
2 Matériels et méthodes
2.1 Spectroscopie RMN
Les spectres ont été obtenus sur un spectromètre Bruker ARX 400 (Bruker Biospin, France). La sonde HR-MAS (4 mm) double résonance proton (1H)/phosphore (31P) utilisée est équipée d'un canal deutérium (utilisé comme signal de référence pour compenser la dérive du champ magnétique principal) et d'une bobine de gradient (orientée suivant l'axe de rotation). Un des flux pneumatiques assure l'entraînement du rotor entre 1 et 5 kHz et est utilisé pour maintenir l'échantillon à une température contrôlée. Par ailleurs, une sonde large bande inverse (BBI, Bruker) a été utilisée pour l'observation des protons en RMN liquide conventionnelle. Un tube équipé d'inserts de susceptibilité magnétique adaptée aux milieux aqueux (Shigemi Inc., États-Unis) a été utilisé pour l'observation des tissus dans la sonde BBI.
Deux types de séquences ont été utilisés pour l'observation des 1H : une séquence simple impulsion (30°) et une séquence d'écho de spin Carr–Purcell–Meiboom–Gill (CPMG), avec un temps d'écho de 120 ms, couplées à une séquence de pré-saturation du signal des protons de l'eau. Les paramètres suivants ont été utilisés :
- (i) pour l'acquisition : 32K points échantillonnés pour couvrir une fenêtre spectrale de 8 kHz ; délai entre deux impulsions 2s ; 64 à 256 acquisitions par spectre ;
- (ii) pour le traitement du signal : augmentation de la résolution digitale à 64K ; apodisation du signal avant transformation de Fourier (1 Hz).
Les spectres RMN 31P ont été réalisés avec une séquence simple impulsion (30°) et avec découplage des protons. Les paramètres suivants ont été utilisés :
- (i) pour l'acquisition : 16K points échantillonnés pour couvrir une fenêtre spectrale de 12 kHz ; délai entre deux impulsions 1s ; 256 à 1024 acquisitions par spectre ;
- (ii) pour le traitement du signal : augmentation de la résolution digitale à 64K ; apodisation du signal avant transformation de Fourier (25 Hz).
Les spectres ont été réalisés à 4 ou 14 °C.
Le 3-(triméthylsylil)-1-propane sulfonique-d6 (TMPS-d6) et l'acide méthylphosphonique ont été utilisés comme référence de déplacement chimique et de quantification des spectres 1H et 31P, respectivement.
2.2 Animaux
Les vers de terre endogés Aporrectodea caliginosa ainsi que les larves du carabe Harpalus rufipes ont été prélevés dans un potager du Sud-Ouest de la France. Les animaux ont été maintenus dans la terre argilo-siliceuse du lieu d'origine, dans l'obscurité et à 14 °C jusqu'au moment de leur analyse, effectuée dans les 12 h suivant le prélèvement.
Des rats mâles Wistar ont été utilisés pour les expériences utilisant des biopsies de tissu (10 à 80 mg).
2.3 Végétaux
Trois variétés de courges potagères ont été analysées : Potimarron et Bleu de Hongrie de l'espèce Cucurbita maxima et Butternut de l'espèce Cucurbita moshata. Les échantillons ont été obtenus par carottage au centre de la partie charnue du fruit (80 ± 7 mg, n = 18). Le cylindre obtenu, de 3 mm de diamètre interne et 14 mm de longueur, est ensuite inséré dans le rotor.
2.4 Protocole d'extraction
Certains échantillons ont été soumis à un protocole d'extraction rapide permettant de séparer simultanément les métabolites hydrosolubles et les lipides [9]. Brièvement, l'échantillon est mixé en présence d'un mélange chloroforme/méthanol/eau dans la proportion volumique de 8:3:2. Après centrifugation et séparation des phases, les solvants sont évaporés pendant 1 h dans un Speed-Vac ; les résidus des différentes fractions sont stockés à −80 °C. Avant l'analyse RMN, la fraction aqueuse et la fraction organique sont reprises dans un solvant deutéré, respectivement D2O et CDCl3. La procédure complète, qui inclut l'extraction des biopsies et la préparation des tubes d'analyse, nécessite 3 h pour 10 à 15 biopsies préparées en simultané.
2.5 Analyse statistique
Les données RMN sont introduites dans le logiciel de traitement AMIX (Bruker) et les spectres sont échantillonnés par pas de 0,02 ppm pour les spectres 1H et 0,3 ppm pour les spectres 31P. La numérisation des intensités des spectres fournit une table croisant les variables avec les individus. L'analyse en composantes principales de cette table est ensuite réalisée.
3 Résultats et discussion
3.1 De la rotation à l'angle magique
La rotation à l'angle magique a pour conséquence d'éliminer les effets de différents phénomènes (variation de susceptibilité magnétique, anisotropie de déplacement chimique et interactions dipolaires), qui contribuent à l'augmentation de la dispersion spectrale du signal.
L'intérêt principal de la technique HR-MAS est d'obtenir des signaux en haute résolution pour les composés présentant une grande mobilité, en éliminant les effets des différences de susceptibilité magnétique pouvant exister au sein de l'échantillon. Ainsi, des spectres 1H et 31P des métabolites du ver Aporrectodea caliginosa non dépuré, c'est-à-dire contenant de la terre minérale, ont été obtenus avec une bonne résolution des signaux [10]. L'analyse RMN 31P du ver in vivo montre, par exemple, une diminution de la largeur de raie de la phospholombricine, qui passe de 160 Hz en RMN conventionnelle à 13 Hz en HR-MAS (Fig. 1). Cette expérience est très comparable du point du vue phénoménologique à l'expérience initiale de validation de l'HR-MAS réalisée par Doskočilová et al., expérience ayant montré pour la première fois qu'il était possible d'obtenir avec une bonne résolution le signal d'un solvant dans un système hétérogène (billes de silice de quelques μm de diamètre) [11]. Les tissus biologiques (à l'exception du sang ou de la lymphe) peuvent grossièrement être considérés comme constitués de cellules maintenues dans un support de nature cellulosique pour les végétaux ou protéique pour les animaux, l'ensemble baignant dans le milieu extracellulaire. La technique HR-MAS diminue d'environ 30% la largeur de raie à mi-hauteur des signaux 1H des tissus du muscle squelettique, du cœur ou du rein de rat par rapport à celle obtenue avec une sonde RMN liquide conventionnelle. Cette diminution est d'environ 1 Hz (Tableau 1). Dans ces tissus, les variations de susceptibilité magnétique sont donc en réalité modérées, expliquant que l'utilisation de la technique HR-MAS n'améliore que modérément la résolution.
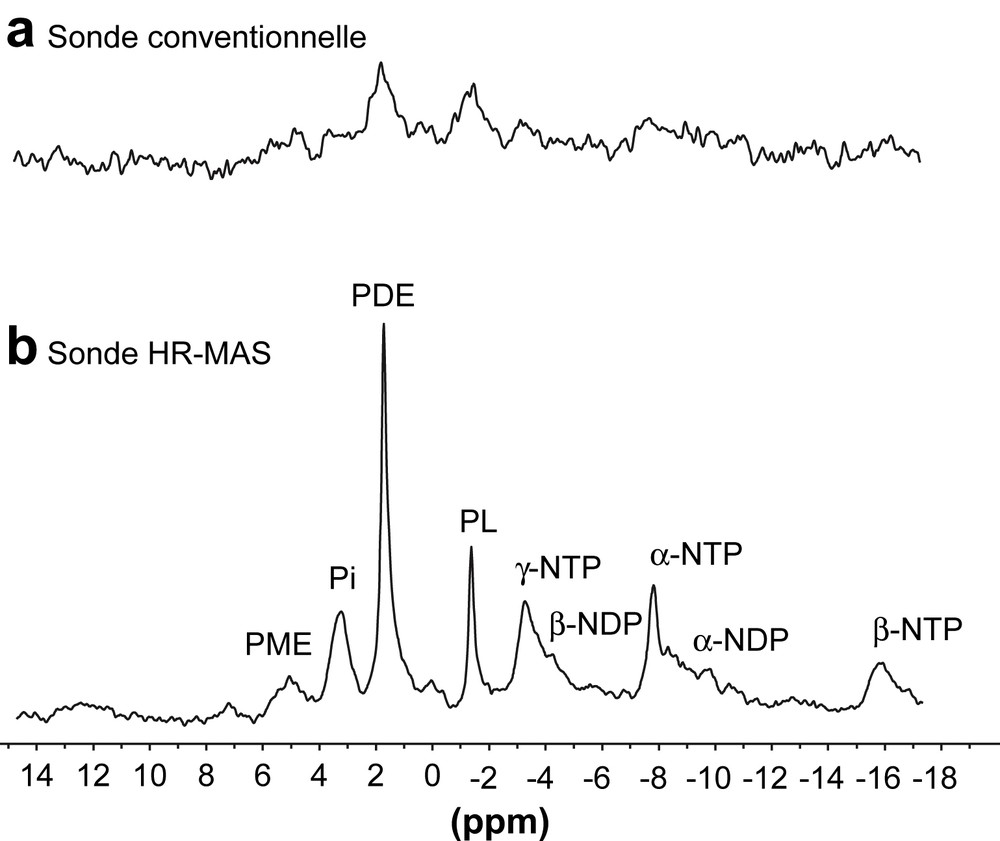
Spectres RMN 31P caractéristiques du ver Aporrectodea caliginosa non dépuré in vivo. (a) Spectre obtenu avec une sonde liquide conventionnelle de 10 mm. (b) Spectre obtenu avec la sonde HR-MAS à une fréquence de rotation de 1 kHz. PME : phosphomonoesters; Pi : phosphate inorganique; PDE : phosphodiesters; PL : phospholombricine; α- et β-NDP : phosphores α- et β- des nucléotides diphosphates; α-, β- et γ-NTP : phosphores α-, β- et γ- des nucléotides triphosphates.
Effet de l'HR-MAS sur la résolution du signal de la créatine
| Largeur à mi-hauteur (Hz) | ||
| Sonde conventionnelle | Sonde HR-MAS | |
| Cœur | 4,7 ± 0,6 | 3,5 ± 0,6 |
| Rein | 4,6 ± 0,5 | 3,6 ± 0,6 |
| Muscle | 4,9 ± 0,4 | 4,0 ± 0,5 |
3.2 De la vitesse de rotation
Compte tenu de ces observations, une vitesse de rotation de quelques dizaines de hertz serait théoriquement suffisante pour éliminer les variations de susceptibilité magnétique existant au sein de l'échantillon [12]. Dans la pratique, cette vitesse de rotation est couramment comprise entre 1 et 5 kHz. Des impératifs de nature différente influent sur le choix de la vitesse de rotation du rotor :
- – impératif technique : le système de régulation pneumatique assurant l'entrainement et la sustentation du rotor impose une vitesse minimum d'utilisation comprise entre 0,6 et 1 kHz, suivant les équipements [10,13] ;
- – impératif physique : les altérations du champ magnétique induites par les différents éléments du rotor avec la présence éventuelle d'air emprisonné sont supérieures à celle de l'échantillon per se. En conséquence, la vitesse de rotation doit être au moins égale à la dispersion spectrale du signal observé en condition statique (liée essentiellement aux inhomogénéités du champ B0 provoquées par la sonde et le rotor), soit de l'ordre de la centaine de Hertz [12] ;
- – impératif de lisibilité des spectres : des bandes latérales de rotation apparaissent et se superposent au spectre lorsque la fréquence de rotation est inférieure à la dispersion spectrale des signaux sur le spectre (Fig. 2). Bien que ces bandes latérales de rotation puissent être éliminées en utilisant des séquences d'impulsions RF [12] ou par combinaison de spectres obtenus à différentes vitesses de rotation [13], ces méthodes impliquent, soit une pondération du signal en fonction du temps de relaxation transversale (T2), soit une augmentation du nombre de spectres par analyse.
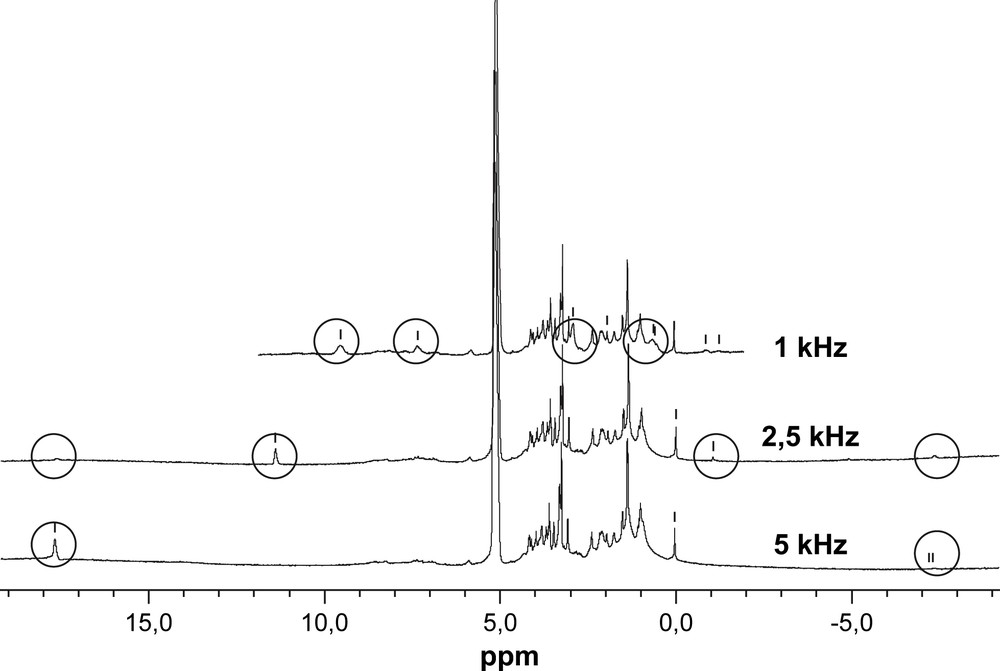
Spectres HR-MAS 1H d'un échantillon de rein de rat (12 mg) obtenus à différentes fréquences de rotation : 1, 2,5 et 5 kHz. Les zones encerclées correspondent aux bandes latérales de rotation.
Les conséquences mécaniques de la vitesse de rotation du rotor sur l'échantillon ont été évaluées de façon théorique [14,15] et pratique [13,16,17]. L'échantillon est soumis à un gradient de force centrifuge de plusieurs dizaines de milliers de g, provoquant des contraintes mécaniques élevées. La pression générée par la force centrifuge peut atteindre plusieurs dizaines de bars dans l'enceinte contenant l'échantillon [15]. L'étude histologique du tissu après analyse HR-MAS montre que sa structure est modérément altérée pour des vitesses inférieures à 700 Hz [13] ou tout du moins reste interprétable d'un point de vue histopathologique. Cependant, le maintien relatif de la matrice du tissu n'exclut pas une altération des cellules, comme cela a été démontré par ailleurs [16]. La plupart des études publiées sont réalisées à une vitesse de rotation comprise entre 1 et 5 kHz. À ces vitesses, nous avons systématiquement observé une modification de l'échantillon, en particulier pour les échantillons qui ont été préalablement congelés, avec apparition d'une phase liquide importante séparée d'un reste fibreux de tissu. Pour certains échantillons, ce liquide d'origine intracellulaire et interstitielle contribuait majoritairement au spectre.
3.3 De l'observation simultanée des métabolites hydrosolubles et des lipides
Les lipides présents dans les échantillons peuvent être classés en deux catégories en fonction de leur capacité à être observés par RMN :
- (i) les lipides à mouvements anisotropes, comme les lipides constitutifs des membranes (phospholipides, cholestérol), qui sont organisés et soumis à un couplage dipolaire et à une anisotropie de déplacement chimique donnant des signaux non résolus couvrant plusieurs centaines de Hertz ;
- (ii) les lipides à mouvements isotropes rapides, comme les lipides neutres (triglycérides) concentrés dans des gouttelettes lipidiques donnant des signaux résolus de quelques hertz.
Sur les spectres obtenus par HR-MAS, la contribution du signal des lipides membranaires augmente avec la vitesse de rotation (Fig. 2). Les signaux des lipides membranaires se superposent alors aux signaux des métabolites sur les spectres 1H (Figs. 2 et 3).
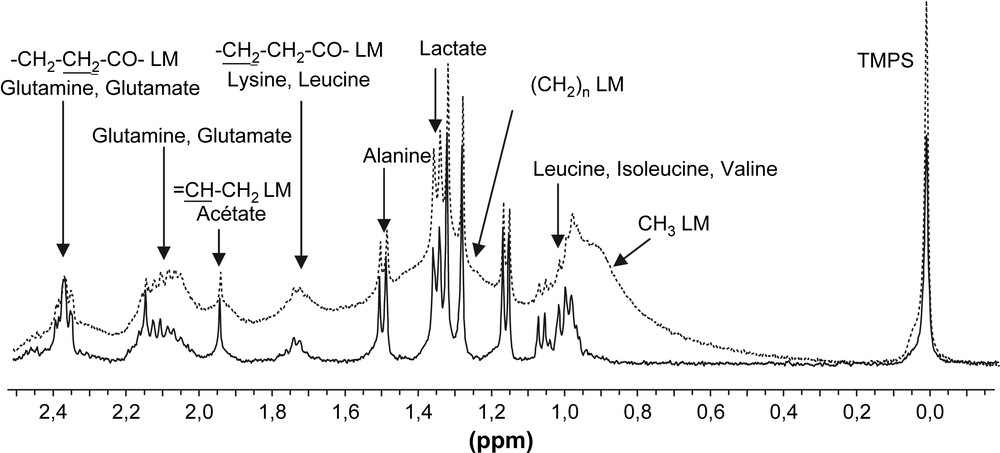
Spectres HR-MAS 1H d'un échantillon de tissu rénal de rat (12 mg). Spectre obtenu avec une séquence simple (impulsion/acquisition) et pré-saturation du signal des protons de l'eau (trait en pointillés). Spectre obtenu avec une séquence d'écho de spin (CPMG) avec un temps d'écho de 120 ms et une pré-saturation du signal des protons de l'eau (trait plein). LM : lipides membranaires.
Les triglycérides de réserve observés dans les tissus ont une résolution spectrale suffisante pour être identifiés et quantifiés. Par exemple, il est possible de mesurer in situ, sur la larve d'un carabe placée directement dans le rotor, le niveau de polyinsaturation moyen et le contenu relatif en lipides insaturés en oméga-3. Cette étude nous a permis de mettre en évidence une adaptation de la larve aux conditions de température hivernale, en observant une augmentation de la concentration relative en lipides oméga-3 (Fig. 4).
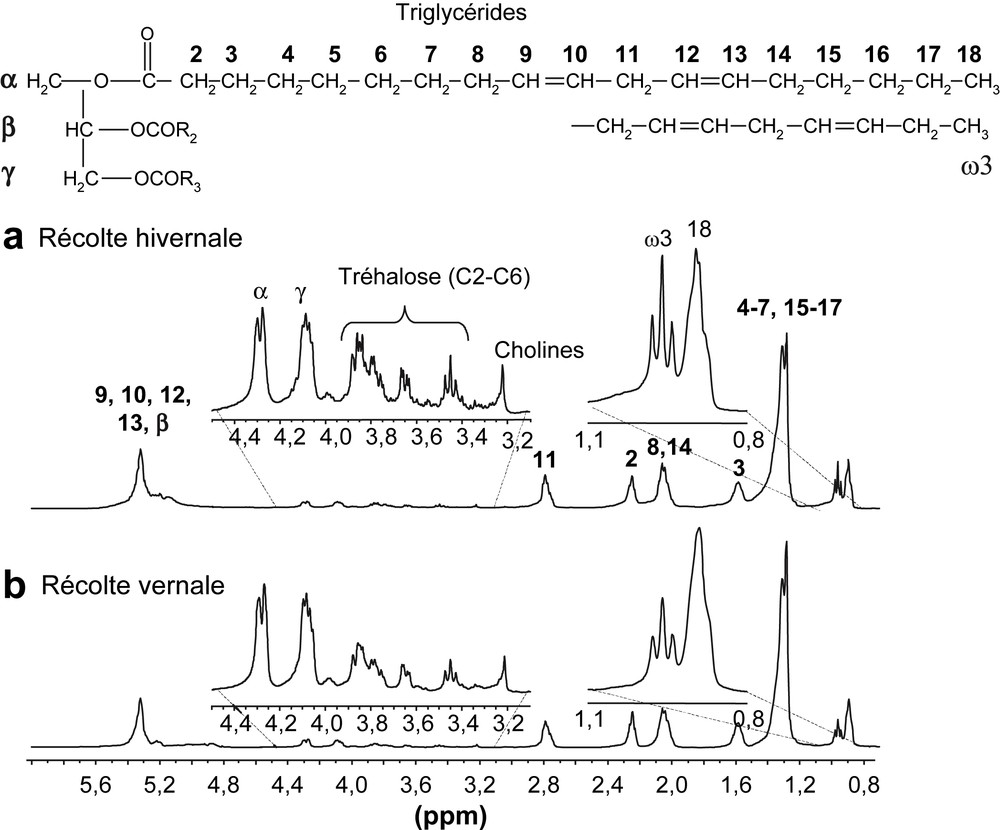
Spectres HR-MAS 1H caractéristiques de larves de carabe (Harpalus rufipes). (a) Larve récoltée en hiver. (b) Larve récoltée au printemps. Spectres obtenus avec une séquence simple (impulsion-acquisition) et pré-saturation du signal des protons de l'eau. Signaux attribués selon la formule générale des triglycérides (formule en insert).
Cependant, l'objectif de la plupart des études étant la détermination des modifications des contenus en métabolites hydrosolubles, l'élimination de la contribution des lipides est habituellement recherchée. La séquence d'écho de spin CPMG qui pondère le signal en fonction du T2 est couramment utilisée pour limiter la contribution des lipides membranaires, dont le temps de relaxation est très court (Fig. 3). En revanche, cette séquence ne permet pas d'atténuer convenablement les signaux provenant des triglycérides. On le constate, par exemple, pour un fragment de rein qui a été prélevé avec du tissu adipeux adhérent (Fig. 5a et b). Ainsi, le spectre HR-MAS, même obtenu avec une séquence CPMG, n'est pas directement exploitable pour l'analyse des métabolites hydrosolubles. Un tel échantillon aurait été rejeté d'une étude alors que l'analyse des métabolites hydrosolubles dans la fraction aqueuse de l'extrait est réalisable (Fig. 5c).
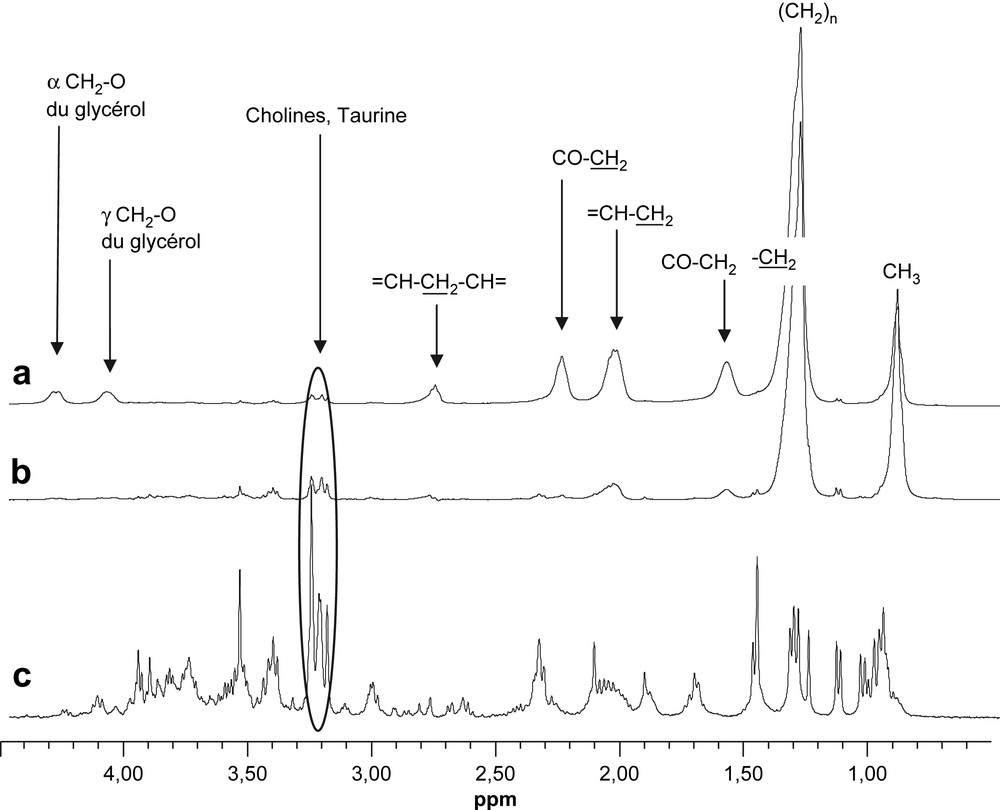
Spectres HR-MAS 1H d'un échantillon atypique de tissu rénal de rat (15 mg) (a) Spectre obtenu avec une séquence simple (impulsion/acquisition) et pré-saturation du signal des protons de l'eau. (b) Spectre obtenu avec une séquence d'écho de spin (CPMG), avec un temps d'écho de 120 ms et pré-saturation du signal des protons de l'eau. (c) Spectre de la fraction aqueuse de l'extrait de cet échantillon. Pour les spectres 5a et 5b, les signaux attribués concernent les triglycérides, à l'exception du signal des composés à choline et de la taurine.
3.4 Une antenne RF et un rotor adaptés à l'analyse de faibles volumes
Par nature, la sonde HR-MAS est limitée à l'analyse des petits échantillons (3 à 50 mg) avec des antennes RF particulièrement adaptées aux faibles volumes de l'ordre de 50 μl pour la sonde HR-MAS 4 mm [15]. De plus, le basculement de l'échantillon permet d'utiliser des bobines de type solénoïde, qui ont un excellent facteur Q [14]. Pour ces échantillons, la sensibilité en 1H de la sonde HR-MAS est donc très supérieure à celle de la sonde BBI 5 mm. Ce constat, bien que trivial, doit cependant être souligné. En effet, nous utilisons avantageusement la sonde HR-MAS, en particulier lorsque notre cryosonde n'est pas disponible, pour analyser les extraits aqueux et organiques obtenus à partir de très petits échantillons.
Les rotors (longueur 21 mm, diamètre intérieur 3 mm) sont composés d'un tube, qui est le plus souvent en zircone (oxyde de zirconium) et de pièces en Kel-f® (polychlorotrifluoroéthylène, PCTFE), avec trois volumes utiles différents, une sphère de 12 μl, un ovoïde de 50 μl ou un cylindre de 92 μl. Les rotors de 12 et 50 μl sont composés de quatre éléments. Après la mise en place de l'échantillon et du D2O dans le tube, un insert servant à limiter la partie supérieure du volume utile est descendu dans le tube. Le volume utile est ensuite isolé de la partie supérieure du tube en serrant une vis (1 mm) pour obstruer l'orifice de l'insert. Enfin, le montage du rotor se termine en plaçant sur le tube un capuchon faisant office de turbine. Pour la plupart des échantillons, afin de limiter la dégradation des composés organiques, ces opérations minutieuses sont réalisées à froid (sur lit de carboglace). Nous avons constaté qu'un déplacement de liquide survenait entre le compartiment de l'échantillon et la partie supérieure du tube en raison de la surpression générée durant la rotation et d'un défaut d'étanchéité entre la vis et l'insert. Ce défaut d'étanchéité rend aléatoire la quantification avec les rotors de 12 μl, seuls les rotors de 50 μl (partiellement remplis à 30 μl) ont été utilisés pour la quantification absolue des composés. L'utilisation d'un rotor étanche [18] ou d'un tube étanche en Kel-f® à insérer dans le rotor permettront d'éliminer ce défaut. Le rotor de 92 μl n'a été utilisé que pour l'analyse directe d'animaux ou d'échantillons cylindriques adaptés (carottage de végétaux, par exemple).
3.5 Des échantillons biologiques
L'origine des tissus biologiques, ainsi que leurs conditions de prélèvement, de stockage et d'analyse, peuvent extrêmement variées. Ces éléments doivent être réellement appréciés avant de débuter une étude, afin d'évaluer leur impact sur la reproductibilité et la validité expérimentales, sur la réutilisation éventuelle de l'échantillon et, enfin, sur la sécurité sanitaire.
Il convient tout d'abord de différencier les analyses réalisées sur le tissu frais des analyses réalisées sur le tissu congelé. Dans la pratique, peu d'études ont une logistique de collection des échantillons compatible avec une analyse immédiate du tissu [19]. La majorité des études est réalisée avec des échantillons qui ont été rapidement congelés dans de l'azote liquide, puis maintenus à −80 °C jusqu'au moment de l'analyse [8,17,18]. En l'absence d'agent cryoprotecteur, le cycle congélation/décongélation détruit les tissus [20]. Cette destruction est essentiellement liée à l'éclatement des cellules constitutives du tissu. Elle affecte donc l'organisation subcellulaire et la compartimentation métabolique. Les différences observées sur les spectres HR-MAS de biopsies du muscle squelettique de la cuisse du rat (biceps femoris) révèlent l'effet délétère de la congélation sur le tissu. Conformément a des observations antérieures [21,22], le contenu en ATP du muscle frais reste constant au moins 2 h à 4 °C, alors qu'il est indétectable dans le muscle ayant subi un cycle de congélation (azote liquide)/décongélation (4 °C) avant l'analyse (Fig. 6a). L'analyse 1H HR-MAS montre, en accord avec les travaux de Middleton et al. [23] sur une biopsie corticale de rein, que les signaux de l'échantillon soumis à un cycle de congélation/décongélation sont mieux résolus (Fig. 6b). La précipitation des protéines et la modification des temps de relaxation [24,25] consécutive au cycle de congélation/décongélation expliquent l'affinement des signaux. En particulier, de nombreuses protéines solubles ne sont pas résistantes à la congélation et peuvent se dénaturer de manière irréversible ou précipiter, provoquant ainsi la libération dans le milieu de ligands ou de métabolites. Nous avons observé, sur certains tissus, que la combinaison des effets du cycle congélation/décongélation et de la centrifugation conduit à la formation d'un exsudat et d'un amas fibreux dans le rotor. À titre anecdotique, signalons que la quantité et la qualité du liquide obtenu par centrifugation est un moyen utilisé par la répression des fraudes pour vérifier qu'une viande commercialisée « fraîche » n'a pas été soumise à un cycle de congélation/décongélation [26].
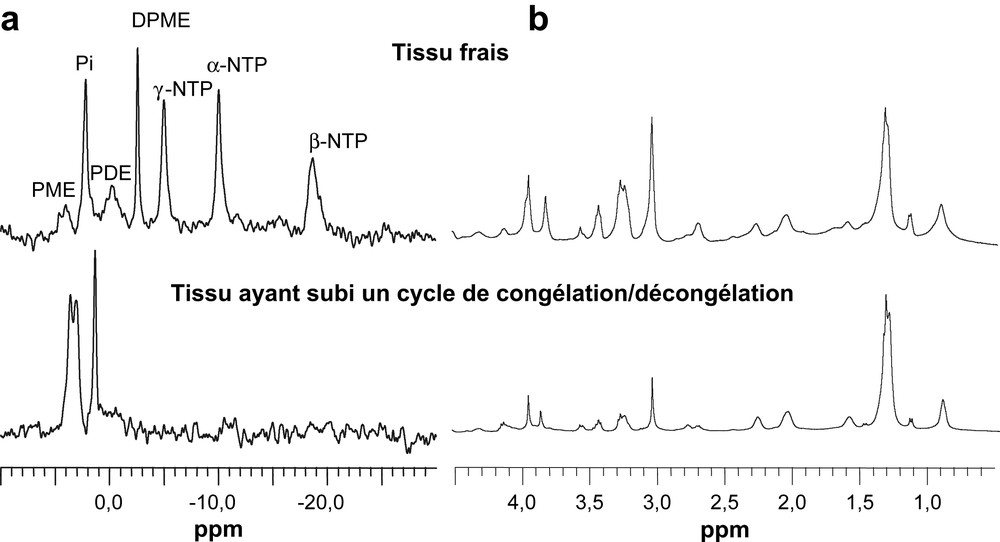
Spectres HR-MAS 31P et 1H d'échantillons frais ou congelé/décongelé de muscle squelettique de rat. (a) Spectres 31P. (b) Spectres 1H. PME : phosphomonoesters; Pi : phosphate inorganique; PDE : phosphodiesters; DPME : diphosphomonoesters; α- et β-NDP : phosphores α et β des nucléotides diphosphates; α-, β- et γ-NTP phosphores α, β et γ des nucléotides triphosphates.
Les biopsies sont des échantillons biologiquement actifs, ce qui implique une activité enzymatique et un risque biologique potentiel. Les modifications du contenu en métabolites sont susceptibles d'intervenir dès le prélèvement, durant le stockage, la préparation de l'échantillon et le temps d'analyse. Malgré la manipulation et l'analyse des échantillons à basse température, la dégradation enzymatique des métabolites persiste [18]. Le risque biologique est particulièrement prégnant pour les échantillons d'origine humaine. En effet, la manipulation des biopsies doit être réalisée en conformité avec les exigences de sécurité sanitaire liées aux risques biologiques L2 ou L3, c'est-à-dire au minimum dans une salle dédiée et sous un poste de sécurité microbiologique (PSM, norme : NF EN 12 469). La mise en place de l'échantillon et le montage du rotor actuel sont peu compatibles avec le respect de ces normes. L'utilisation d'inserts étanches, à usage unique, dans lequel l'échantillon est placé immédiatement après le prélèvement, pourrait être une alternative.
3.6 Signature métabolique et/ou quantification des métabolites
Les méthodes d'analyse statistique multivariée permettent une classification sans a priori de l'ensemble des échantillons. Initialement utilisées pour la représentation des données de la génomique fonctionnelle (transcriptomique), elles sont aujourd'hui appliquées au traitement des données issues des spectres RMN (métabolomique ou métabonomique par RMN) [27,28]. Le profil des intensités des signaux du spectre traduit le contenu en métabolites présents dans l'échantillon donnant ainsi sa signature (ou son empreinte) métabolique. L'analyse en composantes principales (ACP) est couramment utilisée, car elle permet, par réduction des données, une représentation graphique simplifiée en deux dimensions de la distribution des échantillons. La combinaison de l'HR-MAS et de l'ACP constitue une méthode simple et rapide de reconnaissance et de classification des échantillons.
Nous avons utilisé cette méthode pour une étude sur la caractérisation du phénotype métabolique de variétés potagères de courges. La distribution des échantillons des différents fruits déterminée à partir des variables issues des spectres 1H ou 31P HR-MAS permet une identification claire de la variété testée (Fig. 7). Le contrôle indirect de la dérive génétique des variétés ou la mesure du degré de mûrissement des fruits sont des applications pratiques de cette méthode [29].

Analyse en composantes principales de spectres HR-MAS, réalisée sur trois variétés de courges potagères. (a) Représentation des individus suivant les composantes principales CP1 et CP2 calculées avec les variables obtenues à partir des spectres 31P. (b) Représentation des individus suivant les composantes principales CP1 et CP2 calculées avec les variables obtenues à partir des spectres 1H. Les spectres caractéristiques de ces variétés sont présentés à droite de la représentation ACP.
La méthode HR-MAS-ACP est aujourd'hui couramment appliquée aux investigations cliniques, en particulier pour la détection de marqueurs métaboliques, pour l'aide au diagnostic ou le suivi d'effets thérapeutiques [30–32].
La simplicité apparente d'utilisation de la méthode s'accompagne de la difficulté à obtenir en HR-MAS des variations d'intensités qui soient mesurables et spécifiques de l'événement étudié. Les variations aspécifiques des spectres HR-MAS, dues au cycle de congélation/décongélation et à la centrifugation conduisant à une modification de l'intensité des signaux [19], peuvent, pour certains tissus, constituer un biais expérimental.
De même, la variation de l'intensité du signal d'un métabolite, présent en concentration relative élevée ou la modification aspécifique du contenu en lipides (voir § 3.3) modifie le profil du spectre et affecte fortement le résultat de l'analyse en ACP [33]. Des méthodes d'acquisition des spectres (pondération du signal en T2) ou de traitement des données (normalisation par traitement algébrique des variables) permettent de rééquilibrer le poids de ces variables sur l'ACP [34].
Les métabolites à l'origine des variables discriminantes entre les groupes étudiés, qui sont susceptibles de devenir des marqueurs métaboliques potentiels, doivent être identifiés, puis quantifiés. Afin d'obtenir une interprétation globale des études qui sont parfois contradictoires dans le cas de la clinique, la quantification des métabolites est une nécessité. La quantification relative ou absolue permet la comparaison généralisée par méta-analyse des données de différentes sources. Cette quantification est réalisable à partir de signaux identifiés, non superposés et résolus. Ces conditions sont rarement obtenues sur les spectres HR-MAS réalisés avec la séquence simple (impulsion/acquisition) dans lesquels les signaux provenant des lipides (triglycérides de réserve et phospholipides membranaires) se superposent aux signaux des métabolites, en particulier dans la zone de 0,5 à 3 ppm. Le recours à une séquence pondérant les signaux en fonction de leur T2 simplifie le spectre, mais complique sérieusement la détermination quantitative des métabolites. De plus, la quantification suppose une connaissance du temps de relaxation T2 des différents signaux dans tous les groupes expérimentaux étudiés. La forte concentration de l'eau dans les tissus implique de réaliser une pré-saturation de son signal afin de maintenir une bonne dynamique des signaux des métabolites. Cette pré-saturation affecte l'intensité des signaux proches de la résonance des protons de l'eau, et donc leur quantification.
3.7 Observation directe par HR-MAS ou observation des extraits des tissus
La capacité à détecter in situ et en haute résolution les métabolites contenus dans un fragment de tissu, sans extraction préalable, est à l'origine de l'engouement porté à l'utilisation de l'HR-MAS. La RMN permet théoriquement d'accéder à des informations sur l'environnement et la mobilité du composé détecté. Cependant, hormis de rares travaux sur la partition de l'eau [35] et du glyphosate [10], à notre connaissance, aucune information tangible liée à la compartimentation ou à la détermination des fractions libres ou liées de métabolites n'a été obtenue par HR-MAS. La destruction partielle de l'organisation du tissu en est certainement la raison majeure, en particulier pour les tissus préalablement congelés (voir § 3.5).
Dans ces conditions, on s'attend à ce que les informations sur les contenus en métabolites obtenues à partir du spectre HR-MAS d'un échantillon de tissu rénal de rat ou à partir du spectre de la fraction aqueuse de l'extrait de ce tissu soient similaires, comme l'illustre la Fig. 8. L'élimination de l'étape d'extraction de l'échantillon se révèle être l'intérêt principal de la méthode HR-MAS. En évitant une procédure d'extraction, l'utilisation de l'HR-MAS permet d'augmenter très sensiblement le débit des échantillons analysés. Cet avantage sera accentué quand des inserts à usage unique seront disponibles. En effet, ces inserts pourront être pré-remplis, puis congelés sur le site où le prélèvement de la biopsie aura été réalisé. La préparation pour l'analyse HR-MAS sera ainsi réduite à la mise en place de l'insert dans le rotor et limitera le risque biologique (voir 3.5). Compte tenu de la procédure actuelle de stockage et de mise en place des échantillons dans le rotor, le recours à une méthode d'extraction présente toujours des avantages sur les plans logistique, sanitaire et analytique. Des protocoles d'extraction réalisables sous PSM, reproductibles et adaptés à l'analyse par RMN, ont été développés [9,36,37]. Ces méthodes, dérivées de la méthode de Bligh et Dyer [36], offrent une très bonne reproductibilité et remplacent progressivement la méthode classique d'extraction à l'acide perchlorique, qui peut conduire à une dégradation des métabolites [37,38]. La méthode est basée sur une extraction avec un mélange méthanol/chloroforme/eau, ce qui permet d'obtenir simultanément une fraction aqueuse contenant les métabolites hydrosolubles et une fraction organique contenant les lipides. Ces fractions sont biologiquement inactives, donc sans risque biologique, ce qui facilite leur manipulation et leur stockage. Sur le plan de l'analyse RMN l'utilisation d'extraits présente de nombreux avantages. Les spectres obtenus sur ces fractions ne présentent pas d'altération de la ligne de base ; les signaux sont systématiquement résolus sans avoir recours à des séquences d'impulsions qui modifient la proportionnalité entre les signaux. La quantification relative comme absolue est donc simple à réaliser. De plus, les modifications de paramètres physicochimiques de l'échantillon, comme le pH et la température, ou l'ajout de standards peuvent être réalisées afin de résoudre la superposition ou l'attribution de signaux. L'analyse de la fraction organique permet une détermination fine des lipides membranaires et des triglycérides présents dans l'échantillon. Enfin, l'extrait peut être analysé par d'autres méthodes (LC–MS, GC–MS…), qui offrent des informations métaboliques complémentaires.
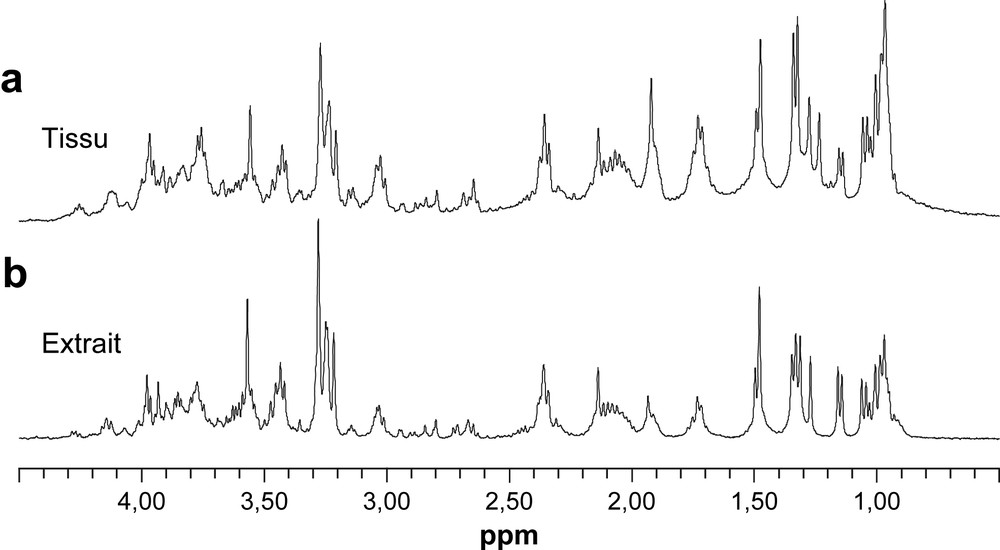
Spectres RMN 1H (a) HR-MAS obtenu avec une séquence d'écho de spin (CPMG), avec un temps d'écho de 120 ms et pré-saturation du signal des protons de l'eau ; (b) de la fraction hydrosoluble du même échantillon de tissu rénal de rat de 11 mg, avec une simple séquence d'impulsion et pré-saturation du signal des protons de l'eau.
4 Conclusion
La RMN HR-MAS présente deux avantages qui permettent d'augmenter sensiblement la cadence d'analyse par rapport à la RMN liquide conventionnelle. D'une part, elle permet l'analyse directe du tissu, sans aucun traitement préalable et, d'autre part, elle est beaucoup plus sensible. Cependant, ces avantages sont fortement contrebalancés par des contraintes et limitations. En particulier, la quantification relative ou absolue des métabolites relève de l'exploit technique et suppose que les paramètres et conditions d'obtention des spectres soient figés pour des études qui, en particulier pour les études cliniques, peuvent se prolonger sur plusieurs années. Une réelle amélioration des conditions d'utilisation de l'HR-MAS surviendra lorsque des inserts à usage unique seront utilisés afin que l'échantillon soit placé et congelé sur le site du prélèvement. Hormis les études que nous avons réalisées en HR-MAS sur des échantillons de tissus frais ou d'animaux vivants, nous préférons, lorsque les tissus ont été congelés, l'analyse conventionnelle des extraits. Par conséquent, dans le cadre des études cliniques que nous avons entreprises, pour lesquelles le flux d'échantillons entrants est inférieur à la cadence d'analyse, ce qui est généralement le cas, nous avons abandonné le recours systématique à l'HR-MAS. Nous privilégions l'analyse fiable et reproductible des fractions hydro- et organo-solubles des extraits des biopsies sur un spectromètre équipé d'une cryosonde.


