1 Introduction
Le silicium est le deuxième élément le plus abondant (27%) de la lithosphère, après l'oxygène. Il est un élément très utilisé dans l'industrie humaine depuis les céramiques et les poteries jusqu'aux piles photovoltaïques. Il est également un élément présent dans la plupart des organismes végétaux et animaux et son rôle est important, que ce soit sous forme de traces, comme par exemple dans la croissance et le développement du squelette des Vertébrés [1–3] ou comme constituant de structure squelettique, que ce soient des tests d'unicellulaires ou le squelette de métazoaires [4]. Au sein des métazoaires, les éponges montrent une diversité de structures siliceuses particulièrement spectaculaire. Deux classes d'éponges, les Hexactinellida, connues aussi sous l'appellation éponges de verre (Fig. 1), et les Demospongiae ont un squelette composé d'éléments de silice, dénommés spicules [5]. Ces deux classes sont actuellement le plus souvent regroupées sous le terme Silicispongiae [6]. Selon les reconstitutions phylogénétiques, ces deux clades auraient un ancêtre commun ayant développé un squelette de silice [7,8]. Ce squelette est constitué de spicules dont le mode de sécrétion est considéré comme homologue dans les deux classes. Quatre-vingt-douze pour cent des éponges actuelles ont un squelette de silice.

Reproduction de deux planches du Challenger [38]. (A) Pheronema giganteum Schulze, 1887 spécimen entier et les différents types de spicules constituant le squelette (pl. XLV). (B) Hyalonema thomsoni Marshall, 1875, individu entier, et les différents microsclères et macrosclères (pl. XXXIV).
2 Morphologie des spicules
Les spicules sont classés en fonction de leur taille en deux grandes catégories : les mégasclères, dont la taille est supérieure à 100 μm et qui peuvent atteindre plusieurs millimètres, voire trois mètres dans le cas exceptionnel de l'hexactinellide Monorhaphis chuni Schulze, 1904 (Fig. 2) et les microsclères, dont la taille est inférieure à 100 μm et qui peuvent au contraire avoir des dimensions de quelques microns pour des épaisseurs parfois bien inférieures au micron (Figs. 1–3). Les deux classes Hexactinellida et Demonspongiae sont définies en fonction du nombre d'axes de symétrie des mégasclères. Six axes de symétrie chez les Hexactinellida et quatre maximum chez les Demospongiae [9]. On reconnaît une douzaine de type de mégasclères et une trentaine de microsclères. Les mégasclères constituent la charpente de soutien des éponges et leur répartition varie selon les espèces elle peut être radiaire, réticulée, axiale, plumeuse etc. La cohésion du squelette est obtenue, soit par un ciment de silice [10] (Hexactinellida, lithistides), soit par un ciment de calcite [11] (Demospongiae, Calcispongiae), soit par de la spongine, ce dernier cas étant présent seulement au sein des Demospongiae et y étant très fréquent [5]. Les microsclères sont d'une infinité de formes, plus esthétiques les unes que les autres (Figs. 1–3). Ils sont souvent situés dans la partie superficielle du corps de l'éponge, où ils peuvent constituer un cortex épais, ou bien une couche relativement fine autour des canaux aquifères, ou bien encore être distribués, sans ordre apparent, dans le corps de l'éponge. Leur rôle s'exerce donc principalement dans le renforcement du squelette. Cependant, dans le cas exceptionnel des éponges carnivores [12] ces microsclères sont utilisés comme un piège pour capturer les proies vivantes. Dans ces mêmes espèces (et en particulier chez Asbestopluma hypogea Vacelet & Boury-Esnault, 1996) un autre type de microsclère est utilisé, à la fois pour accroître la flottabilité des cystes spermatiques et pour permettre de perforer la surface d'un autre individu.

Monorhaphis chuni Schulze, 1904. (A) Spicule géant, échelle 3 cm. (B) Détail de l'extrémité montrant le canal axial (flèche) et les couches de silice, échelle 3 mm. (C) Coupe oblique dans le spicule montrant les diverses couches de silice, échelle 100 μm.
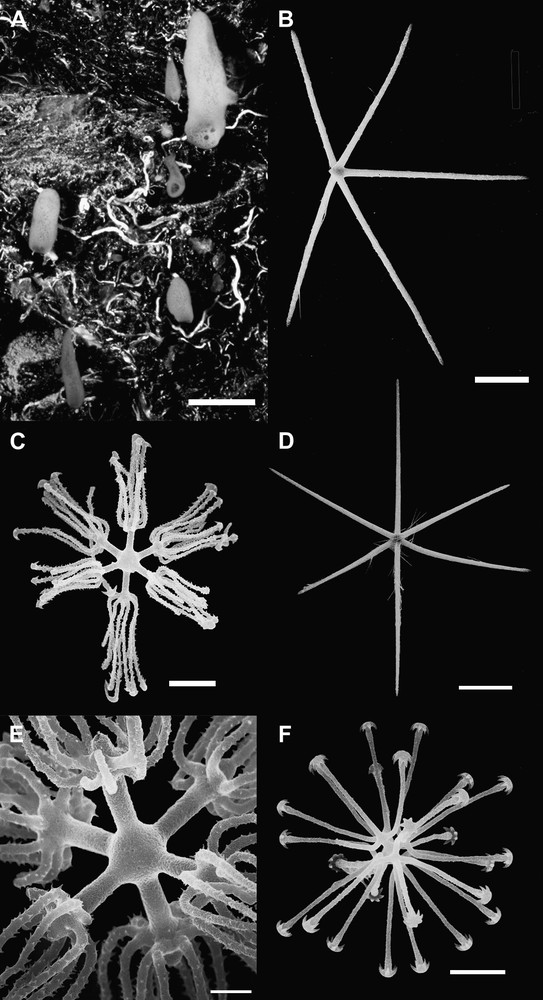
Oopscas minuta Topsent, 1927. Éponge hexactinellide d'une grotte méditerranéenne. (A) Spécimens in situ sur une parois de la grotte, échelle 1 cm (photo Jean Vacelet). (B)–(F) Micrographies au MEB de divers types de spicules présents chez Oopsacas minuta. (B) Pentactine dermique, échelle 30 μm ; (C) discohexaster 1, échelle 6 μm ; (D) hexactine atrial, échelle 52 μm ; (E) détail de la partie centrale d'un discohexaster 1, échelle 1,8 μm ; (F) discohexaster 2, échelle 15 μm.
3 Formation des spicules siliceux
Les spicules siliceux se forment dans un milieu sous-saturé en silicium ; il s'agit donc d'un processus actif. C'est un processus généralement intracellulaire, au moins dans la phase initiale de la formation, et qui est sous contrôle génétique, puisque chaque espèce d'éponge siliceuse possède un squelette caractéristique [5]. Ceci a d'ailleurs conduit les taxonomistes a utilisé les caractères du squelette pour identifier les différents taxa. Les spiculocytes (cellules spécialisées dans la sécrétion des spicules), que ce soit chez les Hexactinellida ou les Demospongiae, possèdent un cytoplasme contenant de nombreuses mitochondries et vésicules. On reconnaît avec certitude un spiculocyte lorsque le filament axial est formé. Celui-ci se trouve au sein d'une vacuole limitée par une membrane appelée le silicalemme [13]. Le filament axial a une section carrée chez les Hexactinellida (Fig. 4) et une section triangulaire ou hexagonale chez les Demospongiae [14]. Ce filament sert en quelque sorte de patron pour le dépôt de la silice. Il a été montré qu'il existait un lien très fort entre les molécules protéiques du filament et la silice [15]. Les molécules organiques les plus importantes de ce filament semblent être des silicatéines, enzymes de la famille des cathepsines [16]. Ces silicatéines catalysent l'hydrolyse et la polycondensation d'alkadoxydes de silice [17]. Une proportion élevée de silice est également présente au sein du filament axial [5,18,19]. Un travail sur la diffraction aux rayons X du filament axial a permis d'émettre l'hypothèse suivante [20] pour décrire les processus de biosilicification des spicules : dans une étape initiale, les unités de silicatéines agissent comme une matrice pour la formation d'une structure très organisée similaire aux matériaux mésoporeux. À cette étape, la sérine et l'histidine pourraient former le centre catalytique pour la polymérisation de la silice dans les mailles formées par les protéines du filament. Dans une seconde étape, le processus continuerait, avec un dépôt de silice amorphe à l'extérieur du filament mésoporeux. Il a également été suggéré que le collagène présent chez toutes les éponges (Hexactinellida, Demospongiae, Calcispongiae) [21] pourrait jouer un rôle dans la silicification, en particulier chez les Hexactinellida [22]. Même si une minéralisation de silice a pu être obtenue in vitro, sous forme de nanosphère, par mélange de collagène et d'une solution de tétraéthylorthosilicate (TEOS) [23], il est probable que des silicatéines interviennent également dans le processus de minéralisation chez les hexactinellides [24]. Récemment, on a synthétisé [25] des nanotubes de silice à double paroi, qui s'auto-organisent en fibres hautement structurée, de l'ordre du centimètre. La minéralisation de ces tubes est obtenue en mettant en contact un gel de lanréotide et une solution de TEOS dans des capillaires de verre. Cette expérience démontre, d'une manière très élégante, que la minéralisation s'effectue en même temps que la croissance de la matrice organique, et que ces deux processus sont interdépendants. Ceci pourrait être un mécanisme plus fondamental utilisé dans les systèmes biologiques en général et dans la synthèse et la croissance des spicules chez les éponges.
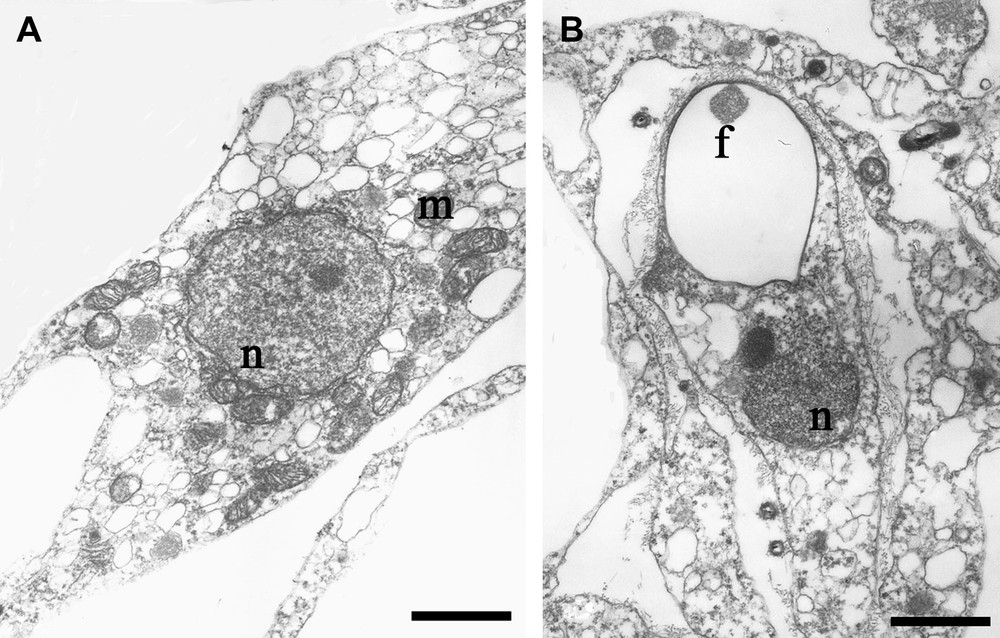
Oopsacas minuta : micrographies en TEM. (A) Spiculocyte avec un noyau nucléolé (n) et de nombreuses mitochondries (m), échelle 0,9 μm. (B) Détail du filament axial de section carrée (f), caractéristique des Hexactinellida, échelle 1,1 μm.
4 Éponges de verre « architecture exceptionnelle »
Non seulement les spicules ont des propriétés optiques semblables à celles des fibres optiques, mais elles sont structurellement plus résistantes et plus flexibles pour une longueur identique [26]. Les spicules d'éponges ont des longueurs qui peuvent varier entre quelques micromètres et trois mètres pour le spicule géant de l'éponge hexactinellide Monorhaphis chuni décrite par Schulze en 1904 [27] au cours de l'expédition de la Valdivia (Fig. 2). Ce spicule a une structure laminée caractéristique (Fig. 2B et C). Ces couches sont secrétées à partir du filament axial (Fig. 2B) et séparées les unes des autres par des intercouches protéiques. Il a été montré [28] que la complexité structurale du squelette d'une autre hexactinellide, Euplectella sp., constitue un exemple de « l'habileté » de la nature à construire une stabilité structurale à un coût minimal. Les spicules d'hexactinellides agiraient également pour concentrer et transmettre la lumière au même titre que les fibres optiques [29–32].
5 Conclusions
La quantité de silice dans l'océan mondial est aujourd'hui réduite, avec l'exception notable des zones bathyales et abyssales et des côtes de l'Antarctique. Il est remarquable de noter que l'abondance des éponges à squelette siliceux, et tout particulièrement des hexactinellides, est corrélée positivement à ces zones riches en silice. Les champs d'hexactinellides décrits dans l'Antarctique [5,33] sont particulièrement spectaculaires. Il a été démontré que la quantité de silice présente dans l'eau avait une influence importante sur la morphologie des spicules [34]. Le filament axial peut se former même dans un milieu très pauvre en silice. Cependant, la silicification n'a lieu qu'à partir d'un taux minimal d'acide orthosilicique. Des cultures de la larve de l'éponge méditerranéenne Crambe crambe ont démontré [35] que la présence des microsclères et des desmes était fonction de la concentration en silice du milieu. L'absence de ces spicules dans la plupart des individus de la Méditerranée nord-occidentale est sans doute liée à un taux de silice de l'eau de mer qui ne permet pas l'expression phénotypique de certains spicules. La diminution considérable des espèces à squelette hypersilicifié (lithistides, hexactinellides) par rapport à leur abondance au Jurassique est vraisemblablement liée à l'abondance des diatomées dans la zone photique de l'océan récent [36,37]. Ces espèces ne restent abondantes que dans le benthos profond et certaines zones côtières de l'océan mondial particulièrement riches en silice, telles que celles de l'Antarctique ou du Pacifique nord-est.


