1 Introduction
Depuis trente ans, il est bien établi que si les solvants dipolaires aprotiques, et notamment le diméthylsulfoxyde, sont de piètres solvatants des anions à charge localisée, ce sont en revanche d'excellents solvants de gros anions polarisables et ce d'autant plus que leur charge est dispersée par effet mésomère [1–4]. Ainsi, contrairement aux acides carboxyliques dont l'acidité décroît progressivement lorsque l'on passe de l'eau au Me2SO [4,5] (le pKa de l'acide benzoique par exemple passe ainsi de 4,20 dans l'eau à 11,1 dans le Me2SO [4]), l'acidité des polynitro diphénylamines augmente régulièrement [6]. C'est ainsi que le pKa de la trinitro diphénylamine passe de 10,50 dans l'eau [7] à 7,97 dans 95 % en volume (83,1 % en fraction molaire) de Me2SO [6]. Une telle situation n'est pas sans incidence sur l'ordre des acidités successives d'acides 2,4,6-trinitro diphénylamine carboxyliques. En effet, si l'acidité de la fonction carboxylique de ces diacides est bien la plus forte dans les milieux riches en eau (chemin 1 du Schéma 1 avec R ≡ groupement picryle), on constate un rapprochement progressif de ces acidités successives lorsque le milieu s'enrichit en Me2SO de sorte que dans les milieux de teneur voisine de 80 - 85% en volume de Me2SO, on observe la coexistence des deux monoanions : carboxylate I1 et amidure I2 (i.e. KT ≈ 1) [8].
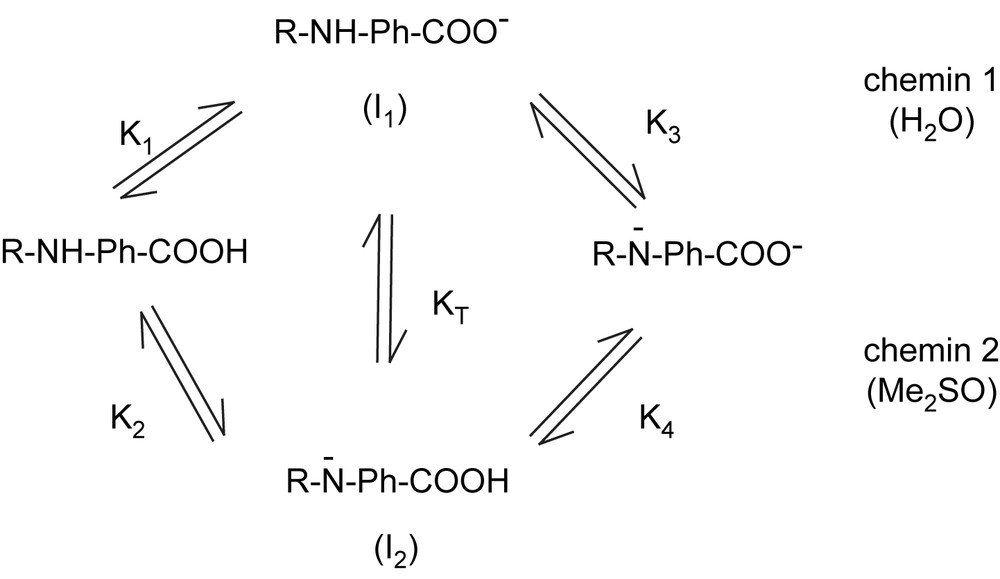
Pour des teneurs plus riches en Me2SO (voir dans Me2SO pur), c'est donc le chemin 2 qui prédomine pour devenir très vite unique [8].
Comme nous avons montré que le groupement 4-nitrobenzofurazanyle (NBD) est un peu plus délocalisant que le groupement picryle (Pic) [9], une telle inversion d'acidité, induite par la composition du milieu, doit également caractériser des structures de type : NBD-NH-Ph-COOH. On peut en effet estimer que l'acidité NH/N− (K2 du Schéma 1) du diacide 7-para carboxy anilino-4-nitrobenzofurazane, noté 4H,COOH doit être très
proche de celle de son ester méthylique (hypothèse d'Ebert [10]), dont nous avons mesuré le pKa (≡ 7,05) [9] dans le mélange eau - Me2SO étudié (20 - 80% en volume). Quant à l'acidité COOH/COO− de 4H,COOH (K1 du Schéma 1), elle doit être très légèrement inférieure au COOH de l'acide 2,4,6-trinitro diphénylamine 4'-carboxylique si l'on se réfère aux effets électroattracteurs comparatifs des groupements NBD et Pic ; celle-ci a été estimée à pK1 = 7,20 [8] dans ce même milieu. On peut donc en conclure que le point d'inversion pour les deux acidités de 4H,COOH (i.e. pour lequel pK1 = pK2, KT = 1) se situerait pour une teneur en Me2SO légèrement inférieure à 80% en volume.
2 Résultats et discussions
Le diacide 4H,COOH a été préparé dans des conditions proches de celles ayant permis l'obtention de l'ester méthylique [9] et le sel monopotassique a été précipité par ajout de chloroforme à une solution de 4H,COOH dans Me2SO, après salification d'une fonction acide par un équivalent de bicarbonate de potassium solide.
La première remarque concerne la quasi-identité des paramètres RMN 1H et 13C du diacide 4H,COOH et de son ester méthylique (Tableaux 1 et 2) ; l'hypothèse d'Ebert concernant la très faible influence de la méthylation sur la structure du diacide est donc ici pleinement justifiée [10]. Concernant le monoanion, on doit noter l'important effet de solvant, quand on passe de D2O au Me2SO-d6, qui ne peut s'expliquer que par une modification structurale du sel. Sous forme carboxylate dans D2O (4H,COO− ; i.e. I1), il est entièrement tautomérisé en amidure (4−,COOH ; i.e. I2) dans Me2SO-d6, comme en témoigne l'identité entre les paramètres RMN 1H et 13C et ceux de l'anion (4−,COOMe) issu de l'ester (à part , cf. Tableaux 1 et 2). A cet égard, un titrage RMN 1H des deux acidités de 4H,COOH a été réalisé dans Me2SO-d6 par la base forte tertiobutylate de potassium (Tableau 3 et Fig. 1).
Comparaison des paramètres RMN 1H du diacide 4H,COOH et son sel monopotassique à ceux de l'ester méthylique correspondant.(solvant : Me2SO). T = 23 °C.
| composé | solvant | |||||||
| 4H,COOH | Me2SO-d6 | 8,56 | 6,99 | 7,56 | 8,03 | 11,13 | 8,7 | 8,6 |
| 4H,COOMe | Me2SO-d6 | 8,57 | 7,01 | 7,63 | 8,05 | 11,16 | 8,8 | 8,7 |
| 4−,COOH | Me2SO-d6 | 7,81 | 5,75 | 6,99 | 7,96 | 10,0 | 8,2 | |
| 4−,COOMe | Me2SO-d6 | 7,80 | 5,69 | 7,00 | 7,94 | 9,9 | 8,2 | |
| 4H,COO– | D2O | 7,60 | 6,16 | 6,95 | 7,73 | 10,2 | 8,6 | |
| 4−,COO− | Me2SO-d6 | 7,68 | 5,73 | 6,75 | 7,82 | 10,2 | 8,2 |
Comparaison des paramètres RMN 13C du diacide 4H,COOH et son sel monopotassique à ceux de l'ester méthylique correspondant (solvant : Me2SO-d6). T = 23 °C.
| composé | |||||||||||
| 4H,COOH | 124,5 | 137,3 | 103,5 | 140,7 | 145,3 | 144,1 | 142,3 | 122,4 | 130,9 | 127,5 | 166,7 |
| 4H,COOMe | 124,8 | 137,2 | 103,7 | 140,6 | 145,4 | 144,1 | 142,8 | 122,3 | 130,8 | 126,2 | 165,6 |
| 4−,COOH | 111,4 | 133,6 | 103,4 | 150,1 | 148,7 | 146,7 | 155,3 | 120,7 | 130,7 | 125,6 | 167,4 |
| 4−,COOMe | 111,2 | 133,8 | 103,5 | 150,6 | 149,0 | 146,9 | 156,6 | 121,0 | 130,8 | 123,9 | 166,3 |
Valeurs des déplacements chimiques 1H correspondants au titrage de 4H,COOH (c ≈ 0,08 M) par le tertiobutylate de potassium. T = 23 °C.
| neq.(tBuOK) | ||||
| 0 | 8,547 | 6,982 | 7,593 | 8,023 |
| 0,23 | 8,381 | 6,682 | 7,450 | 7,982 |
| 0,67 | 8,006 | 6,076 | 7,157 | 7,947 |
| 1 | 7,792 | 5,728 | 6,972 | 7,919 |
| 1,32 | 7,753 | 5,732 | 6,900 | 7,882 |
| 1,78 | 7,701 | 5,730 | 6,800 | 7,835 |
| 2 | 7,680 | 5,731 | 6,746 | 7,824 |
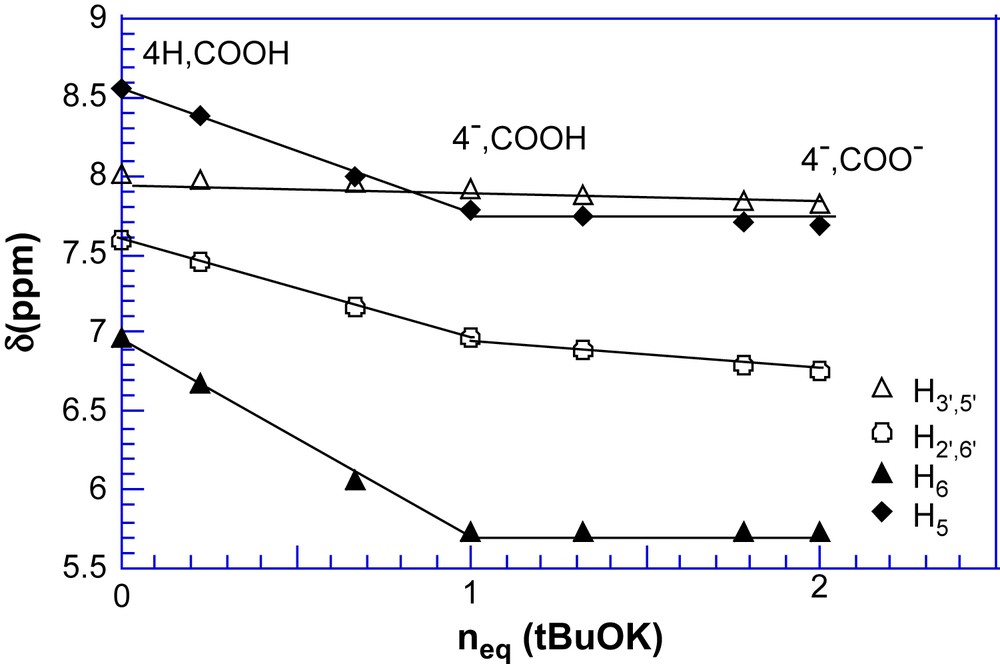
Titrage RMN 1H des deux acidités de 4H,COOH par le tertiobutylate de potassium dans Me2SO-d6. T = 23 °C.
On retrouve bien après ajout d'un équivalent de tBuOK les paramètres RMN 1H du sel isolé 4−,COOH et on peut constater que le passage au dianion 4−,COO− produit moins de modifications des déplacements chimiques que la déprotonation préalable de la fonction amidure.
Compte tenu de la différence importante d'absorption UV - Visible des chromophores NBD-NH-R et NBD-N−-R, il est évident que l'influence du solvant sur le transfert protonique entre le site azoté de I1 et le site carboxylate de I2 est facilement détectable par cette technique. Ainsi, les enregistrements UV - Visible du sel monopotassique de 4H,COOH (c = 6−5 mol l−1), réalisés dans divers mélanges eau - Me2SO (cf. Fig. 2), révèlent qu'à partir d'environ 40% de Me2SO en volume, la bande d'absorption caractéristique de l'anion amidure N− (λmax = 395 nm) apparaît, montrant ainsi que l'anion I1 cède alors progressivement la place à l'anion I2, qui semble être la seule espèce dans Me2SO pur. D'autre part, le tracé sigmoïdique de l'absorbance de 4− relevé à 395 nm en fonction de la teneur en Me2SO (cf. Fig. 3) montre un point d'inflexion aux alentours de 70% de Me2SO en volume qui doit être proche du milieu dans lequel les populations de I1 et de I2 sont identiques (KT = 1 ou pK1 = pK2).
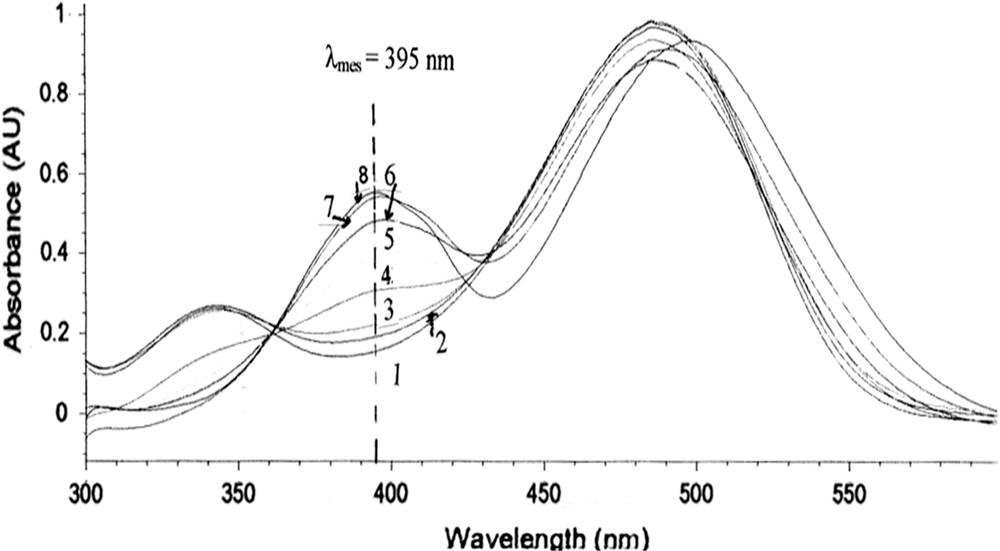
Ionisation de 4H,COOH dans des milieux mixtes eau – Me2SO, T = 25 °C ; c = 6.10−5 mol l−1 ; λmesure = 395 nm : (1) 2%, A = 0,157 ; (2) 20%, A = 0,192 ; (3) 40%, A = 0,221 ; (4) 60%, A = 0,308 ; (5) 70%, A = 0,388 (point d'inflection) ; (6) 80%, A = 0,481 ; (7) 90%, A = 0,542 ; (8) 100% de Me2SO en volume, A = 0,554.
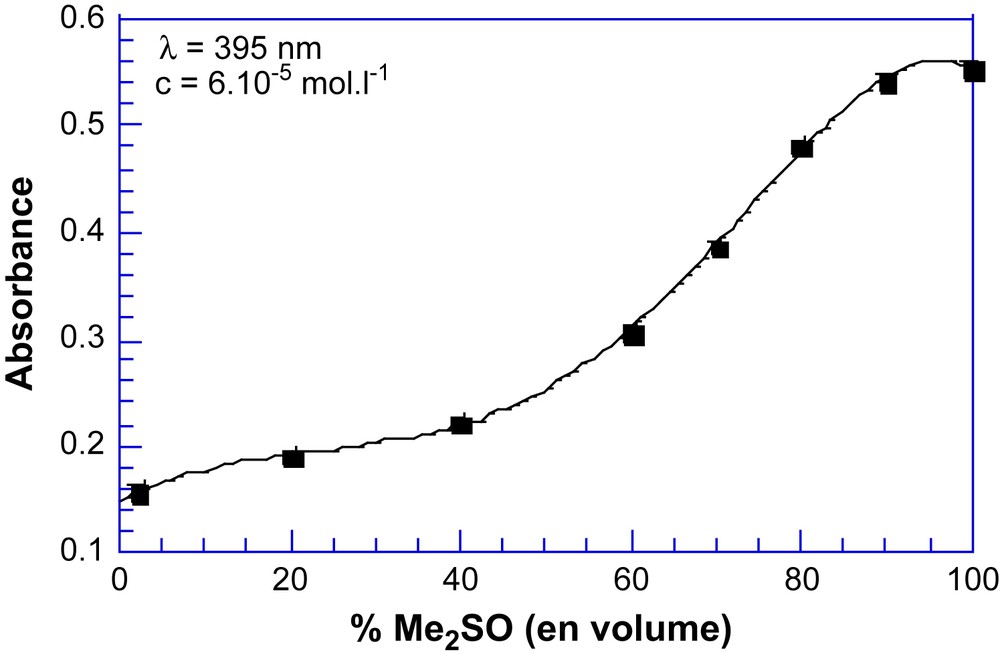
Tracé de la variation de l'absorbance de 4− en fonction de la teneur en Me2SO (en volume) à la longueur d'onde λ = 395 nm. T = 25 °C.
3 Estimation par RMN de la première acidité de 4H,COOH dans Me2SO-d6 pur
Dans la mesure où les déplacements chimiques de certains sites ( et ) du diacide, que l'on notera dorénavant 4H2 pour simplification, sont très sensibles à la déprotonation de la fonction amine (cf. Tableaux 1 et 2), la connaissance du moyenné, correspondant au mélange des deux espèces 4H2 et 4H− en échange rapide permet de calculer les populations de ces deux espèces
| (1) |
| (2) |
Dans la mesure où les signaux de l'acide 3,5-dinitrobenzoique (en mélange avec son sel) risquent d'interférer avec ceux de 4H2/4H− et que le couple Et3NH+/Et3N semble être un peu élevé, nous avons opté pour le 9-cyano fluorène, noté FlH, qui présente le même processus d'ionisation i.e. :
| (3) |
| (4) |
| (5) |
Ainsi, la détermination de K permet d'accéder à à partir de l'étalon 9-cyanofluorène ( = 10−8.3 dans Me2SO pur [13]) :
| (6) |
| (7) |
4 Détermination de la constante K
Si l'on désigne par co et .co les concentrations initiales respectives en 4H− et FlH, et par x leur concentration ayant réagi à l'équilibre, on a d'après (4) et (7)
| (8) |
| (9) |
| (10) |
Une solution de réserve de 4HK (M = 338,3 g mol−1) a été préparée en dissolvant 0,1247 g de sel dans 3,5815 g de Me2SO-d6. Cette solution de réserve contient donc 9,946 × 10−5 mole de 4HK par gramme de solution (compte tenu de la masse volumique du Me2SO-d6 égale à 1,19 g/cm3, cette solution est donc environ 0,12 mol l−1).
A un prélèvement d'environ 0,5 - 0,6 cm3 de cette solution de réserve, de masse mres, on ajoute des masses croissantes mFLH de 9-cyano fluorène solide (M = 191,2 g mol−1) dans le tube RMN. Les données numériques relatives aux quatre expériences réalisées, désignées par les entrées A, B, C et D sont réunies dans le Tableau 4 où apparaissent également les valeurs calculées du rapport défini précédemment.
Préparation et caractéristiques des solutions de mesure RMN.
| Entrée | mres (g) | 105 n4HK (mole) | mFlH (g) | 105 nFlH (mole) | |
| A | 0,5834 | 5,802 | 0,0042 | 2,197 | 0,3787 |
| B | 0,5267 | 5,238 | 0,0135 | 7,060 | 1,348 |
| C | 0,5942 | 5,909 | 0,0344 | 17,989 | 3,044 |
| D | 0,6416 | 6,381 | 0,0505 | 26,408 | 4,139 |
A partir des on peut donc calculer les populations de la forme moléculaire 4H2 en mélange avec son anion 4H−(Tableau 5). Les valeurs ainsi obtenues sont très homogènes bien qu'il soit nécessaire de noter que la moyenne de celles déduites des mesures faites en 13C, soient légèrement inférieures à la moyenne des provenant des mesures faites en 1H (Tableau 6). L'application de l' Éq. (10) à ces valeurs permet l'estimation graphique (cf. Fig. 4) du pK de la réaction d'échange protonique (Éq. (4)). A cet égard, il est logique que la précision maximale soit obtenue pour les solutions C et D pour lesquelles les populations voisines des espèces 4H2 et 4H− encadrent parfaitement le point d'ordonnée nulle (pour lequel ) qui correspond au pK. En revanche, l'écart important entre ces populations rend, en solution A notamment, leur détermination beaucoup plus incertaine (cf. Fig. 4 et Tableau 6) et dans ce cas, il convient d'ajouter l'imprécision sur la pesée du 9-cyano fluorène introduit (Tableau 4).
Valeurs des déplacements chimiques du mélange 4H2 / 4H− correspondant aux solutions A, B, C et D dont les caractéristiques sont indiquées dans le Tableau 4. Les valeurs calculées pour (Éq. (1)) sont indiquées entre parenthèses. i ≡ C4, C7, C1' ; H5, H6 ; [4H2] + [4H−] = 0,12 mol l−1 et T = 23 °C.
| i | C4 | C7 | C1′ | H5 | H6 |
| 4H− | 111,34 | 150,10 | 155,34 | 7,808 | 5,748 |
| A | 113,40 | 148,59 | 153,36 | 7,947 | 5,962 |
| (0,156) | (0,161) | (0,151) | (0,186) | (0,173) | |
| B | 115,94 | 146,85 | 150,85 | 8,084 | 6,197 |
| (0,349) | (0.347) | (0,343) | (0,370) | (0,363) | |
| C | 117,53 | 145,68 | 149,27 | 8,176 | 6,350 |
| (0,469) | (0,472) | (0,464) | (0,493) | (0,487) | |
| D | 118,21 | 145,30 | 148,50 | 8,214 | 6,417 |
| (0,521) | (0,512) | (0,523) | (0,544) | (0,541) | |
| 4H2 | 124,54 | 140,73 | 142,26 | 8,555 | 6,985 |
| 13,20 | −9,37 | −13,08 | 0,747 | 1,237 |
Calcul des populations de la forme moléculaire 4H2 moyenné à partir des (a), (b) et de l'ensemble (c). Application à l'Éq. (10).
| Entrée | ||||
| A | 0,3787 | (a) 0,156 | 0,733 | 0,155 |
| (b) 0,180 | 0,659 | 0,043 | ||
| (c) 0,165 | 0,704 | 0,112 | ||
| B | 1,348 | (a) 0,346 | 0,277 | 0,462 |
| (b) 0,366 | 0,239 | 0,429 | ||
| (c) 0,354 | 0,261 | 0,448 | ||
| C | 3,044 | (a) 0,468 | 0,056 | 0,741 |
| (b) 0,490 | 0,0174 | 0,717 | ||
| (c) 0,477 | 0,040 | 0,731 | ||
| D | 4,139 | (a) 0,519 | −0,033 | 0,844 |
| (b) 0,542 | −0,073 | 0,822 | ||
| (c) 0,528 | −0,049 | 0,835 |
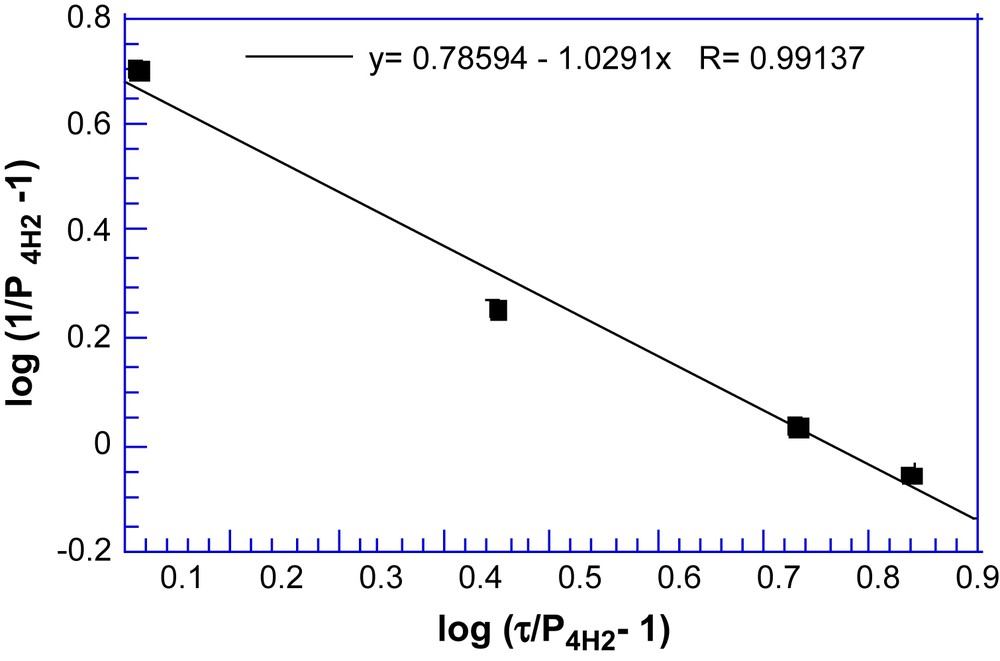
Estimation du pK de la réaction (4) à partir des mesures RMN 1H et 13C. T = 23 °C.
Du pK (=0,8 ± 0,05) ainsi obtenu pour l'équilibre (4), on peut donc estimer la première acidité de 4H2 à (± 0,05) dans le diméthylsulfoxyde si toutefois on admet que les constantes d'acidité, et notamment celle du 9-cyano fluorène (pKa = 8,3 [13]) ne sont pas, ou peu, affectées par la deutération du Me2SO. Cette valeur, est tout à fait compatible avec celle mesurée par spectroscopie (7,05) pour l'ester méthylique dans le mélange Me2SO - H2O de fraction molaire 0,51 en Me2SO.
5 Partie expérimentale
5.1 Préparation des 7-anilino 4-nitrobenzofurazanes 4H,COOH et 4H,COOMe
La condensation des anilines para substituées (produits Aldrich) sur le 7-Chloro 4-nitrobenzofurazane NBD-Cl commercial (produit Fluka) a été réalisée en utilisant le protocole décrit par Ghosh [15].
4H,COOMe : Solide rouge ; Rdt 66% ; F 238 °C. Anal. Calc. : C, 53,51 ; H, 3,21 ; N, 17,83 ; Trouvé : C, 53,80 ; H, 3,31 ; N, 17,58 [9].
4H,COOH : Solide rouge ; Rdt 60% ; F 220 °C. Anal. Calc. : C,52,02 ; H,2,67 ; N,18,67% ; Trouvé : C,52,15 ; H,2,73 ; N,18,52%.
5.2 Matériels
L'ionisation de 4H,COOH a été suivie sur un spectrophotomètre UV-Visible HP8453.
Les enregistrements RMN ont été réalisés sur un spectromètre Bruker AC 300.


