1 Introduction
Actuellement, les rejets de l'industrie textile sont chargés en colorants [1,2]. Ces rejets présentent un véritable danger pour l'homme et son environnement en raison de leur stabilité et de leur faible biodégradabilité [3,4]. L'élimination des colorants dans les eaux résiduaires, se base sur l'utilisation de la méthode classique du traitement qui comporte deux parties : l'une physico-chimique caractérisée par l'ajout de réactifs chimiques (chlorures d'aluminium, chlorures ferriques,⋯) et l'autre biologique réalisée à l'aide des boues activées sous une aération suffisante [5]. La difficulté rencontrée avec l'utilisation des agents de coagulation-floculation, réside dans le fait qu'il est pratiquement impossible d'éliminer toute la quantité de colorants dans l'eau en plus de la mauvaise décantabilité des flocons formés [6]. Les procédés de traitement biologique sont très peu utilisés dans le traitement des eaux polluées par des colorants à cause de la faible biodégradabilité des colorants. A l'échelle industrielle, on utilise le couplage physicochimie-biodégradation pour éliminer la pollution des colorants. D'autres traitements physico-chimiques sont actuellement utilisés. Ils incluent la chloration, l'ozonation et l'osmose inverse. Toutes ces méthodes sont sensiblement différentes en termes d'élimination de la couleur, le fonctionnement et le coût financier [7,8].
La nouveauté de ce travail est d'apporter une contribution dans ce domaine, en proposant un nouveau procédé de traitement des eaux colorées. Dans ce contexte, nous nous sommes proposés de tester de nouveaux adsorbants compétitifs au charbon actif. Parmi ces adsorbants : la bentonite et le kaolin.
La bentonite est une argile de type montmorillonite. Le feuillet élémentaire de la montmorillonite est formé par une couche octaédrique comprise entre deux couches tétraédriques (T–O–T). Les ions Si4+ sont situés à l'intérieur d'un tétraèdre dont les sommets sont occupés par des atomes d'oxygènes. Les ions Al3+ sont situés à l'intérieur d'un octaèdre dont les sommets sont occupés par quatre atomes d'oxygènes et deux ions hydroxyles. Les feuillets élémentaires sont de type 2/1 séparés par des molécules d'eau et des cations échangeables [9,10]. Le kaolin est une argile qui se compose de kaolinite. Le feuillet élémentaire est de type 1 :1 composé d'une couche de silice et d'une couche d'alumine. Le contact se fait entre un plan contenant les ions hydroxyles OH− de l'octaèdre, et celui contenant les ions d'oxygène O2− du tétraèdre. Ce qui se traduit par de liaisons fortes qui empêchent l'hydratation entre les couches [11,12].
2 Matériel et méthode
2.1 Matériaux utilisés
La bentonite utilisée au cours de notre travail est extraite du gisement de Hammam-Boughrara à Maghnia (Tlemcen). Elle nous a été fournie à l'état finement broyé (environ 54% des grains ont un diamètre inférieur à 2 μm) par la société (ENOF), des bentonites de Maghnia (Tlemcen). Le kaolin utilisé provient du gisement de Tamazert (Mila). Il nous a été fourni par l'entreprise du céramique de Ghazaouet (Tlemcen) à l'état finement broyé (environ 39% des grains ont un diamètre inférieur à 2 μm). Les valeurs des surfaces spécifiques mesurées par adsorption d'azote à 77 K pour Les deux argiles sont très proches 23 m2/g pour la bentonite et 22 m2/g pour le kaolin.
Pour la réalisation de notre travail, nous nous sommes intéressés à l'élimination de trois colorants : le Jaune Bezanyl, le Rouge Bezanyl et le Vert Nylomine. Ce sont des colorants acides appartenant à la catégorie des colorants solubles dans l'eau. Ils nous ont été fournis par la société de production de soie artificielle (SOITEX) de (Tlemcen). Ces colorants sont produits et commercialisés par des firmes étrangères et portent des dénominations commerciales codées.
Avant les études des cinétiques et des équilibres d'adsorption des colorants sur les argiles utilisées, la première approche consiste à la détermination des propriétés spectrophotométries de ces trois colorants : détermination de λmax pour laquelle l'absorbance est maximale (Tableaux 1 et 2).
Composition chimique des argiles utilisées.
| % Massique | Bentonite | Kaolin |
| SiO2 | 65,2 | 49,3 |
| Al2O3 | 17,25 | 33,5 |
| Na2O | 3 | 0,09 |
| CaO | 5 | 0,08 |
| K2O | 1,7 | 2,75 |
| MgO | 3,10 | 0,4 |
| SiO2/Al2O3 | 3,78 | 1,47 |
Déterminations des λmax des colorants utilisés.
| Colorants | λmax (nm) |
| Jaune Bezanyl (E-4G) | 403 |
| Rouge Bezanyl (E-3G) | 512 |
| Vert Nylomine (C-8B) | 604 |
2.2 Cinétique d'adsorption
Pour étudier les cinétiques d'adsorption des colorants à 25 °C, un volume de 0,3 l de solution contenant le colorant de concentration 100 mg/L est mis en contact, au temps t = 0, avec une quantité de 1 g d'adsorbant dans un bécher de 0,5 l. La vitesse d'agitation est fixée à 400 tours par min. Pour déterminer la concentration instantanée du colorant en fonction du temps, l'échantillon est centrifugé pendant 5 min à 3000 , puis le surnageant est immédiatement dosé par un spectrophotomètre UV–visible.
La quantité de colorant fixée par gramme d'adsorbant est donnée par la relation suivante :
La constante de vitesse d'adsorption du premier ordre est déduite à partir du modèle établi par Lagergreen [13]. Dans le souci d'approcher le plus possible le mécanisme réactionnel réel, Ho et Mc Kay [14,15] ont opté plutôt pour un modèle cinétique d'ordre 2. Ces modèles mathématiques ont été choisi d'une part pour sa simplicité et d'autre part par son application dans le domaine d'adsorption des composés organiques sur les différents adsorbants.
Pour le premier ordre : la constante de vitesse kv est donné par la relation suivante :
Pour le pseudo second ordre, la constante de vitesse K est donnée par la relation suivante :
Pour le second ordre, la constante de vitesse k est donnée par la relation suivante :
Avec : qe : Quantité d'adsorbat à l'équilibre par gramme d'adsorbant (mg/g), t : le temps de contact (min), kv, K et k : Constantes de vitesse d'adsorption respectivement pour le premier ordre (min−1), le pseudo second ordre (g min/mg) et le second ordre (min−1 g/mg).
2.3 Isothermes d'adsorption
Pour étudier les isothermes d'adsorption des colorants par la bentonite et le kaolin, des volumes de 0,05 l de concentrations différentes de colorant allant de (10 à 500 mg/l) sont mis en contact avec une masse de 0,1 g de l'adsorbant. Les conditions expérimentales sont analogues à celles des cinétiques d'adsorption.
2.3.1 Modélisation de l'isotherme d'adsorption
La dernière étape de l'étude des isothermes consiste à modéliser la courbe, ou plus précisément, à rendre compte par une équation mathématique de l'ensemble de la courbe. Les modèles classiques de Langmuir et de Freundlich caractérisant la formation d'une monocouche seront utilisés pour leur simplicité de mise en œuvre.
Le modèle de Langmuir [16] est basé sur les hypothèses suivantes :
La formation d'une seule couche d'adsorbat sur la surface de l'adsorbant, l'existence de sites définis d'adsorption, la surface est uniforme avec absence d'interaction entre les molécules adsorbées.
L'équation de Langmuir s'écrit de la façon suivante :
Le modèle de Freundlich [17], est basé sur une équation empirique traduit une variation des énergies avec la quantité adsorbée. Cette distribution des énergies d'interaction s'explique par une hétérogénéité des sites d'adsorption. Contrairement au modèle de Langmuir, l'équation de Freundlich ne prévoit pas de limite supérieure à l'adsorption ce qui restreint son application aux milieux dilués. En revanche, ce modèle admet l'existence d'interactions entre les molécules adsorbées [18]. Elle est de la forme suivante :
Avec : k : la capacité de l'adsorbant (l/g) et n : facteur d'hétérogénéité.
3 Résultats et discussions
3.1 Cinétiques d'adsorption des colorants par les différentes argiles
Les Figs. 1–3, représentent l'évolution de la quantité adsorbée en fonction du temps. Les cinétiques d'adsorption des colorants sur les argiles utilisées présentent les mêmes allures caractérisées par une forte adsorption du colorant sur l'argile dès les premières minutes de contact colorant–argile, suivie d'une augmentation lente jusqu'à atteindre un état d'équilibre(Figs. 4–9)

Cinétiques d'adsorption du Jaune Bezanyl sur les argiles utilisées.
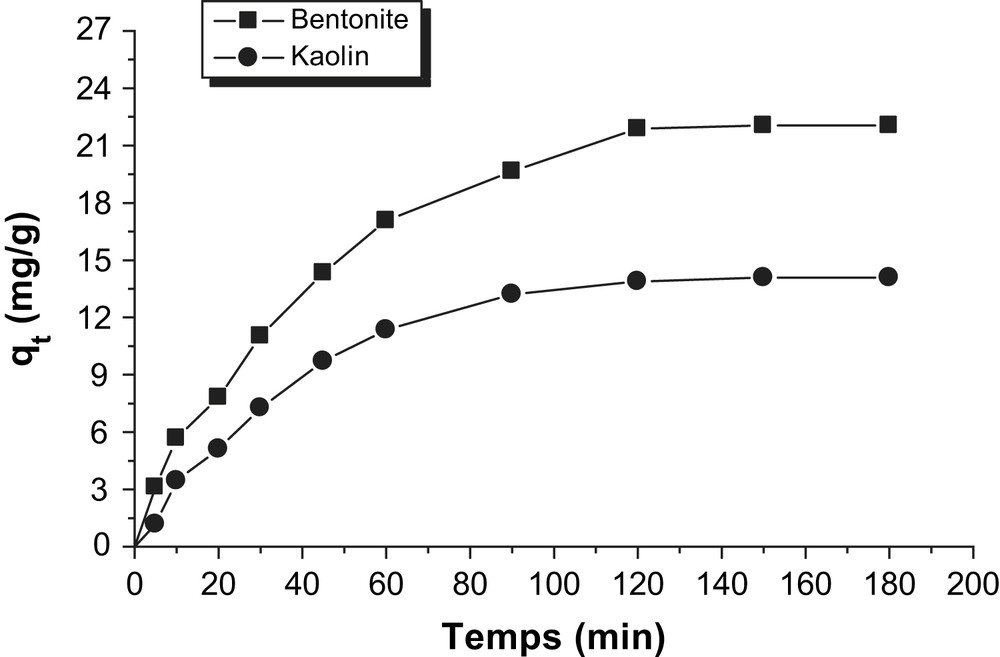
Cinétiques d'adsorption du Rouge Bezanyl sur les argiles utilisées.
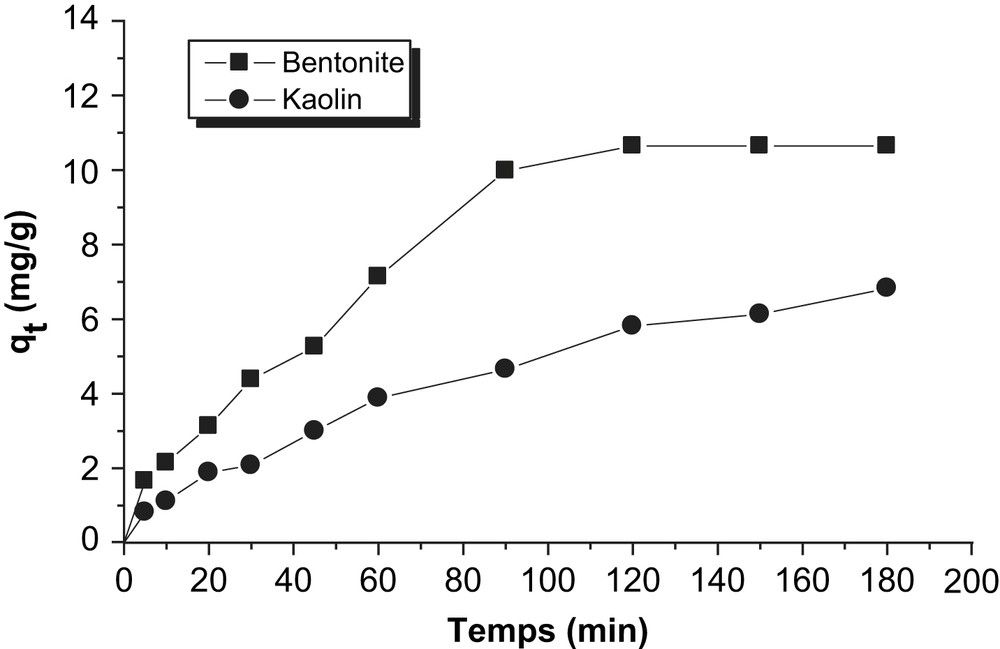
Cinétiques d'adsorption du Vert Nylomine sur les argiles utilisées.
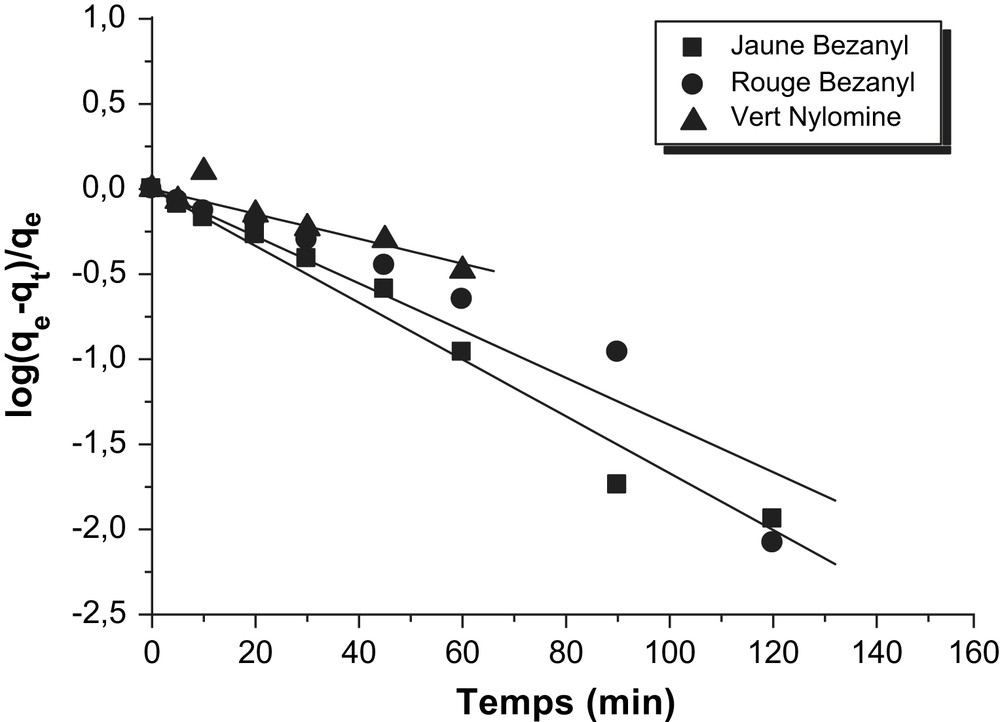
Détermination des constantes de vitesse du premier ordre de l'adsorption des colorants par la bentonite.
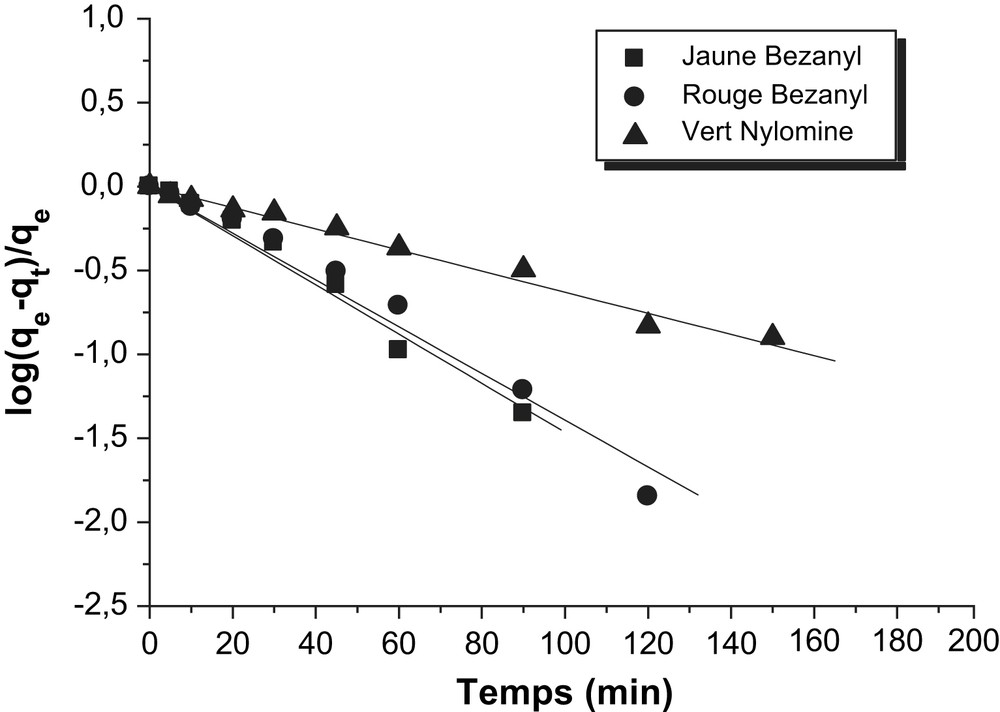
Détermination des constantes de vitesse du premier ordre de l'adsorption des colorants par le kaolin.
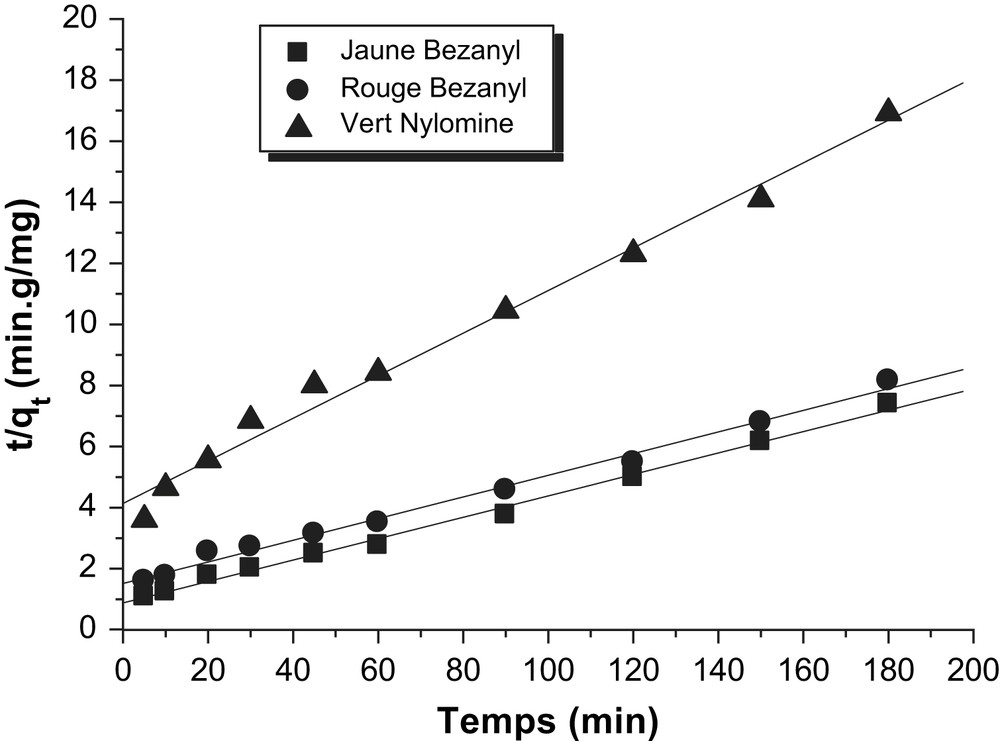
Détermination des constantes de vitesse du pseudo second ordre de l'adsorption des colorants par la bentonite.
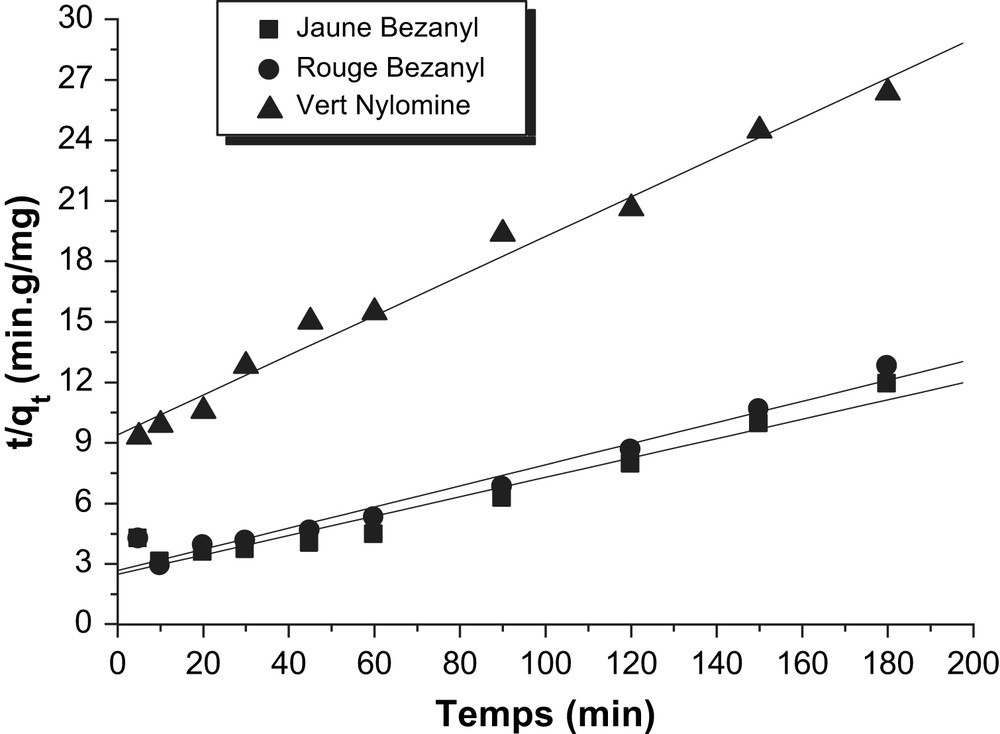
Détermination des constantes de vitesse du pseudo second ordre de l'adsorption des colorants par le kaolin.
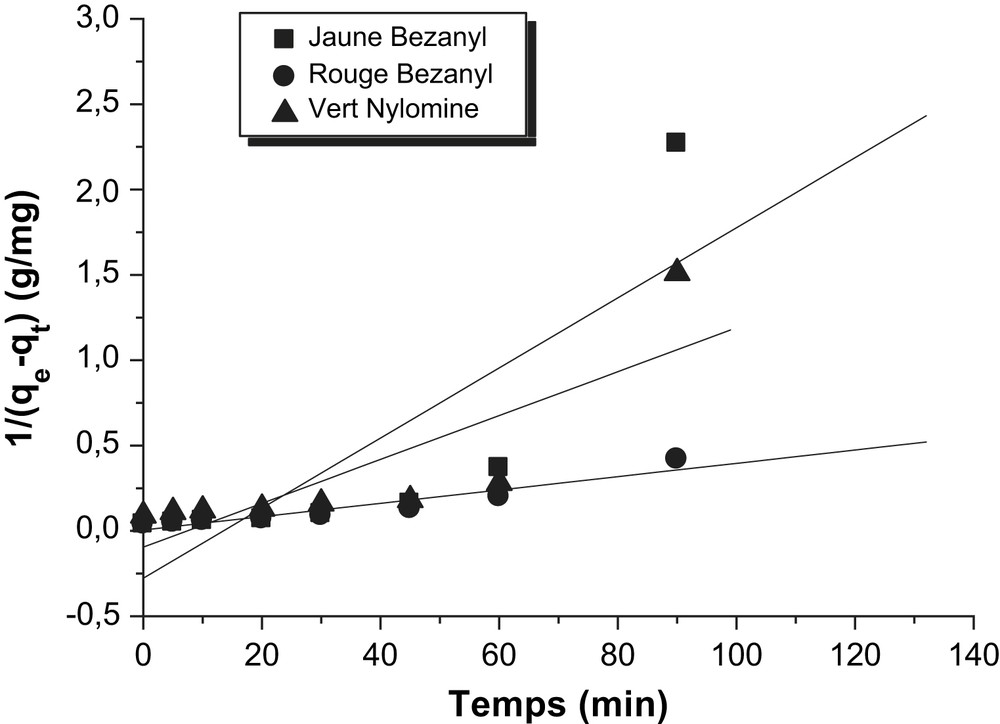
Détermination des constantes de vitesse du second ordre de l'adsorption des colorants par la bentonite.
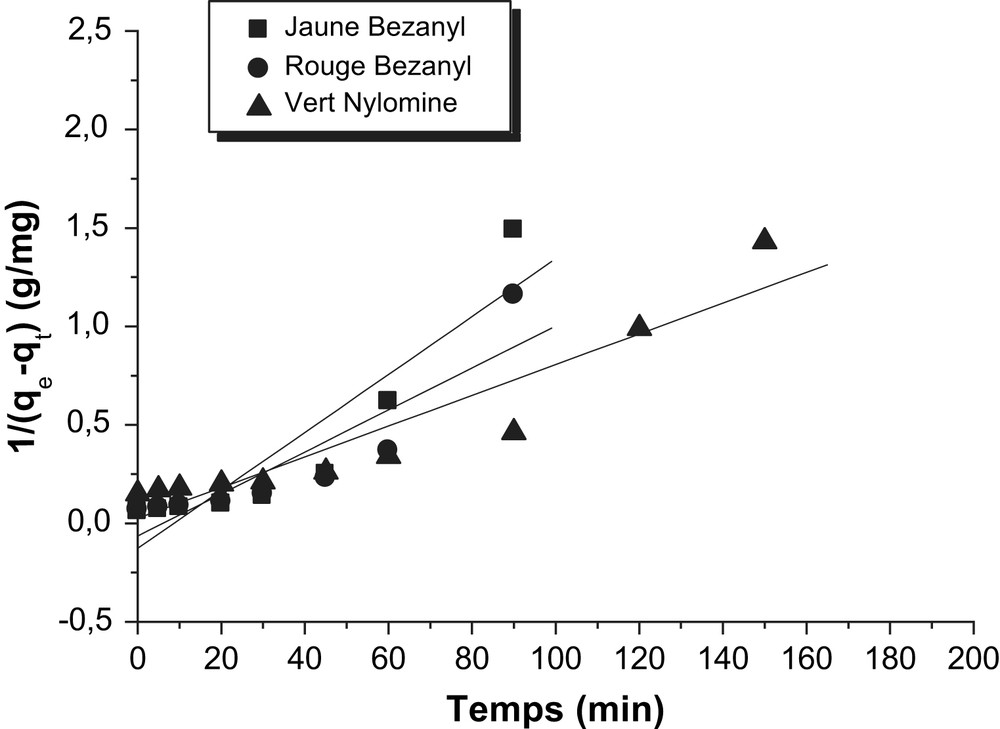
Détermination des constantes de vitesse du second ordre de l'adsorption des colorants par le kaolin.
La cinétique d'adsorption rapide pendant les premières minutes de réaction, peut être interprétée par le fait qu'en début d'adsorption, le nombre des sites actifs disponibles à la surface du matériau adsorbant, est beaucoup plus important que celui des sites restant après un certains temps [19,20].
A l'état d'équilibre la bentonite fixe davantage ces trois colorants que le kaolin. Le vert Nylomine est le colorant le moins adsorbé quelque soit l'argile utilisée. Le temps d'équilibre est presque identique pour toutes les cinétiques réalisées varie entre 120 et 150 min. A l'exception du couple kaolin – Vert Nylomine, l'équilibre est atteint à 180 min, au-delà de ce temps nous avons constaté que la quantité fixée est constante qui est de l'ordre de 6,83 mg/g.
Les constantes de vitesse d'adsorption des colorants sur la bentonite et le kaolin pour le premier, le pseudo second ordre et second ordre sont déterminées graphiquement. Pour chaque couple colorant – bentonite ou colorant – kaolin, nous avons calculé les constantes de vitesses pour le premier, pseudo second ordre et le second ordre à partir des droites obtenues.
D'après les résultats obtenus indiqués sur les Tableaux 3–5, nous remarquons que le modèle de pseudo second ordre est le plus fiable pour déterminer l'ordre des cinétiques d'adsorption des différents colorants par la bentonite et le kaolin et qui représente un bon coefficient de corrélation (R2 = 0,99). De même et d'après les valeurs de qe montrées sur le Tableau 6, on remarque que cette valeur calculée par le modèle de pseudo second ordre est très proche à celle déterminée expérimentalement ce que justifié encore que les cinétiques d'adsorption des colorants utilisés par la bentonite et le kaolin sont de pseudo second ordre. Plusieurs études [21–23] ont trouvé que les cinétiques d'adsorption des colorants sur les supports argileux obéissent au pseudo-seconde ordre.
Constantes de vitesse du premier ordre.
| Adsorbants | Colorants | kv (min−1) | R2 |
| Bentonite | Jaune Bezanyl | 0,038 | 0,989 |
| Rouge Bezanyl | 0,014 | 0,956 | |
| Vert Nylomine | 0,011 | 0,944 | |
| Kaolin | Jaune Bezanyl | 0,034 | 0,982 |
| Rouge Bezanyl | 0,032 | 0,979 | |
| Vert Nylomine | 0,034 | 0,981 |
Constantes des vitesses du pseudo second ordre.
| Adsorbants | Colorants | qe (mg/g) | K (min−1 g/mg) | R2 |
| Bentonite | Jaune Bezanyl | 28,51 | 0,006 | 0,993 |
| Rouge Bezanyl | 28,2 | 0,012 | 0,990 | |
| Vert Nylomine | 14,35 | 0,005 | 0,993 | |
| Kaolin | Jaune Bezanyl | 20,82 | 4 × 10−4 | 0,991 |
| Rouge Bezanyl | 19,08 | 5 × 10−4 | 0,992 | |
| Vert Nylomine | 10,19 | 5 × 10−4 | 0,992 |
Constantes des vitesses du second ordre.
| Adsorbants | Colorants | qe (mg/g) | k (min−1.g/mg) | R2 |
| Bentonite | Jaune Bezanyl | 3,61 | 0,02 | 0,827 |
| Rouge Bezanyl | 17,7 | 0,004 | 0,978 | |
| Vert Nylomine | 10,51 | 0,013 | 0,822 | |
| Kaolin | Jaune Bezanyl | 7,88 | 0,014 | 0,842 |
| Rouge Bezanyl | 15,54 | 0,010 | 0,802 | |
| Vert Nylomine | 39,71 | 0,007 | 0,879 |
Comparaison de la quantité adsorbée des différents colorants à l'équilibre par la bentonite et le kaolin entre l'expérience et les modèles utilisés.
| Adsorbants | Colorants | qe exp (mg/g) | qe cal (mg/g) pseudo second ordre | qe cal (mg/g) second ordre |
| Bentonite | Jaune Bezanyl | 24,33 | 28,51 | 3,61 |
| Rouge Bezanyl | 22,05 | 28,2 | 17,7 | |
| Vert Nylomine | 10,64 | 14,35 | 10,51 | |
| Kaolin | Jaune Bezanyl | 15,12 | 20,82 | 7,88 |
| Rouge Bezanyl | 14,08 | 19,08 | 15,54 | |
| Vert Nylomine | 6,83 | 10,19 | 39,71 |
3.2 Equilibres d'adsorption
Pour mesurer les isothermes d'adsorption des colorants par la bentonite et le kaolin à 25 °C, la durée de mise en contact solution–adsorbant a été fixée à 6 h, temps au-delà duquel on est assuré qu'il n'y a aucune variation significative de la concentration des colorants à l'équilibre. Ce temps d'équilibre a été choisi sur la base des résultats des cinétiques d'adsorption des colorants par les argiles utilisées obtenues qui est de l'ordre de 2 h.
D'après les Figs. 10 et 11, nous observons que les isothermes d'adsorption du Jaune Bezanyl, le Rouge Bezanyl et le Vert Nylomine sur bentonite et le kaolin, ont la même allure : la quantité du colorant augmente plus au moins rapidement pour de faibles concentrations en solution, puis s'atténue pour atteindre un plateau formé correspondant à une saturation des sites d'adsorption, et traduisant une adsorption en monocouche. L'isotherme obtenu est de type L d'après la classification de Giles [24].
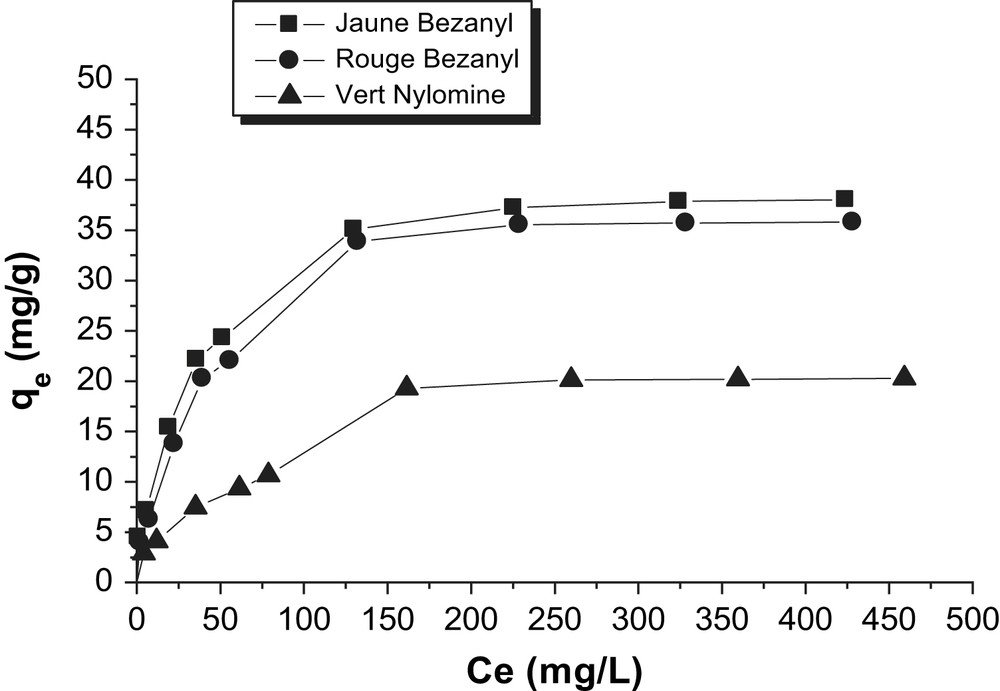
Isothermes d'adsorption des colorants par la bentonite à 25 °C.
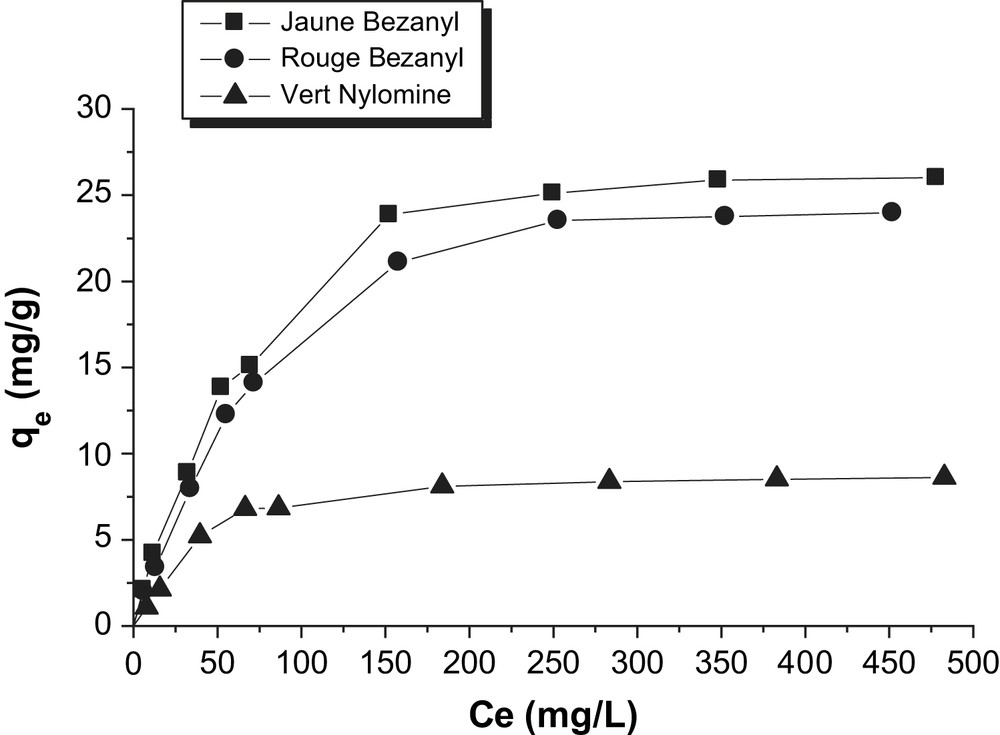
Isothermes d'adsorption des colorants par le kaolin à 25 °C.
La modélisation des isothermes d'adsorption des colorants sur la bentonite par le modèle de Langmuir, a été réalisée avec la forme linéarisée Ce/qe = f (Ce).
D'après les Figs. 12 et 13, nous remarquons que la linéarisation des isothermes d'adsorption des colorants par la bentonite et le kaolin sont satisfaisantes avec de bons coefficients de corrélation. Nous pouvons dire que le modèle de Langmuir, est adéquat pour une bonne description de ces isothermes d'adsorption. Les valeurs de qm obtenues (Tableau 7) pour chaque colorant, confirment la tendance observée précédemment en suivant l'ordre d'affinité des colorants sur la bentonite et le kaolin.
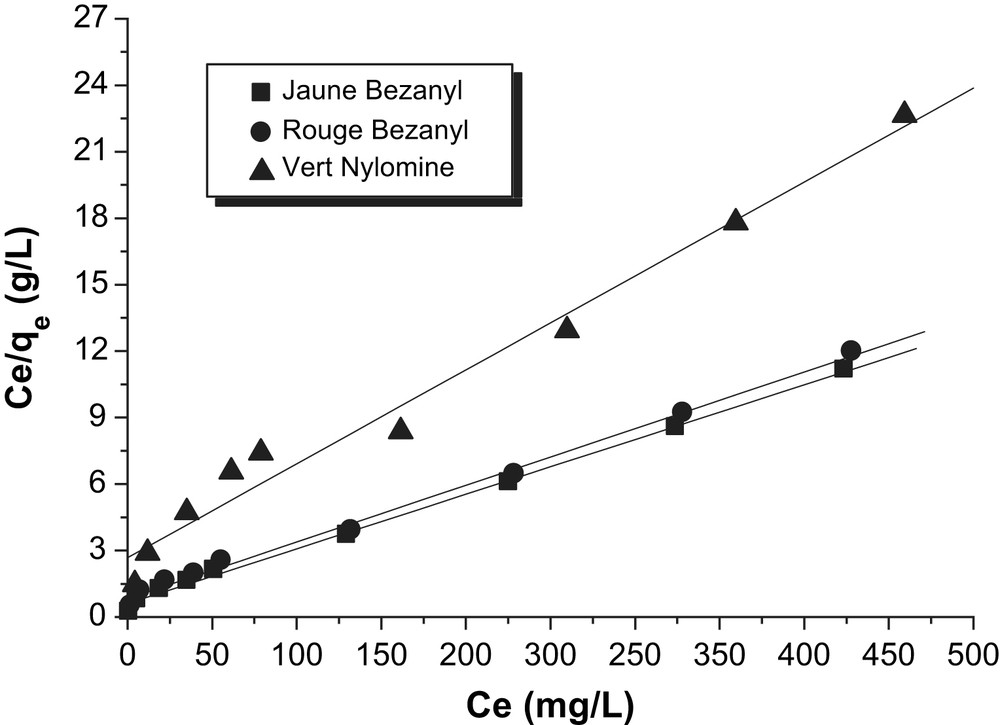
Modélisation des isothermes d'adsorption des colorants par la bentonite selon le modèle de Langmuir.
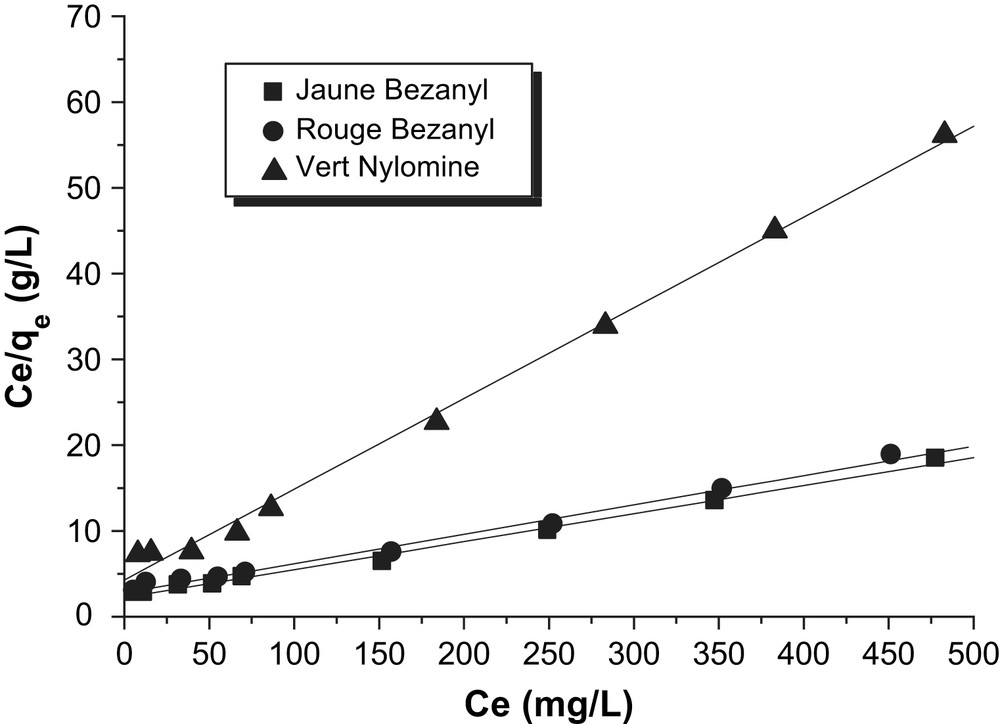
Modélisation des isothermes d'adsorption des colorants par le kaolin selon le modèle de Langmuir.
Constantes du modèle de Langmuir.
| Adsorbants | Colorants | qm (mg/g) | b (l/g) | R2 |
| Bentonite | Jaune Bezanyl | 40,50 | 0,041 | 0,997 |
| Rouge Bezanyl | 39,11 | 0,031 | 0,997 | |
| Vert Nylomine | 23,58 | 0,016 | 0,980 | |
| Kaolin | Jaune Bezanyl | 30,60 | 0,015 | 0,994 |
| Rouge Bezanyl | 29,22 | 0,012 | 0,996 | |
| Vert Nylomine | 9,45 | 0,025 | 0,995 |
Les résultats de l'essai de modélisation des isothermes d'adsorption des trois colorants par la bentonite et le kaolin, selon le modèle de Freundlich, sont représentés sur les Figs. 14 et 15. D'après les coefficients de corrélation R2 présentés sur le Tableau 8, nous déduisons que le modèle de Freundlich n'est pas adéquat pour modéliser les isothermes d'adsorption des colorants sur la bentonite et le kaolin dans tout le domaine des concentrations étudiées.
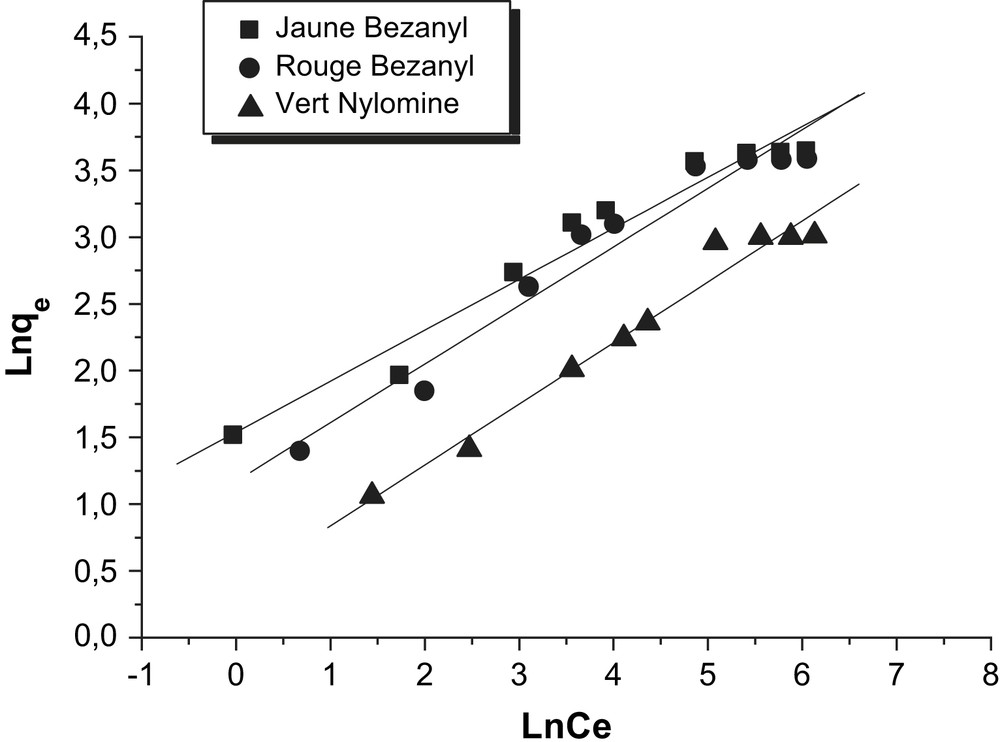
Modélisation des isothermes d'adsorption des colorants par la bentonite selon le modèle de Freundlich.
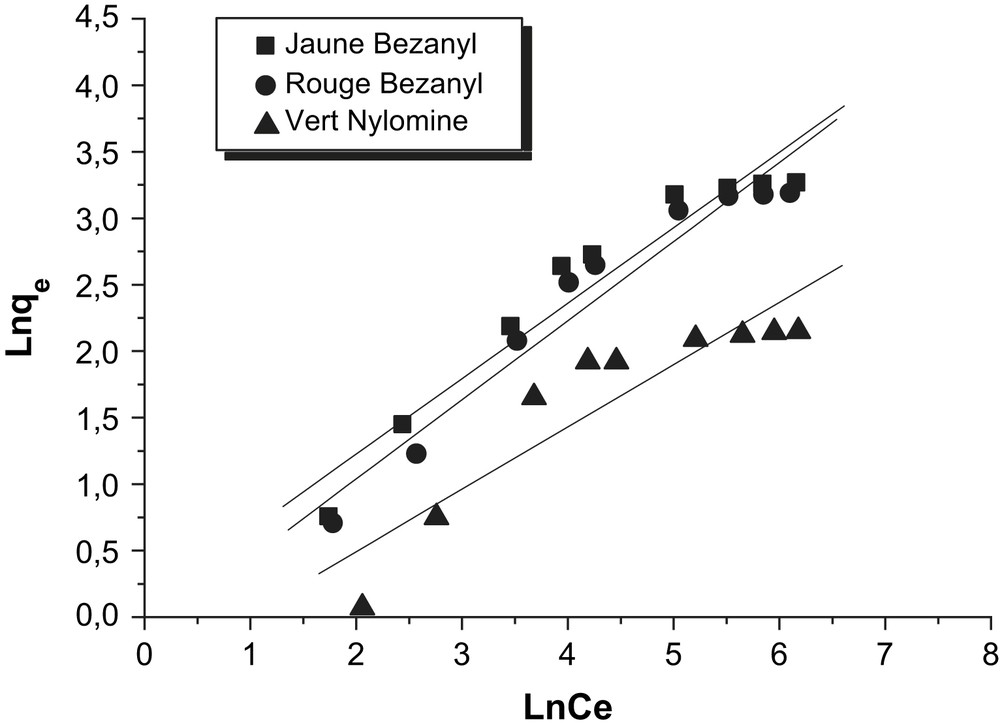
Modélisation des isothermes d'adsorption des colorants par le kaolin selon le modèle de Freundlich.
Constantes du modèle de Freundlich.
| Adsorbants | Colorants | n | K (l/g) | R2 |
| Bentonite | Jaune Bezanyl | 0,38 | 4,661 | 0,957 |
| Rouge Bezanyl | 0,44 | 3,231 | 0,950 | |
| Vert Nylomine | 0,46 | 1,461 | 0,973 | |
| Kaolin | Jaune Bezanyl | 0,568 | 1,094 | 0,930 |
| Rouge Bezanyl | 0,595 | 0,859 | 0,943 | |
| Vert Nylomine | 0,469 | 0,641 | 0,831 |
3.3 Effet de la température sur les équilibres d'adsorption des colorants sur les argiles utilisées
D'après les Figs. 16 et 17, on constate qu'une augmentation de la température provoque une diminution dans la capacité d'adsorption des colorants à l'équilibre quelque soit l'argile utilisée.
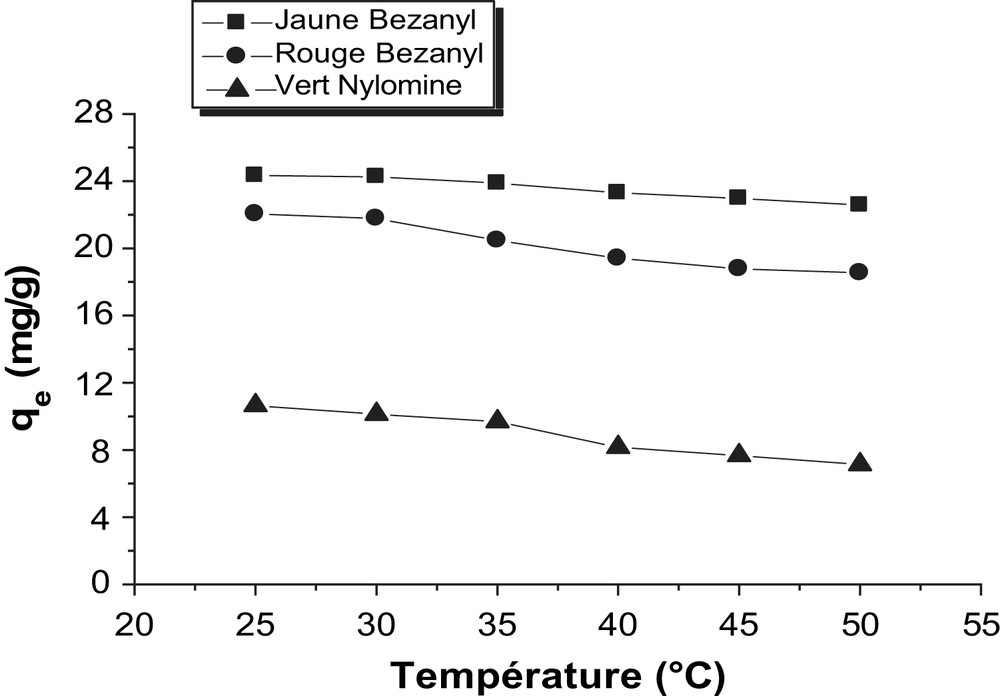
Evolution de la température sur les équilibres d'adsorption des colorants sur la bentonite.
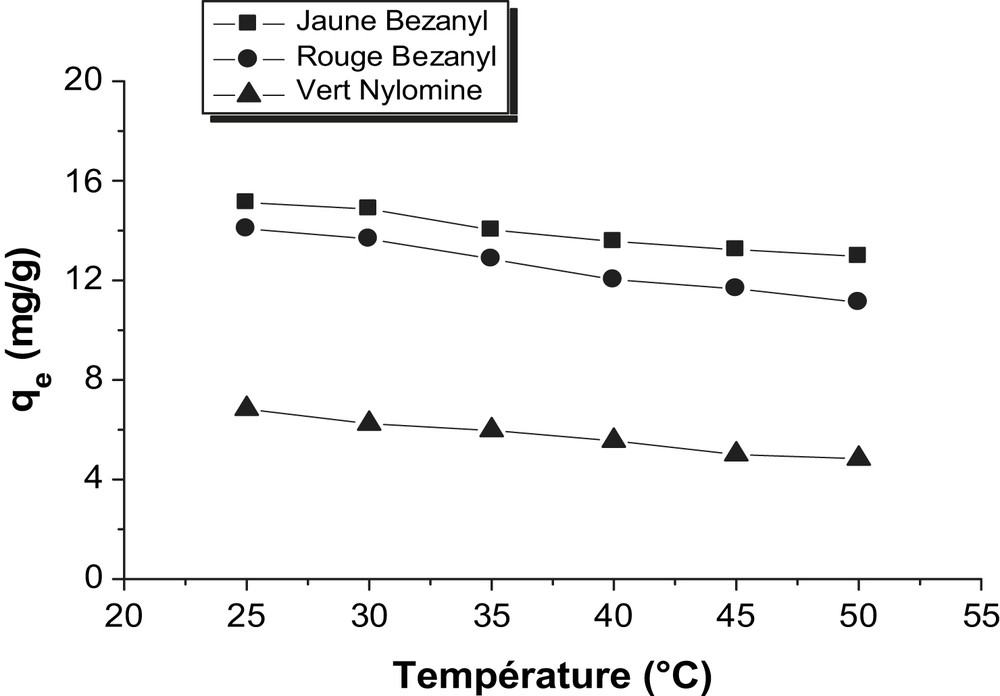
Evolution de la température sur les équilibres d'adsorption des colorants sur le kaolin.
La diminution d'adsorption dans l'intervalle de température 25–50 °C, signifie que le processus d'adsorption des trois colorants par la bentonite et le kaolin est exothermique.
3.4 Détermination des paramètres thermodynamiques d'adsorption
D'une façon générale, le phénomène d'adsorption est toujours accompagné d'un processus thermique [25,26] qui peut être soit exothermique (ΔH < 0) ou endothermique (ΔH > 0). La mesure de la chaleur d'adsorption ΔH est le principal critère qui permet de différencier la chimisorption de la physisorption.
La chaleur d'adsorption ΔH est donnée par la relation de Gibbs–Helmholtz [27,28] :
Avec :
Où :
- Kc : Constante d'équilibre
- ΔG : l'enthalpie libre (Joule/mole)
- ΔH : L'enthalpie (Joule/mole)
- ΔS : L'entropie (Joule/mole K)
- T : Température absolue (K)
- Co : Concentration initiale de l'adsorbat
- Ce : Concentration à l'équilibre de l'adsorbat
- R : constante des gaz parfaits (8,314 Joule/mole K)
Les paramètres thermodynamiques : chaleurs d'adsorption ΔH et l'entropie ΔS des colorants sur la bentonite et la kaolin sont déterminées graphiquement en portant Ln Kc en fonction de l'inverse de la température du milieu en degré kelvin.
D'après les Figs. 18 et 19, nous avons obtenu des droites avec des bons coefficients de corrélations, ce qui nous permet de calculer ΔH et ΔS d'adsorption des colorants par la bentonite et le kaolin.
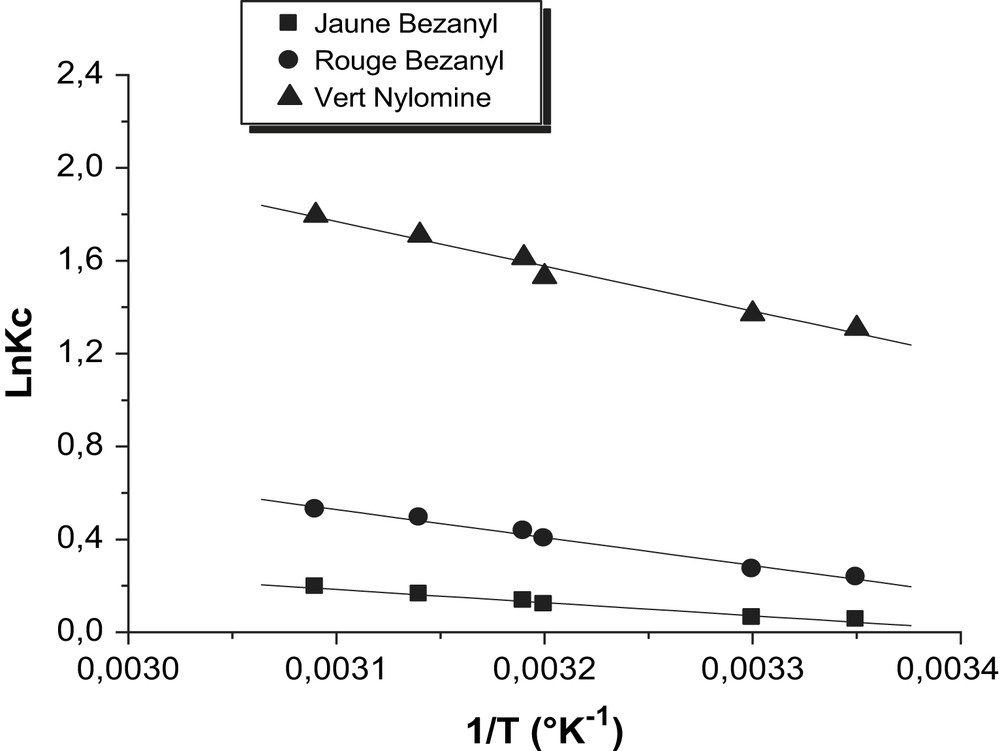
Détermination des enthalpies et des l'entropies de l'adsorption des colorants sur la bentonite.

Détermination des enthalpies et des l'entropies de l'adsorption des colorants sur le kaolin.
D'après le Tableau 9, les valeurs négatives de ΔH confirment que l'adsorption des colorants sur les différentes argiles est un processus exothermique. Les valeurs faibles de cette chaleur (<de 40 K Joule/mole) montrent qu'il s'agit d'une adsorption physique. Les valeurs positives de l'entropie montrent que l'adsorption de ces colorants sur les différentes argiles est accompagnée par un désordre du milieu. Ce résultat montre que les molécules de colorant adsorbées sur la surface de la bentonite et le kaolin sont organisées de façon beaucoup plus aléatoire que par rapport à la situation dans la phase aqueuse.
Paramètres thermodynamiques de l'adsorption des colorants par la bentonite et le kaolin.
| Adsorbants | Colorants | ΔH (K Joule/mole) | ΔS (Joule/mole K) | R2 |
| Bentonite | Jaune Bezanyl | −4,69 | 16,07 | 0,990 |
| Rouge Bezanyl | −9,99 | 10,43 | 0,993 | |
| Vert Nylomine | −16,02 | 64,36 | 0,991 | |
| Kaolin | Jaune Bezanyl | −7,17 | 30,94 | 0,988 |
| Rouge Bezanyl | −10,30 | 52,14 | 0,978 | |
| Vert Nylomine | −12,35 | 56,72 | 0,982 |
De même les valeurs négatives de l'enthalpie libre ΔG données sur le Tableau 10, montrent que le processus d'adsorption des colorants sur la bentonite et la kaolin est un processus spontané.
Valeurs de l'enthalpie libre de l'adsorption des colorants par la bentonite et le kaolin.
| Adsorbants | Colorants | ΔG (K Joule/mole) à 25 °C | ΔG (K Joule/mole) à 40 °C | ΔG (K Joule/mole) à 50 °C |
| Bentonite | Jaune Bezanyl | −9,48 | −9,72 | −9,88 |
| Rouge Bezanyl | −13,10 | −13,25 | −13,36 | |
| Vert Nylomine | −35,20 | −36,16 | −36,81 | |
| Kaolin | Jaune Bezanyl | −16,39 | −16,85 | −17,16 |
| Rouge Bezanyl | −25,84 | −26,62 | −27,14 | |
| Vert Nylomine | −29,25 | −30,10 | −30,67 |
4 Conclusion
Les matériaux argileux que nous avons utilisés dans ce travail ont montré l'efficacité pour diminuer la pollution des eaux des rejets textile sous deux aspects : cinétique et équilibre. Les expériences ont montré que les colorants étudiés s'adsorbent sur la bentonite et le kaolin. Les cinétiques d'adsorption des colorants sur les deux argiles sont de même ordre (pseudo second ordre). Les isothermes d'adsorption des colorants par la bentonite et le kaolin sont décrites de manière satisfaisante par le modèle de Langmuir, alors que le modèle de Freundlich ne peut décrire nos résultats expérimentaux sur tout le domaine de concentration étudié. L'adsorption des colorants sur la bentonite et le kaolin est un processus spontané et exothermique caractérisé par un désordre du milieu. Les faibles valeurs de la chaleur d'adsorption confirment bien que les interactions entre ces argiles et les colorants sont de nature physique.


