1 Introduction
Les aziridines font l’objet d’une recherche très active dans le domaine biologique. Ces petits hétérocycles entrent dans la structure d’un certain nombre de composés naturels présentant des propriétés thérapeutiques intéressantes. À titre d’exemple, les azinomicynes ont une importante action cytotoxique et antitumorale in vitro et in vivo. Les rares études ont montré que ces molécules agissent par alkylation d’un double brin de l’ADN [1]. Ces aziridines possèdent aussi une activité immunotropique à médiation non spécifique, cellulaire ou humorale marquée qui stimule considérablement la prolifération des lymphocytes humains B et T, en absence ou en présence d’agents mitogènes [2]. Par ailleurs, dans les conditions physiologiques, l’aziridino-DAP est un puissant inhibiteur irréversible de l’enzyme bactérienne de l’acide diaminopimelique épimerase [3].
En synthèse organique, la littérature a rapporté que les N-acylaziridines réagissent avec l’acide sulfurique et l’éthérate de trifluorure de bore pour conduire à des oxazolines [4]. Cependant, Semenov a signalé que la N-p-chlorobenzoyl-2,2-diméthylaziridine s’isomérise quantitativement en N-(2-méthylprop-2-ényl)-4-chlorobenzamide en présence de gel de silice [5].
Pour notre part, nous avons remarqué que la N-benzoyl-2,2-diméthylaziridine est instable sur ce catalyseur hétérogène solide et se réarrange en un mélange d’amides et d’oxazolines résultant aussi de l’ouverture régiosélective du cycle aziridine du côté du carbone C2 le plus substitué [6].
2 Résultats et discussion
Les résultats prometteurs obtenus nous ont alors encouragé à compléter nos travaux en étudiant la stabilité de diverses N-acyl-2,2-diméthylaziridines en présence de supports à caractère acide de Lewis et d’une structure à base de silice et d’alumine comme le gel de silice, l’alumine neutre et les argiles activées à l’acide (Tableau 1).
Caractéristiques a des supports utilisés pour le réarrangement des aziridines 1a–e.
| Support | Taille (μm) | Eau physisorbée (%) | Surface spécifique (m2/g) |
| GSf | 200–500 | 5,40 | 415 |
| GSp | 63–200 | 11,72 | 253 |
| ALN | 60–80 | 0,68 | 20 |
| ARA0,5 | < 63 | 11,32 | 162 |
| ARA2 | < 63 | 12,55 | 179 |
| ARA7 | < 63 | 14,21 | 204 |
a GSf : gel de silice fin ; GSp : gel de silice en poudre ; ALN : alumine neutre ; ARA : argile activée à l’acide.
Ainsi, la réaction du gel de silice fin GSf (200–500 μm) avec les N-acylaziridines 1 dans l’éther anhydre à la température ambiante, pendant des temps variables, conduit à un mélange d’allylamides 2, d’oxazolines 3 et d’amidoalcools 4 résultants de la coupure sélective de la liaison C2N.
Le réarrangement des aziridines 1 en composés 2–4 à la température ambiante est un résultat surprenant. En effet, nous avons obtenu les méthallylamides 2 par chauffage de 1 dans le toluène à reflux pendant deux jours [7]. Les oxazolines 3 sont préparées par action de l’acide sulfurique concentré sur les aziridines 1a–d pendant deux heures à la température ambiante [8]. Les amidoalcools 4 sont formés par traitement de 1 par l’eau en milieu neutre à la température ambiante pendant trois jours [9].
L’analyse des résultats collectés dans le Tableau 2 montre clairement que la transformation des aziridines 1 en produits correspondants est fonction de la nature du support utilisé et du groupe acyle porté par l’azote. Ainsi, la N-cinnamoylaziridine 1a se réarrange en présence du GSf en un mélange de trois produits 2a, 3a et 4a (Tableau 2, entrée 1). On remarque que l’isomère 2a est le produit majoritaire de la réaction.
Actiona des gels de silice et de l’alumine neutre sur les N-acylaziridines 1a–e..
| Entrée | Support | Réactif | t (heures) | Rdt (%) | 2 (%) | 3 (%) | 4 (%) |
| 1 | GSf | 1a | 72 | 100 | 62 | 23 | 15 |
| 2 | GSf | 1b | 72 | 86 | 20 | 24 | 42 |
| 3 | GSf | 1c | 72 | 100 | 40 | 17 | 43 |
| 4 | GSf | 1c | 24 | 24 | 10 | 10 | 4 |
| 5 | GSp | 1c | 72 | 83 | 15 | 11 | 57 |
| 6 | ALN | 1c | 72 | 57 | 16 | 9 | 32 |
| 7 | ALN | 1c | 24 | 16 | 7 | 7 | 2 |
| 8 | GSf | 1d | 72 | 100 | 15 | 23 | 62 |
| 9 | GSf | 1d | 24 | 81 | 13 | 20 | 48 |
| 10 | GSf | 1d | 12 | 64 | 13 | 21 | 14 |
| 11 | GSf | 1d | 6 | 45 | 12 | 25 | 8 |
| 12 | GSp | 1d | 72 | 32 | 8 | 16 | 8 |
| 13 | ALN | 1d | 24 | 32 | 9 | 15 | 8 |
| 14 | GSf | 1e | 72 | 0 | 0 | 0 | 0 |
a GSf : gel de silice fin ; GSp : gel de silice en poudre ; ALN : alumine neutre ; Rdt : rendement globale de la réaction.
Or nous avons constaté que la substitution du groupe cinnamyle 1a par un propyle 1b ou un benzyle 1c diminue le rendement en N-méthallylamides 2b et 2c (entrées 2 et 3).
L’obtention d’un mélange de 2c, 3c et 4c après traitement de 1c par GSf pendant un jour suggère que ces trois composés se forment en même temps à partir de 1c suivant des processus concurrents (entrée 4). À partir de ces résultats, nous pouvons alors proposer que l’amidoalcool 4c résulterait de l’hydratation des hétérocycles 1c et 3c sur gel de silice fin. Pour confirmer cette hypothèse, nous avons traité l’oxazoline 3c par GSf humide à la température ambiante et pendant trois jours. Nous avons récupéré partiellement l’amidoalcool 4c.
La conversion de l’aziridine 1c en amidoalcool 4c est rendue majoritaire en présence d’un autre type de gel de silice plus humide et composé de particules plus petites (63–200 μm) : le gel de silice en poudre GSp (entrée 5). Il est remarquable de constater que l’utilisation de l’alumine neutre ALN, de surface spécifique et de quantité d’eau physisorbée inférieures à celles des gels de silice GSf et GSp, conduit aux composés 2c, 3c et 4c avec des rendements ne dépassant pas 57 % (Tableaux 1 et 2, entrées 6 et 7).
Pour confirmer ces hypothèses, nous avons vérifié la stabilité de la N-benzoylaziridine 1d sur les trois supports GSf, GSp et ALN. Ainsi, le traitement de 1d par GSf pendant des temps variables conduit aux composés 2d, 3d et 4d (entrées 8–11). Les résultats obtenus révèlent que le pourcentage de 2d et 3d sont quasi constants au cours du temps alors que l’amidoalcool 4d se forme avec des rendements croissants. Par ailleurs, nous avons constaté que la présence du groupe benzoyle sur l’azote de l’aziridine 1d augmente la conjugaison avec son doublet et diminue sa réactivité vis-à-vis du GSp et de ALN (entrées 12 et 13).
Curieusement, l’aziridine 1e, analogue à 1d mais substituée en position 3 par un groupe phényle, est inerte en présence du gel de silice GSf (entrée 14). Elle l’est aussi en présence d’autres réactifs (aniline, pyrrolidine, eau et iodure de sodium) [9,10]. Pour expliquer ce résultat, nous pouvons suggérer que la conformation la plus stable de l’aziridine 1e empêche son adsorption sur la surface active du GSf et par conséquent son réarrangement en d’autres produits [6].
Par ailleurs, des travaux ont rapporté que la bentonite acidifiée par l’acide sulfurique, présentant une affinité envers le phénol et d’un colorant rouge, est utilisée dans le traitement d’un rejet de l’industrie du textile pour éliminer ces produits indésirables [11]. D’autres études ont montré que la montmorillonite intercalée au titane catalyse l’oxydation de l’alcool allylique (E)-hex-2-ène-1-ol en acide hex-2-ènoique et en trans-2,3-époxyphénol [12]. Plus intéressante, la réaction des N-tosylaziridines avec l’éthanol et les amines en présence d’argile montmorillonite KSF qui conduit à des produits d’attaque des nucléophiles sur les carbones C2 et C3 du cycle aziridine [13].
Ces résultats nous ont alors poussé à utiliser dans ce travail un autre support à base de silice et d’alumine tel que les argiles activées à l’acide ARA0,5, ARA2 et ARA7. L’analyse des résultats regroupés dans le Tableau 3 révèle que les N-acylaziridines 1b–d se transforment en composés 2b–d, 3b–d et 4b–d avec de faibles rendements (Tableau 3, entrées 15–19). Les sites de Lewis (Al et Si) et de Brönsted des argiles activées à l’acide interviennent dans l’étape de formation des oxazolines 3b–d à partir de 1b–d et de leurs décompositions en amidoalcools 4b–d.
Actiona des argiles activées à l’acide sur les N-acyl aziridines 1b–d pendant 72 heures.
| Entrée | Support | Réactif | Rdt (%) | 2 (%) | 3 (%) | 4 (%) |
| 15 | ARA0,5 | 1b | 26 | 2 | 16 | 8 |
| 16 | ARA0,5 | 1c | 37 | 5 | 15 | 17 |
| 17 | ARA0,5 | 1d | 30 | 3 | 7 | 20 |
| 18 | ARA2 | 1d | 38 | 4 | 10 | 24 |
| 19 | ARA7 | 1d | 42 | 3 | 12 | 27 |
a ARA0,5 : argile activée à l’acide pendant 0,5 heures ; ARA2 : argile activée à l’acide pendant deux heures ; ARA7 : argile activée à l’acide pendant sept heures ; Rdt :rendement globale de la réaction.
D’après l’étude cinétique, nous pouvons conclure que la stabilité des N–acyl–2,2–diméthylaziridines sur les différents supports dépend des caractéristiques physiques. Ces supports à caractère acide de Lewis pourront être alors classés comme suit : GSf > GSp > ALN > ARA0,5 > ARA2 > ARA7.
Par ailleurs, des études ont montré que le gel de silice, l’alumine et l’argile smectite présentent à leurs surfaces actives des groupes Si–OH, Si–O et/ou AlOH, AlO [14,15]. Les atomes Si et Al possèdent des orbitales 3d vacantes accepteurs d’électrons pouvant jouer le rôle d’acide de Lewis. En effet, il est rapporté dans la littérature [16] que les alcools β-allyliques s’obtiennent par condensation du 2,2’-biphénolate de lithium sur les alcényltrichlorosilanes via des intermédiaires silicates de lithium. De même, il est connu que les chlorures d’acides se forment à partir d’acides carboxyliques et de AlCl3 via des aluminates.
Sur ces bases théoriques et expérimentales, il est possible d’envisager que les atomes de silicium et d’aluminium des différents supports formeraient des liaisons de coordinance avec l’azote pyramidal des N-acylaziridines pour conduire à des intermédiaires aziridiniums silicatés penta-coordonnés Ia et aziridiniums aluminatés tetracoordonnés Ib actifs.
La coupure hétérolytique de la liaison la plus substituée C2N du cycle aziridinium conduirait, après départ du support, aux zwitterions IIa et IIb. Ces derniers subiraient soit (a) un transfert de proton conduisant au N-méthallylamide 2, soit (b) une cyclisation intramoléculaire menant à l’oxazoline 3 ou encore (c) l’attaque de l’eau conduisant à l’amidoalcool 4 (Schéma 1). La compétition entre la nucléophilie et la basicité de l’oxygène du groupe amidate des intermédiaires IIa et IIb, conduisant aux produits 2 et 3, dépend de la nature des substituants R portés par le groupe carbonyle de l’aziridine 1 (Tableaux 1 et 3).
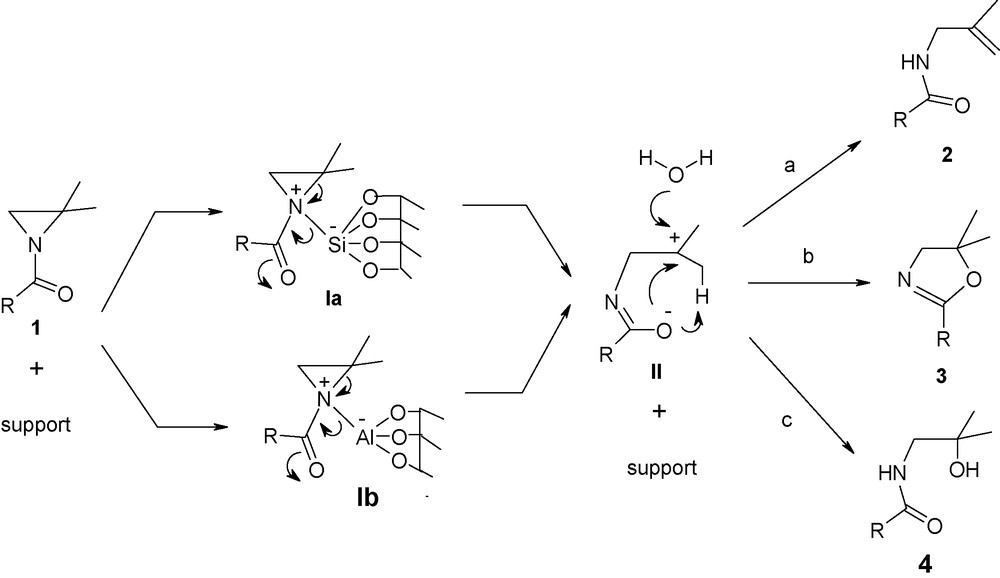
Mécanisme du réarrangement de N-acylaziridines 1 en produits 2, 3 et 4 via les silicates d’aziridinium Ia et les aluminates d’aziridinium Ib.
L’oxazoline 3 s’adsorbe à son tour sur la surface active du support pour conduire aux ions oxazoliniums IIIa et IIIb (Schéma 2). L’attaque de l’eau physisorbée du support sur le carbone C5 des intermédiaires IIIa et IIIb conduit à IVa et IVb. Après départ du support on obtient alors l’amidoalcool 4.
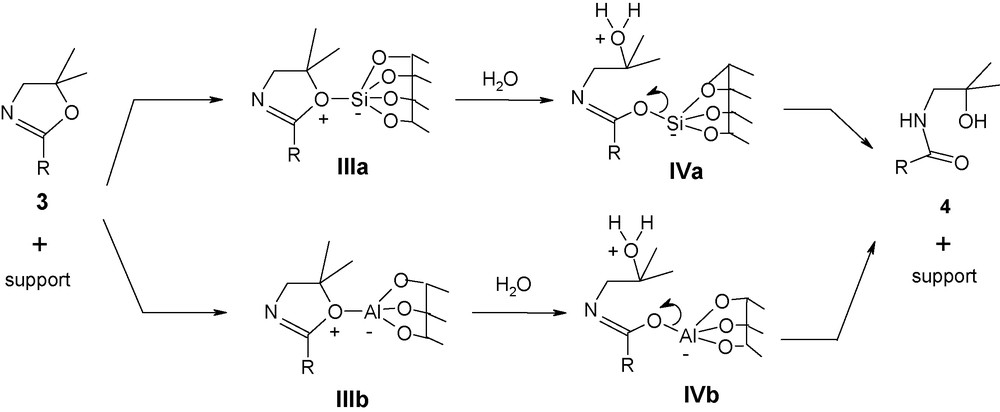
Mécanisme du réarrangement de l’oxazoline 3 en amidolacool 4 via le silicate d’oxazolinium IIIa et l’aluminate d’oxazolinium IIIb.
L’absence d’amidoalcools qui pourraient résulter de l’attaque nucléophile de type SN2 sur le carbone C3 le moins substitué du cycle aziridine est un résultat surprenant. Le facteur stérique ne joue pas alors un rôle déterminant sur le choix du sens d’attaque du nucléophile sur le cycle aziridine. Afin de confirmer cette hypothèse, nous avons complété nos travaux en étudiant le comportement de N-acylaziridines vis-à-vis d’un nucléophile plus réactif que l’eau. Nous avons ainsi découvert que l’aziridine 1d réagit avec le carbanion du cyanure de benzyle, formé in situ, dans le THF anhydre à température ambiante pendant huit jours par traitement à l’hydrure de sodium, pour conduire après hydrolyse à un mélange de deux produits 5d (36 %) et 6d (51 %) clairement détectables sur le spectre de RMN 1H du brut réactionnel (Schéma 3). Cependant, l’iminopyrrolidine 6d est l’unique produit isolé après chromatographie sur gel de silice. Elle est obtenue avec un bon rendement de 68 %. Pour expliquer la formation des produits 5d et 6d, il est possible d’envisager un mécanisme ionique analogue à celui de l’attaque de l’ion éthylate ou de l’ion iodure sur le carbone C2 des N-acyl-2,2-diméthylaziridine [17,18]. L’assistance électrophile entre le cation sodium et l’oxygène du groupe carbonyle de 1d rendrait la liaison C2N plus labile et faciliterait ainsi l’attaque directe du carbanion sur le carbone C2 le plus apte à porter une charge partielle positive. L’anion amidate IV issu de l’ouverture de l’aziridine 1d pourrait alors attaquer le carbone du groupe nitrile pour conduire après cyclisation à un anion iminopyrrolidine V. Cet anion V évoluerait par migration intramoléculaire du groupe benzoyle vers un second anion iminopyrrolidine VI plus stable du fait de la conjugaison accrue. L’hydrolyse du brut réactionnel conduit en effet uniquement à un mélange de deux hétérocycles 5d et 6d. Une tautomérie du composé 5d catalysée par le gel de silice induirait la formation exclusive de l’isomère 6d. La force motrice de cette réaction serait liée à la stabilisation de ce dernier produit par liaison hydrogène intramoléculaire (Schéma 3).
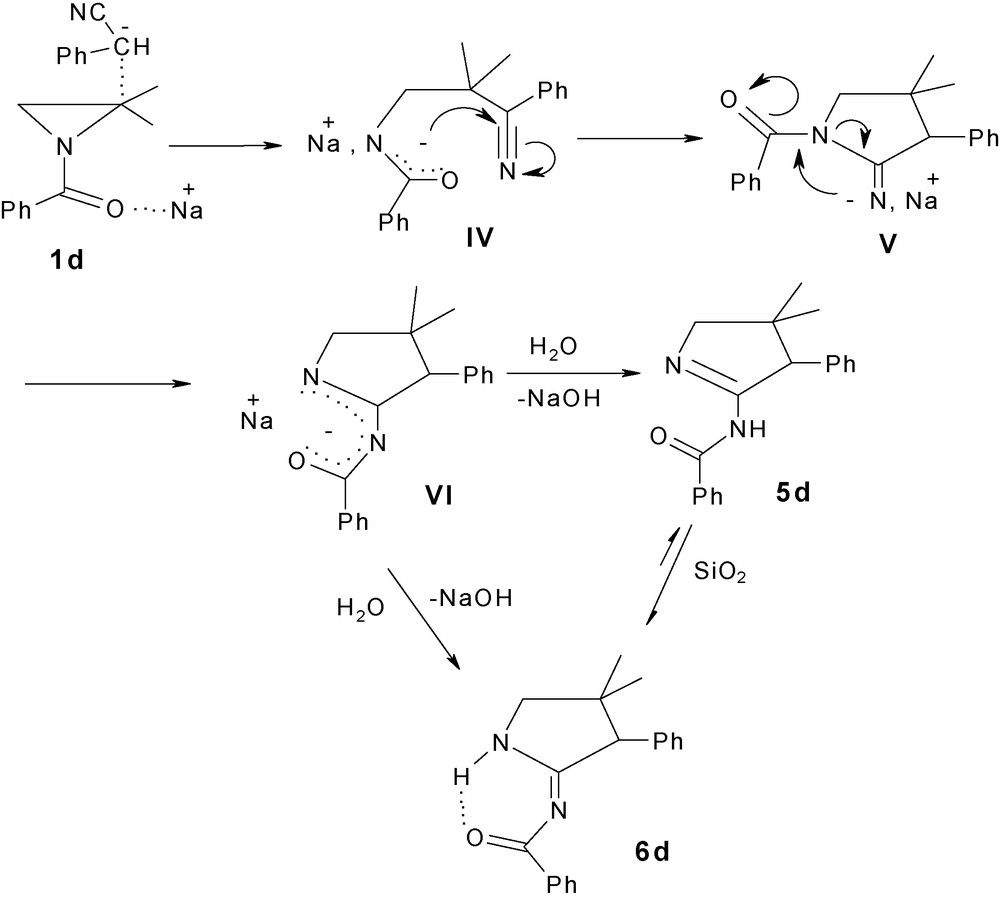
Mécanisme de l’action du cyanure de benzyle sur la N-benzoyl-2,2-diméthylaziridine 1d.
En plus, les calculs théoriques semi-empiriques AM3 confirment que 6d est bien l’espèce la plus stable (enthalpie de formation de 16,77 kcal/mol), par rapport à 5d (19,43 kcal/mol).
Il est intéressant de noter que d’autres nucléophiles comme la pipéridine, la morpholine, l’ion thiophénolate et le diméthylsulfoxyde [19] réagissent avec ces composés pour former des produits d’ouverture régiosélective du cycle aziridine du côté du même carbone C2.
Par ailleurs, nous avons récupéré l’aziridine 1e, après traitement par le carbanion du cyanure de benzyle. Par contre, ce composé 1e s’ouvre par thermolyse et par l’acide sulfurique suivant des mécanismes ioniques. La conformation de l’aziridine 1e pourrait aussi empêcher le rapprochement du cation sodium de l’oxygène du carbonyle. L’attaque du carbanion du cyanure de benzyle sur l’un des carbones C2 et C3 de 1e est alors difficile à réaliser.
3 Conclusion
Dans ce travail, nous avons montré que les N-acylaziridines 1 sont instables sur gel de silice, alumine neutre et argiles activées à l’acide. L’étude cinétique d’ouverture révèle que la formation des produits 2, 3 et 4 dépend à la fois de la nature des réactifs et du temps de réaction. Par ailleurs, nous avons décrit un accès aisé à de nouvelles pyrrolidines par ouverture d’aziridines. Cette extension du cycle aziridine en pyrrolidine dépend de la nature des substituants des N-acylaziridines utilisées.
Des mécanismes purement ioniques sont proposés pour élucider la formation des produits 2–6.
4 Partie expérimentale
4.1 Appareillage
Les spectres IR ont été effectués en solution dans CH2Cl2, sur un spectromètre Bruker IFS66 V/S -IR 420 dont la précision est de 2 cm−1 entre 400 et 4000 cm−1. La position des bandes d’absorption (ν) est exprimée en cm−1. Les spectres de RMN ont été enregistrés sur un spectromètre Bruker AC (300 MHz 1H et 75 MHz 13C). Les déplacements chimiques (δ) des signaux décrits sont exprimés en ppm par rapport au TMS pris comme référence interne. Les abréviations suivantes sont utilisées : s : singulet, d : doublet, t : triplet, m : multiplet, l : large. Les constantes de couplage (J) sont exprimées en Hz. Le spectre de masse a été enregistré sur un spectromètre VARIAN MAT CH 5 avec une énergie d’ionisation de 70 eV et introduction directe.
4.2 Substrats
Les N-acylaziridines 1a–e sont préparées selon les méthodes décrites dans la littérature [20].
Le gel de silice fin GSp (200–500 mesh), le gel de silice poudre GSp (70–230 mesh) sont des produits commerciaux Merck et l’alumine neutre ALN est un produit Aldrich.
L’argile brute Hb aluminosilicatée tunisienne, est un minéral interstratifié illite–smectite–bentonite composé d’environ 68 % de smectite, 12 % d’illite et 20 % de quartz.
4.2.1 Préparation des argiles activées à l’acide
Deux cent grammes de Hb sont dispersées dans 60 mL d’eau distillée, puis soumis à une bonne agitation jusqu’à l’homogénéisation complète de la suspension. On élimine les débris de fossiles animaux et les débris végétaux. L’argile brute à caractère basique Hb est séchée, puis concassée dans un mortier en agate jusqu’à l’obtention de particules de 1 mm au plus.
Dix grammes de cette argile Hb sont chauffés à reflux dans 100 mL d’une solution de HCl (3 M) pendant 0,5 heures, deux heures et sept heures. Après refroidissement et filtration, l’argile est lavée à l’eau distillée par des cycles d’agitation par centrifugation et changement de l’eau pour éliminer les chlorures, le carbonate de calcium, le carbonate de potassium et le quartz. Les argiles activées à l’acide ARA0,5, ARA2 et ARA7 récupérées ont tendance à rester en suspension et à avoir un pH neutre ou légèrement acide. Après filtration, elles sont séchées à l’étuve à 60 °C pendant quelques jours, puis broyées.
4.2.2 Détermination des caractéristiques physiques des supports
La taille des particules des supports utilisés est déterminée à l’aide de tamis de type ASTME 11–70 Prüfsieb. Leurs surfaces spécifiques, estimées en utilisant la méthode BET, sont déterminées à l’aide d’un appareil volumétrique d’adsorption d’azote automatisé de type Quantachrome-Autosorb-1. La quantité d’eau physisorbée existantes dans ces supports est déterminée par chauffage dans une étuve de type Memmert pendant deux heures à 150 °C.
4.3 Action des supports sur les N-acylaziridines 1a–d
Un mélange de 2 mmol de N-acylaziridines 1a–d, 20 mL d’éther anhydre et 1 g de support est agité à la température ambiante pendant des temps variables. Après filtration du support et évaporation du solvant sous vide, on récupère un résidu. Les produits 2a–d, 3a–d et 4a–d sont ensuite séparés par chromatographie sur colonne de silice. Les 5,5-diméthyloxazolines 3 sont éluées par un mélange éther de pétrole–éther éthylique (20/80). Les N-(2-méthylprop-2-ényl)-amides 2 sont éluées par un mélange éther de pétrole–éther éthylique (50/40). Les N-(2-méthyl-2-hydroxypropyl)-amides 4 sont éluées par un mélange éther éthylique–acétate d’éthyle (90/10).
N-cinnamoyl-2,2-diméthylaziridine 1a : IR : 1620 (CC), 1660 (CO). RMN 1H : 1,33 (s, 6H, 2CH3), 2,20 (s, 2H, CH2N), 6,60 (d, J17, 1H, CHC), 7,35-7,90 (m, 6H, CCHC6H5). RMN 13C : 22,95 (2CH3), 37,52 (CH2), 43,46 (Cq), 116,51 (C, Ph), 127,52 (C, Ph), 128,42 (2C, Ph), 129,34 (2C, Ph), 134,52 (Cq), 134,82 (CH), 173,40 (CO). 2a : IR : 1625, 1650 (CC), 1670 (CO), 3300, 3450 (NH). RMN 1H : 1,69 (s, 3H, CH3), 3,85 (d, J6, 2H, CH2N), 4,80 (s, 2H, CH2), 6,66 (d, J17, 1H, CHC), 6,90 (tl, J6, 1H, NH), 7,06-7,60 (m, 5H, C6H5), 7,63 (d, J17, 1H, CCHPh). RMN 13C : 20,36 (CH3), 45,41 (CH2N), 111,24 (CH), 119,04 (CH), 127,50 (C, Ph), 128,31 (2C, Ph), 129,33 (2C, Ph), 134,82 (Cq), 135,02 (CH), 165,65 (CO). 3a : IR : 1640 (CC), 1655 (CN). RMN 1H : 1,38 (s, 6H, 2CH3), 3,63 (s, 2H, CH2N), 6,46 (d, J17, 1H, CHC), 7,00-7,46 (m, 6H, CCHPh). RMN 13C : 27,32 (2CH3), 66,72 (CH2), 83,90 (Cq), 116,64 (CHC), 127,48 (2C, Ph), 128,30 (2C, Ph), 129,32 (2C, Ph), 134,48 (Cq), 134,92 (CH), 165,75 (CN). 4a : IR : 3590 (OH), 3440 (NH), 1660 (CO), 1625 (CC). RMN 1H : 1,23 (s, 6H, 2CH3), 3,40 (d, J6, 2H, CH2), 3,68 (sl, 1H, OH), 6,60 (d, J17, 1H, CHC), 7,06 (tl, J6, 1H, NH), 7,20-7,66 (m, 5H, C6H5), 7,70 (t, J17, 1H, CCHPh). RMN 13C : 26,95 (2CH3), 50,02 (CH2N), 69,83 (Cq), 119,14 (CH), 127,45 (C, Ph), 128,28 (2C, Ph), 129,31 (2C, Ph), 134,62 (C), 135,09 (CH), 165,65 (CO).
N-propanoyl-2,2-diméthylaziridine 1b : IR : 1678 (CO). RMN 1H : 1,15 (q, J6, 3H, CH3), 1,35 (s, 6H, 2CH3), 2,12 (s, 2H, CH2N), 2,35 (t, J6, 2H, CH2). RMN 13C : 9,32 (CH3), 23,06 (CH3), 30,92 (CH2), 36,82 (CH2N), 40,65 (Cq), 185,32 (CO).
2b : IR : 1648 (CC), 1665 (CO), 3333, 3445 (NH). RMN 1H : 1,19 (q, J 6, 3H, CH3), 1,73 (s, 3H, CH3), 2,28 (t, J 6, 2H, CH2), 3,70 (d, J6, 2H, CH2N) ; 4,83 (s, 2H, CH2C), 5,84 (tl, J6, 1H, NH). RMN 13C : 10,01 (CH3), 20,34 (CH3), 29,74 (CH2), 44,95 (CH2N), 110,74 (CH2), 142,17 (C), 173,80 (CO). 3b : IR : 1662 (CN). RMN 1H : 1,18 (t, J6, 3H, CH3), 1,40 (s, 6H, 2CH3), 2,28 (q, J6, CH2), 3,55 (s, 2H, CH2N). RMN 13C : 10,02 (CH3), 21,91 (CH2), 27,33 (2CH3), 66,43 (CH2N), 83,41 (Cq), 168,34 (CN). 4b : IR : 3585 (OH), 3443 (NH), 1657 (CO). RMN 1H : 1,12 (t, 2H, J6, CH2), 1,28 (s, 6 H, 2CH3), 2,28 (q, J6, 2H, CH2), 2,56 (sl, 1H, OH), 3,27 (d, J6, 2H, CH2N), 6,22 (tl, J6, 1H, NH). RMN 13C : 10,06 (CH3), 27,21 (2CH3), 29,59 (CH2), 50,36 (CH2N), 70,77 (Cq), 175,13 (CO).
N-benzyloyl-2,2-diméthylaziridine 1c : IR : 1675 (CO). RMN 1H : 1,20 (s, 6H, 2CH3), 2,05 (s, 2H, CH2N), 3,60 (s, 2H, CH2Ph), 7,10-7,25 (m, 5H, C6H5). RMN 13C : 23,69 (2CH3), 36,97 (CH2N), 41,35 (Cq), 45,22 (CH2Ph), 126,83 (C, Ph), 127,29 (2C, Ph), 128,62 (2C, Ph), 134,73 (Cq), 181,69 (CO). 2c : IR : 1635 (CC), 1655 (CO), 3320, 3445 (NH). RMN 1H : 1,70 (s, 3H, CH3), 3,55 (s, 2H, CH2Ph), 3,76 (d, J6, 2H, CH2N), 4,75 (s, 2H, CH2C), 6,15 (tl, J6, 1H, NH), 7,15-7,32 (m, 5H, C6H5). RMN 13C : 20,21 (CH3), 43,57 (CH2Ph), 44,90 (CH2N), 110,47 (CH2), 126,65 (C, Ph), 128,24 (2C, Ph), 127,39 (2C, Ph), 134,82 (Cq), 141,73 (C), 171,87 (CO). 3c : IR : 1659 (CN). RMN 1H : 1,28 (s, 6H, 2CH3), 3,40 (s, 2H, CH2Ph), 3,45 (s, 2H, CH2N), 7,12-7,21 (s, 5H, C6H5). RMN 13C : 27,83 (2CH3), 43,46 (CH2Ph), 66,09 (CH2N), 84,20 (Cq), 126,82 (C, Ph), 128,67 (2C, Ph), 129,10 (2C, Ph), 134,05 (Cq), 166,03 (CN). 4c : IR : 3580 (OH), 3440 (NH), 1655 (CO). RMN 1H : 1,10 (s, 6 H, 2CH3), 3,15 (d, J6, 2H, CH2N), 3,52 (s, 2H, CH2Ph), 3,56 (sl, 1H, OH), 6,22 (tl, J6, 1H, NH), 7,20-7,40 (m, 5H, C6H5). RMN 13C : 27,05 (2CH3), 43,50 (CH2), 50,47 (CH2N), 70,51 (Cq), 126,14 (C, Ph), 128,24 (2C, Ph), 128,60 (2C, Ph), 141,73 (C), 172,20 (CO).
N-benzoyl-2,2-diméthylaziridine 1d : IR : 1668 (CO). RMN 1H : 1,19 (s, 6H, 2CH3), 2,20 (s, 2H, CH2N), 7,05-7,85 (m, 5H, C6H5). RMN 13C : 22,83 (2CH3), 36,62 (CH2N), 42,30 (C), 127,03 (2C, Ph), 128,24 (2C, Ph), 131,85 (C, Ph), 134,56 (Cq), 178,00 (CO). 2d : IR : 1635 (CC), 1655 (CO), 3340, 3450 (NH). RMN 1H : 1,71 (s, 3H, CH3), 3,89 (d, J8, 2H, CH2N), 4,79 (s, 2H, CH2C), 6,81 (tl, J8, 1H, NH), 7,20-7,90 (m, 5H, C6H5). RMN 13C : 20,32 (CH3), 45,37 (CH2N), 110,63 (CH2), 127,22 (2C, Ph), 128,03 (2C, Ph), 131,66 (C, Ph), 137,74 (Cq), 141,94 (C), 167,75 (CO). 3d : IR : 1670 (CN). RMN 1H : 1,36 (s, 6H, 2CH3), 3,60 (s, 2H, CH2N), 7,16-8,10 (m, 5H, C6H5). RMN 13C : 27,30 (2CH3), 66,82 (CH2N), 83,94 (Cq), 126,81 (2C, Ph), 128,52 (2C, Ph), 129,17 (C, Ph), 134,12 (Cq), 166,56 (CN). 4d : IR : 3592 (OH), 3445 (NH), 1666 (CO). RMN 1H : 1,25 (s, 6H, 2CH3), 3,32 (sl, 1H, OH), 3,40 (d, J6, 2H, CH2), 7,11 (tl, J6, 1H, NH), 7,16-8,10 (m, 5H, C6H5). RMN 13C : 27,32 (2CH3), 50,73 (CH2N), 70,95 (Cq), 126,91 (C, Ph), 128,43 (2C, Ph), 128,51 (2C, Ph), 131,55 (C, Ph), 134,60 (Cq), 168,55 (CO).
4.4 Action du cyanure de benzyle sur la N-benzoyl-2,2-diméthylaziridines 1d
Un mélange d’aziridine 1d (2 mmol), de cyanure de benzyle (2 mmol) et d’hydrure de sodium (2 mmol) dans 200 mL de THF anhydre est agité pendant huit jours à la température ambiante, puis traité par 100 mL d’eau. On extrait la phase aqueuse par l’éther (3 × 100 mL). Les phases organiques sont réunies, puis séchées sur sulfate de magnésium. Après filtration et évaporation des solvants sous vide, on récupère un brut réactionnel dont le spectre de RMN 1H révèle la présence du produit de départ 1d et des produits 5d et 6d dans les proportions 1–4–3. Les principaux signaux des deux nouveaux composés sont : 5d : 0,66 (s), 1,11 (s), 3,29 (s), 3,65 (s) et 6d : 0,71 (s), 1,23 (s), 3,36 (s), 3,81 (s). Après chromatographie sur colonne de silice avec l’éther éthylique comme éluant, un seul produit 6d est isolé.
2-(N-benzoylimino)-4,4-diméthyl-3-phénylpyrroli-dine 6d : IR : 3300 (N-H), 1615, 1580, 1555 (CN-CO). RMN 1H : 0,70 (s, 3H, CH3), 1,20 (s, 3H, CH3), 3,36 (s, 2H, CH2), 3,73 (s, 1H, CHPh), 6,60-7,60 (m, 8H, C6H5 et 3CH du Ph), 7,83-8,30 (m, 2H, 2CH du Ph), 9,76 (sl, 1H, NH). RMN 13C : 22,88 (CH3), 27,57 (CH3), 40,02 (Cq), 58,17 (CH2N), 62,03 (CHPh), 126,88 (C, Ph), 127,71 (C, Ph), 127,97 (2C, Ph), 128,15 (2C, Ph), 129,19 (2C, Ph), 131,46 (2C, Ph), 135,55 (Cq), 136,90 (C), 175,11 (CN), 178,78 (CO). SM m/z (%) : 293 (7,8), 292 (39,2 ; M.+), 290 (20,3), 277 (22,3), 215 (10,5), 200 (6,3), 171 (16,3), 149 (4,3), 135 (5,3), 134 (8,5), 131 (8,1), 117 (8,4), 116 (6,2), 106 (8,6), 105 (100), 91 (10,0), 78 (7,1), 77 (57,2), 69,9 (6,7), 55 (8,4), 50,9 (10,9), 40,9 (5,0), 39 (4,7), 28 (9,5).
Remerciements
Nous remercions le Pr Helmut Stamm de l’université Heidelberg en Allemagne pour ses discussions fructueuses.


