1 Introduction
De nombreuses activités humaines (agricoles ou industrielles) conduisent à la pollution de l’eau par des composés azotés tels que NH4+, NO2− et NO3−. Les effets néfastes tant sur l’homme (méthémoglobinémie et carcinogenèse) que sur l’environnement (eutrophisation) de ces composés imposent de traiter l’eau ainsi polluée afin d’abaisser leur teneur en dessous des seuils autorisés.
L’hydrogénation catalytique des ions NO3− et NO2− a fait l’objet de nombreuses recherches au cours des dernières années [1] et de nombreuses formulations catalytiques à base de catalyseur au Pd ont été proposées, la plus performante étant un système Pd-Cu. Toutefois, une sélectivité insuffisante en N2 lors de la réduction des nitrates est le principal obstacle au développement d’un procédé d’élimination des nitrates basé sur cette technique. Pour résoudre ce problème, nous proposons un nouveau procédé catalytique, combinant deux étapes catalytiques (Fig. 1) :
- • l’hydrogénation catalytique de NO3− avec formation de N2 et de NH4+ ;
- • l’oxydation photocatalytique de NH4+ conduisant à la reformation de NO3- afin d’abaisser, grâce à la transformation partielle lors de chaque cycle des ions azotés en N2, la concentration des nitrates en dessous de la norme sans dépasser le taux maximum permis pour l’ammonium et pour les nitrites.
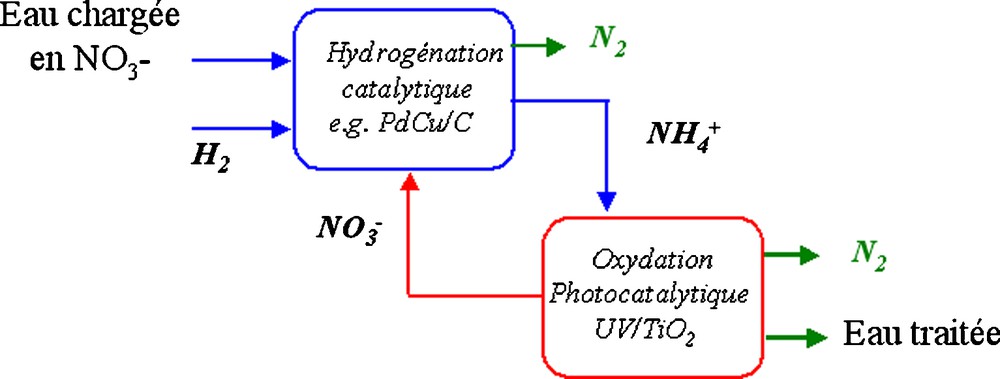
Principe du procédé à recirculation combinant hydrogénation et photoxydation.
Les données disponibles montrent qu’il existe des catalyseurs d’hydrogénation suffisamment performants, i.e., conduisant à un rendement supérieur à 50 % en azote. Par ailleurs, l’oxydation photocatalytique de l’ammonium NH4+ a également été étudiée [2–4]. Cependant, si les meilleurs résultats en hydrogénation sont obtenus en milieu acide, ceux pour la photocatalyse le sont en milieu basique. Il convient donc de trouver des conditions et/ou des catalyseurs efficaces à un pH proche de 7 qui ne nécessiterait pas d’addition d’agents régulateurs de pH (soude et/ou acide).
L’ion ammonium est un des polluants les plus nocifs dans les eaux, en raison de son seuil de toxicité bas (teneur maximale autorisée dans les rejets : 0,5 mg/L).
Il existe plusieurs méthodes pour enlever les NH4+/NH3 de l’eau, comme l’osmose inverse et l’échange d’ion. Ces deux procédés physicochimiques ont pour inconvénient que les ammoniums sont extraits de l’eau, mais non éliminés, La nitrification biologique est très utilisée pour le traitement d’eaux, mais nécessite des temps de contact importants. En effet, cette réaction est lente et pour cela il est nécessaire d’employer des installations grandes et coûteuses [5].
L’oxydation photocatalytique est une technique qui présente certains avantages pour le traitement d’eau du fait qu’elle utilise TiO2, un catalyseur bon marché, stable et non toxique [2]. En outre, comme il a été montré que le rayonnement solaire peut être utilisé pour la photocatalyse, le traitement de l’eau selon cette technique peut devenir économiquement compétitif [3].
La photocatalyse hétérogène pour le traitement de NH3 gazeux ou de NH3/NH4+ dans l’eau fait l’objet de recherche. Ainsi Mozzanega et al. [6] ont rapporté la décomposition photocatalytique de NH3 gazeux lors de l’utilisation de différents oxydes métalliques (y compris TiO2). Harrison [7] a étudié la décomposition de NH4NO2 sous irradiation UV et proposé un mécanisme rendant compte de l’effet du pH sur la vitesse de dégradation. Wang [4] a constaté qu’une dégradation de NH3 en présence du photocatalyseur (Fe2O3/TiO2) en milieu acide et une dégradation de NH3 sans photocatalyseur en milieu basique avec rayonnement était possible. Il a remarqué que la vitesse d’oxydation photocatalytique de NH4+/NH3 la plus élevée est atteinte à pH alcalin en raison de la dépendance du pH de la charge de surface de TiO2. Toutefois, les activités rapportées dans la littérature demeurent faibles et il est nécessaire d’obtenir des photocatalyseurs plus performants afin de réaliser la destruction des ions ammonium dans des temps plus courts.
Les objectifs du présent travail sont :
- • comprendre l’influence de pH sur la réaction afin de vérifier l’existence d’un domaine de condition opératoire compatible avec le pH du milieu réactionnel issu de l’étape d’hydrogénation catalytique de NO3− ;
- • étudier l’effet de l’ajout de métaux déposés sur TiO2 sur l’activité et la sélectivité du photocatalyseur.
2 Partie expérimentale
2.1 Dépôt de métal sur TiO2
Les catalyseurs M/TiO2 ont été préparés par imprégnation de TiO2 (Degussa P25, 50 m2 g−1) en suspension dans de l’eau permutée (50 cm3 g−1) par la quantité de complexe métallique nécessaire pour obtenir une teneur en de métal imprégné de 3 % massique. La suspension est concentrée à sec en évaporateur rotatif à 80 °C durant huit heures, puis le solide imprégné est séché dans un four à 120 °C durant deux heures. Le solide est ensuite réduit sous hydrogène (20 mL/min) à 300 °C durant 15 heures, les montée et descente en température étant effectuées sous balayage de N2. Les sels métalliques précurseurs et les solides préparés figurent dans le Tableau 1. Les catalyseurs Au/TiO2 sont préparés par réduction de HAuCl4 par NaBH4 en présence de PVA, suivi par adsorption sur TiO2, selon la méthode de Comotti et al. [8]. Le catalyseur Pd-Cu/TiO2 est préparé par co-imprégnation [9] de sels de ces métaux suivie d’évaporation sous vide et de réduction sous courant d’hydrogène.
Précurseurs utilisés et catalyseurs préparés.
| Catalyseur | Méthode | Précurseur | Fournisseur |
| Pt/TiO2 (3 %) | Imprégnation | Pt(OH)2(NH3)2 | Strem |
| Ni/TiO2 (3 %) | Imprégnation | Ni(NO3)26H2O | Alfa Aesar |
| Zn/TiO2 (3 %) | Imprégnation | Zn(NO3)26H2O | Acros |
| Cr/TiO2 (3 %) | Imprégnation | Cr(NO3)36H2O | Aldrich |
| Fe/TiO2 (3 %) | Imprégnation | Fe(NO3)36H2O | Acros |
| Au/TiO2 (1 %) | Réduction/adsorption | HAuCl43H2O | Alfa Aesar |
| Au/TiO2 (3 %) | Réduction/adsorption | HAuCl43H2O | Alfa Aesar |
| Pd-Cu/TiO2 (5–1,5 %) | Coimprégnation | Pd(NO3)2-Cu(NO3)2 | Alfa Aesar-Aldrich |
Les solutions d’ammonium ont été préparées soit à partir de solutions concentrées de NH4OH (Fluka, solution à 25 % massique), soit à partir de NH4Cl (Janssen) dissous dans l’eau permutée.
2.2 Le photoréacteur
Toutes les irradiations ont été réalisées à l’aide d’un photoréacteur en pyrex (volume 60 cm3), contenant 25 cm3 de solution ammoniacale et TiO2 en suspension et équipé :
- • d’une agitation magnétique permettant l’homogénéisation de la solution et une bonne dispersion de TiO2 ;
- • d’un système de circulation d’eau permettant fixer la température de réaction.
La source lumineuse utilisée est une lampe HPK PHILIPS 125 W dont le spectre d’émission s’étend de 240 à 440 nm, qui est refroidie par circulation d’eau (Fig. 2).
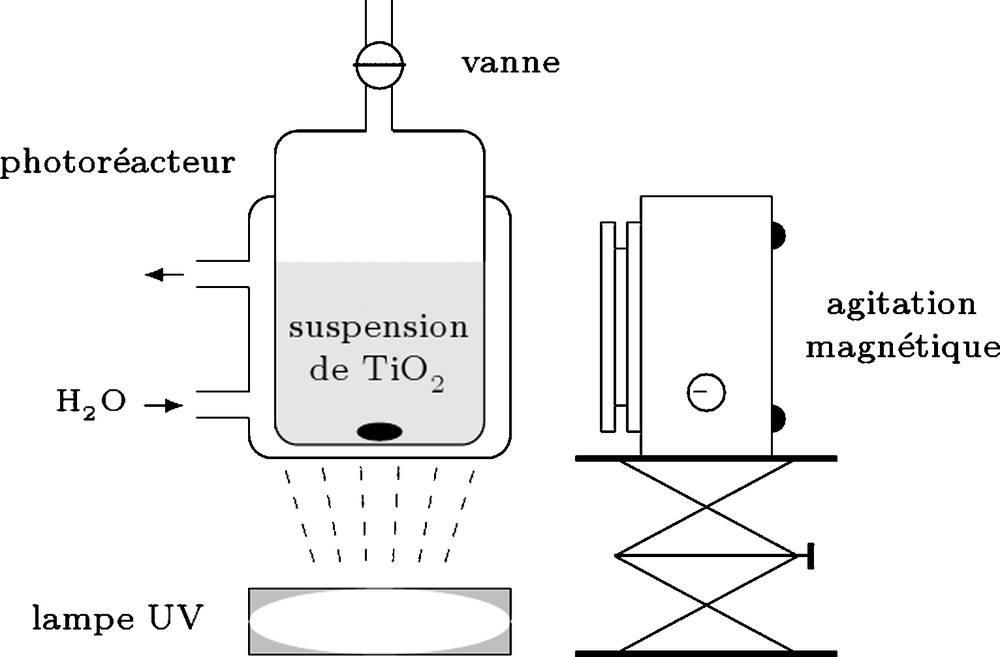
Schéma du montage.
2.3 Analyse par chromatographie ionique
L’analyse des ions présents en solution (NO3−, NO2− et NH4+) est réalisée par chromatographie ionique (IC 1000, Dionex) en utilisant une colonne AS23 pour le dosage des anions et une colonne CS12A pour le dosage des cations .
3 Résultats et discussion
3.1 Influence du pH sur les performances du catalyseur
Dans un premier temps, nous avons confirmé que la dégradation photocatalytique de NH4+ dans l’eau peut être réalisée en employant TiO2 en suspension a pH initial élevé (pH ∼10), qui est le pH de la solution de sortie du réacteur d’hydrogénation. On observe au fur et à mesure de l’avancement de la réaction une diminution du pH et de la vitesse de réaction (Fig. 3). La conversion (XNH4+) atteinte après cinq heures est d’environ 60 %, et l’on observe qu’à pH inférieur à 7, la vitesse de disparition de NH4+ devient très faible.
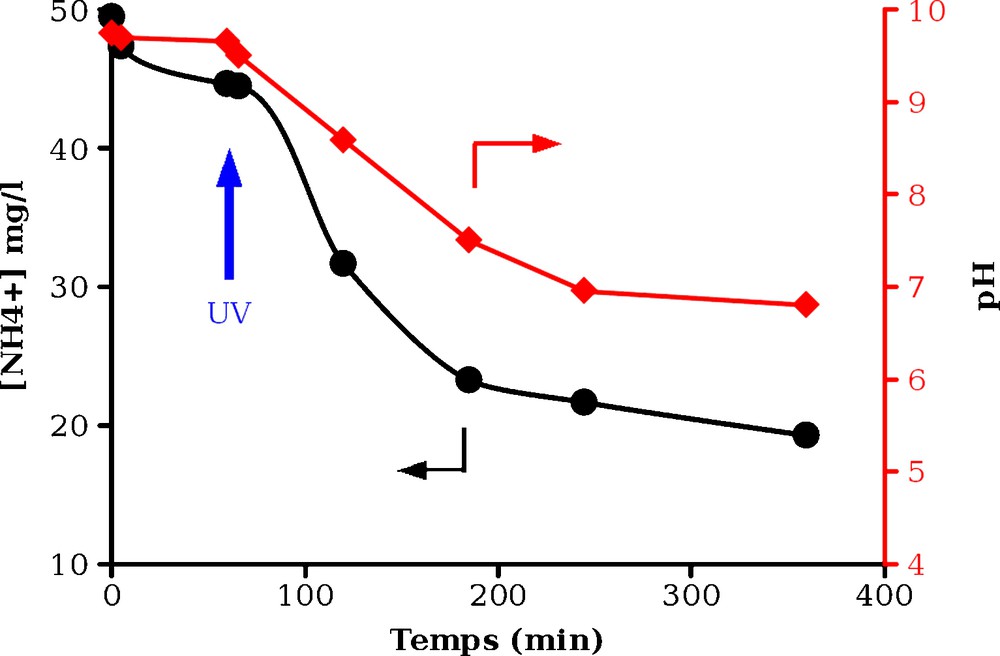
Évolution de la teneur en NH4+ et du pH lors de l’irradiation en présence de TiO2 (conditions de réaction : NH4+ = 50 mg/L ; mcata = 40 mg, T = 20 °C, P = 0,1 MPa).
Le pH est ainsi un paramètre ayant un effet important pour l’oxydation photocatalytique de NH4+. Afin d’étudier son influence sur la vitesse de cette réaction, des essais ont été réalisés à quatre valeurs (3 ; 7,5 ; 10 ; 12,5) de pHinitial fixé par ajout soit d’acide chlorhydrique, soit de soude. La Fig. 4 montre que la vitesse d’oxydation de NH4+/NH3 est très faible à pH 3. Pour un pHinitial de 7,5, l’oxydation photocatalytique de NH4+/NH3 a lieu mais demeure lente. À pH supérieur la réaction est plus rapide et l’on obtient la même valeur de vitesse initiale à pH 10 et 12,5.
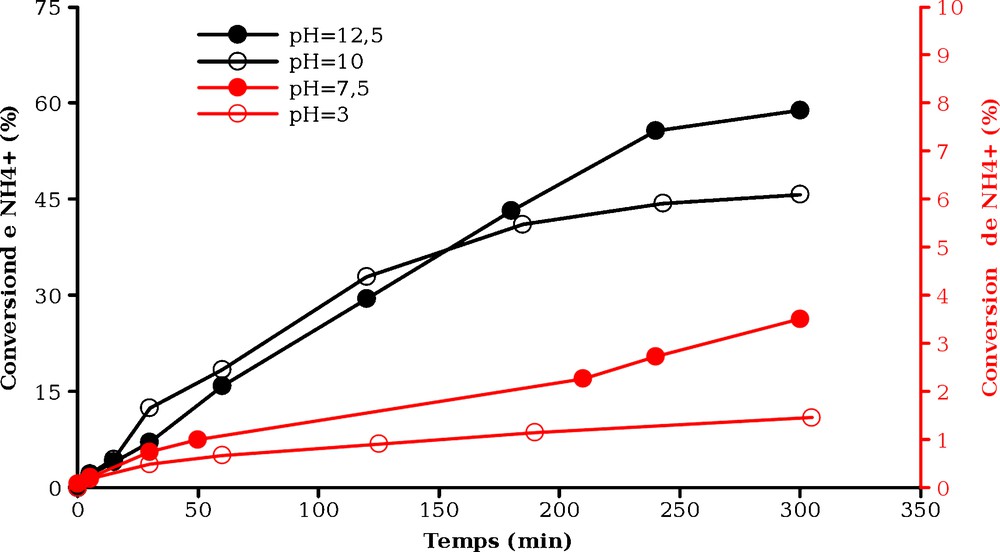
Effet du pH sur la destruction de NH4+ en présence de TiO2 (axe de gauche pH = 10 et 12,5 ; axe de droite pH = 3 et 7,5).
L’avancement de la réaction s’accompagne d’une diminution de pH (Tableau 2) qui conduit à une diminution de la vitesse de réaction. Ainsi, alors que les essais réalisés à pH 10 et 12,5 présentent la même vitesse initiale, la conversion après cinq heures d’irradiation est de 45 % à pH 10 et de 60 % à pH 12,5. En effet, plus le pHinitial est élevé, plus l’avancement de la photoxydation de NH4+ sera élevé avant qu’elle ne s’arrête lorsque le pH devient trop bas. Le pH doit donc être maintenu au-dessus de 7,5 pour notre application.
Vitesse initiale et pHfinal après cinq heures de photooxydation de NH4+ en présence de TiO2.
| pHinitial | Vinitiale (mol/L min gcatalyseur) | pHfinal |
| 3 | 2,3 × 10−5 | 2,6 |
| 7,5 | 5,2 × 10−5 | 5,9 |
| 10 | 3,3 × 10−4 | 6,9 |
| 12,5 | 3,7 × 10−4 | 8,9 |
3.2 Performance des catalyseurs Metal/TiO2
Les différents photocatalyseurs à base de TiO2 dopé par des métaux de transition ont été évalués pour l’oxydation d’une solution d’ammoniaque à 50 mg/L, soit à un pH initial de 10,3.
3.2.1 Effet de l’ajout de métal sur la conversion
La Fig. 5 présente la conversion obtenue après cinq heures d’irradiation, ainsi que le pH final observé. On observe qu’un des photocatalyseurs (Au/TiO2) présente une activité moindre que le photocatalyseur de référence (TiO2 non dopé), d’autres présentant une activité supérieure (Zn/TiO2 > Ni/TiO2 > Fe/TiO2), les autres présentant des activités très proches de celle de TiO2. La conversion obtenue varie entre 40 et 55 % selon les catalyseurs, il s’agit donc d’écarts faibles. En revanche, les écarts de pH après cinq heures d’irradiation sont plus importants, puisque le pHfinal observé varie selon les photocatalyseurs entre 6,4 et 8,5, sans que l’on puisse établir de relation simple entre l’activité et le pHfinal comme le montre la Fig. 5. L’évolution du point isoélectrique en fonction de la teneur en dopant pourrait éventuellement expliquer ces observations car celui-ci peut baisser lors de traitements thermiques [10] de TiO2 lors de la réduction du précurseur métallique.
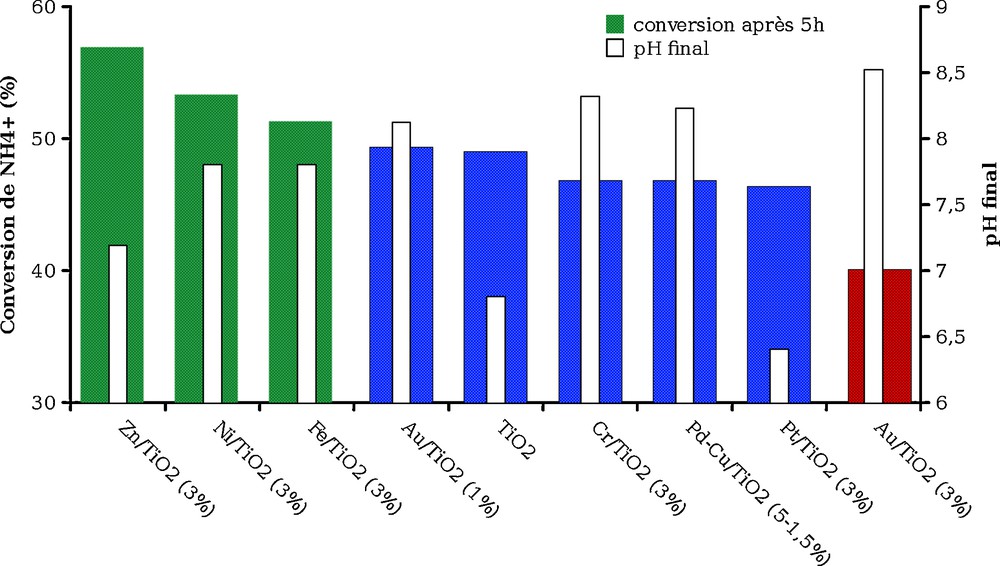
Comparaison des différents photocatalyseurs pour l’oxydation de l’ammoniaque ([NH4+] = 50 mg/L (2,8 × 10–3 mol/L), mcat = 60 mg, température et pression normale).
La diminution de la vitesse de photoxydation observée dans le cas des deux catalyseurs dopés à l’or peut s’expliquer par un effet d’écran dû au masquage de la surface de TiO2 par les particules métalliques [11,12], puisque pour ce métal l’activité diminue sensiblement lorsque la teneur en métal augmente de 1 à 3 %.
Par ailleurs, les catalyseurs TiO2 dopé par Zn, Ni et Fe semblent présenter une activité légèrement supérieure, ce qui peut s’expliquer par la capacité du métal à récupérer des électrons ou des trous sur la surface de BC ou BV réduisant, de cette façon, la recombinaison non désirée électron/trou dans TiO2 [4,11,12]. Dans le cas de TiO2 dopé au Zn, Li et al. [13] attribuent l’effet favorable du dopant sur l’activité à la position respective des BV de ZnO et de TiO2.
3.2.2 Effet de l’ajout de métal sur la sélectivité
La Fig. 6 montre que la sélectivité peut varier de façon importante en fonction de la nature de métal déposé sur TiO2. Les teneurs en NO3− et NO2− sont obtenues par chromatographie ionique et celle en N2 par différence. En se basant sur la sélectivité en N2 (sous réserve d’une mesure directe de N2 formé), on observe que les catalyseurs Ni/TiO2 et Fe/TiO2 sont ceux qui produisent le moins d’anions oxydés qu’il faudra ensuite réduire par hydrogénation catalytique. Ces photocatalyseurs permettant de transformer préférentiellement les ions NH4+ en azote moléculaire sont les plus performants pour le procédé envisagé.
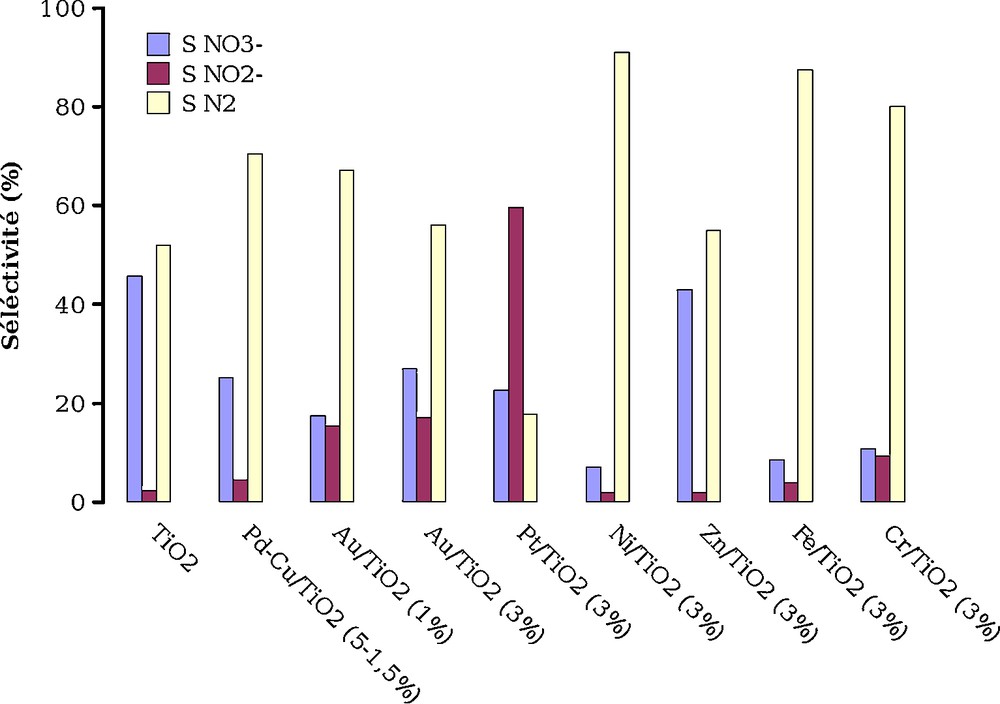
Sélectivité de la photooxydation de NH4+ en présence de différents photocatalyseurs à avancement similaire (40 à 55 %).
3.3 Conditions de réaction
Après avoir étudié les effets du milieu réactionnel et de la nature du photocatalyseur, l’influence des conditions de réaction sur la dégradation des ions ammonium a été mesurée.
3.3.1 Effet de la masse de catalyseur
La Fig. 7 présente le résultat de l’étude menée pour déterminer l’effet de la masse de catalyseur sur la conversion de NH4+. On observe dans les conditions de réaction utilisées, qu’il existe masse optimale (proche de 40 mg) conduisant à une destruction de 60 % des ions ammonium en cinq heures. S’agissant d’une réaction mettant en jeu un catalyseur hétérogène en suspension, l’existence d’une masse optimale de catalyseur assurant la conversion la plus élevée dans un temps fixé, s’explique simplement car :
- • pour les faibles quantités de catalyseur, la conversion augmente avec la masse de photocatalyseur ;
- • pour les quantités élevées de catalyseur, le masquage d’une partie du photocatalyseur par les particules en suspension empêche l’absorption des photons par le photocatalyseur et conduit à une décroissance de la conversion avec l’augmentation de la masse de photocatalyseur.
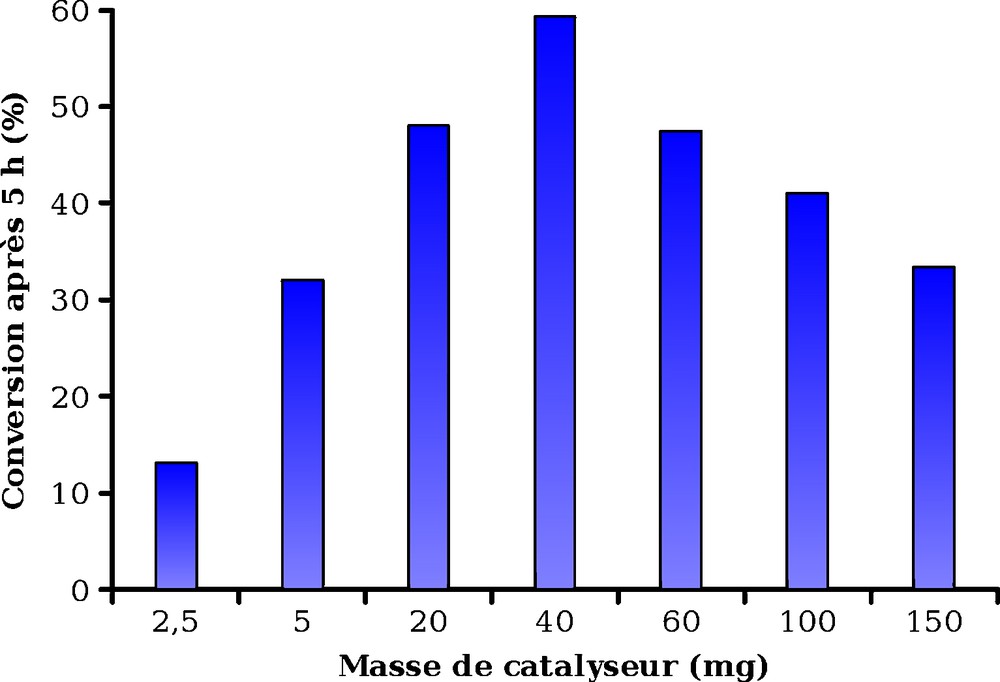
Effet de la masse de catalyseur sur la conversion après 6 h d’irradiation pour le catalyseur Zn/TiO2 (conditions de réaction : [NH4+] = 50 mg/L, T = 25 °C, pHi = 10,3).
3.3.2 Effet de la température
L’effet de la température sur les photocatalyseurs les plus performants a été étudié dans entre 15 et 60 °C. Pour le photocatalyseur TiO2 non dopé, une très faible dépendance de la température sur l’efficacité de dégradation est observée. Dans le cas des photocatalyseurs dopés par les métaux comme Ni/TiO2 et Zn/TiO2, l’augmentation de la conversion lorsque la température augmente est plus importante. La Fig. 8 portant le logarithme de la vitesse initiale en fonction de l’inverse de la température permet de définir une énergie d’activation apparente Ea de 5,4 kJ/mol pour TiO2, de 8,0 kJ/mol pour Ni/TiO2 et de 8,2 kJ/mol pour Zn/TiO2.
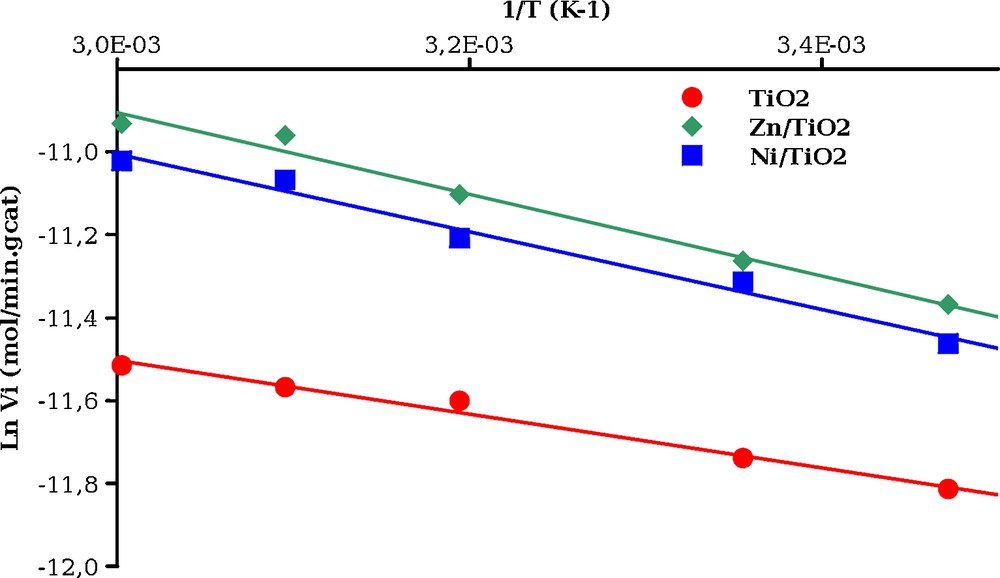
Effet de la température sur la dégradation de NH4+ en présence des catalyseurs TiO2, Ni/TiO2 et Zn/TiO2 (conditions de réaction : NH4+ = 50 mg/L, mcata = 60 mg, pHi = 10,3, Patm = 0,1 MPa).
Cette observation suggère un changement de mécanisme pour les photocatalyseurs dopés en métal. Si l’on décrit le mécanisme de la photoxydation en utilisant un formalisme de type Langmuir-Hinshelwood, le terme d’adsorption présent au dénominateur va peu dépendre de la température et la vitesse de dégradation de NH4+ sera peu sensible à la température [3] dans le cas de TiO2 non dopé. La présence de particules métallique dans le cas de Ni/TiO2 ou Zn/TiO2 peut faciliter l’adsorption des réactifs et des produits et conduire à un terme d’adsorption plus fortement dépendant de la température selon le mécanisme décrit par Herrmann [12] pour la photocatalyse en présence de catalyseurs bifonctionnels comme Pt/TiO2. Des travaux visant à déterminer les chaleurs d’adsorption des espèces NH4+, NO2−, NO3− et O2 sur les catalyseurs TiO2 et TiO2 dopés sont nécessaires pour confirmer cette analyse.
4 Conclusion
Au cours de ce travail, il a été montré que :
- • la dégradation photocatalytique de NH3/NH4+ dans l’eau en présence de TiO2 comme photocatalyseur est possible en milieu alcalin ;
- • l’ajout d’un métal peut augmenter l’activité du photocatalyseur, en particulier l’ajout de Zn, Fe ou Ni ;
- • les différents photocatalyseurs Métal/TiO2 présentent des sélectivités très différentes : Ni/TiO2 et Fe/TiO2 sont ceux qui produisent le plus d’azote moléculaire.
Nous avons pu obtenir des photocatalyseurs :
- • actifs avec des temps caractéristiques comparables à ceux de la réaction d’hydrogénation ;
- • sélectifs puisque transformant une partie des ions NH4+ en N2 ;
- • fonctionnant dans des conditions de pH compatibles avec celles de la réaction d’hydrogénation et le respect des normes de rejet (6,5 < pH < 9).
Ainsi, à un pH de 10 et avec des suspensions de Zn (3 %) /TiO2, un rendement de dégradation de 60 % est obtenu après cinq heures et moins de 34 % de NH3/NH4+ converti est transformé en NO3− le reste étant attribué à la formation d’azote moléculaire. Ces résultats montrent que le procédé d’élimination des ions azotés envisagé est parfaitement viable.
L’interprétation des observations réalisées au cours de ce travail nécessite :
- • une caractérisation plus approfondie des photocatalyseurs (potentiel zéta et dispersion métallique) ;
- • une étude mécanistique plus détaillée incluant l’étude de l’adsorption des diverses espèces sur les photocatalyseurs, afin de choisir le solide photocatalytique le plus performant pour le procédé proposé.
Remerciements
Les auteurs souhaitent remercier J.-P. Deloume qui a fourni les catalyseurs Au/TiO2 et N. Wehbe qui a fourni le catalyseur Pd-Cu/TiO2.


