1 Introduction
Hormis certaines spécificités physiques, les argiles présentent les mêmes propriétés chimiques que les zéolithes ou tamis moléculaires. Il en est ainsi de l’hygroscopie, de l’adsorption et de l’échange d’ions. La possibilité d’incorporer des cations multivalents ou volumineux permet aux argiles d’accroître leur acidité de surface ou leur porosité et devenir ainsi, des tamis moléculaires acides à grands pores pouvant se substituer aux zéolithes dans certains cas [1–3]. Comme les zéolithes, les argiles échangées présentent une acidité de surface comportant des centres acides de types Brönsted et Lewis et peuvent, par conséquent, avoir une activité catalytique appréciable dans certaines réactions chimiques organiques [4,5].
L’introduction de cations bivalent et trivalent dans une structure zéolithique de type Y a pour effet de promouvoir les propriétés catalytiques de ce matériau [6–9]. Des études ultérieures ont permis d’entrevoir le même effet sur des argiles de type bentonite [10,11].
On admet généralement que la conversion catalytique du toluène découle selon un mécanisme ionique [6,8]. Celui-ci fait intervenir l’attaque d’un carbocation sur le cycle aromatique. Cette réaction, dite de dismutation du toluène, s’accompagne souvent de réactions secondaires : dismutation des xylènes, transalkylation toluène–triméthylbenzène ou toluène–xylènes, déméthylation, pyrolyse et réactions de polycondensation [8,11]. Le nombre de réactions impliquées est fonction de l’activité et la sélectivité des catalyseurs utilisés. La conversion catalytique du toluène est influencée par plusieurs paramètres, à savoir la température, la pression, la vitesse spatiale, la nature du cation échangé (catalyseur) et autres.
Dans ce contexte, le présent travail a pour objectif de mettre en évidence l’effet précurseur de l’activité catalytique résultant de l’introduction de l’ion uranyle UO22+ dans la structure d’une argile algérienne de type montmorillonite (Mt). L’activité catalytique a été étudiée dans la réaction de conversion du toluène.
2 Matériels et méthodes
2.1 Préparation des échantillons et procédure d’échange
L’argile naturelle contient essentiellement de la Mt et provient des gisements de Maghniya (Algérie). Elle a une composition chimique qui se caractérise par la présence des constituants regroupés dans le Tableau 1. Le Tableau 2 montre aussi quelques propriétés et caractéristiques physiques de l’argile utilisée.
Composition chimique de la montmorillonite de Maghniya (Algérie).
| Constituants | SiO2 | Al2O3 | TiO2 | Fe2O3 | CaO | MgO | K2O | Na2O |
| Pourcentage (%) | 69,39 | 14,67 | 0,16 | 1,16 | 0,3 | 1,07 | 0,79 | 0,91 |
Propriétés physiques de la montmorillonite de Maghniya (Algérie).
| Densité apparente (kg m−3) | Densité vraie (kg m−3) | pH | Surface spécifique (m2 g−1) | Volume poreux (ml g−1) | Perte au feu (% mass) | Humidité (%) | Couleur |
| 1160 | 2530 | 8,35 | 23,45 | 0,011 | 11,65 | 15,85 | Blanche |
L’échange avec l’ion UO22+ des échantillons a été effectué en batch à l’aide d’une solution aqueuse de nitrate d’uranyle, UO2 (NO3)2 6H2O. Des solutions de 100 ml de différentes concentrations en UO22+ont été mis en contact avec 500 mg d’adsorbant à pH égale à 2 et à une température de 25 °C. Le mélange est soumis à une agitation durant 100 minutes à l’aide d’une secoueuse (350 tr min−1). Les deux phases solide et liquide sont séparées par centrifugation et les filtrats obtenus sont analysés par spectrophotométrie UV/Visible par la méthode Arsenazo-III [12].
Les quantités adsorbées des ions uranyles (qt) sont déterminées à partir de l’équation suivante :
| (1) |
où C0 et Ct (mg l−1) sont les concentrations initiales et au temps t, m (mg) est la masse de l’adsorbant et V (ml) est le volume de la solution aqueuse.
Les taux de fixation des ions uranyles (%) ont été calculés par l’expression suivante :
| (2) |
où C0 et Cf sont les concentrations initiales et finales du métal en solution (mg/L).
Les acidités de surface ont été mesurées par la technique de thermodésorption de l’ammoniac (stepwise thermal desorption [STD]) [13]. Elle consiste en la mesure de l’acidité globale ou densité totale des sites acides et la mesure de leur force de manière quantitative. Des échantillons de 100 mg subissent au préalable une calcination à 550 °C pendant six heures et ramenés, par la suite, à 100 °C. Ils sont alors traversés par un flux d’ammoniac à fort débit pendant au moins 15 minutes. Après l’étape d’adsorption, la température évolue par gradient et paliers successifs toutes les 30 minutes. L’ammoniac désorbé entre 150 et 550 °C, détecté par un catharomètre, est ensuite récupéré dans des barboteurs contenant une solution d’acide de titre connu. L’acidité globale est mesurée et exprimée en mmoles de NH3 adsorbé/g de catalyseur à sec.
Cette acidité globale a été aussi mesurée par adsorption de butylamine. Dans un tube à essai filtré, 0,1 g de catalyseur sont mis en contact avec 5 ml de butylamine (0,1 N) préparée dans du benzène. Après 24 heures, la solution est transvasée dans un Erlenmeyer avec 5 ml d’éthanol et 0,1 ml d’indicateur coloré (0,1 % éthanol). L’acidité globale (mmoles de butylamine adsorbé/g de catalyseur) est déterminée par titrage en retour par l’acide chlorhydrique (0,1 N) préparé dans de l’éthanol.
2.2 Réaction de dismutation du toluène
La réaction catalytique utilisée a eu lieu en phase gazeuse, à pression atmosphérique et dans un réacteur tubulaire en verre pyrex. Le Tableau 3 regroupe les conditions opératoires de la réaction de dismutation du toluène.
Conditions opératoires de la réaction catalytique.
| Réaction | Dismutation du toluène |
| Réacteur | À lit fixe |
| Catalyseur | 0,5 g |
| Granulométrie | 2 × 2 mm |
| WHSV (h−1) | 8,2 |
| Température | 475 |
| Temps de réaction (min) | 60 |
| Gaz vecteur | Hélium N60 |
| Débit He (ml h−1) | 120 |
| Réactifs | Toluène, C6H5-CH3 |
| Débit Toluène (ml h−1) | 4,8 |
Les produits de la réaction ont été analysés par chromatographie en phase gazeuse à l’aide d’un appareil de type VARIAN 3300 muni d’un détecteur FID. Une colonne de 6 m à base de 5 % bentone 34 et 5 % dodécylphthalate déposés sur du Chromosorb W-HP (80/100 mesh) a été utilisée.
3 Résultats et discussions
3.1 Effet de la concentration initiale sur la quantité adsorbée des ions uranyles
L’effet de la concentration initiale des ions uranyles sur la quantité adsorbée des ions UO22+ par l’argile a été étudié et les résultats sont montrés dans le Tableau 4. Il ressort de ces résultats que la quantité adsorbée des ions uranyles augmente avec l’augmentation de la concentration initiale de 5 à 100 mg l−1. Cependant, d’autres travaux effectués sur des argiles et des zéolithes naturelles ont montré un effet inverse en utilisant des concentrations de métaux à base de Cu2+, Co2+, Zn2+ et Mn2+ allant de 100 à 400 mg l−1 [14]. Effectivement, à des concentrations supérieures à 100 mg l−1, le processus d’échange des ions avec les cations de l’adsorbant (argile) devient plus difficile. Durant l’échange, les ions métalliques doivent se déplacer et diffuser à travers les pores et interstices de l’argile afin de remplacer ses cations échangeables (surtout le sodium et le calcium). Dans le cas des ions uranyles (5 à 100 mg l−1), leur diffusion est rapide à travers la porosité de l’argile et retardée quand ils se déplacent à travers des canaux de faibles dimensions. Par conséquent, l’adsorption des ions uranyles peut être attribuée à des réactions d’échange d’ions dans le matériau argileux.
Quantités adsorbées de UO22+, surfaces spécifiques et volumes poreux des échantillons d’argiles.
| No échantillon | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| Concentrations UO22+ (mg l−1) | 5 | 7 | 10 | 15 | 30 | 50 | 65 | 80 | 90 | 100 |
| Quantités adsorbées (qmax) (mg g−1) | 1 | 1,4 | 2 | 3 | 6 | 10 | 11 | 16 | 18 | 20 |
| Surface spécifique (m2 g−1) | 23,24 | 23,02 | 22,59 | 22,17 | 21,95 | 21,53 | 21,04 | 20,84 | 20,80 | 20,72 |
| Volume poreux (ml g−1) × 103 | 10,9 | 10,8 | 10,6 | 10,4 | 10,3 | 10,1 | 9,87 | 9,78 | 9,76 | 9,72 |
3.2 Effet des ions UO22+ sur l’acidité totale des argiles échangées
Conformément à nos prévisions, l’introduction des ions UO22+ par échange d’ions a pour effet d’accroître l’acidité totale de surface de l’argile étudiée. En effet, la Fig. 1 montre l’existence d’une proportionnalité entre la quantité adsorbée des ions uranyles et l’acidité totale de surface de l’argile. L’acidité totale des argiles chargées de UO22+ augmente avec l’augmentation de la quantité adsorbée (qe). Cette acidité résulte essentiellement de la formation de centres ou de sites acides [(Si-O-Al)−, H+] de type Brönsted [15,16] nécessaire pour le mécanisme de la réaction de dismutation du toluène. Le catalyseur utilisé dans cette réaction qui se déroule à une température allant de 400 à 550 °C doit avoir, en général, une acidité et une force d’acidité assez élevées.

Évolution de l’acidité totale de l’argile en fonction du taux de fixation de l’ion uranyle.
Généralement, l’introduction d’un cation polyvalent, comme UO22+, dans la structure d’une argile ou d’une zéolithe a pour effet de créer des champs électrostatiques dus à la délocalisation des charges. En plus, ces cations polyvalents s’associent à des molécules d’eau lors de leur échange sur les surfaces des catalyseurs. Ce phénomène d’hydrolyse a lieu après calcination des catalyseurs échangés. Les cations occupent alors des positions privilégiées dans leurs structures et charpentes et génèrent, par conséquent, une acidité traduite par des sites acides de type Brönsted et même de Lewis.
3.3 Effet des ions UO22+ sur la force d’acidité de l’argile échangée
L’effet des ions UO22+ sur la force d’acidité de l’argile échangée a été étudié sur l’échantillon chargé avec une concentration initiale de 80 mg l−1 en ions uranyles. La thermodésorption par paliers de l’ammoniac entre 150 et 550 °C a permis la détermination de plusieurs forces d’acidité, comme le montre la Fig. 2. Chaque pic représente une acidité partielle à une température de désorption bien définie correspondant à une force acide de la surface de l’argile. Ainsi, une distribution des centres acides de différentes forces d’acidité, en fonction de la température d’activation, a été établie. Le pic le plus intense qui apparaît à 200 °C correspond à une force d’acidité faible. Dans le domaine limité par les températures 250 et 350 °C, les pics de désorption d’ammoniac correspondent à des forces d’acidités moyennes. Quant au domaine de température allant de 400 à 550 °C (celui des transformations des BTX), les pics correspondent à des forces d’acidités peu fortes (400 °C), fortes (450 °C) et très fortes (500–550 °C).
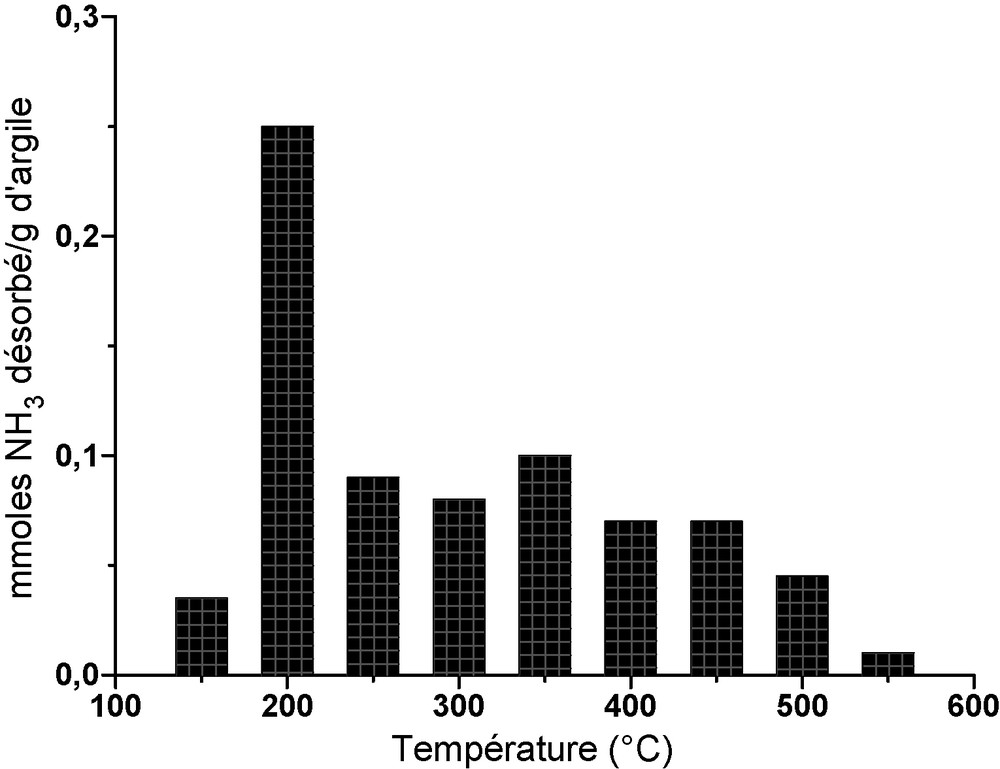
Distribution de la force d’acidité du matériau argileux échangé aux ions UO22+ de concentration 80 mg l−1.
Ainsi, la surface du matériau argileux échangé aux ions UO22+ possède les caractéristiques de forces d’acidités nécessaires pour le mécanisme réactionnel des transformations des BTX. Cela suggère que l’introduction de l’ion uranyle dans la structure de l’argile améliore sa surface et de ce fait, la stabilise. Ce qui concorde avec des travaux similaires de Karge et al. [17] qui avaient constaté que des ions volumineux, tels que La3+ et UO22+ fixés sur des zéolithes Y sont responsables de la genèse des sites acides forts et très forts dans le même domaine de température étudié.
3.4 Réaction de dismutation du toluène
Selon la littérature [8,16,18–20], la réaction de dismutation du toluène peut avoir lieu selon deux mécanismes possibles montrés par la Fig. 3. Le premier a lieu par l’intermédiaire de type diphénylméthane et le second par la scission du groupement méthyle.

Mécanismes possibles de la réaction de dismutation du toluène (a) par l’intermédiaire de type diphénylméthane et (b) par la scission du groupement méthyle.
Indifféremment de la variante acceptée, il s’agit d’un mécanisme bimoléculaire de substitution électrophile sur le noyau aromatique. Il s’est avéré que pour les catalyseurs présentant une sélectivité de forme prononcée, la vitesse de réaction de dismutation est de beaucoup inférieure à celle de l’isomérisation des xylènes [21]. Cela présente une preuve que le schéma réactionnel « a » est plus probable.
De plus, tenant compte des espèces moléculaires participant au processus, il est certain qu’il s’agit de « sélectivité de l’état de transition » [22]. Dans ces conditions, le paraxylène est un produit primaire de la réaction car il est favorisé du point de vue tant énergétique que stérique. Les résultats expérimentaux confirment cette affirmation. Dans ce contexte, la Fig. 4 représente la dépendance entre la « parasélectivité » et la conversion du toluène sur trois types de matériaux. Nous avons utilisé deux zéolithes HY et HM afin de comparer leurs activités catalytiques à celles des matériaux argileux échangés aux UO22+. Les principales caractéristiques de ces zéolithes sont présentées dans le Tableau 5. Il se trouve que la tendance d’approche de la proportion d’équilibre du paraxylène est très accentuée, même pour les faibles valeurs de conversions du toluène. Ce comportement est dû à la sévérité des conditions opératoires qui déterminent aussi bien l’augmentation de la conversion du toluène que le déroulement des réactions secondaires et plus particulièrement, l’isomérisation du paraxylène. Il est à constater aussi que le comportement des Mt échangées à l’ion uranyle est similaire à celui des zéolithes HY et HM et présentent même une parasélectivité appréciable (Fig. 4).

Sélectivité pour le paraxylène en fonction de la conversion du toluène. T = 475 °C.
Caractéristiques des zéolithes HY et HM utilisées dans la réaction de dismutation du toluène.
| Échantillon | Composition chimique anhydre | Surface spécifique (m2 g−1) | Volume poreux (ml g−1) | Acidité (mmoles butylamine ads/g) | ||
| Na | Si | Al | ||||
| HY | 15,06 | 65,23 | 19,69 | 360 | 0,12 | 1,36 |
| HM | 10,10 | 75,13 | 15,12 | 278 | 0,067 | 1,20 |
Le Tableau 6 montre les principaux produits de la réaction de dismutation du toluène obtenus sur ces échantillons, à savoir le benzène (B), le paraxylène (p-X), le métaxylène (m-X), l’orthoxylène (o-X), les triméthylbenzènes (TMB) et le coke (C). Ces matériaux montrent des sélectivités intéressantes concernant les produits de xylènes et spécialement, l’isomère para. Cette sélectivité est exprimée par le rapport B/X. Quand ce dernier tend vers l’unité, nous obtenons une sélectivité maximale, comme c’est le cas des échantillons 9, 10 et 11 dont leurs activités catalytiques (exprimées par la conversion du toluène) sont supérieures à 2,5 % mol. Nous remarquons aussi qu’il existe une relation entre ce rapport B/X et l’acidité totale des argiles échangées.
Performances des matériaux argileux échangés aux ions UO22+ dans la réaction de dismutation du toluène à 475 °C.
| No échantillon | Conv. T. (% mol) | B (% mol) | pX (% mol) | mX (% mol) | oX (% mol) | TMB (% mol) | C (% mol) | B/X |
| 1a | 0,20 | 0,14 | 0,02 | 0,02 | 0,01 | – | 0,07 | 2,80 |
| 2 | 0,25 | 0,17 | 0,02 | 0,04 | 0,01 | 0,03 | 0,06 | 2,42 |
| 3 | 0,46 | 0,34 | 0,03 | 0,04 | 0,02 | 0,01 | 0,43 | 3,77 |
| 4 | 0,49 | 0,35 | 0,04 | 0,05 | 0,02 | – | 0,06 | 3,18 |
| 5 | 0,96 | 0,51 | 0,20 | 0,16 | 0,09 | – | 0,08 | 1,13 |
| 6 | 1,10 | 0,55 | 0,14 | 0,22 | 0,11 | 0,08 | 0,08 | 1,17 |
| 7 | 1,40 | 0,83 | 0,21 | 0,21 | 0,10 | 0,15 | 0,13 | 1,59 |
| 8 | 1,58 | 0,81 | 0,20 | 0,30 | 0,13 | 0,09 | 0,16 | 1,29 |
| 9 | 2,87 | 1,27 | 0,31 | 0,56 | 0,26 | 0,05 | 0,24 | 1,12 |
| 10 | 3,40 | 1,70 | 0,34 | 0,79 | 0,32 | – | 0,25 | 1,17 |
| 11 | 4,72 | 2,06 | 0,72 | 1,23 | 0,11 | – | 0,12 | 1,00 |
a Échantillon : argile non échangée.
Comme nous l’avons déjà expliqué, cette acidité totale génère les sites acides [(Si-O-Al)−, H+] nécessaires pour la réaction de dismutation du toluène. Les Fig. 5 et 6 montrent l’évolution de l’activité catalytique des argiles échangées en fonction de leur acidité totale et de la quantité adsorbée des ions UO22+, respectivement. Ce qui prouve l’effet précurseur de ces ions uranyles sur l’activité catalytique. Ces résultats sont en concordance avec ceux obtenus dans une étude comparative de l’effet de l’introduction des ions uranyles et d’autres cations sur une faujasite Y et une bentonite [23].
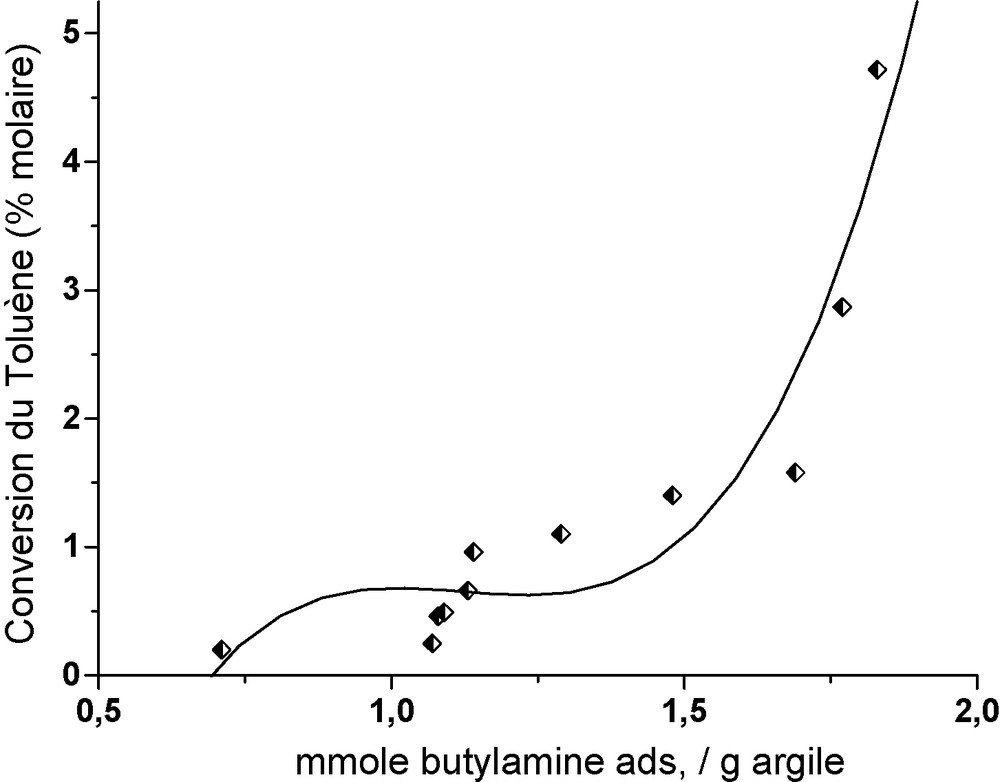
Évolution de l’activité de l’argile en fonction de l’acidité totale dans la dismutation du toluène.

Évolution de l’activité de l’argile en fonction du taux d’échange de l’ion uranyle dans la dismutation du toluène.
4 Conclusion
Il ressort de la présente étude que les argiles de type Mt échangées aux ions uranyles manifestent une activité et une sélectivité appréciables dans la conversion du toluène.
Les mesures d’acidité par la technique STD ont permis la caractérisation des sites acides des échantillons et la détermination de leurs forces d’acidités générées par l’introduction des ions uranyles dans la structure des argiles. Il a été aussi montré que l’activité catalytique est étroitement liée à cette force et qu’elle est conservée même à des températures de 550 °C.
Il ressort aussi d’après cette étude que le comportement des Mt échangées à l’ion uranyle est similaire à celui des zéolithes HY et HM et présentent même une parasélectivité meilleure.


