1 Introduction
Les cyclodextrines (CD) (également connues sous le nom de cyclomaltose, cycloamyloses ou encore dextrines de Schardinger) sont des oligosaccharides cycliques constitués de six à plus de 100 unités α-d-glucopyranose. Elles sont synthétisées par bioconversion de l’amidon en utilisant une enzyme appelée la cycloglucanotransférase (CGTase) [1]. La particularité des CD est qu’elles se présentent sous forme de cône tronqué avec une cavité intérieure hydrophobe et un extérieur hydrophile. Cette structure cage permet aux CD d’encapsuler une large gamme de molécules pour former un complexe hôte-invité. Le complexe formé change les propriétés (stabilité, solubilité, hydrophobicité, goût…) de la molécule invitée ce qui rend la CD intéressante à l’échelle industrielle.
Les CD natives CD6, CD7 et CD8 (contenant respectivement six, sept et huit unités de glucose), communément appelées α-, β- et γ-cyclodextrines, ont été bien caractérisées et largement utilisées dans l’industrie. En revanche, les CD à large cycle (CD-LC) contenant plus de huit unités de glucose, ont été peu étudiées et les informations disponibles sur ces molécules sont limitées. Dans les années 1990, des études se sont intéressées à leurs synthèses et leurs caractérisations ont démontré l’existence de CD à plus de 100 unités de glucose [2]. Ces CD-LC sont produites soit à partir d’enzymes spécifiques [3], soit dans des conditions particulières de température et de temps d’incubation [4]. La purification des CD-LC à l’échelle industrielle reste un verrou qui empêche le développement de ces molécules. Au niveau du laboratoire, la disponibilité croissante des CD-LC a permis une caractérisation plus poussée de ces molécules, prélude nécessaire à leurs utilisations dans des applications. Bien que de formes et de tailles très différentes des α-, β- et γ-CD (Fig. 1), la capacité des cavités des CD-LC à encapsuler des molécules dans des complexes hôte-invité a été démontrée [5,6]. En particulier, une étude a montré qu’un mélange de CD-LC ayant un degré de polymérisation (DP : nombre de motif glucose) de 22 à 45 peut être utilisé comme macromolécule chaperonne artificielle pour le repliement de protéines dénaturées (première application importante des CD-LC) [7]. Vu l’intérêt croissant porté à ces CD-LC, nous proposons dans ce qui suit une mise au point bibliographique sur la synthèse, la purification et les applications potentielles de ces molécules.
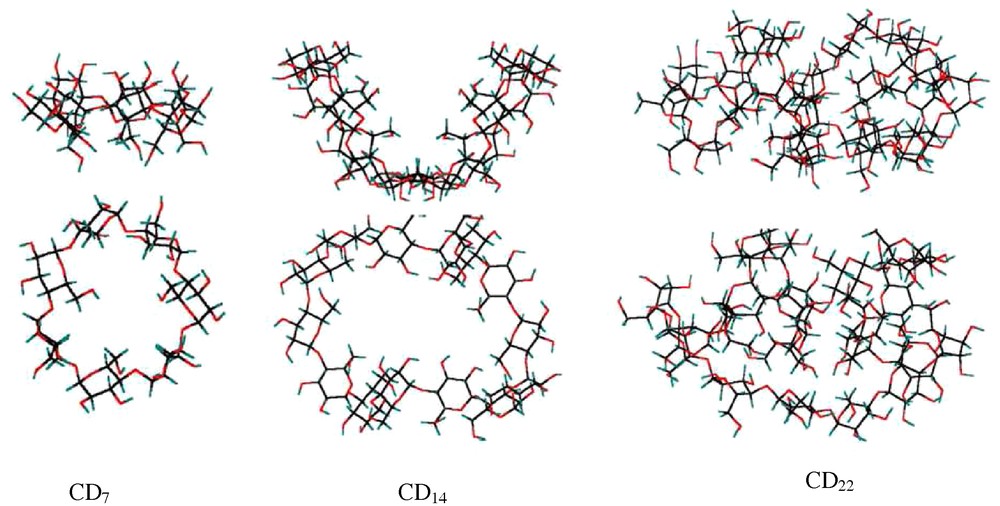
Structure de la CD7, CD14 et CD22 [8].
2 Production des cyclodextrines
La production de CD-LC en quantité appréciable est une étape cruciale nécessaire au développement de ces composés. La première étape du procédé de synthèse des CD est la liquéfaction de l’amidon par élévation de la température [9] ou par utilisation d’enzyme hydrolytique [10]. L’enzyme CGTase est ensuite ajoutée à la solution obtenue. Cette enzyme, par l’intermédiaire de deux groupements catalytiques (un groupement acido-basique Glu 257 et un autre nucléophile Asp 229), engendre la réaction de transglycosylation intramoléculaire responsable de la formation des CD [4,11]. En réalité quatre différentes réactions de transglycosylation peuvent avoir lieu : (1) la réaction de cyclisation, (2) la réaction d’allongement de chaîne par couplage, (3) la réaction de dismutation par transglycosylation intermoléculaire et (4) un transfert de site actif par hydrolyse à l’eau [4]. Toutes ces réactions influent sur la quantité et la distribution de taille finale des CD produites.
Plusieurs travaux ont étudié la production des CD-LC par des CGTases obtenues à partir de différents isolats bactériens [4,12,13]. Des enzymes issues de trois souches différentes de Bacillus ont été testées sur l’amylose [12]. Il a été montré que les CD-LC sont essentiellement produites aux premiers stades de la réaction. Lorsque le temps d’incubation est prolongé, ces composés sont convertis en CD6-CD8. La CGTase obtenue de la souche A2-5a de Bacillus alcalophilus produit majoritairement, après 1 heure d’incubation, des CD-LC qui se convertissent ensuite en un mélange de CD6 à CD8. Dans le cas de la CGTase issue de la Bacillus macerans, la conversion de ces CD-LC en CD à petit cycle est beaucoup plus lente. Enfin la CGTase de Bacillus stearothermophilus produit majoritairement dés le début de la réaction un mélange de CD6 à CD8. Des CGTases issues d’autres souches (BT3, BT4, BT25, BT57) ont été également testées sur l’amylose [13]. Ces CGTases se comportent différemment avec une production de CD-LC qui augmente avec le temps : dans le cas des isolats BT3 et BT4, la quantité de CD-LC augmente avec le temps de réaction et celle des CD à petit cycle diminue, alors que pour les isolats de BT25 et BT57 le rendement des deux fractions augmentent avec le temps. Récemment, la même équipe a travaillé sur la synthèse des CD contenant plus de huit unités de glucose avec la CGTase de B. macerans [4]. Ils ont montré que la température et le temps d’incubation de la réaction pouvaient être optimisés pour obtenir des rendements satisfaisants en CD-LC. À 40 °C, la production de CD-LC atteint un rendement maximal de 35 % au bout de deux heures d’incubation. Au-delà de deux heures, les CD-LC se convertissent progressivement en CD6-CD8 pour complètement disparaître après 20 heures de réaction. En revanche, à 60 °C, la conversion de l’amylose initial en CD-LC atteint un rendement maximal de 50 % après deux heures d’incubation et au-delà des deux heures, le rendement reste pratiquement constant. Les auteurs ont pu expliquer l’influence de ces paramètres par la compétition entre les deux réactions de transglycosylation de cyclisation et d’ouverture de cycle. Une étude plus récente effectuée par Qi et al. [14] a montré l’effet de l’ajout d’éthanol sur la réaction de transglycosylation intramoléculaire. Les auteurs ont observé que l’éthanol a pour effet d’augmenter la quantité des CD-LC obtenue par la CGTAse de Bacillus Sp. BT3-2 et celle de B. macerans. La présence de 15 % d’éthanol dans la réaction avec la CGTase de Bacillus Sp. BT3-2 entraîne une augmentation de la quantité des CD10-CD13 de 30 % après cinq heures de réaction. La présence de 20 % d’éthanol augmente dix fois le rendement des CD14-CD21. D’autres études se sont intéressées à la production ciblée des CD-LC en utilisant des enzymes spécifiques. L’effet de la d-enzyme de pomme de terre (α-(1,4)-d-glucan 4-glucosyl transférase) sur l’amylose de degré de polymérisation élevé a été expérimenté [15]. Il a été observé que la réaction produit des CD-LC possédant un DP de 17 à 160 avec un rendement supérieur à 95 %. La glucanotransférase (GTase) issue du Pyrococcus kodakaraensis KOD 1 a également été utilisée afin de synthétiser des CD-LC [16]. Cette GTase est capable de catalyser des réactions de transglycosylation intramoléculaire (avec cyclisation) pour produire des CD-LC de DP compris entre 16 et 55 avec un rendement pouvant atteindre 67 %.
Nous observons à partir de cette synthèse bibliographique que la préparation des CD-LC se trouve le plus souvent en compétition avec celle des CD6 à CD8 dont la production industrielle est bien connue et les paramètres opératoires optimisés. Cependant, en conclusion de cette partie, on peut dire que la synthèse, avec de bons rendements, de CD-LC commence à être maîtrisée et qu’un développement à grande échelle est potentiellement envisageable. Contrairement au cas des CD6-CD8, l’étape de purification pourrait être un facteur limitant car les CD-LC sont produites en mélange complexe de CD ayant de six à plus de 100 unités de glucose.
3 Purification des cyclodextrines
Les méthodes chromatographiques sont souvent les plus efficaces pour séparer et isoler des composés dans un mélange complexe : c’est ce qui a été appliqué avec succès dans le cas des CD-LC [2,17–25]. Taira et al. [23] ont purifié les CD36, CD37, CD38 et CD39 par plusieurs étapes chromatographiques en utilisant des colonnes octadecylsilyl-silica gel (ODS) et amino (NH2). Cette technique reste onéreuse et nécessite plusieurs étapes de purification. Miyazawa et al. [17] ont purifié la CD9 à partir d’un mélange commercial de CD par chromatographie afin de déterminer ses propriétés physicochimiques. La technique utilisée est très fastidieuse ; le mélange complexe est d’abord prépurifié pour obtenir la CD9 brute.
Ce prétraitement consiste à diluer le mélange initial dans un tampon acétate (pH 2,5), puis à l’incuber à 30 °C pendant trois jours en présence de β-amylase, pullulanase et de levure. Les dextrines et les CD ramifiées sont ainsi converties en glucose et CD. Après centrifugation, les CD6 à CD8 sont éliminées par ajout de solvants : du tétrachloréthane pour complexer la CD6 et du bromobenzene pour complexer la CD7 et CD8. Les dextrines restantes sont précipitées par ajout d’éthanol, puis éliminées par centrifugation. Le surnageant riche en CD-LC est par la suite récupéré par précipitation sous l’effet de l’acétone. Le précipité obtenu est à son tour purifiée par chromatographie pour obtenir la CD9 laquelle est fractionnée par HPLC en utilisant une colonne d’ODS. La fraction composée principalement de CD9, CD7, d’oligosaccharides linéaires et d’autres contaminants est purifiée par chromatographie conventionnelle sur une colonne silica C18 pour obtenir une fraction enrichie en CD9. Cette fraction est par la suite purifiée sur une colonne amino pour obtenir 235 mg de CD9 pure (soit un rendement d’environ 2 %). Une procédure similaire a été utilisée pour purifier la CD12 (pureté > 98 %) [18]. La chromatographie à exclusion stérique (colonne Superdex 30) a également été utilisée pour fractionner un mélange de CD-LC de DP allant de 17 à une centaine d’unités glucose [24]. La fraction CD17–CD30 est récupérée et isolée par précipitation à l’éthanol. Une colonne phase inverse C18 est ensuite utilisée pour extraire la CD21. Une procédure similaire a été appliquée pour isoler la CD26 [25].
Les techniques chromatographiques ont jusqu’ici été utilisées à des fins de caractérisation des CD-LC. Elles permettent également d’isoler ces différentes CD-LC avec un degré de pureté élevé mais avec un rendement très faible qui dépend de la fraction du composé dans le mélange. En revanche, ces techniques ne sont pas adaptées à une production industrielle à un coût raisonnable. Dans le cas des CD6-CD8, le mélange formé à partir de la bioconversion enzymatique d’amidon par la CGTase est habituellement traité afin d’isoler séparément chaque CD. Ces composés sont extraits avec une pureté supérieure à 99 % à l’échelle industrielle par précipitation sélective en ajoutant des agents complexant appropriés [9]. Cette procédure de purification assure une large production des CD6-CD8 à des coûts modérés, ce qui a permis le succès commercial de ces molécules. Des procédures de production similaires ont été expérimentées sur les CD-LC. Cependant, aucun complexant sélectif n’a été trouvé jusqu’ici pour les CD-LC [26]. Afin de produire des CD-LC à coût raisonnable, une approche basée sur le fractionnement partiel des CD-LC de manière à obtenir des coupes de répartition resserrée en nombre d’unités glucose, a été proposée. Cette approche repose sur le fractionnement d’un mélange initial de CD contenant 8 % glucose, 17 % CD6-CD8 et 75 % de CD LC (DP = 9–60) par procédé membranaire [27]. Une cascade de filtration utilisant le recyclage des rétentats obtenus sur trois membranes (nanofiltration HL et ultrafiltration serrée GH et GK) de seuil de coupure respectivement égal à 200, 1000 et 2000 Da a été effectuée successivement de la membrane la plus serrée à la plus lâche. Cette opération a permis d’obtenir deux coupes : la première enrichie en CD9-CD21 et la seconde en CD22-CD60. Cette technique très facilement industrialisable semble prometteuse dans la mesure où elle peut constituer soit seule soit en couplage avec la chromatographie préparative une voie de purification de fractions de CD-LC.
4 Applications des cyclodextrines
La formation d’un complexe d’inclusion entre une CD hôte et une molécule active invitée est à l’origine des nombreuses applications des CD. En effet, les propriétés physicochimiques et biologiques de la molécule invitée sont fortement influencées par son inclusion dans la cavité des CD [8,28]. La force motrice conduisant à la formation de ce complexe est liée à l’interaction hydrophobe entre l’intérieur de la CD et les parties hydrophobes des molécules à inclure. La stabilité du complexe dépend de nombreux facteurs, en particulier l’adéquation entre la taille et la forme des deux partenaires. Parmi les changements de propriétés, nous pouvons citer l’augmentation de la solubilité en milieu aqueux, la stabilisation des molécules sensibles à la lumière et à l’oxygène, la modification de la réactivité chimique des molécules et l’augmentation de la biodisponibilité de la molécule invitée. C’est pourquoi, les CD ont trouvé des applications dans de nombreux secteurs industriels, notamment dans les industries alimentaires, cosmétiques et pharmaceutiques [29–31]. Les CD-LC ont pour l’instant peu d’applications car elles ne sont pas disponibles en quantité suffisante. Cependant, puisqu’elles possèdent des structures uniques avec des cavités déformées [32], elles pourraient être utilisées comme nouvelles molécules hôtes pour former des complexes d’inclusion spécifiques. De plus, leur solubilité à l’eau élevée [33] et les propriétés non hémolytiques de certaines CD-LC [34] peuvent leur assurer des applications potentielles dans les secteurs pharmaceutiques, alimentaires et biotechnologiques.
Ainsi, l’aptitude de la CD9 à solubiliser des molécules hydrophobes (anthracène, amphotercine B, Ajmalicine, aimaline, carbamazepine, digitoxine et spironolactone) a été étudiée mais les résultats se sont avérés décevants excepté pour les deux derniers composés [17]. Cependant, l’augmentation de solubilité observée reste moins importante que celle obtenue avec la CD7 et la CD8. Les constantes de complexation, des CD7 à CD9, calculées à partir des diagrammes de solubilité sont respectivement de 13 000 M−1, 3900 M−1 et 820 M−1 pour la spironolactone [17], et de 63 000 M−1, 33 000 M−1 et 1700 M−1 dans le cas de la digitoxine [17]. Dans la plupart des cas étudiés, la solubilisation et les constantes de stabilité mesurées sont au mieux égales à celles obtenues dans les cas des petites CD. Il semble donc que les structures flexibles des CD-LC ne sont pas favorables à la formation et à la stabilisation des complexes d’inclusion du moins dans les mêmes conditions que celles jusqu’ici étudiées pour les petites CD [34,35].
Les diagrammes de solubilité obtenus par interaction entre un mélange de CD-LC (DP = 20–50) et une série de principes actifs comme la prednisolone, le cholestérol, la digitoxine et la nitroglycérine montrent la formation de complexes d’inclusion, excepté dans le cas de la nitroglycérine [36]. Il faut noter que la solubilisation du cholestérol obtenue par mélange de CD-LC est d’environ un ordre de grandeur plus élevée que celle observée avec les CD à petit cycle. Ainsi l’utilisation de CD-LC en mélange pourrait s’avérer plus intéressante qu’en composé isolé. Par ailleurs, il a été décrit que la CD12 permet la solubilisation de nanotubes de carbone monofeuillet par formation d’un complexe d’inclusion soluble dans l’eau [37]. Une autre application qui se développe concerne le repliement des protéines dénaturées en présence de tensioactifs. Il a été montré que les CD-LC présentent une grande efficacité pour empêcher l’agrégation des protéines lors de leur repliement assisté par un tensioactif. Ainsi, des enzymes dénaturés retrouvent leurs activités par action de CD-LC (DP = 22–45 et DP > 50) [7]. L’extraction des molécules tensioactives, par les CD-LC sans interaction forte avec les parties hydrophobes des protéines, est le mécanisme proposé pour expliquer cette propriété.
5 Conclusion
Bien que connues depuis plus de 50 ans, ce n’est que récemment que l’on a commencé à s’intéresser aux CD-LC. D’importants progrès biotechnologiques ont été accomplis, ce qui a permis leurs productions en quantité soit à partir d’enzymes spécifiques soit avec la CGTase dans des conditions particulières de température et de temps d’incubation. À l’heure actuelle, ces composés sont produits en mélange couvrant toute la gamme des tailles de CD depuis l’α-CD à six unités glucose jusqu’à des cycles de plus de 100 unités. Cette spécificité implique que chaque composé n’est produit qu’avec un rendement faible à moins que l’on arrive à trouver des enzymes pouvant conduire à l’obtention d’un seul cycle ou d’une gamme restreinte de composés.
Les CD-LC possèdent des structures cycliques uniques et flexibles, ce qui leur permettrait de former des complexes d’inclusion spécifiques mais aussi d’avoir généralement des interactions moins fortes avec les substrats. Le point limitant qui empêche le développement et l’utilisation des CD-LC à large échelle est leur purification. Actuellement, la technique généralement utilisée pour purifier et isoler les CD-LC est la chromatographie. Cette technique est complexe, onéreuse et inappropriée pour une production à échelle industrielle. L’avenir de ces molécules à large cycle, en terme d’applications, se situe a priori plus dans l’utilisation des mélanges que des produits purs. Le fractionnement des CD-LC en gamme restreinte de composés par procédés membranaires semble une alternative prometteuse pour le développement commercial de ces molécules.


