1 Introduction
Les fluides supercritiques (SC) ont attiré l’attention de chercheurs chimistes dans le cadre de la protection de l’environnement. Leur utilisation a été étendue de l’extraction à la synthèse et catalyse asymétrique des intermédiaires pharmaceutiques [1–4]. Les fluides SC sont des solvants de choix qui possèdent une combinaison unique et comparable des propriétés de gaz et de liquide. Comme gaz, ils ont une grande diffusion et une faible viscosité, comme liquides ils ont des densités remarquables et peuvent dissoudre différentes espèces. Par ailleurs, la densité et le pouvoir de solvatation des fluides SC sont tenaces permettant un degré de contrôle qui est absent chez les solvants conventionnels.
Les solides divisés sont largement utilisés dans plusieurs secteurs : chimie fine, cosmétique, industries agroalimentaires, industries pharmaceutiques [5–7]. Actuellement, les procédés de cristallisation utilisent les fluides SC afin de réduire la taille des particules et de varier leur formes. Ces matériaux pouvant être employés dans la préparation : de particules ultra-fines et mono-disperses, de molécules sensibles à la chaleur, et dans la fabrication de systèmes à libération contrôlée [8–10].
Dans ce travail, nous présentons les différentes applications du gaz carbonique (CO2) SC dans la synthèse organique et en pharmacologie. Nous indiquons également l’intérêt d’obtenir des molécules organiques finement divisées à l’aide de ce nouveau milieu réactionnel.
2 Propriétés du fluide supercritique
Les propriétés physiques indispensables pour l’utilisation de fluide SC sont : la densité, la viscosité et la diffusion. Une comparaison de ces propriétés [11] pour les gaz, les liquides et les fluides SC est illustrée dans le Tableau 1. Pour accroître le pouvoir de pénétration du fluide SC, trois points sont essentiels :
- • faible viscosité ;
- • grande diffusion du soluté ;
- • absence de tension de surface.
Comparaison de propriétés physiques et de transport des gaz, liquide et fluides supercritiques (SC) [13].
| Propriétés | Gaz | Liquide | Fluide SC |
| Densité ρ (kg/m3) | 0,6–2 | 600–1600 | 200–500 |
| Viscosité η (mPa) | 0,01–0,3 | 0,2–0,3 | 0,01–0,03 |
| Coefficient de diffusion D (106 m2s-1) | 10–40 | 0,0002–0,002 | 0,07 |
Ces caractéristiques leurs permettent des applications variées telles la micro-encapsulation, l’imprégnation [12]. Vue leurs faibles viscosités, les fluides SC ont généralement une densité massique supérieure et des propriétés de transport élevées et sont ainsi d’intéressants solvants potentiels pour de nombreuses réactions chimiques.
La technique du CO2 SC utilise du CO2, qui dans certaines conditions de pressions et de températures (7,4 MPa et 31 °C), se comporte comme un solvant. Cette technique connue depuis environ 25 ans dans l’industrie présente de nombreux intérêts. Elle permet de travailler à une température modérée (à partir de 31 °C), ce qui ne dénature pas les qualités organoleptiques et les principes actifs de l’extrait obtenu. L’extrait reste dans un état proche du naturel.
Elle permet en outre d’obtenir des extraits exempts de tous résidus de solvant d’extraction. À la fin de l’extraction, par abaissement de la pression (phase de détente), on provoque le passage du gaz carbonique de l’état SC à l’état gazeux et le CO2 s’élimine tout seul de l’extrait sous pression atmosphérique. Le CO2 SC permet de solubiliser des composés apolaires, de faibles poids moléculaires et thermosensibles. Cependant beaucoup d’autres molécules ne sont solubles. Cela nécessite alors l’emploi de co-solvant (comme le méthanol) et la variation de pression, température, composition, densité et solubilité du soluté dans le mélange binaire.
Dans le Tableau 2, nous comparons les constantes critiques de quelques fluides SC usuels.
Comparaison de constantes critiques de fluides supercritiques (SC) usuels [14].
| Fluide | Température critique T (°C) | Pression critique P (MPa) |
| Dioxyde de carbone (CO2) | 31,1 | 7,37 |
| Méthane (CH4) | −82,1 | 4,64 |
| Éthane (C2H6) | 32,3 | 4,88 |
| Propane (C3H8) | 96,7 | 4,24 |
| Argon (Ar) | −122,3 | 4,86 |
| Protoxyde d’azote (N2O) | 36,5 | 7,34 |
| Eau (H2O) | 374,1 | 22,11 |
3 Applications pour la synthèse organique
L’intérêt d’utiliser les fluides SC dans des réactions chimiques s’accroît dans le but de remplacer les solvants organiques souvent toxiques par les fluides SC. D’importantes réactions ont été étudiées grâce aux fluides SC telles que : polymérisation, oxydation, métathèse, alkylation, hydrogénation, hydroformylation, etc. L’emploi des fluides SC dans les processus catalytiques a permet de surmonter beaucoup de difficultés particulièrement en chimie, industrie et environnement. De manière générale, la catalyse homogène est préférée aux réactions hétérogènes due aux rendements élevés et aux sélectivités supérieures. Par ailleurs, les réactions employant les fluides SC présentent un excellent avantage dans la séparation des produits et l’élimination du solvant du mélange.
3.1 Réaction de condensation
Les chercheurs d’Hoffmann-La Roche [15] ont réalisé la synthèse racémique de l’intermédiaire (D,L)-α-tocophérol, à partir de la 2,3,5-triméthyl-1,4-hydroquinone et de l’isophytole dans du CO2 SC. La réaction a montré une conversion totale suivie d’un rendement élevé (Fig. 1).
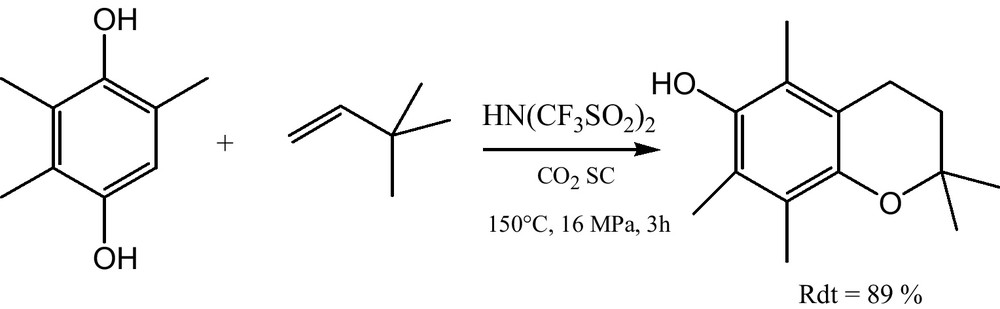
Synthèse du (D,L)-α-tocophérol.
3.2 Réaction d’oxydation
Rayner et al. ont étudié la diastéréosélectivité de l’oxydation asymétrique de la cystéine en sulfoxydes correspondants [16] en optimisant la pression du fluide SC. Un excès diastéréomérique de 95 % d.e a été obtenu à 11 MPa de CO2 (Fig. 2). Aucune diastérosélectivité n’a été observée dans les conditions normales de la réaction d’oxydation (acide méta-chloroperbenzoïque (mCPBA)/CH2Cl2, −78 °C).

Oxydation asymétrique de la cystéine.
3.3 Réaction de Pauson-Khand
Il s’agit de la cyclisation des alcynes vrais avec les alcènes terminaux et de dicobalt octacarbonyle pour obtenir des cyclopentènones (Fig. 3) [17].
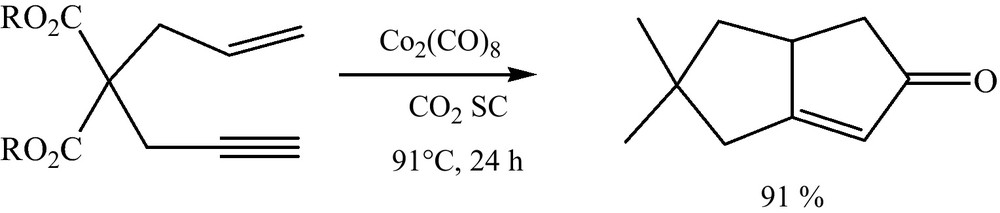
Réaction de Pauson-Khand.
3.4 Réaction d’hydrogénation
L’hydrogénation catalytique de l’acide benzoïque est utilisée dans la préparation de quelques intermédiaires pharmaceutiques, tel que : le 1-hydroxycyclohexylphénylcétone, le praziquantel, l’acide trans-4-isopropylcyclohexyle, le cyclohexylméthylcarbamate, et la N-(cyclohexylcarbonyl)-(D)-phénylalanine [18,19]. Les auteurs ont obtenu une sélectivité de 100 % en employant le Rh/C. L’étude a révélée que cette activité diminue du rhodium au palladium (Rh/C > Ru/C > Pt/C > Pd/C) (Fig. 4) [20].
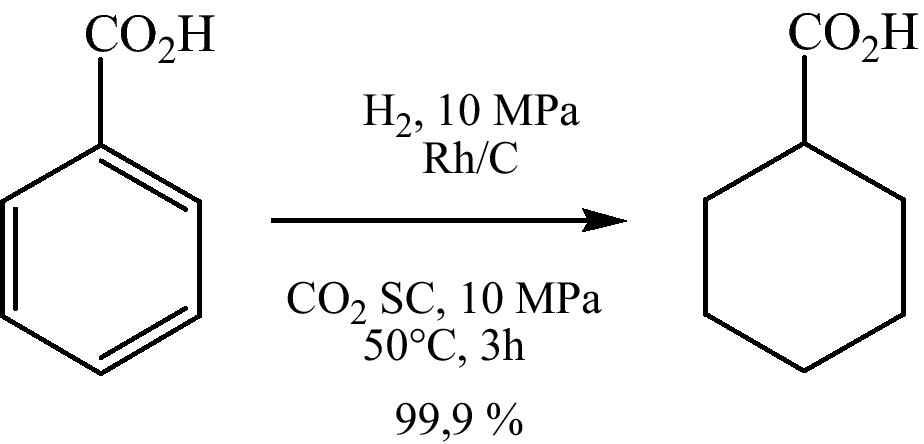
Hydrogénation catalytique de l’acide benzoïque dans CO2 supercritiques.
3.5 Réaction de Friedel-Crafts
Pour la synthèse de l’acide téréphtalique, précurseur des polyesters, l’équipe d’Olah et al. ont travaillé dans des conditions de grande sélectivité de la réaction et un excellent rendement [21]. Le toluène en présence de chlorure d’aluminium CO2 SC (5,7 MPa, et 80 °C) fournit de l’acide p-toluique. L’avantage d’utiliser le CO2 SC est d’éviter la contamination de l’eau par des déchets organiques, et d’augmenter la solubilité de l’oxygène nécessaire à l’oxydation (Fig. 5).
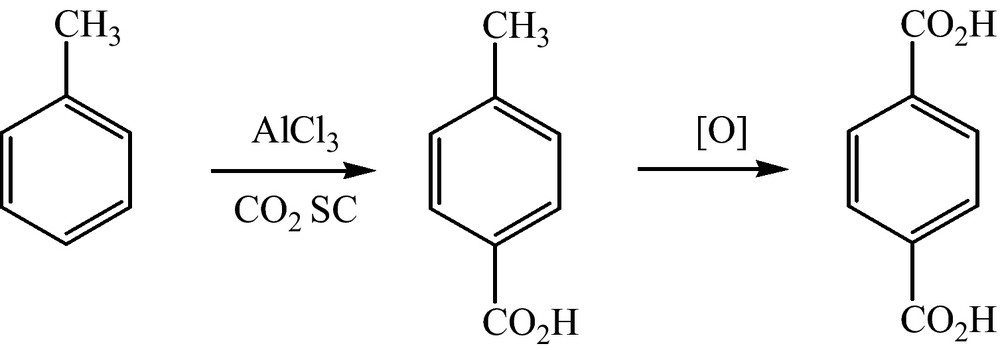
Réaction de Friedel-Crafts et oxydation.
3.6 Réaction de métathèse
La réaction de métathèse est établie sur les fondements de la catalyse hétérogène. Grâce aux avancées technologiques, les auteurs l’ont développée et transformée en milieu homogène [22]. La sélectivité de cette réaction a été contrôlée par la pression de CO2 SC. Le composé hétérocyclique est obtenu majoritairement (87 %) sous la pression de 20 MPa (Fig. 6).
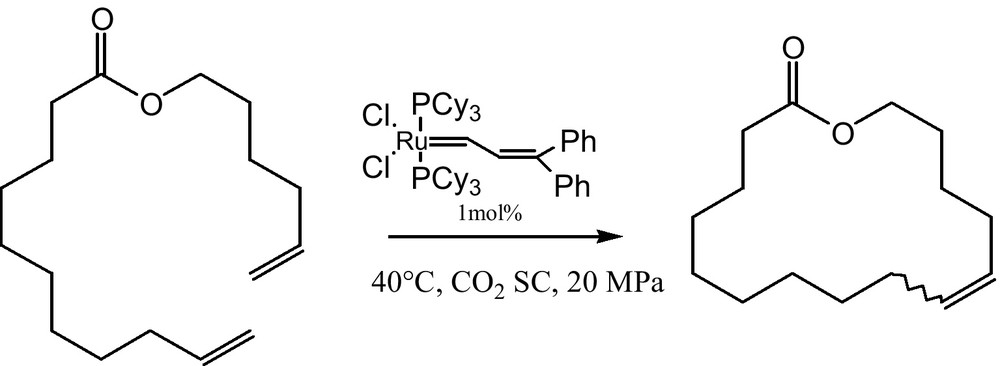
Réaction de métathèse.
Dans la synthèse de l’épilachnène, les auteurs ont remarqué que le catalyseur de ruthénium est empoisonné par l’amine secondaire [23]. La même réaction reprise sous atmosphère de CO2 SC, permet la formation de dérivé d’acide carbamique. Ainsi, le CO2 SC peut être employé comme groupe protecteur (Fig. 7).
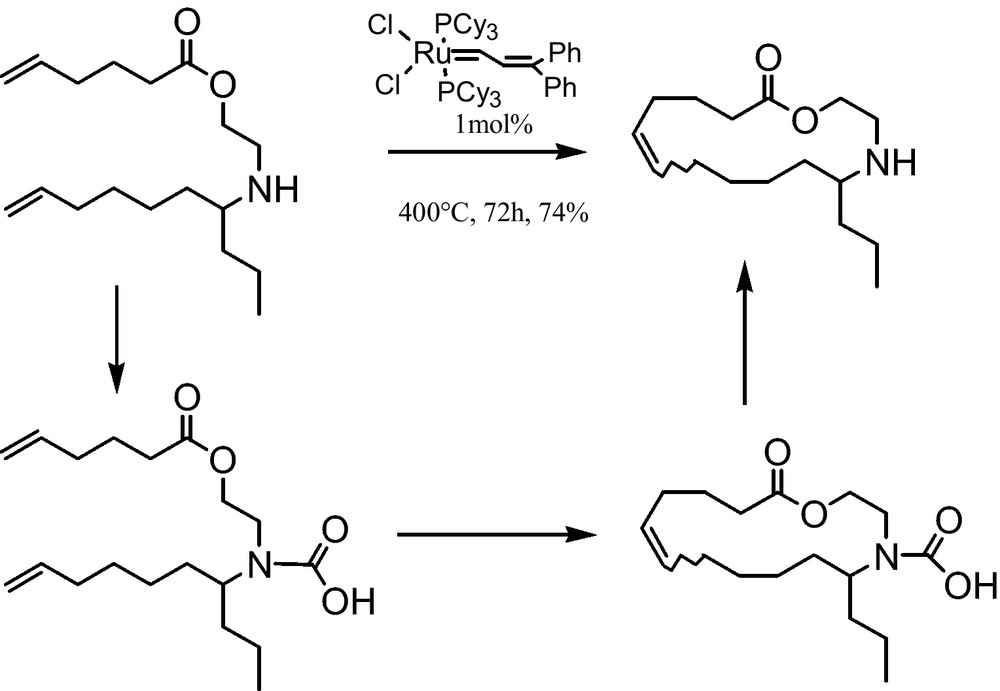
Réaction de métathèse pour l’obtention de l’épilachnène.
3.7 Polymérisation
La solubilité des monomères et polymères dans du CO2 SC permet de réaliser le mode de polymérisation approprié à ce milieu. Beaucoup de composés organiques de faible poids moléculaire apolaires, ainsi que quelques substances polaires possèdent des solubilités moyennes dans du CO2 SC. Dans les conditions douces de température et de pression (<100 °C, < 35 MPa), le CO2 SC est un solvant de choix pour les copolymères poly(éther-carbonates). Ces derniers sont synthétisés à partir des précurseurs peu coûteux (propylène et CO2) (Fig. 8) [24].
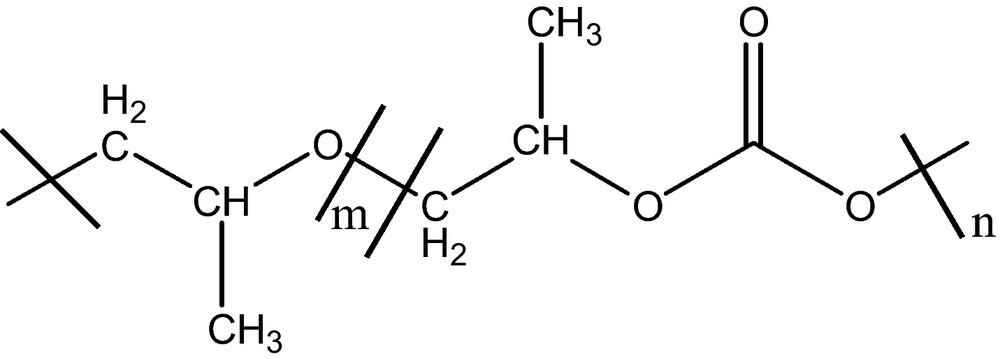
Structure de copolymères poly(éther-carbonate).
3.8 Synthèse des polyamides
La synthèse a été accomplie en une seule étape de polycyclisation en faisant réagir des dianhydrides tétracarboxyliques avec des diamines à haute pression (Fig. 9) [25].

Synthèse de polyamides.
4 Molécules employées en pharmacologie
La plupart des nouvelles molécules destinées à devenir des médicaments sont quasiment insolubles dans l’eau. La diffusion d’un produit biologiquement actif dépend essentiellement de sa solubilité et de sa vitesse de dissolution dans les fluides biologiques.
De particules ultra-fines ayant une distribution de taille resserrée, présentent des surfaces de contactes spécifiques élevées et augmentent la vitesse de dissolution.
Les systèmes d’encapsulation à libération contrôlée sous la forme de microsphères ou de microcapsules augmentent la solubilité de la molécule bioactive dans le milieu biologique. Cela se traduit par un effet thérapeutique prolongé sur plusieurs heures, voire plusieurs jours. De plus, ces systèmes peuvent également constituer des barrières aux sucs gastriques ou servir à masquer un goût désagréable.
4.1 Étapes principales pour l’obtention des particules
Les étapes principales pour obtenir des particules sont fonctions de la forme de ces dernières. Nous représentons cela par le Schéma 1.

Étapes principales pour obtenir des particules.
Ce principe a surtout été appliqué à des composés minéraux, comme les métaux, les oxydes métalliques et les céramiques. Autres solvants que le CO2 SC, sont souvent utilisés, en particulier l’eau et le pentane.
4.2 Protéine
Des avancées technologiques ont permis l’apparition de nouvelles protéines thérapeutiques. Ces dernières représentent un cas particulier de molécules organiques. Elles sont fragile à des températures élevées, sensibles au pH, et facilement hydrosolubles. L’insuline recombinante humaine a été créée par ces nouveaux procédés avec conservation de son activité biologique [26]. Cette dernière a été précipitée sous forme de particules sphériques de tailles variables (allant de 4 μm (90 %) à 1 μm [10 %]) par le mélange de solvants diméthylsulfoxyde/N,N-diméthylformamide (DMSO/DMF) et utilisant le CO2 SC comme anti-solvant (Fig. 10).

Structure de l’insuline humaine représentant la chaîne A et la chaîne B attachées au peptide C.
4.3 Molécule cage
L’utilisation de molécule cage (telle que les β-cyclodextrines) augmente la solubilité en formant avec la molécule originelle un complexe plus soluble. Cette famille de molécules est constituée d’oligomères cycliques de glucose contenant six, sept ou huit unités. La β-cyclodextrine possède à l’intérieur une cavité tronconique hydrophobe (constituée du cycle glucose) et à l’extérieur une partie hydrophile constituée majoritairement des groupements hydroxyles. Ainsi, une molécule hydrophobe de taille comparable peut s’insérer dans la β-cyclodextrine et donner une solubilité hautement élevée. Cette complexation peut être réalisée en mode statique selon deux méthodes [27]. La première voie consiste à percoler le mélange SC à travers un lit de la β-cyclodextrine [28]. Dans la seconde méthode, les deux molécules (β-cyclodextrine et molécule hydrophobe) co-cristallisent [29]. En 2003, l’équipe de Fages ont mis au point un procédé qui a permis l’augmentation de la biodisponibilité de l’éflucimibe [30]. Obtenues selon un procédé peu coûteux, les β-cyclodextrines peuvent être greffées sur des supports nucléophiles et utilisées dans la séparation chromatographique chirale avec des facteurs de séparation très élevés (Fig. 11) [31–35].

Inclusion de molécule hydrophobe dans une cyclodextrine.
4.4 Système à libération contrôlée : molécule encapsulée
L’usage croissant des composés pharmaceutiques a permis de produire des poudres directement actives ou des systèmes à libération contrôlée. Ils sont composés d’une substance active enrobée ou encapsulée dans un polymère biocompatible. De nombreux systèmes à visé thérapeutique sont formulés pour provoquer une cinétique contrôlée de libération d’un principe actif.
Malcolmson et Embleton ont réalisé la micro-encapsulation et l’enrobage pour la formulation de poudres administrables par voie pulmonaire [36]. Ces poudres doivent posséder les propriétés suivantes [37]. Leur manipulation et inhalation doivent être faciles. La poudre enrobée (principe actif et excipient) doit être utilisée avec une très faible granulométrie (comprise entre 1 et 5 μm) pour faciliter l’absorption par les alvéoles pulmonaires.
Parmi les biomatériaux sélectionnés pour assurer les soins de plaies traumatiques ou chroniques, nous citons les travaux suivants portant sur les propriétés comparatives aux gels, hydrogels, oléogels, hydrocolloïdes :
- • la lovastatine a été cristallisée sous forme d’aiguilles et enrobée dans de microsphères d’acide polylactique (PLA), et d’acide polyglycolique (PGA). Ce sont des polymères biodégradables les plus utilisés en raison de leur excellente compatibilité après implantation dans le corps humain (Fig. 12) [38] ;
- • le poly-3-hydroxybutyrate (PHB) est un plastique biodégradable utilisé à des fins biomédicales. Il est biocompatible, non toxique, et accepté facilement par le corps humain, est utilisé comme système de libération contrôlée de principe actif. La vitamine A a été englobée dans des microparticules de PHB par la méthode de solvant-évaporation (Fig. 13) [39] ;
- • l’acide p-hydroxybenzoïque a été co-cristallisé avec des polymères biodégradables tels que PLA et PGA (Fig. 14) [40].

Structure de la Lovastatine.
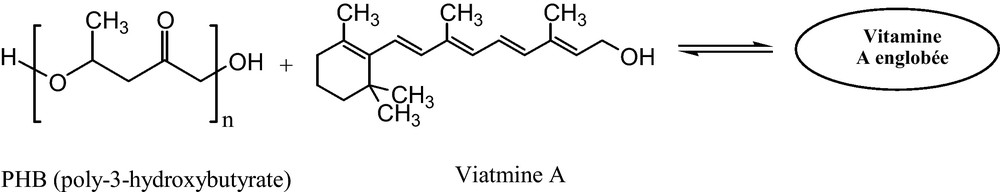
Préparation de la vitamine A englobée dans du poly-3-hydroxybutyrate.
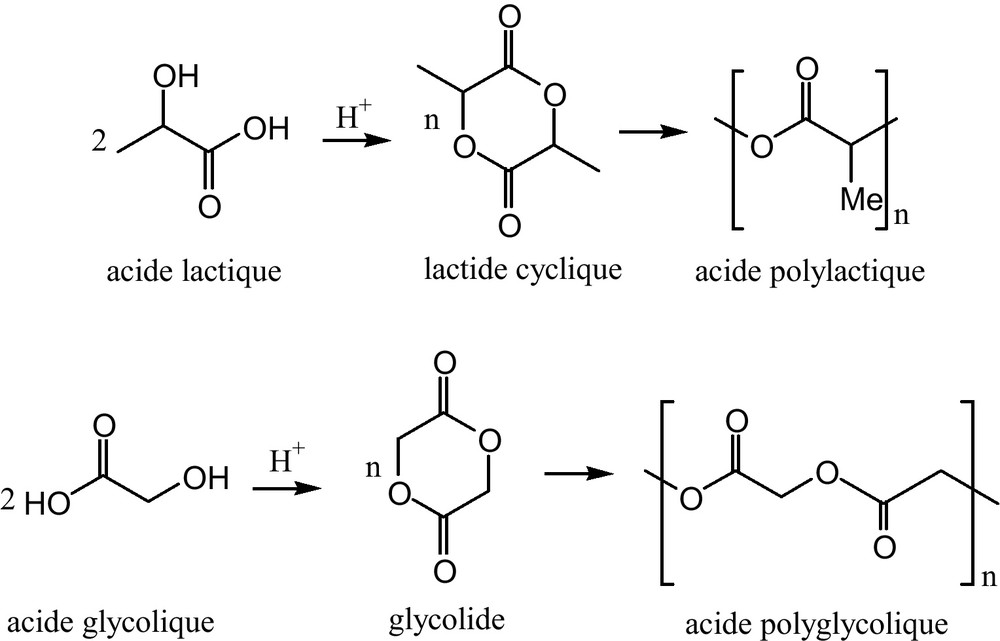
Obtention des acides polylactique et polyglycolique.
Récemment, Chong at al. ont réalisé une encapsulation d’eudragit RL 100 (un copolymère des esters polyacrylate et de polyméthacrylate avec un faible taux de groupe ammonium quaternaire) en nanoparticules utilisant de la microsilice et de l’acétaminophène (paracétamol) dans du CO2 SC. Les tailles des nanocomposites obtenues sont respectivement de 16–30 nm pour la silice et de 50 nm pour l’acétaminophène (Fig. 15) [41].
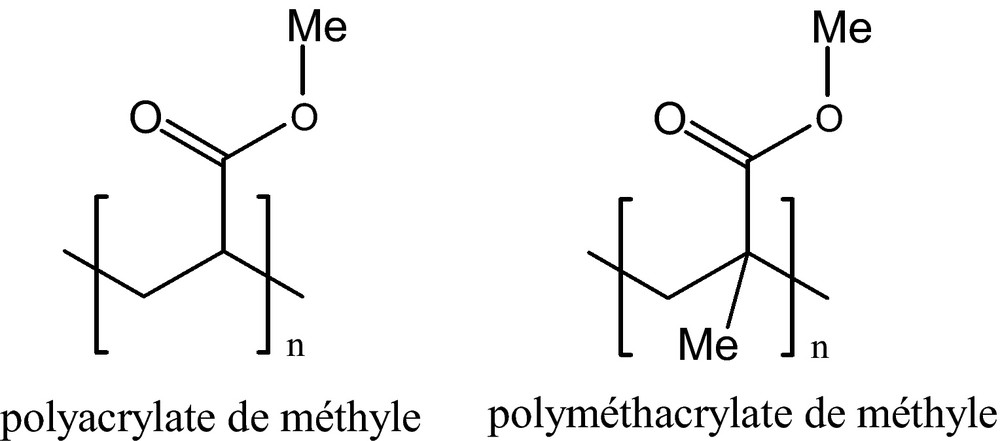
Structures des esters polyacrylate et polyméthacrylate.
5 Conclusions
La technique de CO2 SC représente un large spectre de potentialités dans de nombreux domaines d’activités. Elle peut remplacer les traitements utilisant un liquide à caractère apolaire comme des hydrocarbures et des solvants halogénés.
Les applications les plus courantes sont les traitements : d’extraction, de fractionnement, de déposition, d’imprégnation, de réaction, de chromatographie et d’autres.
Les procédés d’élaboration de poudres utilisant les fluides SC présentent des avantages considérables : réduction du nombre d’opérations unitaires d’un procédé, pureté des produits obtenus, importante réduction des rejets toxiques, réalisation de particules composites, amélioration des propriétés d’usage de poudres.


