1 Introduction
Avec le développement des marchés industriels et des besoins en matériaux toujours plus performants et spécifiques, le monde industriel exerce d’une manière consciente ou non, une pression sur le monde de la recherche pour pouvoir élaborer des matériaux nouveaux ayant des caractéristiques très précises et bien définies, mais aussi parfaitement contrôlées, reproductibles et stables afin de répondre aux critères de qualité actuellement exigés. Au début du xxe siècle, les matériaux de synthèse remplacent peu à peu les matériaux traditionnels. L’approfondissement des connaissances permet d’améliorer les propriétés de ces nouveaux matériaux et d’innover sans cesse dans ce domaine. À cet égard, une nouvelle méthode de synthèse connue sous le nom de procédé « Sol-Gel » [1–3] s’est developpée ces dernières années. Elle met en jeu des réactions chimiques douces et ouvrant la voie à des applications originales. Ce procédé a été utilisé pour synthétiser des gels, à partir des oxydes métalliques [4–6], donnant des solides finement divisé et aussi transparents [7–9]. Ils sont connus sous le nom de xérogels, aérogels, cansogel et cryogel selon la méthode de séchage utilisée [10–15]. En 1989, Pekala et al. introduiront pour la première fois la synthèse d’aérogel de carbone par polycondensation du résorcinol et de formaldéhyde en présence de carbonate de sodium comme catalyseur basique [10,16]. Ces aérogels de carbone conviennent à beaucoup d’applications particulièrement comme matériaux pour les phases stationnaires des colonnes HPLC [17–19], électrodes de supercapaciteurs [20–22], support de catalyseurs et des enzymes [23–27], adsorbants et filtres de gaz [28–30], dispositifs de stockage d’énergie [20]. Cependant le succès des aérogels de carbone et leurs applications dans différents domaines sont largement liés à leurs porosités et à leurs surfaces spécifiques [24,31]. En revanche, il est primordial de connaître parfaitement la structure moléculaire et les caractéristiques microscopiques des matériaux candidats à ces applications diverses.
Dans ce cadre, ce travail s’inscrit où il vise la synthèse d’une résine résorcinol/formaldéhyde par le procédé sol-gel puis la séché pour obtenir le xérogel. Le xérogel R/F obtenu est pyrolysé à partir de la température ambiante jusqu’à 800 oC pour former le charbon actif. Ainsi, nous nous sommes intéressés de suivre la réaction de polymérisation du résorcinol avec du formaldéhyde en milieu aqueux en présence d’un catalyseur acide (CH3COOH) ou basique (Na2CO3) par RMN. Cela, nous permet de déterminer le mécanisme de la réaction et la structure du xérogel obtenu.
2 Résultats et discussion
La synthèse du xérogel R/F se déroule en deux étapes. La première réside dans la préparation de l’hydrogel par une polycondensation du résorcinol avec du formaldéhyde en milieu aqueux avec un rapport molaire formaldéhyde/résorcinol = 2. Deux types de catalyseurs ont été utilisé : l’acide acétique comme catalyseur acide et le carbonate de sodium comme catalyseur basique. La deuxième stipule le séchage conventionnel de l’hydrogel obtenu selon quatre paliers de température à 25, 50, 100, 110 oC.
Les résultats de mesure du temps de gélification et du rendement sont donnés dans le Tableau 1.
Mesure du rendement et du temps de gélification.
| Échantillon | tg (heures) | Masse obtenue après séchage | Rdt (%) |
| E1 | 27,35 | 3,274 | 61 |
| E2 | 209,10 | 4,01 | 75 |
Les résultats obtenus montrent que le rendement est meilleur avec une catalyse basique. Ainsi, il s’avère que le temps de gélification est plus long en comparaison avec celui correspondant à une catalyse acide. Après gélification les échantillons ont été soumis à un séchage à quatre paliers de température 25, 50, 100 et 110 oC à la pression atmosphérique. Le suivi de la variation de la masse de l’échantillon en fonction du temps est visualisé dans les Schémas 1 et 2.
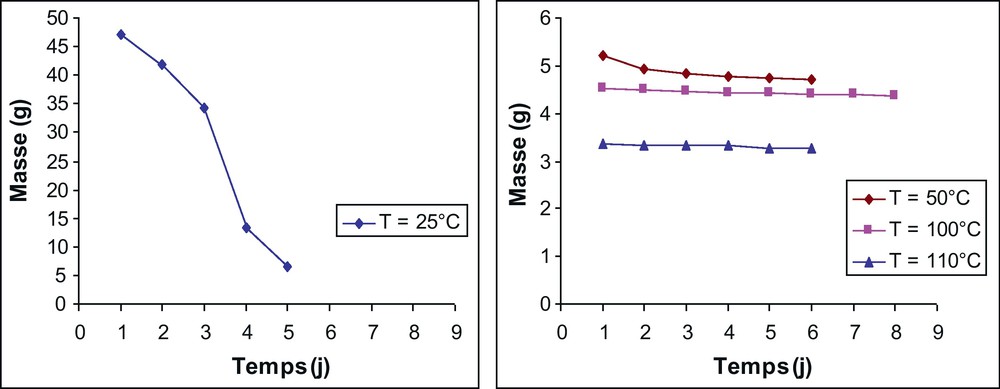
Variation de la masse de l’échantillon E1 en fonction du temps.
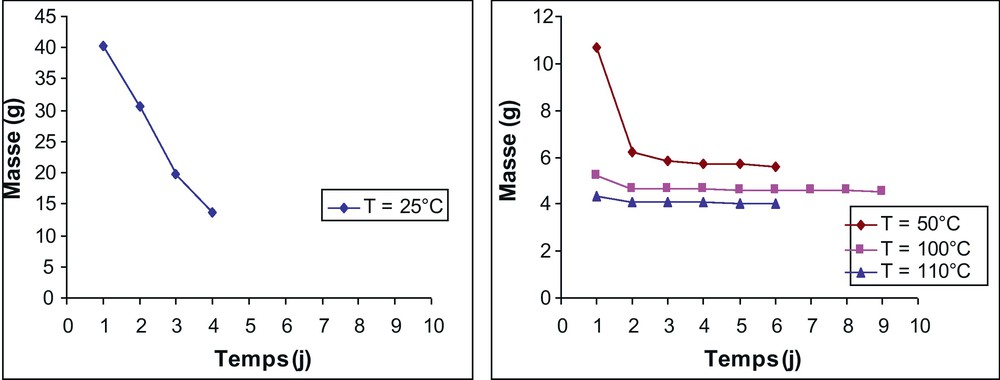
Variation de la masse de l’échantillon E2 en fonction du temps.
Les courbes (m = f[t]) obtenus montrent que les échantillons ont perdu plus de 85 % de leur masse au cours du séchage aux températures 25 et 50 oC. Cependant, la perte de masse est inférieure à 15 % pour une température de 100 oC. Par ailleurs, la masse demeure pratiquement constante à 110 oC. Ainsi, la perte de masse se fait en deux étapes consécutives rapide puis lente. La première correspond à l’évacuation de l’eau des grands pores alors que la deuxième correspond à l’évacuation de l’eau des pores de taille plus petite. À ces deux étapes s’ajoute une étape qui correspond à la stabilisation de la masse de l’échantillon.
En suivant la variation de la composition du mélange au cours du temps par RMN liquide, nous avons obtenu les spectres RMN 1H et 13C des Schémas 3 et 4.

Spectres RMN proton et 13C de l’échantillon E1.

Spectres RMN proton et 13C de l’échantillon E2.
L’interprétation des spectres obtenus nous a permis de proposer une structure avec une jonction de type CH2OCH2O entre les noyaux aromatiques (Schémas 5 et 6).

Structure proposée pou l’échantillon E1.
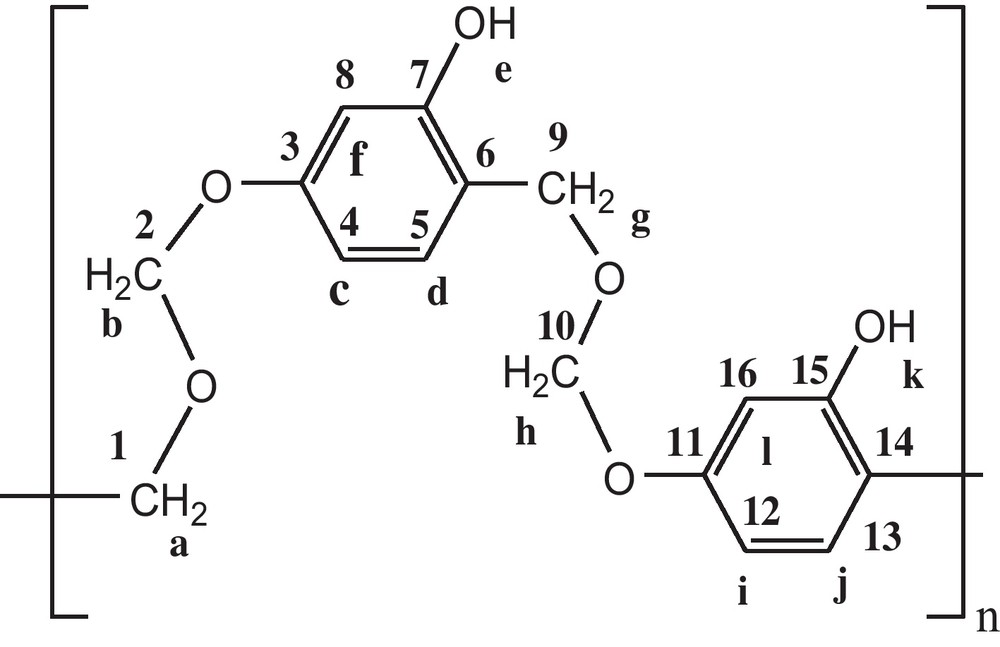
Structure proposée pou l’échantillon E2.
La comparaison entre les spectres RMN 13C des deux produits issus de la réaction de polymérisation en milieu acide ou basique montre la présence de deux pics supplémentaires dans le spectre de l’échantillon E1. Un pic vers 176,43 ppm attribué au carbone de la fonction ester. Un pic vers 20,53 ppm attribué au carbone du groupe méthyle lié à la fonction carbonyle. La présence de ces deux pics prouve qu’en milieu acide se produit une réaction d’estérification de l’acide acétique avec des fonctions alcools présentes sur le noyau aromatique du gel (Tableaux 2–5).
Déplacements chimiques du 1H de l’échantillon E1.
| δ (ppm) | 2,10 | 4,71–5,09 | 5,93–6,68 |
| 1 H | m, m’ | a, e, k, g | b, c, d, f, h, i, j, l |
Déplacements chimiques du 13C de l’échantillon E1.
| δ (ppm) | 20,53 | 54,84 ; 49,58 | 82,35 ; 86,05 ; 89,74 ; 93,45 | 102,98 |
| 13 C | 17, 17′ | 1, 9 | 2, 10 | 8, 16 |
| δ (ppm) | 107,72 | 130,49 ; 131,01 | 155,34 ; 157,41 | 176,43 |
| 13 C | 4, 12 | 5, 6, 13, 14 | 3, 7, 11, 15 | 18, 18′ |
Déplacements chimiques du 1H de l’échantillon E2.
| δ (ppm) | 4,68–5,05 | 5,89–6,61 |
| 1H | a, e, k, g | b, c, d, f, h, i, j, l |
Déplacements chimiques du 13C de l’échantillon E2.
| δ (ppm) | 48,50 ; 49,34 ; 59,89 | 82,17 ; 89,44 ; 89,88 | 102,82 | 107,29 ; 107,69 |
| 13 C | 1, 9 | 2, 10 | 8, 16 | 4, 12 |
| δ (ppm) | 118,24 ; 118,64 | 127,93 ; 128,38 ; 131,22 | 155,54 ; 155,94 ; 156,74 ; 157,13 | |
| 13 C | 6, 14 | 5, 13 | 3, 7, 11, 15 |
En se basant sur la structure du xérogel, nous proposons les mécanismes de réaction de polymérisation en milieu acide et en milieu basique consignés dans les Schémas 7 et 8.
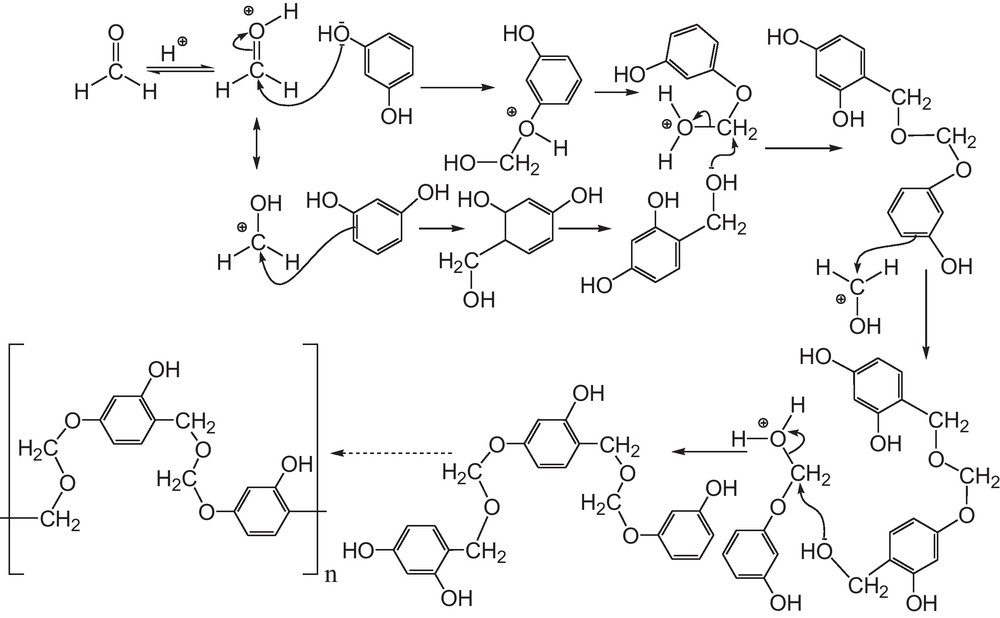
Mécanisme proposé pour la réaction de polymérisation du résorcinol avec du formaldéhyde en milieu aqueux catalysée par l’acide acétique.
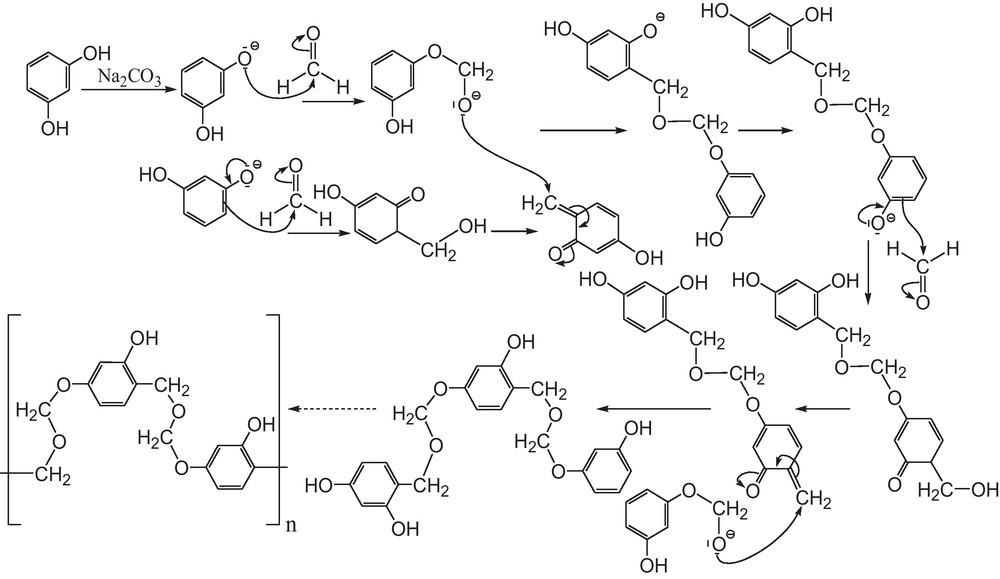
Mécanisme proposé pour la réaction de polymérisation du résorcinol avec du formaldéhyde en milieu aqueux catalysée par le carbonate de sodium.
Après séchage, les gels secs sont pyrolysés sous argon, dans un four tubulaire de la température ambiante jusqu’à 800 oC. Lors, de la pyrolyse, les xérogels subissent une nouvelle réduction de la masse et deviennent totalement noir. Le solide obtenu est appelé charbon actif.
L’échantillon E1 est caractérisé par l’adsorption désorption de l’azote à 77 K pour avoir son isotherme et cela avant et après pyrolyse (Schéma 9). De cette caractérisation texturale, il en sort que la surface spécifique passe de 13 m2/g à 650 m2/g (Tableau 6). De l’allure des isothermes, on peut dire que les xérogels et charbon présentent une texture microporeuse. Ce résultat est confirmé par RMN du xénon qui montre l’uniformité de la taille des pores (Schéma 10).
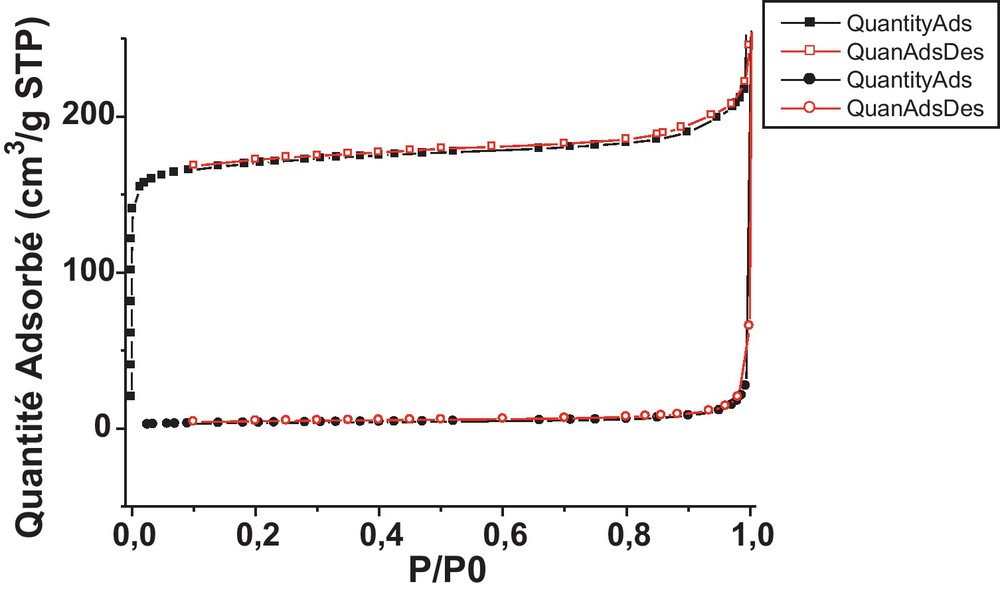
Isothermes d’adsorption désorption d’azote du xérogel (E1) après et avant pyrolyse.
Mesure de la surface spécifique avant et après pyrolyse.
| SBET avant pyrolyse (m2/g) | SBET après pyrolyse (m2/g) |
| 13 | 650 |

Porosité du charbon actif (E1) : RMN du xénon.
Par microscopie électronique à balayage, la topologie de l’échantillon E1 est uniforme et formée par des petites particules à l’échelle micrométrique. En effet, il est montré par l’image MEB des sphères de diamètre inférieur à 10 μm (Schéma 11).

Images SEM du matériau du carbone.
3 Conclusion
Des matériaux carbonés très poreux peuvent être obtenus par séchage par évaporation du solvant et pyrolyse de gels aqueux résorcinol/formaldéhyde. Cependant, la présente étude à montré que la structure du xérogel obtenu est la même en présence de catalyse acide (acide acétique) ou basique (carbonate de sodium). En effet, la jonction entre les noyaux aromatiques est de type OCH2OCH2. Le matériau carboné obtenu après pyrolyse présente une surface spécifique de 650 m2/g et une texture poreuse uniforme avec des pores micrométriques.
4 Partie expérimentale
Les réactifs utilisés sont le résorcinol (99 %), le Formaldéhyde (en solution dans l’eau à 37 %), acide acétique et le carbonate de sodium.
Les spectres RMN ont été enregistrés sur un appareil Bruker Avance DRX 400 (400 MHz pour 1H et 100 MHz pour 13C).
Les spectres RMN-129X ont été obtenus, à 298 K, à l’aide d’un spectromètre Bruker AC 250 L à 69,19 MHz. L’échantillon en poudre a été chauffé sous vide (10 mbar) à 523 K. L’échantillon a été ensuite soumis à des pressions de gaz de xénon allant de 133 à 1333 mbar à 298 K. Les spectres de RMN-129Xe ont été donnés en termes de déplacement chimique par rapport au xénon gazeux.
Les isothermes d’adsorption désorption de l’azote ont été obtenues à 77 K sur un prosimètre sorptomatic 1900 (Fisons Instruments UK).
Les images de microscopie électronique à balayage (MEB) ont été obtenues à partir d’un microscope Hitachi S-2600 N utilisant un détecteur d’électrons secondaires.
Mode opératoire : dans un flacon de 50 mL, on introduit 30 mmoL de résorcinol et 30 mL d’eau distillée. La solution est agitée jusqu’à dissolution complète du résorcinol. On ajoute à ce mélange 60 mmoL de formaldéhyde et 9 mL de la solution 1 M du catalyseur (acide acétique ou carbonate de sodium). La solution est soigneusement agitée. Finalement, le récipient est fermé est gardé à température ambiante et on mesure pour chaque échantillon le temps de gélification. Le séchage du gel est réalisé dans un four à température réglable.


