1 Introduction
Les dérivés organostanniques contenant le résidu SnPh3 ont été beaucoup étudiés à cause de leurs multiples applications dans des domaines très variés, comme ceux des fongicides et des pesticides, mais aussi à cause de leur potentielle activité antitumorale [1–6]. Ford et al. [7] et Poller et al. [8] ont étudié des composés du type RCO2SnPh3 et conclu à l'existence de chaînes infinies, avec des groupements SnC3 plans reliés par l'anion. De tels composés peuvent cependant avoir des structures discrètes contenant des atomes d'étain à environnement tétraédrique ou cis-bipyramidal trigonal. Ces deux dernières structures sont surtout obtenues dans le cas où les radicaux R sont volumineux ou contiennent des groupements électro-attracteurs, mais aussi dans le cas où les groupements carboxyliques sont chélatants. Il a été démontré que l'électronégativité des radicaux R joue un rôle essentiel dans le mode de coordination des carboxylates [9–11]. L'étude par diffraction des rayons X a permis de montrer que le dérivé PhCO2SnPh3 a une structure en chaîne infinie à l'état solide [12]. Nous décrivons dans le présent article une méthode simple permettant d'obtenir des complexes d'addition entre Ph3SnX et Bu2SnCl2 (X = Cl, Br, SCN) avec l'ion benzoate, stabilisés par des ions tels que l'ion tétraméthylammonium ou l'ion tétraphénylphosphonium, et que nous étudierons par spectroscopies infrarouge, Mössbauer et RMN.
2 Partie expérimentale
Tous les produits utilisés sont d'rigine Merck et n'ont subi aucune autre forme de purification. Les analyses élémentaires ont été effectuées au Service central d'analyses (CNRS), Vernaison (France). Les spectres infrarouge ont été enregistrés à partir de poudres en suspension dans le nujol, au moyen d'un spectromètre PerkinElmer 580 dans la région 4000–200 cm−1 et d'un spectromètre FTIR-Nicolet (650–50 cm−1). Les spectres Mössbauer ont été enregistrés dans un cryostat à azote liquide à la température de 80 K à l'université catholique de Louvain-la-Neuve (Belgique). La source Ca119SnO3 est maintenue à la température ambiante et à une accélération constante. Un logiciel adéquat a été utilisé pour affiner les spectres. Les spectres RMN ont été enregistrés au moyen d'un spectromètre Bruker 300 MHz dans le chloroforme au Centre régional des mesures physiques de l'Ouest (université de Rennes, France). Les données spectroscopiques infrarouge, Mössbauer et RMN sont exprimées en cm−1, mm−1 et ppm, respectivement. Les déplacements chimiques sont déterminés par rapport au TMS (1H et 13C) et au SnMe4 (119Sn). Les paramètres Mössbauer QS, IS et Γ représentent : l'éclatement quadripolaire, le déplacement isomérique et la largeur de la raie à mi-hauteur, respectivement. Les complexes [Me4N][PhCO2SnPh3Cl] (A), [Me4N][PhCO2·2SnPh3Cl] (B) et [Me4N][PhCO2SnBu2Cl2] (F) ont été obtenus en faisant réagir Ph3SnCl et Bu2SnCl2 avec le sel [Me4N][PhCO2]. L'addition de bases de Lewis telles que Ph4PCl, Ph4PBr et [Me4N][NCS] sur PhCO2SnPh3 a conduit aux complexes d'addition de type [Ph4P][PhCO2SnPh3Cl] (C), [Ph4P][PhCO2SnPh3Br] (D) et [Ph4P][PhCO2SnPh3NCS] (E). Nous reportons ci-dessous la méthode de synthèse et de purification des complexes (A–F) ainsi que les résultats d'analyses élémentaires.
2.1 [Me4N][PhCO2·SnPh3Cl] (A) et [Me4N][PhCO2·2SnPh3Cl] (B)
Le mélange de deux solutions éthanoliques contenant Ph3SnCl et [Me4N][C6H5CO2] dans les stœchiométries (1:1) et (1:2) donne un précipité blanc, dans les deux cas. La solution résultante est agitée pendant plus de 2 h, puis le précipité est récupéré par filtration, lavé à l'éthanol à chaud et recristallisé dans le chloroforme. Les produits obtenus sont identifiés comme étant (A) et (B).
(A) : Rendement 78%, résultats d'analyse élémentaire : trouvés (calculés) %C 60,01 (59,98) ; %H 5,66 (5,52) ; %N 2,55 (2,40). (B) : Rendement 85% ; résultats d'analyses élémentaires : trouvés (calculés) %C 58,56 (58,61) ; %H 4,32 (4,48) ; %N 1,33 (1,45).
2.2 [Ph4P][PhCO2SnPh3Cl] (C) ; [Ph4P][PhCO2SnPh3Br] (D) ; et [Ph4P][PhCO2SnPh3SCN] (E)
Le mélange de deux solutions éthanoliques contenant C6H5CO2SnPh3, d'une part, et Ph4PCl, Ph4PBr et Me4NSCN, d'autre part, dans les stœchiométries (1:1) donne par évaporation lente des cristaux blancs filtrés et séchés à l'étuve à 60 °C. Les produits seront identifiés comme étant : (C), (D) et (E). (C) : Rendement 73% ; résultats d'analyses élémentaires : trouvées (calculées) %C 70,32 (69,57) % H 4,54 (4,73). (D) : Rendement 83% ; résultats d'analyses élémentaires : trouvés (calculés) %C 66,14 (66,14) %H 4,51 (4,49). (E) : Rendement 77% ; résultats d'analyses élémentaires : trouvés (calculés) %C 59,47 (59,73) ; %H 5,53 (5,31) ; %N 4,71 (4,65).
2.3 [Me4N][PhCO2·SnBu2Cl2] (F)
Deux solutions éthanoliques contenant 3,00 mmol de Bu2SnCl2 et 3,00 mmol [Me4N][PhCO2] mélangées et agitées pendant 1 h donnent par évaporation lente des cristaux blancs qui sont filtrés, lavés et séchés à l'étuve à 60 °C. Ces cristaux sont identifiés comme étant (F). Rendement 78% ; résultats d'analyses élémentaires : trouvés (calculés) %C 45,44 (45,73) ; %H 6,97 (7,02) ; %N 2,68 (2,72).
3 Résultats et discussion
3.1 Étude par spectroscopie Mössbauer
Les principaux paramètres Mössbauer des complexes A–F sont reportés sur le Tableau 1. Les spectres Mössbauer de ces complexes présentent un doublet symétrique avec des valeurs de déplacement isomérique (I.S.) comprises entre 1,21 et 1,50 mm s−1 ; ces valeurs sont en accord avec la présence d'un site d'étain (IV) organométallique [13,14]. Les valeurs de l'éclatement quadripolaire QS (comprises entre 2,95 et 3,51 mm s−1) des composés A–E, supérieures à 2,55 et 2,48 mm s−1 (valeurs obtenues pour Ph3SnCl et Ph3SnBr) montrent une augmentation du nombre de coordination de l'étain. Ces valeurs sont en adéquation avec l'existence d'atomes d'étain à environnement bipyramidal trigonal [13,14]. Les largeurs des raies à mi-hauteur sur les différents spectres sont suffisamment étroites (0,8 − 0,9 mm s−1) pour qu'on puisse considérer la présence d'un seul type d'étain. La valeur de QS de F, plus faible que celle mesurée dans le cas de Bu2SnCl2 seul (3,40 mm s−1), dans lequel l'environnement de l'étain est trans-octaédrique [15], permet de conclure à un environnement bipyramidal trigonal autour de l'étain. On rappelle que, dans les composés Bu2Sn(O2CPh)2, Bu2Sn(O2CCl)2 et Bu2Sn(O2CCHCl2)2, pour lesquels un environnement trans-octaédrique a été trouvé pour l'étain, les valeurs de QS sont 3,50, 3,93 et 3,67 mm s−1, respectivement [16]. Il faut aussi signaler que la valeur de QS dans F est plus grande que celle des composés cis-octaédriques de Bu2SnCl2,dans lesquels le QS est de l'ordre de 2 mm s−1 [14].
Principaux paramètres Mössbauer (mm s−1)
| Complexes | I.S. | Q.S. | Γ | A (%) |
| A | 1,36 | 3.02 | 0,86 | 100 |
| B | 1,32 | 3,08 | 0,90 | 100 |
| C | 1,22 | 2,99 | 0,90 | 100 |
| D | 1,30 | 3,01 | 0,88 | 100 |
| E | 1,21 | 2,95 | 0,95 | 100 |
| F | 1,26 | 2,93 | 0,89 | 100 |
3.2 Étude par spectroscopie infrarouge
Les attributions des principales bandes des spectres infrarouge des complexes (A–F) sont reportées sur le Tableau 2. Les structures des esters organostanniques sont très étudiées, surtout par diffraction des rayons X [17–20]. Les données infrarouge de ces composés corroborent la théorie proposée par Alckok [21], qui permet de déterminer le mode de coordination des anions RCO2− en fonction de la valeur de
Attributions des principales bandes des spectres des complexes contenant le groupement triphénylétain (A–F), en cm−1
| Attr. | Δν | νSnX | νSnO | ||||
| A | 1626 F | 1342 F | 284 | 271 F | 225 f | 215 f | 192 F |
| B | 1570 F | 1420 F | 150 | 266 F | 200 m | 215 f | 181 F |
| C | 1630 F | 1350 F | 280 | 287 F | 252 | 214 f | 175 f |
| 1580 F | |||||||
| D | 1630 F | 1350 F | 280 | 287 F | 252 f | 214 f | 175 m |
| 1580 F | |||||||
| E | 1630 F | 1340 F | 290 | 275 F | – | 208 f | 171 f |
| 1580 F | 1300 f | 280 | |||||
| F | 1700 F | 1360 F | 340 | 690 F | 284 F | 605 f | 192 F |
| 1610 |
a n = 3 (dans A–E) et n = 2 dans F.
Les bandes dues à

Structure monodentate.
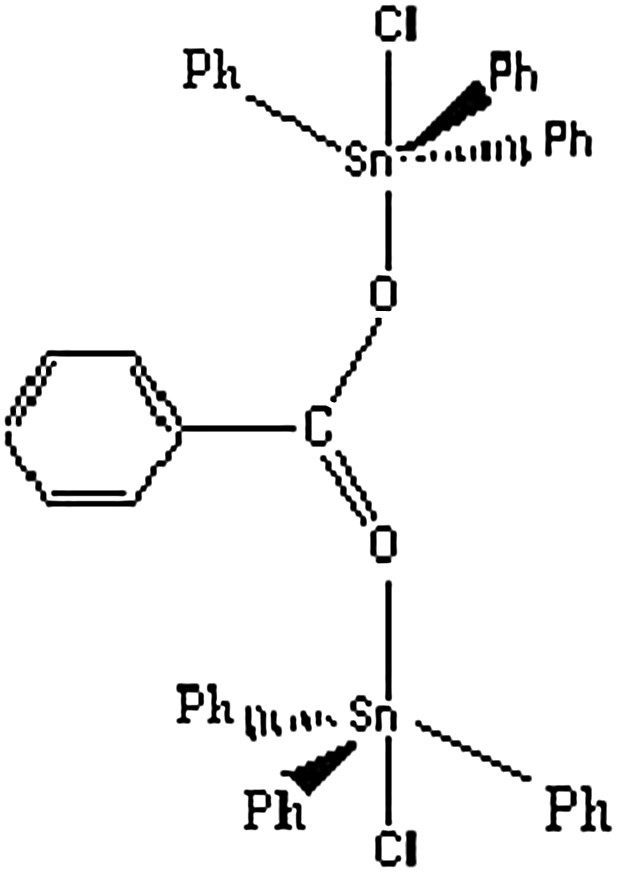
Structure bidentate.
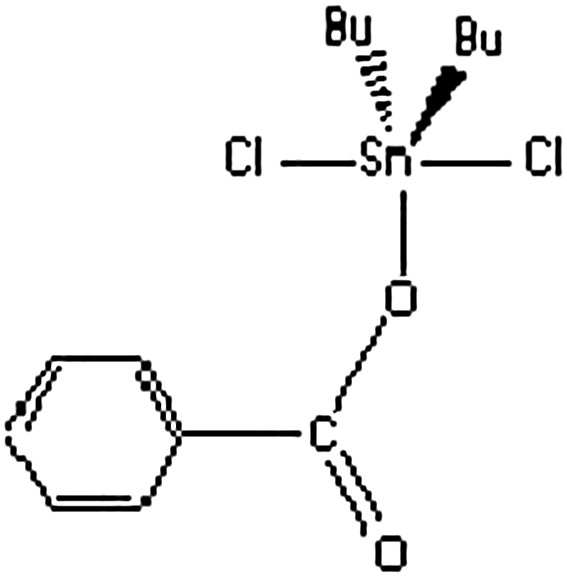
Structure discrète.
3.3 Étude par spectroscopie RMN des complexes B et D
3.3.1 RMN 1H
Sur les spectres RMN 1H de ces complexes, on observe un multiplet complexe dû aux protons phényliques. Le singulet à 3,1 ppm sur le spectre RMN 1H de B est dû aux protons méthyliques.
3.3.2 RMN 13C et 119Sn
Les attributions des principaux signaux des spectres du carbone 13 et de l'étain sont reportées dans le Tableau 3.
Attribution des principaux signaux des spectres RMN 13C et 119Sn (ppm)
| Complexes | δ(119Sn) | Ci | Co | Cp | Cm |
| B | −145 | 140,5 | 136,5 | 129,5 | 128,4 |
| D | −134 | 139,3 | 137,2 | 129,3 | 128,1 |
Les spectres RMN de l'étain des complexes B et D montrent l'existence d'un seul type d'étain, de déplacement chimique −145 et −134 ppm, en accord avec une coordination des molécules tétraédriques de Ph3SnCl et Ph3SnBr qui ont des déplacements chimiques δ(119Sn) de −44,7 et 59 ppm, respectivement [14]. (L'augmentation du déplacement chimique de l'étain permet de conclure à une coordination des molécules de Ph3SnX (X = Cl, Br) en solution, ce qui permet de dire que l'environnement autour de l'étain est bipyramidal trigonal en solution comme à l'état solide.) Un résultat similaire a été trouvé pour les complexes de type [(R4N)2AO4][Ph3SnX]m (R = Me, Et ; A = Mo, Cr, S, C2 ; m = 2, 3 et X = Cl, Br) [29] et dans les composés de type {(Ph4P)2[SeO4(Ph3Sn)(Ph3SnX)]}n (X = Cl, Br), qui ont une structure en chaîne infinie [30].
4 Conclusion
Ce travail a permis de synthétiser de nouveaux complexes d'halogénures de triphénylétain contenant l'ion benzoate. L'utilisation des spectroscopies infrarouge, Mössbauer et RMN a permis de montrer que ces composés ont des structures discrètes, l'ion benzoate étant monodentate ou pontant.


