1 Introduction
Fitchia nutans (astéracée), appartenant à l'un des rares genres endémiques de la Polynésie française, est une plante traditionnellement utilisée pour la préparation d'un monoï sacré à Tahiti, qui n'a pas encore fait l'objet d'une étude phytochimique [1]. Dans le genre Fitchia, seule l'espèce Fitchia speciosa a fait l'objet d'une étude phytochimique reportée dans la littérature [2], montrant ainsi l'intérêt qu'il y a d'avoir une meilleure connaissance de cette plante endémique très peu connue, mais ayant eu un usage traditionnel d'importance culturelle.
F. nutans est un arbuste à odeur aromatique puissante, autrefois utilisé dans la cosmétopée polynésienne, et dont les feuilles servaient pour parfumer le monoï sacré qui était destiné spécifiquement aux membres de la famille royale (Arii) [1,3].
Le genre Fitchia endémique de la Polynésie orientale comporte huit espèces : F. nutans (endémique de Tahiti), Fitchia cordata (endémique de Bora-Bora), Fitchia cuneata (endémique de Raiatea et de Tahaa), Fitchia mangarevensis (endémique des Gambier), Fitchia rapensis (endémique de Rapa), F. speciosa (endémique des Iles Cook), F. tahitensis et Fitchia temariiana (endémiques de Tahiti). Toutes ces espèces sont très odorantes et souvent utilisées pour cette propriété.
F. nutans (J.D. Hooker) est une espèce endémique restreinte à Tahiti appartenant à la famille des Astéracées et à l'ordre des Astérales. Appelé localement « anei », c'est un arbuste de 4 à 8 m de hauteur, poussant dans les forêts de nuages (800–1400 m) sur les sommets de Tahiti. Le bois est jaune et aromatique. Les limbes des feuilles sont simples et opposés, ovales, longs de 7 à 11,5 cm et larges de 4 à 7 cm. Les feuilles dégagent une forte odeur caractéristique. C'est une plante liguliflore, avec des capitules homogames volumineux (jusqu'à 4 cm de diamètre) à fleurs ligulées, dont le réceptacle, portant des palettes lancéolées, est entouré d'un large involucre comportant de nombreuses bractées imbriquées. Les fleurs sont jaune orangé et à multiples pétales. L'arbre est à feuilles caduques et produit des akènes [3].
Actuellement rare et présente à des stations difficiles d'accès, F. nutans se régénère relativement bien, en raison de plantules abondantes dans le sous-bois des stations connues et pourrait probablement faire l'objet de plantations en conditions favorables ; des essais de plantations pour la conservation sont actuellement menés [1].
Compte tenu de son usage passé, nous avons tout d'abord procédé à une analyse phytochimique afin d'identifier ses principaux constituants, puis réalisé une étude de l'extrait de feuilles de F. nutans pour prospecter ses potentialités dans le domaine cosmétique en tant qu'ingrédient actif anti-âge par des tests ex vivo sur des explants de peau humaine maintenus en survie. En effet, les propriétés de cette plante oubliée pourraient être davantage valorisées dans le domaine de la cosmétique, étant donné que sa mise en culture pourrait être possible et envisageable.
2 Matériels et méthodes
2.1 Obtention de l'extrait
Collecte : le matériel végétal de F. nutans, constitué de feuilles et branches, a été collecté et identifié au col de Hamuta (Aorai), à une altitude de 980 m, par J.-F. Butaud le 26 décembre 2013.
Séchage : les branches ont été effeuillées, puis les feuilles et écorces mises à sécher à part en milieu aéré et à l'ombre pendant plusieurs jours jusqu'à séchage complet, ensuite conservées à l'abri de l'humidité.
Extraction : l'extraction à partir des feuilles séchées de F. nutans a été effectuée selon la méthode adaptée de F. Bohlmann [2]. Deux cent vingt grammes de feuilles sèches ont été broyées, puis extraites par macération sous ultrasons avec 3,2 L d'un mélange de solvants cyclohexane/éther (2:1) pendant 1 h. L'extrait brut a été filtré avec du papier filtre (Whatman), puis évaporé à sec à l'évaporateur rotatif (Buchi vacuum pump V-700) sous pression réduite. L'extrait ainsi obtenu a été pesé.
2.2 Fractionnement de l'extrait
Fractionnement et séparation de F. nutans : le fractionnement de l'extrait brut de F. nutans a été effectué principalement par chromatographie liquide sur silice (silice 60 Merck 40 μm) à basse pression sur colonne ouverte. L'élution a été guidée puis suivie par analyse en chromatographie sur couche mince (CCM ; plaques de 20 × 20 cm, gel de silice 60 Merck F254, épaisseur de couche de 200 μm, taille de particule de 10–12 μm) de l'extrait brut dans des mélanges cyclohexane/éther, 2,50 g d'extrait brut de feuilles ont été déposés sur gel de silice. Un gradient de solvants a été utilisé pour l'élution, du moins polaire au plus polaire : 150 mL de cyclohexane 100 %, 250 mL de cyclohexane/éther (3:1) et 150 mL d'éther 100 %. Les fractions de 25 mL ont été recueillies, puis contrôlées par CCM avant leur regroupement.
Le contrôle des fractions a été réalisé par analyse CCM avec un dépôt de chaque fraction sur une plaque de CCM, puis migration avec un mélange de cyclohexane/éther (3:1). La révélation est faite par observation directe à la lampe UV à 254 nm ou par pulvérisation de la plaque à l'acide sulfurique (1 mL/10 mL d'éthanol) et à la vanilline (500 mg/100 mL d'éthanol) ; elle est suivie d'un chauffage à 100 °C qui permet de mettre en évidence les composés carbonylés. Les fractions identiques ont été réunies, séchées puis pesées. Les composés suivants ont été isolés : 1 (10 mg), 2 (14 mg), 3 (3.1 mg), 4 (12 mg), 5 (5.8 mg), 6 (2 mg), 7 (1,2 mg), 8 (1 mg), 9 (3 mg).
2.3 Identification des constituants
L'identification des constituants a été réalisée par analyse par résonance magnétique nucléaire (RMN) des composés isolés.
Les spectres RMN 1D (1H et 13C) et 2D (DEPTQ135, corrélation homonucléaire COSY 1H1H, corrélation hétéronucléaire HMBC 1H13C et corrélation HSQC) des composés isolés ont été réalisés avec un spectromètre 600 MHz Bruker Advance DRX-500 au service Spectropole de l'université d'Aix-Marseille. Les échantillons analysés ont été solubilisés dans du chloroforme deutéré (CDCl3).
2.4 Préparation des explants
15 explants d'un diamètre d'environ 11 mm ont été préparés à partir d'une plastie abdominale d'une femme caucasienne âgée de 59 ans. Les explants ont été mis en survie pendant 8 jours (J0 à J8) dans un milieu de culture spécifique BEM (BIO-EC's Explants Medium) à 37 °C en atmosphère humide, enrichie de 5 % de CO2. Les explants ont été répartis en cinq lots, comme indiqué dans le Tableau 1.
répartition des explants et application des produits.
| Lot | Nb explants | Traitement | Prélèvement |
| T0 | 3 | – | J0 |
| T | 3 | – | J8 |
| P1 | 3 | Extrait de F. nutans à 20 mg/mL | J8 |
| P2 | 3 | Extrait de F. nutans à 30 mg/mL | J8 |
| P3 | 3 | Extrait de F. nutans à 50 mg/mL | J8 |
Le produit a été préparé aux concentrations de 20 mg/mL, 30 mg/mL et 50 mg/mL dans de l'huile d'amande douce. Les produits ont été appliqués à la surface de la peau et étalés à l'aide d'une spatule tous les 2 à 3 jours à raison de 2 μL/explant. Les explants du lot T n'ont reçu aucun traitement. Le milieu a été renouvelé par moitié tous les deux à trois jours.
2.5 Prélèvements et histologie
Au début de l'étude et après huit jours de survie, trois explants de chaque lot ont été prélevés et coupés en deux. Une partie a été fixée dans une solution de formol tamponné et l'autre a été congelée à −80 °C. Les explants fixés au formol ont été imprégnés en paraffine, mis en bloc, et des coupes (épaisseur 5 μm) ont été réalisées et montées sur des lames de verre histologiques Superfrost® pour les colorations. Les prélèvements congelés ont été coupés (7 μm) à l'aide d'un cryostat et les coupes ont été collées sur des lames de verre histologique silanisées Superfrost® Plus, pour les immunomarquages. Les observations microscopiques ont été réalisées en microscopie optique, à l'aide d'un microscope Leica type DMLB ou Olympus BX43. Les prises de vue ont été réalisées avec une caméra Olympus DP72 et le logiciel CellˆD.
2.6 Morphologie générale
Pour l'observation de la morphologie générale, les coupes en paraffine ont été colorées au trichrome de Masson variante de Goldner. La morphologie générale a été évaluée par un examen microscopique [4].
2.7 Immunomarquages
Les immunomarquages des collagènes de types I, III, IV et de l'élastine ont été réalisés sur les explants traités avec l'extrait de F. nutans à la concentration de 20 mg/mL (P1) et sur les lots non traités, soit T0, TJ8 et P1J8.
Le collagène l a été marqué sur coupes congelées avec un anticorps polyclonal de lapin anti-collagène l humain (Monosan, Réf PS047), révélé avec un anticorps secondaire couplé à un fluorochrome – AlexaFluor488 (Life technologies, A11008). Les noyaux ont été contre-colorés à l'iodure de propidium.
Le collagène lll a été marqué sur coupes congelées avec un anticorps polyclonal de chèvre anti-collagène lll, (SBA, Réf 1330-01), avec un système amplificateur biotine/streptavidine, révélé en VIP (Vector SK 4600).
Le collagène IV a été marqué sur coupes congelées avec un anticorps polyclonal de chèvre anti- collagène IV (SBA, Réf. 1340-01), révélé avec un anticorps secondaire couplé à un fluorochrome AlexaFluor AF488 (Lifetechnologies, Réf. A11078), avec les noyaux contre-colorés à l'iodure de propidium.
L'élastine a été marquée sur coupes congelées, avec un anticorps polyclonal de lapin anti-élastine (Novotec Réf sc-66192) avec un système amplificateur biotine/streptavidine et révélé en FITC (Invitrogen, SA 1001). Les noyaux ont été contre-colorés à l'iodure de propidium.
Les immunomarquages des collagènes de types I, III, IV et de l'élastine ont été réalisés à l'aide d'un automate d'immunomarquage (Dako, Autostainer Plus) et évaluées par un examen microscopique.
3 Résultats et discussions
3.1 Composition chimique de l'extrait
Après la collecte du matériel végétal, l'étude phytochimique de F. nutans a été réalisée sur les extraits de feuilles qui sont connues pour leur usage traditionnel en tant qu'ingrédient d'un monoï sacré. L'extraction des feuilles de F. nutans a permis d'obtenir un rendement de 2,6 % (5,77 g). L'extrait ainsi obtenu a été soumis à un fractionnement pour l'étude de la composition chimique.
L'étude a été menée suivant la procédure classique « de la plante à la molécule », incluant les étapes suivantes : collecte (et identification botanique), séchage, extraction, fractionnement et séparation, identification des constituants.
L'étude phytochimique de l'extrait de feuille de F. nutans a permis d'identifier un nouveau sesquiterpène : le 15-isovaléroyloxydihydrocostunolide, ainsi que huit composés connus, dont quatre sesquiterpènes, deux dérivés phénylpropanoïdes, un dérivé phénolique et un dérivé d'isopentenyl d'acétophénone (Fig. 1).

Structure des principaux constituants de l'extrait de feuilles de F. nutans.
La structure du 15-isovaléroyloxydihydrocostunolide (composé 8, Fig. 2) a pu être déterminée à partir de ses données spectroscopiques (RMN 1H, 13C et 2D) présentées dans le Tableau 2 et par comparaison avec celles observées avec le dihydrocostunolide et le 15-isovaléroyloxycostunolide, également isolés.

Structure du composé 8, le 15-isovaleroyloxydihydrocostunolide.
Données RMN 1H à 600 MHz, 13C à 150 MHz du composé 8, le 15-isovaleroyloxydihydrocostunolide dans le CDCl3 à 300 K.
| Atome | ||
| 1 | 4.87; brdd (10.8; 5.7) | 126.7 |
| 2 | 2.22; m | 26.8 |
| 3 | 2.53; ddd (12.3; 4.8; 3.0) | 35.8 |
| 2.02; m | ||
| 4 | – | 137.4 |
| 5 | 4.84; brd (10.2) | 131.6 |
| 6 | 4.57; dd (10.1; 9.1) | 79.8 |
| 7 | 1.66; m | 55.0 |
| 8 | 1.88; ddd (13.4; 6.0; 2.0) | 28.4 |
| 1.60; m | ||
| 9 | 2.41; brdd (13.4; 6.0) | 41.2 |
| 2.06; brt (13.4) | ||
| 10 | – | 137.5 |
| 11 | 2.24; m | 42.1 |
| 12 | – | 178.2 |
| 13 | 1.26; d (7.0) | 13.4 |
| 14 | 1.37; brs | 16.3 |
| 15 | 4.64; brd (12.8) | 61.3 |
| 4.54; brd (12.8) | ||
| 1′ | – | 173.1 |
| 2′ | 2.22; m | 43.5 |
| 3′ | 2.12; m | 25.8 |
| 4′, 5′ | 0.96; d (7.0) | 22.6 |
Les structures des huit composés connus ont été déterminées à partir des données spectroscopiques (RMN, MS) et par comparaison avec celles de la littérature. Les principaux constituants connus correspondent au dihydroréynosine [5], au dihydrocostunolide [6], au costunolide [7], au 15-isovaléroyloxycostunolide [8], à l'isovalérate de phényle 4-(3-méthyloxiranyle) [9], à l'isovalérate du phényle 1-trans-propényle [10], à l'hydroxytremetone [11] et à l'atranorine [12].
Les résultats des structures obtenues montrent que F. nutans contient des composés estérifiés par l'acide isovalérique. Il a été reporté que l'acide isovalérique isolé à partir d'un vin rouge âgé de la région de la Rioja en Espagne a une odeur proche de celle du fromage [13]. L'extrait de F. nutans possède en effet une forte odeur caractéristique attribuable à ces esters d'isovalérate. Ceux-ci peuvent être considérés comme des métabolomes marqueurs de la biodiversité de cette plante et du genre Fitchia, car l'espèce F. speciosa contient aussi des composés estérifiés par l'acide isovalérique [2]. Ces résultats incitent à émettre l'hypothèse selon laquelle les composés non estérifiés (costunolide, atranorine, dihydroreynosine) présents dans les extraits seraient issus d'un processus d'hydrolyse des esters isovalériques correspondants, produits au cours de leur voie biosynthétique. L'approfondissement de l'étude de ces voies biosynthétiques serait intéressant à envisager.
Les composés de type sesquiterpène lactone comme le costunolide sont souvent des produits bioactifs. Le costunolide est présent dans un certain nombre de plantes appartenant à la famille des Astéracées, notamment dans Aucklandia lappa (Decne), dont les racines sont utilisées dans la médecine traditionnelle chinoise pour le traitement contre l'asthme, la diarrhée ou encore l'indigestion [14]. D'autres études ont démontré l'activité antifongique du costunolide contre des champignons dermatophytes [15]. Le costunolide isolé à partir des parties aériennes de Podachaenium eminens (famille des Astéracées) a montré une activité anti-inflammatoire par inhibition du facteur de transcription NF-κB, une protéine jouant un rôle dans la réponse immunitaire et l'inflammation à une concentration de 50 μM [16]. Des effets anti-tumoraux du costunolide ont été aussi observés, in vitro, en diminuant l'activité de l'enzyme farnesyl-proteintransferase (FPTase) impliquée dans la modification post-translationnelle de la protéine Ras mutée et provoquant des tumeurs. L'activité de FPTase de rat a été mesurée avec le costunolide, isolé de Magnolia sieboldii, avec un potentiel inhibiteur de cette activité à une valeur d'IC50 inférieure à 2 μg/mL dans des cellules tumorales du système nerveux central, de mélanomes ou encore du colon [17].
La présence du costunolide dans l'extrait de F. nutans est très intéressante et pourrait conférer à cette plante ses propriétés. En effet, de par cette liste non exhaustive de ses activités, le costunolide a un large spectre d'activité biologique par exemple antifongique, anti-inflammatoire, et anti-tumorale.
3.2 Activité biologique de l'extrait de F. nutans sur explants de peau humaine ex vivo
L'activité anti-âge de l'extrait de feuilles de F. nutans a été testée sur les structures épidermiques et dermiques d'explants de peau humaine ex-vivo maintenus en survie. Afin d'identifier les sites d'action spécifiques de l'extrait, une analyse microscopique de la morphologie générale ainsi que des immunomarquages ont été réalisés.
L'activité de l'extrait de plante a été testée à trois concentrations dans l'huile d'amande douce sur les structures épidermiques et dermiques d'explants de peau humaine ex vivo. Cette activité a été évaluée par une expertise histologique de la morphologie générale de la peau après trichrome de Masson.
3.2.1 Morphologie générale
L'évolution de la morphologie générale des explants au cours de l'étude est représentée sur la figure 3. L'observation de chaque lot d'explant traité a fait ressortir les résultats et discussions suivants. La morphologie épidermique du témoin à J8 est proche de celle observée à J0 pour le lot témoin.

Morphologie générale des explants traités aux extraits de feuilles de F. nutans.
Comparé au lot non traité, à J8 (TJ8) :
- - les produits P1 et P2 augmentent légèrement la densité du réseau de collagène dans le derme papillaire ;
- - le produit P3 induit une morphologie épidermique légèrement altérée, caractérisée par quelques cellules avec oedème périnucléaire en suprabasale et une spongiose assez nette en basale.
Au niveau dermique, les produits P1 et P2 augmentent la densité de collagène, tandis que le produit P3 ne présente pas de modification par rapport au témoin (TJ8).
On peut déduire de l'examen de la morphologie générale que l'extrait de F. nutans à 20 mg/mL (P1) et 30 mg/mL (P2) montre une légère stimulation dermique, en induisant une légère augmentation de la densité du réseau de collagène dans le derme papillaire. Des investigations de certains paramètres dermiques, notamment par immunomarquage, ont été menées afin d'identifier l'effet du produit à ces deux concentrations. Lorsque le produit est utilisé à 50 mg/mL, une légère intolérance est observée, ce qui peut expliquer l'absence d'activité à cette concentration.
3.2.2 Immunomarquages
Les fibres de collagènes et d'élastine sont les principales protéines synthétisées par les fibroblastes et libérées dans la matrice extracellulaire (MEC) dermique.
Afin d'approfondir le mécanisme d'action de l'extrait de F. nutans et compte tenu de son activité sur le derme papillaire, des marqueurs tissulaires comme le collagène et l'élastine ont été retenus comme cibles.
Les effets de l'extrait de F. nutans observés par immunomarquages au collagène (I, III et IV) et à l'élastine au niveau tissulaire sont compilés dans le Tableau 3 et la Fig. 4.
Évaluation de l'expression du collagène (I, III et IV) dans le derme papillaire et de l'élastine sur les fibres élastiques du derme papillaire.
| TF | F | M | AN | N | TN | Fo | ||||||||
| a) | ||||||||||||||
| T0 | ||||||||||||||
| TJ8 | ||||||||||||||
| P1J8 | ||||||||||||||
| b) | ||||||||||||||
| T0 | ||||||||||||||
| TJ8 | ||||||||||||||
| P1J8 | ||||||||||||||
| c) | ||||||||||||||
| T0 | ||||||||||||||
| TJ8 | ||||||||||||||
| P1J8 | ||||||||||||||
| d) | ||||||||||||||
| T0 | ||||||||||||||
| TJ8 | ||||||||||||||
| P1J8 |
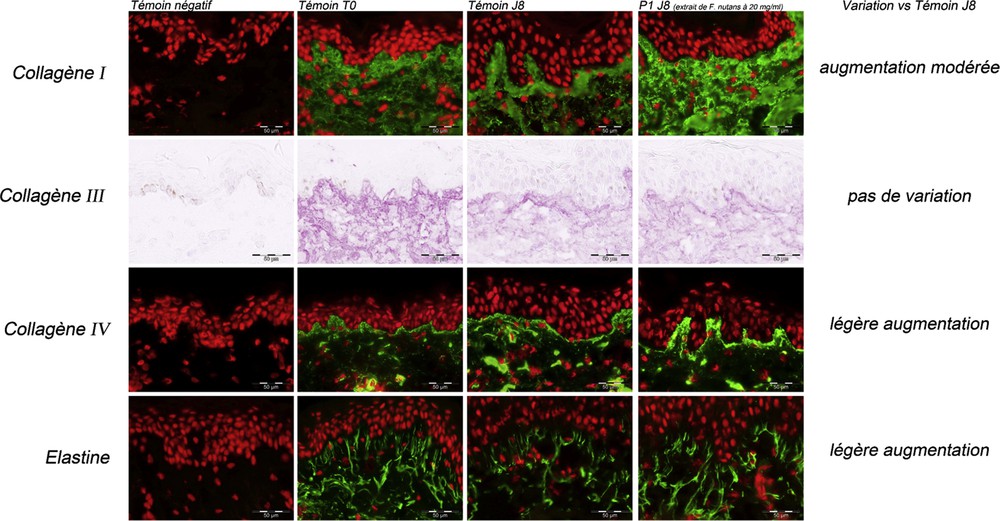
Morphologie générale des explants au début (T0) et à la fin de l'étude observée par immunomarquage histologique des collagènes et élastine.
Les collagènes sont une famille de protéines de structure la plus abondante au sein du corps humain et représentent environ 25 à 30% de la masse corporelle totale. Chez les vertébrés, il existe 19 types de collagènes. Au niveau de la peau, les collagènes de type I, III et V se situent au niveau de la MEC, et le type IV est retrouvé au niveau de la membrane basale de l'épiderme [18].
Les collagènes permettent à la peau de posséder une importante résistance mécanique. L'élastine, quant à elle, confère à la peau des propriétés d'élasticité. Le vieillissement physiologique et d'autres stress environnementaux, à savoir l'exposition quotidienne aux UVs, conduit à la dégradation des protéines dermiques par des enzymes spécifiques (collagénase, protéase neutre et cathépsines lysosomiales).
3.2.2.1 Collagène I
Le collagène de type I est la protéine structurale la plus importante au sein de la peau. Le niveau d'expression du collagène I décroit de manière très importante en fonction de l'âge ou encore après exposition chronique aux UV [19,20].
A J0, sur le lot témoin (T0), le marquage du collagène I est assez net dans le derme papillaire.
A J8, sur le lot témoin (TJ8), l'expression du collagène I comparable à celle observée sur le lot T0.
L'application du produit P1 induit une augmentation modérée de l'expression du collagène I, comparativement au lot témoin, à J8 (TJ8).
3.2.2.2 Collagène III
Le collagène fibrillaire de type III, formant des fibrilles striées caractéristiques, contribue à l'intégrité de l'organisme. Pendant la phase de réparation dermique, on assiste à une prolifération des fibroblastes influencée par les facteurs de croissance et la composition de la matrice extracellulaire. En effet, la fibronectine et le collagène IV favorisent la prolifération fibroblastique. Ces fibroblastes vont synthétiser du collagène de type III, puis de type I.
A T0, le marquage est assez net dans le derme papillaire.
A J0, sur le lot témoin (T0), le marquage du collagène III est assez net dans le derme papillaire.
A J8, sur le lot témoin (TJ8), l'expression du collagène III est diminuée modérément comparativement au lot T0.
L'application du produit P1 n'induit pas de variations visibles de l'expression du collagène III, comparativement au lot témoin, à J8 (TJ8).
3.2.2.3 Collagène IV
L'élément structural le plus important des membranes basales est le collagène de type IV. Il est présent exclusivement dans les membranes basales. La stabilité de la jonction dermo-épidermique (JDE) est assurée en premier lieu par l'interaction de plusieurs protéines, dont la laminine-5, le nidogène et le collagène IV. Le collagène IV intervient donc dans l'attachement cellulaire au niveau de la JDE.
A T0, le marquage est modéré à assez net le long de la jonction dermo-épidermique (JDE).
A J0, sur le lot témoin (T0), le marquage du collagène IV est modéré à assez net le long de la JDE.
A J8, sur le lot témoin (TJ8), l'expression du collagène IV est augmentée légèrement comparativement au lot T0.
L'application du produit P1 induit une légère augmentation de l'expression du collagène IV, comparativement au lot témoin, à J8 (TJ8).
3.2.2.4 L'élastine
L'élastine est une protéine du tissu conjonctif, responsable des propriétés élastiques de la peau. Elle est riche en aminoacides hydrophobiques, tels que la glycine et la proline, formant des régions hydrophobiques liées entre elles par des résidus de lysine. L'élastine est la composante majeure du réseau élastique de la peau. En recherche dermo-cosmétique, elle est utilisée en tant que bio-marqueur de l'état physiologique du compartiment dermique [21].
A T0, le marquage est assez net au niveau du réseau des fibres élastiques dans le derme papillaire.
A J0, sur le lot témoin (T0), le marquage de l'élastine est assez net au niveau du réseau des fibres élastiques dans le derme papillaire.
A J8, sur le lot témoin (TJ8), l'expression de l'élastine est diminuée légèrement comparativement au lot T0.
L'application du produit P1 induit une légère augmentation de l'expression de l'élastine, comparativement au lot témoin, à J8 (TJ8).
4 Conclusion
L'extrait de feuilles de F. nutans possède des activités biologiques anti-âge intéressantes observées sur explants de peau humaine ex vivo. En effet, l'extrait de F. nutans à 20 mg/mL induit une augmentation modérée de l'expression du collagène I et une augmentation légère du collagène IV et de l'élastine après 8 jours de traitement.
La composition chimique de cet extrait montrant la présence de composés estérifiés par l'acide isovalérique explique son puissant caractère odorant et pourrait constituer un biomarqueur du genre Fitchia. Le costunolide, possédant de nombreuses activités biologiques, permet d'expliquer l'usage particulier de ce monoï sacré à base de F. nutans, en lui conférant certaines vertus thérapeutiques.
L'étude de telles plantes utilisées dans la cosmétopée traditionnelle permet de révéler des propriétés à visée cosmétique intéressantes, qui pourraient être valorisées en cosmétique moderne. La présente étude de F. nutans peut servir d'exemple pour la valorisation d'autres plantes de la cosmétopée.
Remerciements
Les auteurs expriment leurs vifs remerciements au Dr Cécile Debitus (porteur du programme Biopolyval) et à Cosmetic-Valley pour leurs contributions respectives au financement de cette étude.


