1 Introduction
De couleur jaune laiton, le composé LiC6 a été observé pour la première fois en 1955 〚1〛. Mais c’est assez récemment que les composés graphite–lithium ont vu leur étude prendre un essor considérable, en raison de leurs applications dans le domaine électrochimique. En effet, ces matériaux sont très largement utilisés aujourd’hui comme électrodes négatives de batteries lithium–ion.
Ce métal alcalin, dont les propriétés physiques et chimiques diffèrent de celles des autres métaux de la première colonne, présente également un comportement qui se distingue très nettement de celui des alcalins lourds en ce qui concerne ses capacités d’insertion dans le graphite. Néanmoins, comme eux, et contrairement au sodium, il est capable de conduire à un composé binaire dans lequel tous les intervalles graphitiques sont occupés, c’est-à-dire à une phase de premier stade 〚2〛. Dans un tel composé, tous les intervalles graphitiques, qui constituent des lacunes de Van der Waals, sont donc occupés par des plans monoatomiques de métal. Toutefois, probablement en raison de la plus faible taille de ce métal, la quantité insérée est supérieure de 33,3% dans le cas du lithium : le nombre d’atomes métalliques intercalés ramené à un atome de carbone est en effet de 1/6 pour le lithium et de 1/8 seulement pour K, Rb ou Cs 〚3–5〛. Néanmoins, des composés binaires graphite–lithium encore plus riches en métal inséré ont été observés, soit en réalisant les synthèses sous forte pression 〚6〛, soit en utilisant les méthodes de mécanosynthèse 〚7〛. Dans l’un et l’autre cas, les binaires obtenus, de formules chimiques LiC2 ou LiC3, apparaissent, au mieux, métastables sur le plan thermodynamique.
Les métaux alcalins lourds présentent également une autre propriété remarquable en ce qui concerne l’intercalation. Ils sont en effet capables d’entraîner dans le graphite, lors de leur insertion, des éléments chimiques eux-mêmes inaptes à pénétrer seuls dans les intervalles graphitiques. Ces tiers éléments peuvent être aussi bien moyennement électronégatifs (c’est le cas de l’hydrogène 〚9〛, du mercure, du thallium, du bismuth, de l’arsenic 〚8〛...), que très fortement électronégatifs (c’est le cas du soufre 〚10〛 et de l’oxygène 〚11〛). Dans de telles phases, les feuillets insérés ne sont plus des plans monocouches, mais se révèlent être polycouches. Ils sont généralement constitués de deux plans alcalins, qui viennent encadrer un ou, moins fréquemment, plusieurs plans atomiques de l’autre élément. L’insertion simultanée dans le graphite de deux métaux alcalins lourds a également fait l’objet de plusieurs études, qui ont montré que la nature du feuillet inséré dans ces ternaires était de nouveau un plan monoatomique, mais constitué d’une solution solide bidimensionnelle des deux éléments alcalins 〚12〛.
Il nous a semblé intéressant à divers titres d’observer comment se comportait le lithium dans les mêmes conditions. Les premières expériences ont montré qu’il était incapable de conduire à une monocouche insérée bidimensionnelle de type solution solide lorsqu’on cherchait à l’insérer en même temps qu’un autre métal alcalin. Toutes les tentatives mises en œuvre ont conduit à un mélange biphasé, constitué de deux composés binaires de premier stade LiC6 et MC8 (M = métal alcalin lourd). Ces composés d’insertion apparaissent donc comme non miscibles entre eux, dans l’état solide, sans doute en raison de la différence de taille entre le lithium et les métaux alcalins lourds.
De très nombreux essais de coinsertion du lithium avec un élément moyennement, voire fortement, électronégatif sont systématiquement restés vains, qu’il s’agisse de l’hydrogène, de l’oxygène, de l’azote, du mercure, du thallium, de l’argent... Les expériences conduisent en général à la formation du composé binaire LiC6, ou parfois à un composé de stade plus élevé si l’activité du lithium s’avère trop réduite. Un composé graphite–lithium–oxygène semble néanmoins avoir été observé, en réalisant, non pas une co-intercalation, mais un échange cationique par voie électrochimique, en partant d’une phase ternaire graphite–sodium–oxygène 〚13〛. Toutefois, l’interprétation des données structurales concernant cette phase reste bien peu convaincante.
Face à ces résultats négatifs, et avant de conclure à l’impossibilité de coinsérer dans le graphite le lithium avec un autre élément, il nous a paru utile d’effectuer quelques tentatives d’insertion du lithium avec le calcium. Ce dernier métal est, en effet, comme le lithium, capable de s’insérer seul dans le graphite et conduit à une phase de premier stade de formule CaC6, exactement comparable à LiC6, lorsqu’on atteint la saturation en calcium. Après avoir réalisé un alliage calcium–lithium liquide et l’avoir fait réagir sur un échantillon de graphite pyrolytique, nous avons réussi à obtenir une phase ternaire de premier stade présentant une période d’identité de 776 pm. Il s’agit là d’une phase nouvelle, entièrement originale, puisque obtenue pour la première fois au moyen d’une réaction de co-intercalation du lithium avec un autre élément.
2 Synthèse
La synthèse de ce nouveau composé d’insertion du graphite passe par l’établissement d’un protocole expérimental très strict. En effet, si ce dernier n’est pas rigoureusement respecté, il apparaît particulièrement difficile de synthétiser cette phase de façon pure, voire simplement de l’observer. Ce protocole expérimental comporte différentes étapes : purification des réactifs, formation de l’alliage réactionnel, réaction liquide–solide et récupération de l’échantillon. Ces différentes opérations sont systématiquement réalisées en boîte à gants, sous atmosphère d’argon purifié sur alliage Ti–Zr à 800 °C.
2.1 Purification des réactifs
La pureté des réactifs est l’un des facteurs essentiels qui conditionnent l’obtention et la pureté de la nouvelle phase. Le calcium utilisé, qui est distillé et conditionné sous argon, est de nature dendritique et possède une pureté égale à 99,99%. En ce qui concerne le lithium, bien qu’il présente une pureté initiale de 99,95%, il est encore trop imparfait et nécessite, par conséquent, une ultime purification. Pour cela, il est chauffé, en boîte à gants, à 200 °C, température supérieure au point de fusion du lithium pur (180,6 °C) 〚14〛. Une fois celui-ci fondu, les impuretés qui flottent à sa surface sont éliminées par un balayage mécanique. En fin d’opération, le lithium présente un vif éclat métallique, indice de sa très grande pureté.
2.2 Formation de l’alliage réactionnel
En mettant simplement en présence du lithium, du calcium et une plaquette de pyrographite, il n’a pas été possible de synthétiser autre chose que les composés binaires dérivés de ces deux métaux, à savoir les deux phases de premier stade LiC6 et CaC6. L’homogénéité de l’alliage réactionnel joue donc un rôle considérable dans le déroulement de cette synthèse. Il se trouve que le diagramme binaire calcium–lithium 〚15, 16〛 est bien connu ; aussi présenterons-nous dans la suite de cet exposé le rôle que joue la composition de l’alliage initial sur le produit final obtenu. Si on cherche à synthétiser le composé ternaire, que nous avons évoqué ci-dessus, il faut préparer, dans un premier temps, l’alliage de composition équimolaire (Ca–Li), composition correspondant à une température de liquidus proche de 300 °C (Fig. 1). Nous devons donc bien sûr travailler à une température plus élevée, afin d’obtenir le mélange réactionnel fondu. Pour cela, nous avons conçu au laboratoire un dispositif permettant de chauffer un réacteur tubulaire jusqu’à des températures de 350–400 °C, tout en prenant bien soin de limiter la chaleur dégagée dans la boîte à gants. Les deux réactifs sont d’abord minutieusement pesés, puis introduits dans le réacteur, constitué d’un tube en acier inoxydable. Le calcium y est disposé le premier, le lithium ensuite, afin que ce dernier, lors de sa fusion, vienne mouiller le calcium, qui, bien évidemment, reste solide à cette température, puisque son point de fusion est égal à 842 °C 〚14〛. On porte l’ensemble à la température désirée, puis on agite soigneusement le contenu du réacteur, afin d’obtenir un mélange liquide aussi uniforme que possible. La plaquette de pyrographite est ensuite immergée dans le mélange fondu, où il est nécessaire qu’elle soit maintenue. En effet, si aucune fixation n’est prévue, la plaquette de graphite tend à flotter à la surface du liquide, et la réaction ne peut se produire que de manière superficielle. C’est la raison pour laquelle l’échantillon est fixé par ses extrémités et au moyen de deux fils de tungstène à un porte-échantillon rigide, lui-même en tungstène. Après refroidissement, le réacteur est fermé de façon hermétique au moyen d’un bouchon de type Swagelok® à l’une de ses extrémités, tandis que l’autre a été préalablement scellée grâce à une soudure à l’arc électrique sous flux d’argon. Ce réacteur est finalement placé dans une enveloppe métallique, elle-même remplie d’argon, pour réaliser, en toute sécurité, la réaction en dehors de la boîte à gants.
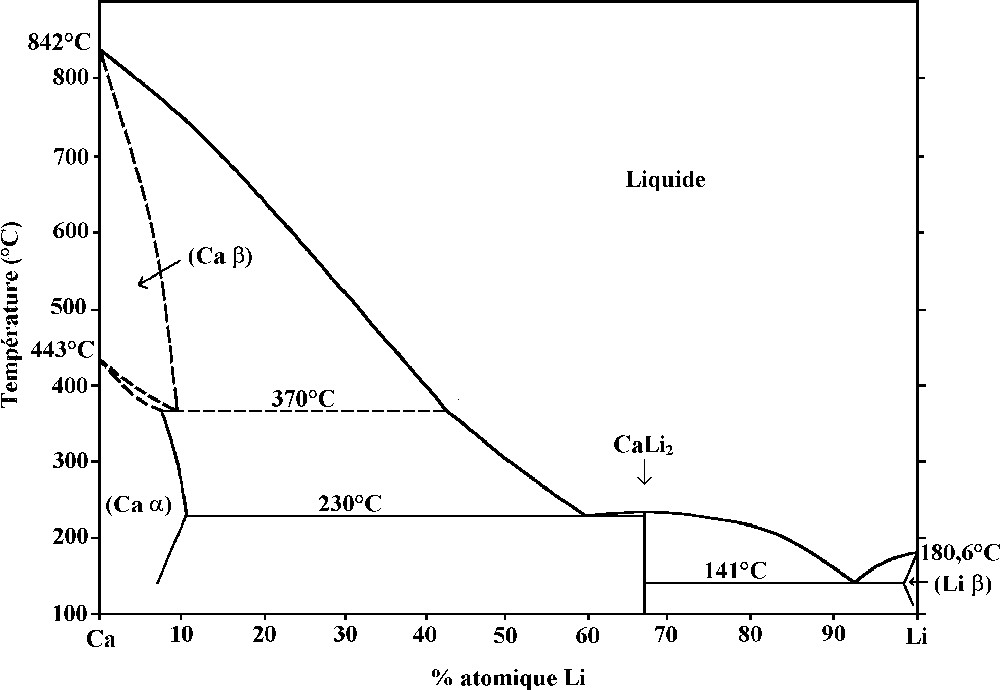
Diagramme de phase du système Ca–Li.
2.3 Conditions de réaction
Différentes températures ont été choisies pour la mise en œuvre de la réaction. Les résultats seront détaillés ultérieurement, mais il est possible de signaler d’ores et déjà que la préparation du composé ternaire pur met en jeu une température de 350 °C, et ce pendant une durée de 10 à 12 jours.
2.4 Récupération de l’échantillon
En fin de réaction, l’ouverture du réacteur s’effectue en boîte à gants. L’extraction de l’échantillon hors de son mélange réactionnel reste une opération particulièrement délicate. Aussi est-il nécessaire de porter l’alliage qui n’a pas réagi à la fusion. Il devient alors aisé de débarrasser l’échantillon de cet alliage, dans lequel il se trouve noyé. Il est ensuite introduit dans un capillaire en verre pyrex ou en verre de Lindemann (selon la taille de l’échantillon), que l’on scelle afin de le soumettre à un examen par diffraction des rayons X, examen qui constitue la première étape du processus d’identification de la phase synthétisée. Le composé que nous avons obtenu, de couleur jaune pâle, possède l’éclat métallique et présente une très grande dureté. Cette dureté exceptionnelle n’a jamais été observée jusqu’ici pour aucun composé d’intercalation du graphite.
Nous avons étudié l’influence des différents paramètres qui interviennent lors de la réaction sur la nature des produits auxquels elle conduit, en cherchant notamment dans quelles conditions apparaît cette nouvelle phase ternaire graphite–lithium–calcium. Dans un premier temps, nous avons fait varier la température en maintenant constante la composition du mélange réactionnel Ca:Li = 1:1. À 400 °C, la phase ternaire tend à disparaître et devient minoritaire, au profit des composés binaires de premier stade CaC6 et surtout LiC6. À 450 °C, on n’observe plus que le composé LiC6 seul. On peut dire que l’élévation de température provoque l’accroissement de l’activité du lithium au sein de l’alliage et favorise ainsi la formation de LiC6. Afin de compenser l’augmentation de son activité, il serait nécessaire de travailler avec un alliage dont la composition serait plus riche en calcium. Ceci n’a malheureusement pu être réalisé, en raison des valeurs élevées des températures correspondant au liquidus dans cette zone du diagramme binaire. Néanmoins, le rôle que joue la composition de l’alliage a été étudié et nous avons choisi une seconde composition pour ce dernier, qui n’est autre que celle de l’unique composé défini qui apparaît sur le diagramme de phase Ca–Li, à savoir le binaire CaLi2 〚16〛. À 350 °C et avec cette composition, un nouveau composé a pu être synthétisé, lui aussi de premier stade, mais présentant une distance interplanaire élevée, de 970 pm. Des études en cours sont destinées à caractériser cette seconde phase de la famille des composés graphite–lithium–tiers élément métallique.
3 Caractérisation
Différentes méthodes d’investigation ont été mises en œuvre pour tenter de caractériser le plus complètement possible ce composé. La diffraction des rayons X est l’une des toutes premières qu’il convient d’utiliser. L’échantillon de départ est une plaquette de pyrographite (PGCCL Carbone Lorraine), qui apparaît comme un graphite très fortement orienté. En effet, dans ce type d’échantillon, tous les axes c des cristallites sont parallèles entre eux, tandis que les axes a et b sont totalement désorientés les uns par rapport aux autres. Cette particularité texturale confère à de tels échantillons les propriétés d’un monocristal selon l’axe c, c’est-à-dire dans la direction perpendiculaire aux plans de graphène, et celles d’une poudre dans les directions parallèles. Il en résulte qu’en positionnant l’échantillon de telle sorte que son axe c soit perpendiculaire au faisceau incident en position θ = 0, il devient possible de n’enregistrer que les réflexions 00l. Inversement, si cet axe c est positionné parallèlement au faisceau incident en position θ = 0, c’est l’ensemble des réflexions hk0 que l’on est en mesure d’isoler. Le diffractogramme des réflexions 00l permet d’affirmer que ce composé appartient au premier stade et possède une distance interplanaire égale à 776 pm (Fig. 2). Ces deux données essentielles sont confirmées par une mesure de prise d’épaisseur de l’échantillon au cours de la réaction. Nous observons en effet un accroissement proche de 157%, qui s’avère être en bon accord avec la valeur calculée à partir de l’accroissement de distance interplanaire, qui s’élève à 132%. Les défauts liés à la non-planéité de la surface de l’échantillon peuvent expliquer la différence. Le diffractogramme des réflexions 00l révèle également la faible présence d’inclusions de calcium orientées par rapport à la matrice graphitique (réflexion 111 du calcium α).

Diffractogramme des réflexions 00l du composé ternaire graphite–lithium–calcium de distance interplanaire égale à 776 pm.
Ce composé a également été étudié par la méthode du cristal tournant. Les axes a et b des cristallites étant totalement désorientés les uns par rapport aux autres, il n’est pas nécessaire de faire tourner l’échantillon pendant l’enregistrement. Le cliché correspondant, représenté sur la Fig. 3, confirme tout d’abord les résultats issus des diffractogrammes 00l et hk0 et montre, de plus, que le composé possède une organisation tridimensionnelle. Le paramètre c est égal à deux fois la période d’identité, soit 1452 pm.

Cliché de cristal tournant du composé ternaire graphite–lithium–calcium de distance interplanaire égale à 776 pm. Le faisceau incident de rayons X étant perpendiculaire à l’axe c pendant l’enregistrement, la rangée des réflexions 00l se situe sur l’axe central du cliché, qui apparaît vertical sur celui-ci.
Par ailleurs, une étude relative à la stabilité chimique du composé vis-à-vis de l’air a été réalisée en effectuant, sur un échantillon de 30 mg abandonné à l’air, des examens réguliers en diffraction des rayons X, ainsi qu’en observant l’évolution de son aspect. Il s’avère qu’il ne subit aucune attaque lors de sa mise à l’air et qu’il faut attendre environ huit jours pour voir apparaître les premières particules de couleur blanche sur les bords des feuillets. Ce phénomène annonce le début de la désintercalation des réactifs, qui, une fois que ceux-ci sont oxydés, conduit rapidement à la formation des hydroxydes correspondants. Cette désinsertion se manifeste notamment sur le diffractogramme X des réflexions 00l par l’apparition et la croissance d’une raie de diffraction large, correspondant à une distance approximative de 470 pm. Si l’on tente de comparer l’aire de cette raie avec celle du pic correspondant à la réflexion diffractée la plus intense par le composé d’insertion, il est possible d’évaluer, au moins de manière assez grossière, le temps nécessaire pour que disparaisse 50% du composé : cette durée atteint environ 12 semaines. Après une durée de 18 à 20 semaines, on observe alors une exfoliation modérée de l’échantillon. L’amorce de la dégradation est également visible sur le cliché de cristal tournant (Fig. 3), ce qui s’explique par la faible taille de l’échantillon. En effet, la qualité du cliché dépendant fortement de la taille de l’échantillon, celui-ci a été clivé à l’air avant d’être placé dans un capillaire en verre de Lindemann.
Il est, par ailleurs, bien connu que l’insertion d’une espèce chimique dans le graphite met en jeu de façon systématique une réaction d’oxydoréduction 〚17〛 et qu’il se produit par conséquent, de façon simultanée, un transfert électronique entre l’insérat et les plans de graphène qui l’encadrent. À partir des données radiocristallographiques, et plus particulièrement à partir de la position des réflexions hk0, il est possible d’évaluer le transfert de charge entre l’insérat et les plans carbonés. Il suffit, pour cela, de déterminer très précisément la position angulaire de la réflexion 110 générée par le plan de graphène. En comparant la valeur obtenue avec le composé d’insertion et celle observée dans le graphite vierge, on évalue aisément l’accroissement de la distance C–C dans le plan de graphène au cours de l’insertion. La distance réticulaire associée à la réflexion 110 du plan de graphène dans le composé ternaire, déterminée en utilisant la raie 220 du diamant comme étalon, est égale à 125,2 pm, alors qu’elle n’atteint que 123 pm dans le graphite vierge. L’accroissement correspondant de la liaison C–C atteint donc 1,8%. Selon Pietronero et Strässler 〚18〛, il existe une relation liant cette dilatation au transfert de charge, noté fc, ramené à un atome de carbone :
Le transfert électronique ainsi calculé dans le nouveau composé ternaire graphite–calcium–lithium atteint 0,111 électron par atome de carbone. À titre de comparaison, celui-ci ne vaut que 0,07 électron par atome de carbone dans le composé LiC6, soit un peu plus de la moitié seulement.
4 Conclusion
Un composé ternaire du lithium a donc été obtenu pour la première fois par co-intercalation de cet alcalin avec un autre élément. D’autres composés de ce type seront sans doute synthétisés dans l’avenir, mais il est probable que leur nombre sera limité et que leur obtention sera vraisemblablement difficile.
Remerciements
Les auteurs tiennent à remercier Sylvie Schneider, dont l’aide efficace a permis la réalisation de mesures radiocristallographiques dans les meilleures conditions.



