1 Introduction
L’utilisation de cristaux liquides comme phases stationnaires en chromatographie en phase gazeuse a été décrite pour la première fois en 1963 par Kelker 〚1, 2〛 et plus tard par Dewar et Schroeder 〚3, 4〛.
Depuis, de nombreux travaux rendent compte de leurs performances analytiques. Mazur et Witkiewicz y ont consacré plusieurs articles comportant plus de 600 références 〚5–7〛.
Les composés mésogènes utilisés en chromatographie en phase gazeuse (CPG) sont monomériques 〚8–10〛, de type nématique, cholestérique 〚11〛 ou smectique 〚12〛. Cependant, ces dernières années, l’intérêt s’est porté sur la synthèse de cristaux liquides polymériques 〚13〛 et de composés mésogènes substitués latéralement par des substituants flexibles 〚14〛.
Les progrès dans le développement des propriétés physico-chimiques des cristaux liquides ont eu pour conséquence un intérêt accru pour l’utilisation de ces phases pour la résolution par CPG de mélanges complexes.
La plupart des exemples de séparation sur phases mésogènes concernent les isomères de position des hydrocarbures aromatiques et polyaromatiques et de leurs dérivés 〚15–17〛, ainsi que les isomères éthyléniques et cyclaniques présents dans les huiles essentielles 〚18–21〛.
Des études récentes sur les composés mésogènes portant une chaîne latérale flexible ont montré que ces derniers présentent un large domaine nématique 〚22, 23〛 et que, ni l’ordre en phase nématique, ni l’étendue du domaine d’existence en température de ces phases ne sont affectés par la présence de cette chaîne. Cependant, la plage nématique est déplacée aux températures relativement moins élevées quand la taille de cette chaîne augmente.
Dans ce travail, nous nous sommes intéressés à l’étude de l’influence de l’introduction d’un substituant latéral rigide ou flexible, polaire ou apolaire, sur les propriétés thermiques et analytiques de trois cristaux liquides nématiques, utilisés comme phases stationnaires en CPG.
Les trois composés choisis sont des dérivés du 2-(3-méthylbenzyloxy)-3-n-hexyloxy-4-(4-chlorobenzoyloxy)-4’-(4-méthylbenzoyloxy)-azobenzène. Ils contiennent quatre cycles aromatiques dans le cœur mésogène, avec trois fonctions : une azo et deux esters. Ils ne diffèrent dans leur structure que par la position méta ou para du groupement apolaire méthyle porté par le substituant latéral benzyloxy ou par la nature polaire (atome de chlore) ou apolaire du groupement CH3 porté par le même substituant en méta. Le premier, noté 3-CH3, renferme dans sa structure un groupement apolaire méthyle. Le radical CH3 occupe la position méta sur le substituant latéral benzyloxy. Le deuxième composé, mésogène, noté 4-CH3 ne diffère du premier que par la position para du méthyle. Le troisième cristal liquide, noté 3-Cl, a la même structure que le premier ; le groupement apolaire CH3 ayant été substitué par un élément polaire, le chlore en position méta.
2 Partie expérimentale
2.1 Choix de la température
Les trois cristaux liquides nématiques ont été synthétisés selon le schéma réactionnel présenté sur la Fig. 1.

Structures des cristaux liquides 3-CH3, 4-CH3 et 3-Cl : schéma réactionnel.
Quatre réactions principales ont été nécessaires à l’élaboration de ces matériaux. La première consiste à réaliser une réaction d’estérification dans le dichlorométhane en présence de N,N-dicyclohexylcarbodiimide (DCC) et de 4-pyrrolidinopyridine (NPP), la DCC étant un agent déshydratant et la NPP jouant le rôle de catalyseur. On procède ensuite à la réduction de l’ester formé précédemment par NaBH4/NiCl2 en présence de méthanol. Une réaction de diazotation est effectuée en présence de NaNO2 et de HCl afin de former le sel de diazonium. Enfin, une réaction d’acylation (substitution électrophile) est effectuée en présence d’un mélange pyridine/chloroforme.
Les produits utilisés pour la synthèse sont fournis par Fluka (Suisse), les solutés injectés proviennent de Meyreau Boiveau (France) et Chrompack (Hollande).
2.2 Appareillage
Les études structurales et le suivi de la pureté des composés mésogènes 3-CH3, 4-CH3 et 3-Cl ont été menés par RMN du proton sur un spectromètre Bruker AM250.
La détermination des transitions de phase a été réalisée à l’aide d’un analyseur enthalpique différentiel (Seiko Instrument DSC 220C) et d’un microscope optique polarisant (Leica DMRXP) équipé d’une platine chauffante (Chaixmeca) dont la vitesse de chauffe est de 10 °C min–1.
L’étude chromatographique en phase gazeuse a été menée en utilisant :
- • un chromatographe de type Hewlett-Packard HP5730A, équipé d’un détecteur à ionisation de flamme ;
- • un injecteur split/splitless utilisé en mode split ;
- • un enregistreur HP7130A.
Les colonnes capillaires utilisées (25 m de long et 0,25 mm de diamètre) sont en verre borosilicaté.
3 Résultats et discussion
3.1 Propriétés thermiques
Les températures de transition ou de changement d’état physique des composés mésogènes ont été détectées par microscopie et par analyse enthalpique différentielle (DSC).
Les changements de structure ont été observés tout d’abord optiquement. La nature des mésophases est de type nématique.
Les températures de transition ont été mesurées et contrôlées par température croissante (+10 °C min–1) par analyse calorimétrique différentielle.
Le Tableau 1 rassemble les valeurs des températures de transition des phases 3-CH3, 4-CH3 et 3-Cl obtenues par microscopie et par analyse calorimétrique différentielle. Dans des travaux précédents 〚20, 25〛, nous avons observé que les températures de transition obtenues par DSC sont en bon accord avec celles obtenues par chromatographie en phase gazeuse.
Températures de transition des cristaux liquides 3-CH3, 4-CH3 et 3-Cl obtenues par DSC et par microscopie.
| Transitions | ||||
| Solide → nématique → liquide | Solide → nématique → liquide | |||
| DSC | Microscopie | |||
| 3-CH3 | 89 °C | 141,5 °C | 89,5 °C | 142 °C |
| 4-CH3 | 107,8 °C | 159,8 °C | 108 °C | 160,5 °C |
| 3-Cl | 112,2 °C | 141,5 °C | 112,5 °C | 141 °C |
L’étude des propriétés thermiques des trois composés mésogènes soulève quelques remarques intéressantes :
- • les valeurs des températures de transition obtenues par DSC sont voisines de celles obtenues par microscopie ;
- • les trois composés ne présentent pas de transition solide–solide ;
- • une mésophase nématique est présente pour les trois composés ;
- • le déplacement du radical méthyle (CH3) porté par le substituant latéral benzyloxy de la position méta (3-CH3) vers la position para (4-CH3) conduit à une augmentation de la température de clarification, car le CH3 en para reste dans l’allongement de la molécule, contrairement au cas d’un méthyle ou un chlore en position méta ;
- • le remplacement du radical méthyle 3-CH3 de la chaîne latérale benzyloxy par un chlore augmente la température de transition solide–nématique (TKN) ; en revanche, il n’affecte pas la transition nématique–isotrope. Le radical méthylbenzyloxy, groupement flexible, permet de conserver des plages nématiques plus élevées comparativement au groupement chlorobenzyloxy.
3.2 Étude des performances analytiques
Les propriétés de rétention des trois phases stationnaires ont été mises en évidence en utilisant des colonnes capillaires.
Les chromatogrammes concernant quelques séparations sont présentés sur les Figs 2–5. Les temps de rétention relatifs sont reportés dans les Tableaux 2–5. Leur étude nous a permis de préciser les points fondamentaux suivants.
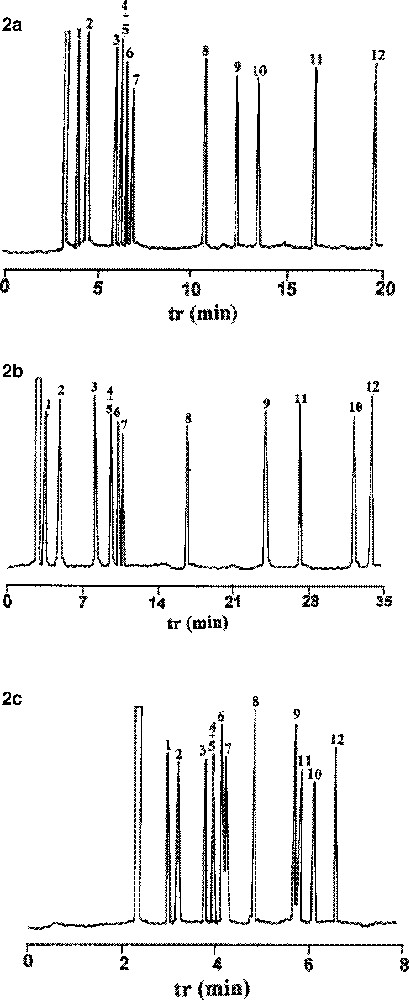
Séparation des hydrocarbures aromatiques : (a) colonne 3-CH3 ; température de la colonne 50 °C ; (b) colonne 4-CH3 ; température de la colonne 50 °C ; (c) colonne 3-Cl ; température de la colonne 100 °C. 1 : Benzène ; 2 : toluène ; 3 : éthylbenzène ; 4 : m-xylène ; 5 : p-xylène ; 6 : o-xylène ; 7 : isopropylbenzène ; 8 : 4-éthyltoluène ; 9 : 1,2,4-triméthylbenzène ; 10 : 1,2-diéthylbenzène ; 11 : 1,3-diéthylbenzène ; 12 : 1,4-diéthylbenzène.

Séparation des hydrocarbures polyaromatiques : (a) colonne 3-CH3, température de la colonne 160 °C ; (b) colonne 4-CH3, programmation de la température de la colonne avec une vitesse de chauffe de 4 °C min–1 à partir de 200 °C ; (c) colonne 3-Cl ; programmation de la température de la colonne avec une vitesse de chauffe de 4 °C min–1 à partir de 150 °C. 1 : Naphtalène ; 2 : 1-méthylnaphtalène ; 3 : 2-méthylnaphtalène ; 4 : 1,6-diméthylnaphtalène ; 5 : acénaphtylène ; 6 : acénaphtène.

Séparation des composés phénoliques : (a) colonne 3-CH3 ; programmation de la température de la colonne avec une vitesse de chauffe de 4 °C min–1 à partir de 80 °C ; (b) colonne 4-CH3, programmation de la température de la colonne avec une vitesse de chauffe de 4 °C min–1 à partir de 80 °C ; (c) colonne 3-Cl ; programmation de la température de la colonne avec une vitesse de chauffe de 4 °C min–1 à partir de 110 °C. 1 : Phénol ; 2 : 2,6-diméthylphénol ; 3 : 2,5-diméthylphénol ; 4 : 2,4-diméthylphénol ; 5 : 2,3-diméthylphénol ; 6 : 3,5-diméthylphénol ; 7 : 3,4-diméthylphénol ; 8 : 2,3,5-triméthylphénol ; 9 : 2,4,5-triméthylphénol.

Séparation des hydrocarbures aromatiques : (a) colonne 3-CH3 ; programmation de la température de la colonne avec une vitesse de chauffe de 4 °C min–1 à partir de 50 °C ; (b) colonne 4-CH3 ; programmation de la température de la colonne avec une vitesse de chauffe de 4 °C min–1 à partir de 50 °C ; (c) colonne 3-Cl, programmation de la température de la colonne avec une vitesse de chauffe de 4 °C min–1 à partir de 100 °C. 1 : α-pinène ; 2 : camphre ; 3 : eucalyptol ; 4 : fenchone ; 5 : estragol ; 6 : acétate de linallyl ; 7 : bornéol ; 8 : menthol ; 9 : α-terpinéol ; 10 : ß-citronellol ; 11 : nérol ; 12 : géraniol ; 13 : carvone ; 14 : acétate de géranyl ; 15 : anéthol ; 16 : carvacrol ; 17 : eugénol.
Temps de rétention relatifs (r) d’hydrocarbures aromatiques sur les trois phases stationnaires « cristal liquide » : 3-CH3, 4-CH3 et 3-Cl (s : état solide).
| Hydrocarbures aromatiques | 3-CH3 | 4-CH3 | 3-Cl | ||||||
| T (°C) | État | r | T (°C) | État | r | T (°C) | État | r | |
| Benzène | 50 °C | S | 0,17 | 50 °C | S | 0,11 | 100 °C | S | 0,28 |
| Toluène | 50 °C | S | 0,35 | 50 °C | S | 0,30 | 100 °C | S | 0,46 |
| Éthylbenzène | 50 °C | S | 0,75 | 50 °C | S | 0,68 | 100 °C | S | 0,74 |
| m-Xylène | 50 °C | S | 0,82 | 50 °C | S | 0,86 | 100 °C | S | 0,85 |
| p-Xylène | 50 °C | S | 0,84 | 50 °C | S | 0,87 | 100 °C | S | 0,89 |
| o-Xylène | 50 °C | S | 0,95 | 50 °C | S | 0,94 | 100 °C | S | 0,97 |
| Isopropylbenbzène | 50 °C | S | 1,00 | 50 °C | S | 1,00 | 100 °C | S | 1,00 |
| 4-Éthyltoluène | 50 °C | S | 1,99 | 50 °C | S | 1,78 | 100 °C | S | 1,34 |
| 1,2,4-Triméthylbenzène | 50 °C | S | 2,42 | 50 °C | S | 2,77 | 100 °C | S | 1,91 |
| 1,2-Diéthylbenzènene | 50 °C | S | 2,73 | 50 °C | S | 3,87 | 100 °C | S | 2,22 |
| 1,3-Diéthylbenzène | 50 °C | S | 3,49 | 50 °C | S | 3,20 | 100 °C | S | 1,93 |
| 1,4-Diéthylbenzène | 50 °C | S | 4,30 | 50 °C | S | 4,05 | 100 °C | S | 2,42 |
Temps de rétention relatifs (r) d’hydrocarbures polyaromatiques sur les trois phases stationnaires « cristal liquide » : 3-CH3, 4-CH3 et 3-Cl (L : état liquide).
| Hydrocarbures polyaromatiques | 3-CH3 | 4-CH3 | 3-Cl | ||||||
| T (°C) | État | r | T (°C) | État | r | T (°C) | État | r | |
| Naphtalène | 160 °C | L | 0,30 | 200 °C puis 4 °C min–1 | L | 0,46 | 150 °C puis 4 °C min–1 | L | 0,43 |
| 1-Méthylnaphtalène | 160 °C | L | 0,52 | 200 °C puis 4 °C min–1 | L | 0,70 | 150 °C puis 4 °C min–1 | L | 0,70 |
| 2-Méthylnaphtalène | 160 °C | L | 0,52 | 200 °C puis 4 °C min–1 | L | 0,70 | 150 °C puis 4 °C min–1 | L | 0,75 |
| 1,6-Diméthylnaphtalène | 160 °C | L | 1,00 | 200 °C puis 4 °C min–1 | L | 1,00 | 150 °C puis 4 °C min–1 | L | 1,00 |
| Acénaphtylène | 160 °C | L | 1,20 | 200 °C puis 4 °C min–1 | L | 1,24 | 150 °C puis 4 °C min–1 | L | 1,22 |
| Acénaphtène | 160 °C | L | 1,22 | 200 °C puis 4 °C min–1 | L | 1,34 | 150 °C puis 4 °C min–1 | L | 1,23 |
| Naphtalène | 160 °C | L | 0,30 | 200 °C puis 4 °C min–1 | L | 0,46 | 150 °C puis 4 °C min–1 | L | 0,43 |
| 1-Méthylnaphtalène | 160 °C | L | 0,52 | 200 °C puis 4 °C min–1 | L | 0,70 | 150 °C puis 4 °C min–1 | L | 0,70 |
| 2-Méthylnaphtalène | 160 °C | L | 0,52 | 200 °C puis 4 °C min–1 | L | 0,70 | 150 °C puis 4 °C min–1 | L | 0,75 |
| 1,6-Diméthylnaphtalène | 160 °C | L | 1,00 | 200 °C puis 4 °C min–1 | L | 1,00 | 150 °C puis 4 °C min–1 | L | 1,00 |
| Acénaphtylène | 160 °C | L | 1,20 | 200 °C puis 4 °C min–1 | L | 1,24 | 150 °C puis 4 °C min–1 | L | 1,22 |
Temps de rétention relatifs (r) des composés phénoliques sur les trois phases stationnaires « cristal liquide » : 3-CH3, 4-CH3 et 3-Cl (L : état liquide ; N : état nématique).
| Composés phénoliques | 3-CH3 | 4-CH3 | 3-Cl | ||||||
| T (°C) | État | r | T (°C) | État | r | T (°C) | État | r | |
| Phénol | 80 °C puis 4 °C min–1 | N | 0,59 | 80 °C puis 4 °C min–1 | N | 0,64 | 110 °C puis 4 °C min–1 | N | 0,57 |
| 2,6-Diméthylphénol | 80 °C puis 4 °C min–1 | N | 0,78 | 80 °C puis 4 °C min–1 | N | 0,82 | 110 °C puis 4 °C min–1 | L | 0,77 |
| o-Nitrophénol | 80 °C puis 4 °C min–1 | N | 0,86 | 80 °C puis 4 °C min–1 | N | 0,99 | 110 °C puis 4 °C min–1 | L | 0,90 |
| 2,5-Diméthylphénol | 80 °C puis 4 °C min–1 | N | 1,00 | 80 °C puis 4 °C min–1 | N | 1,00 | 110 °C puis 4 °C min–1 | L | 1,00 |
| 2,4-Diméthylphénol | 80 °C puis 4 °C min–1 | N | 1,02 | 80 °C puis 4 °C min–1 | N | 1,04 | 110 °C puis 4 °C min–1 | L | 1,01 |
| 2,3-Diméthylphénol | 80 °C puis 4 °C min–1 | L | 1,10 | 80 °C puis 4 °C min–1 | L | 1,11 | 110 °C puis 4 °C min–1 | L | 1,18 |
| 3,5-Diméthylphénol | 80 °C puis 4 °C min–1 | L | 1,13 | 80 °C puis 4 °C min–1 | L | 1,14 | 110 °C puis 4 °C min–1 | L | 1,21 |
| 3,4-Diméthylphénol | 80 °C puis 4 °C min–1 | L | 1,24 | 80 °C puis 4 °C min–1 | L | 1,25 | 110 °C puis 4 °C min–1 | L | 1,37 |
| 2,3,5-Triméthylphénol | 80 °C puis 4 °C min–1 | L | 1,43 | 80 °C puis 4 °C min–1 | L | 1,44 | 110 °C puis 4 °C min–1 | L | 1,67 |
| 2,4,5-Triméthylphénol | 80 °C puis 4 °C min–1 | L | 1,47 | 80 °C puis 4 °C min–1 | L | 1,42 | 110 °C puis 4 °C min–1 | L | 1,63 |
| p-Chlorophénol | 80 °C puis 4 °C min–1 | L | 1,48 | 80 °C puis 4 °C min–1 | L | 1,46 | 110 °C puis 4 °C min–1 | L | 1,74 |
| 4-Cl-3-Méthylphénol | 80 °C puis 4 °C min–1 | L | 1,75 | 80 °C puis 4 °C min–1 | L | 1,75 | 110 °C puis 4 °C min–1 | L | 2,49 |
Temps de rétention relatifs (r) de quelques composés volatils d’huiles essentielles sur les trois phases stationnaires « cristal liquide » : 3-CH3, 4-CH3 et 3-Cl (S : état solide ; L : état liquide ; N : état nématique).
| Composés volatils d’huiles essentielles | 3-CH3 | 4-CH3 | 3-Cl | ||||||
| T (°C) | État | r | T (°C) | État | r | T (°C) | État | r | |
| α-Pinène | 50 °C puis 4 °C min–1 | S | 0,33 | 50 °C puis 4 °C min–1 | S | 0,20 | 100 °C puis 4 °C min–1 | N | 0,17 |
| Camphre | 50 °C puis 4 °C min–1 | S | 0,42 | 50 °C puis 4 °C min–1 | S | 0,22 | 100 °C puis 4 °C min–1 | N | 0,20 |
| Eucalyptol | 50 °C puis 4 °C min–1 | S | 0,43 | 50 °C puis 4 °C min–1 | S | 0,40 | 100 °C puis 4 °C min–1 | N | 0,34 |
| α-Terpinène | 50 °C puis 4 °C min–1 | N | 0,45 | 50 °C puis 4 °C min–1 | S | 0,49 | 100 °C puis 4 °C min–1 | N | - |
| Fenchone | 50 °C puis 4 °C min–1 | N | 0,63 | 50 °C puis 4 °C min–1 | S | 0,70 | 100 °C puis 4 °C min–1 | N | 0,67 |
| Estragol | 50 °C puis 4 °C min–1 | N | 0,64 | 50 °C puis 4 °C min–1 | S | 0,51 | 100 °C puis 4 °C min–1 | N | 0,31 |
| Acétate de lynalyle | 50 °C puis 4 °C min–1 | N | 1,00 | 50 °C puis 4 °C min–1 | N | 1,00 | 100 °C puis 4 °C min–1 | N | 1,00 |
| Bornéol | 50 °C puis 4 °C min–1 | N | 1,04 | 50 °C puis 4 °C min–1 | N | 1,06 | 100 °C puis 4 °C min–1 | N | 1,06 |
| Menthol | 50 °C puis 4 °C min–1 | N | 1,09 | 50 °C puis 4 °C min–1 | N | 1,15 | 100 °C puis 4 °C min–1 | N | 1,14 |
| α-Terpinéole | 50 °C puis 4 °C min–1 | N | 1,16 | 50 °C puis 4 °C min–1 | N | 1,18 | 100 °C puis 4 °C min–1 | N | 1,28 |
| β-Citronellol | 50 °C puis 4 °C min–1 | N | 1,17 | 50 °C puis 4 °C min–1 | N | 1,22 | 100 °C puis 4 °C min–1 | N | 1,25 |
| Nérol | 50 °C puis 4 °C min–1 | N | 1,20 | 50 °C puis 4 °C min–1 | N | 1,24 | 100 °C puis 4 °C min–1 | N | 1,33 |
| Géraniol | 50 °C puis 4 °C min–1 | N | 1,31 | 50 °C puis 4 °C min–1 | N | 1,30 | 100 °C puis 4 °C min–1 | L | 1,56 |
| Carvone | 50 °C puis 4 °C min–1 | N | 1,45 | 50 °C puis 4 °C min–1 | N | 1,49 | 100 °C puis 4 °C min–1 | L | 1,97 |
| Acétate de géranyl | 50 °C puis 4 °C min–1 | N | 1,53 | 50 °C puis 4 °C min–1 | L | 1,56 | 100 °C puis 4 °C min–1 | L | 1,92 |
| Anéthol | 50 °C puis 4 °C min–1 | L | 1,67 | 50 °C puis 4 °C min–1 | L | 1,57 | 100 °C puis 4 °C min–1 | L | 0,60 |
| Carvacrol | 50 °C puis 4 °C min–1 | L | 1.81 | 50 °C puis 4 °C min–1 | L | 1,79 | 100 °C puis 4 °C min–1 | L | 1,78 |
| Eugénol | 50 °C puis 4 °C min–1 | L | 1,88 | 50 °C puis 4 °C min–1 | L | 1,87 | 100 °C puis 4 °C min–1 | L | 3,09 |
- • Indépendamment de la longueur de la colonne et des conditions de remplissage, la phase nématique présente une meilleure efficacité comparativement aux phases solides anisotrope et liquide isotrope pour les trois cristaux liquides, comme le montrent les résultats consignés dans le Tableau 6.
- • Pour les trois composés, la phase solide présente des performances analytiques convenables. Elle permet de réaliser une séparation satisfaisante des hydrocarbures aromatiques. Une séparation complète des isomères possédant trois à quatre carbones aliphatiques sur le cycle aromatique est obtenue lors de l’analyse chromatographique des hydrocarbures benzéniques sur les trois phases. Cependant, il n’est pas possible de séparer les isomères méta- et para-xylène. Un des challenges des phases nématiques est la totale séparation des xylènes selon leur géométrie spatiale, dans l’ordre ortho-, méta- et para-xylène. La phase solide des trois composés ne possède pas ces performances et retient plus l’o-xylène.
- • Les trois composés à l’état liquide présentent des propriétés de rétention convenables vis-à-vis des hydrocarbures polyaromatiques légers (Fig. 3).
- • Nous pouvons comparer les performances analytiques de la phase nématique par rapport au liquide lorsque nous considérons les isomères diméthylés du phénol. L’examen du Tableau 4 montre que, dans le cas de la phase 3-Cl, tous ces isomères sont élués dans la phase solide, le 2,5-diméthylphénol et le 2,4-diméthylphénol étant partiellement résolus. Dans le cas des phases 3-CH3 et 4-CH3, dans leur état nématique (voir Tableau 4), une totale séparation des isomères diméthylés du phénol est obtenue.
- • Dans de précédents travaux 〚15–17〛, nous avons montré que la substitution latérale des molécules mésogéniques permet d’obtenir simultanément les possibilités séparatives des phases polaires et apolaires. La Fig. 5 montre la séparation des composés volatils présents dans les huiles essentielles avec les trois composés étudiés. Les paires d’isomères estragole/anéthole et nérol/géraniol, réputées difficiles à séparer sur les phases classiques, sont correctement résolues sur les trois phases. De plus, les paires polaires menthol/bornéol et nérol/citronellol sont séparées par les trois phases avec une meilleure résolution dans le cas de 3-Cl. D’une manière générale, la phase 3-Cl semble plus adaptée à la séparation des composés organiques volatils présents dans les huiles essentielles. D’un autre côté, sur le polyéthylène glycol, il est bien connu que l’anéthole est élué avant le carvacrol 〚26〛. Cet ordre est respecté sur les trois phases. Il apparaît que le cycle aromatique conjugué avec la double liaison présent dans l’anéthole est moins retenu que le phényle portant un oxygène polaire retrouvé dans le carvacrol. C’est une particularité des phases polaires ou moyennement polaires 〚24〛.
Efficacité des colonnes 3-CH3, 4-CH3 et 3-Cl exprimées en nombre de plateaux théoriques (N) par mètre dans les états solide, nématique et liquide.
| Cristal liquide | États | Solutés | Température | Nombre de plateaux théoriques (N) par mètre |
| Solide anisotrope | Benzène | 50 °C | 2680 | |
| 3-CH3 | Nématique | Eucalyptol | 110 °C | 3180 |
| Liquide isotrope | Naphtalène | 170 °C | 2750 | |
| Solide anisotrope | Benzène | 50 °C | 2396 | |
| 4-CH3 | Nématique | Eucalyptol | 140 °C | 3550 |
| Liquide isotrope | Naphtalène | 200 °C | 2193 | |
| Solide anisotrope | Benzène | 100 °C | 2850 | |
| 3-Cl | Nématique | Naphtalène | 130 °C | 3650 |
| Liquide isotrope | 1-Bromonaphtalène | 150 °C | 2530 |
4 Conclusion
L’étude menée par chromatographie en phase gazeuse capillaire sur les trois cristaux liquides nématiques substitués latéralement, 3-CH3, 4-CH3 et 3-Cl, nous a permis de suivre l’influence de la position du groupement méthyle, porté par le substituant benzyloxy, dans les phases 3-CH3 et 4-CH3, ainsi que l’influence de la nature polaire (chlore) ou apolaire (méthyle) du substituant benzyloxy dans les phases 3-CH3 et 3-Cl sur les propriétés thermiques et analytiques de ces composés mésogènes.
Il ressort des résultats obtenus lors de cette étude que les phases stationnaires 3-CH3 et 4-CH3 présentent des performances analytiques pratiquement identiques vis-à-vis de diverses familles de composés chimiques, à l’inverse des phases 3-CH3 et 3-Cl, pour lesquelles nous avons observé une meilleure aptitude du cristal liquide 3-Cl à séparer plusieurs familles de solutés douées de propriétés de volatilité et de polarité différentes.



