1 Introduction
Les oxydes et hydroxydes de fer ont fait l’objet de nombreuses études. Tous ces travaux ont été rapportés dans un livre qui fait référence, paru en 1996 [1].
L’oxy-hydroxyde de fer FeO(OH) existe sous plusieurs variétés allotropiques, dont les plus importantes sont la gœthite α-FeO(OH) et la lépidocrocite γ-FeO(OH). Il existe deux autres variétés citées dans la littérature : la feroxyhite δ-FeO(OH), dont la structure fait l’objet d’une controverse [1, 2] et l’akaganéite β-FeO(OH), qui n’est pas strictement un oxy-hydroxyde mais un oxy-hydroxychlorure, obtenu par le remplacement d’un oxygène par un hydroxyle OH et l’addition d’un ion chlorure : β-FeO(1–x)(OH)(1+x)Clx. La présence de chlorure est indispensable à la stabilité de l’édifice cristallin, caractérisé par de larges canaux, dans lesquels se positionnent ces ions, stabilisant ainsi la structure [3].
La gœthite est la phase thermodynamiquement stable et il n’est donc pas surprenant qu’elle constitue la variété la plus communément trouvée dans la nature. Néanmoins, dans certaines conditions de formation, la lépidocrocite métastable peut être obtenue. De nombreux travaux ont relaté ces conditions de formation, de façon phénoménologique, sans apporter d’explications satisfaisantes pour interpréter les résultats expérimentaux [1].
Dans une récente publication [4], nous avons montré que la lépidocrocite possédait une structure feuilletée, vraisemblablement obtenue, par une transformation topotactique, à partir des feuillets de type brucite de l’hydroxyde de fer ferreux Fe(OH)2, appelé white rust (WR). L’objet de ce travail est l’étude des structures cristallines, afin de décrire les filiations structurales qui existent entre les différentes phases solides et de proposer des hypothèses de transformations topotactiques. De telles transformations peuvent évidemment aboutir à la définition de mécanismes réactionnels, explicitant ainsi la formation de chacun de ces composés dans des conditions bien définies.
2 Conditions expérimentales de formation des oxy-hydroxydes de fer
Les conditions expérimentales de formation des différents composés sont tirées de la synthèse des travaux effectuée sur ce sujet, parue en 1996 [1].
La gœthite, α-FeO(OH), est l’oxy-hydroxyde de fer trivalent thermodynamiquement stable. Il s’ensuit que toute réaction de formation des oxy-hydroxydes de fer, à l’équilibre, aboutira à la formation de gœthite. C’est le cas de la précipitation des sels de fer trivalent par une solution alcaline.
En revanche, la lépidocrocite, γ-FeO(OH), n’est obtenue que si l’on procède à la précipitation de sels de fer divalent, à température ambiante, dans des conditions très particulières.
- • (1) Le pH doit être voisin de la neutralité, car à ce pH il se forme un hydroxyde précurseur de la lépidocrocite, appelé green rust (GR), comprenant un mélange d’ions Fe2+ et Fe3+ ainsi que des anions, et particulièrement l’ion chlorure Cl–. La formule de la GR(Cl) peut s’écrire:
avec x pouvant varier jusqu’à une valeur autour de 0,33 [5]. Si le pH est trop bas (pH < environ 4), la concentration en ion OH– est trop faible pour que se forme la GR et on obtient un composé pauvre en ion OH–, contenant exclusivement du fer trivalent, appelé ferrhydrite, de formule Fe5O7(OH)·4 H2O. Si le pH est trop élevé (pH > environ 9), il n’y a pas de formation de GR. En revanche, il se forme transitoirement de l’hydroxyde ferreux Fe(OH)2 de type brucite qui, en s’oxydant sous l’effet de l’oxygène dissous, donne naissance à de la gœthite, puis à de la magnétite Fe3O4. Une des hypothèses avancées serait que la gœthite formée à partir de Fe(OH)2 réagirait avec l’hydroxyde résiduel pour donner naissance à la magnétite plus stable, selon la réaction :
- • (2) La vitesse d’oxydation des ions Fe2+ dans la GR doit être très élevée. C’est-à-dire que le rapport O2(dissous)/Fe2+ doit être grand. Si la vitesse d’oxydation est trop lente, on obtient, soit un mélange de lépidocrocite et de gœthite, soit la seule gœthite.
- • (3) La présence d’ions chlorure est indispensable pour la formation de la GR et l’obtention de la lépidocrocite par une oxydation rapide des ions Fe2+. En revanche, d’autres anions, tels que les sulfates et surtout les carbonates, jouent un rôle défavorable et orientent la réaction vers la formation de gœthite. Ces deux derniers anions, ayant un rôle de stabilisation de la GR plus important que celui de Cl–, doivent contribuer à diminuer la vitesse d’oxydation et, de ce fait, orienter les réactions vers la gœthite.
De ces conditions expérimentales complexes peuvent se dégager deux points importants. La GR stabilisée par les ions Cl–, GR(Cl), est un précurseur incontournable de la lépidocrocite. L’oxydation des ions Fe2+ de la GR doit être rapide ; sinon, la réaction s’oriente vers la formation de gœthite stable. Ces deux remarques nous ont conduits à envisager des hypothèses de transformations topotactiques plutôt que de simples réactions de dissolution–recristallisation, qui ne permettent pas de définir des mécanismes réactionnels simples ou évidents pour expliciter les résultats expérimentaux obtenus. De plus, le fait qu’une réaction doive être rapide milite plutôt vers un processus topotactique permettant, dans la plupart des cas, d’obtenir des phases métastables. Certains auteurs ont d’ailleurs envisagé de telles transformations [6].
L’établissement des hypothèses de transformations topotactiques nécessite bien évidemment la connaissance approfondie des structures cristallines des solides concernés.
3 Description des structures cristallines
3.1 β-Fe(OH)2 type brucite, appelée white rust
La structure de ce composé a été réétudiée récemment [7]. Elle est rhomboédrique, de groupe spatial (164), et de type brucite. Les paramètres définis dans une maille hexagonale ont pour valeur: a = 3,265 Å ; c = 4,601 Å. L’ion ferreux se trouve dans un environnement octaédrique Fe(OH)6. L’enchaînement des octaèdres, par la mise en commun de six arêtes, engendre des feuillets réguliers, de formule Fe(OH)2, dont la cohésion est assurée par un tissu de liaisons hydrogène faibles (Fig. 1a).

Structures cristallines : (a) β-Fe(OH)2, white rust ; (b) GR(Cl), green rust.
3.2 Fe2+(1–x)Fe3+x (OH)2Clx·n H2O, green rust, GR(Cl)
La structure a été établie récemment [8]. Elle est rhomboédrique, de groupe spatial (166). Les paramètres définis dans une maille hexagonale ont pour valeur : a = 3,190 Å ; c = 23,85 Å. La structure reportée sur la Fig. 1b est constituée de feuillets de type brucite, de formule [Fe2+(1–x)Fe3+x(OH)2]x+, alternant avec un espace inter-feuillets, qui accueille les ions Cl– et des molécules d’eau. La présence d’anions dans l’espace inter-feuillets se traduit par une augmentation importante de la distance inter-feuillets par rapport à celle de β-Fe(OH)2 (7,95 au lieu 4,601 Å). De plus, les feuillets sont décalés les uns par rapport aux autres d’une valeur égale au tiers du paramètre a suivant cet axe, ce qui implique que le paramètre c correspond à trois espaces inter-feuillets.
3.3 γ-FeO(OH), lépidocrocite
Dans notre récente publication nous avons exposé l’historique de l’étude structurale de la lépidocrocite [4]. La structure est orthorhombique de groupe spatial Cmcm (63). Les paramètres de la maille ont pour valeur : a = 3,072 Å ; b = 12,516 Å ; c = 3,873 Å. Dans une publication plus récente [9], une modification de la position de l’atome d’hydrogène a été formulée. Il est placé à la position 8f du groupe Cmcm, avec un taux d’occupation de 0,5, au lieu de la position 4c, dont nous avions émis l’hypothèse [4]. Cela aboutit à un désordre statistique pour l’hydrogène, entre deux sites possibles proches l’un de l’autre (distance égale à 0,55 Å). La structure est représentée sur la Fig. 2. Elle est constituée d’octaèdres FeO4(OH)2 reliés par quatre arêtes, pour donner naissance à des feuillets ondulés perpendiculaires à l’axe b. L’une des caractéristiques de cette structure réside dans le fait qu’un oxygène possède un environnement particulier, constitué de deux atomes de fer uniquement et d’un atome d’hydrogène. Cet environnement, peu stable comparé à celui de l’oxygène dans la brucite (trois Fe et un hydrogène) ou la gœthite (trois Fe et un hydrogène ou une liaison H forte) est vraisemblablement responsable de la métastabilité de la lépidocrocite.
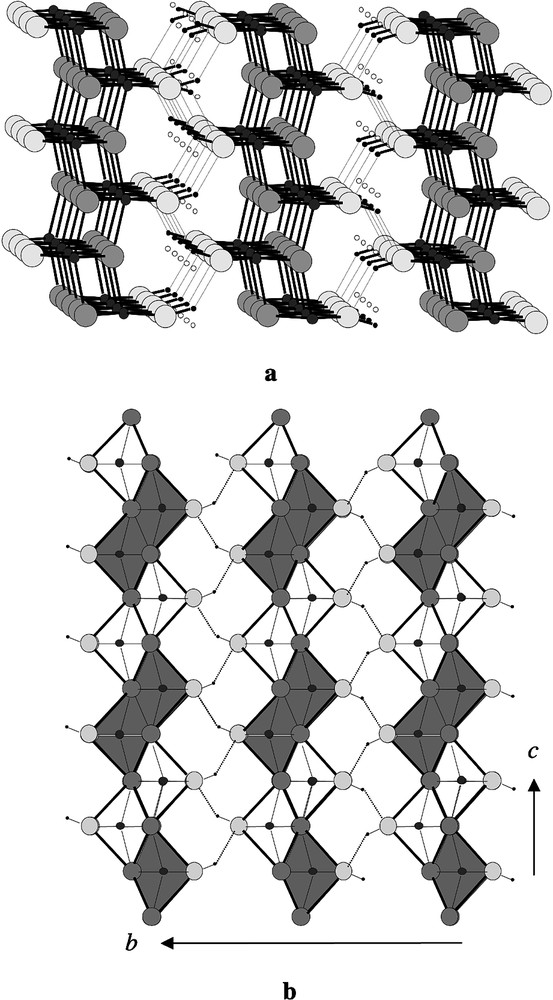
Structure de la lépidocrocite : (a) vue en perspective ; (b) projection suivant a, avec polyèdres.
3.4 α-FeO(OH), gœthite
La structure de la gœthite a été réétudiée en 1968 [10]. Elle possède la symétrie orthorhombique de groupe spatial Pnma (62). Les paramètres ont pour valeur: a = 9,95 Å ; b = 3,01 Å ; c = 4,62 Å. Elle est construite avec des entités comprenant deux octaèdres FeO3(OH)3, reliés entre eux par une arête OH–OH. Chaque entité ainsi définie est reliée à quatre autres par quatre atomes d’oxygène. De cette manière, on obtient, par projection selon l’axe b, un arrangement de ces doubles octaèdres, en quinconce dans le plan (a,c), définissant ainsi des lacunes où sont placés les atomes d’hydrogène (Fig. 3). En outre, suivant la direction b, chaque octaèdre est connecté, de part et d’autre, à deux autres octaèdres par une arête O–OH. Cela donne naissance à des tunnels suivant cette direction et à une structure tridimensionnelle.
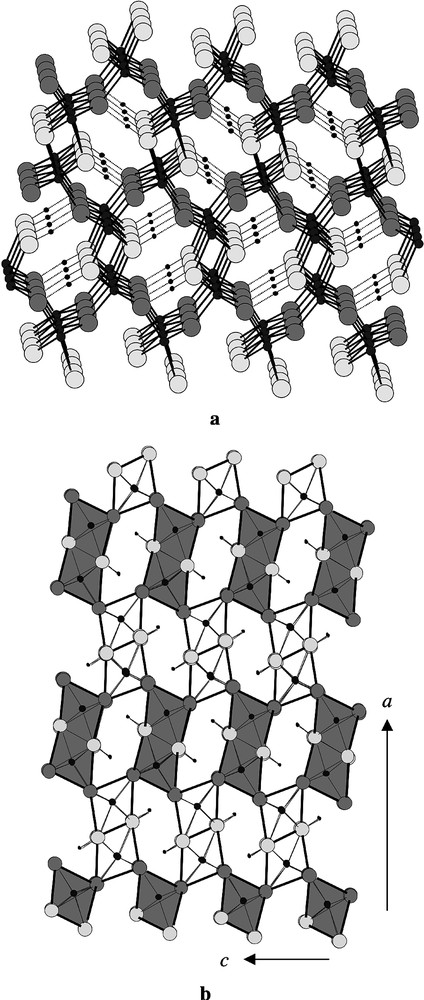
Structure de la gœthite : (a) vue en perspective ; (b) projection suivant b, avec polyèdres.
4 Filiations structurales et hypothèses de transformations topotactiques
L’étude comparée des paramètres de maille de Fe(OH)2, de la GR, de la lépidocrocite et de la gœthite montre qu’un paramètre est commun à ces quatre phases (Tableau 1). Il s’agit du paramètre b (ou a pour la lépidocrocite), correspondant à la distance entre deux atomes de fer appartenant à deux octaèdres adjacents, reliés par une arête. L’enchaînement de ces octaèdres suivant ce paramètre est identique pour les quatre phases. La variation de ce paramètre, de 3,265 à 3,01 Å, est due au remplacement des ions Fe2+ (rayon ionique : 0,74 Å) par les ions Fe3+(rayon ionique : 0,64 Å). De plus, le calcul des distances interatomiques compatibles avec des réarrangements atomiques de faible ampleur dans les autres directions a été effectué systématiquement.
Paramètres des mailles cristallines.
| Phase | a (Å) | b (Å) | c (Å) | groupe spatial | ||
| β-Fe(OH)2 | 3,265 | 3,265 | 4,601 | |||
| GR(Cl) | 3,190 | 3,190 | 23,85 | |||
| Lépidocrocite | 3,072 | 12,516 | 3,873 | Cmcm | ||
| Gœthite | 9,950 | 3,010 | 4,620 | Pnma |
Il ressort de cette étude que, d’un point de vue structural, trois hypothèses de transformations topotactiques entre ces différentes phases solides peuvent être envisagées :
La première transformation, désignée par topo1, entre la green rust(Cl) et la lépidocrocite, correspond à un réaménagement interne à chaque feuillet de la GR(Cl). En effet, la présence d’ions chlorure et de molécules d’eau dans l’espace inter-feuillets ne permet pas l’établissement de liaisons entre feuillets, et ce d’autant plus que leur distance, de l’ordre de 8 Å, est beaucoup trop grande. La GR(Cl) oriente donc la structure vers la formation d’un solide de structure feuilletée, c’est-à-dire vers la lépidocrocite. La Fig. 4 matérialise le passage de la GR(Cl) à la lépidocrocite. Suite au départ de la moitié des atomes d’hydrogène, il se produit la coupure d’une liaison Fe–OH. L’oxygène, ayant perdu son hydrogène, établit alors par compensation une nouvelle liaison avec un quatrième atome de fer appartenant au même feuillet, situé à une distance compatible de 3,91 Å. Par un réajustement coopératif de l’ensemble de la structure, la désorption des ions Cl– et des molécules d’eau, le rapprochement des feuillets et l’établissement de liaisons hydrogène entre ces feuillets, on obtient la structure de la lépidocrocite. Le schéma réactionnel peut s’écrire :
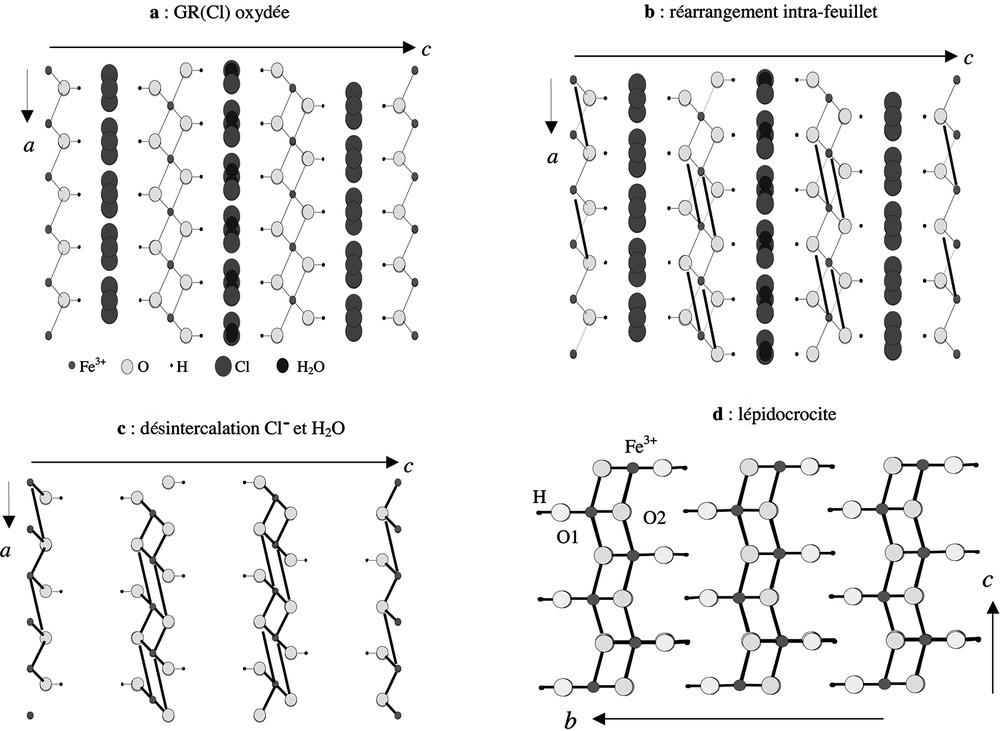
Transformation topo 1 GR(Cl) → lépidocrocite.
La structure feuilletée de la lépidocrocite est un argument de poids pour étayer cette hypothèse de transformation topotactique. Les relations entre les paramètres de ces deux phases sont consignées dans le Tableau 2.
Hypothèse de transformation topotactique GR(Cl) → lépidocrocite.
| GR(Cl) | γ-FeO(OH) Cmcm |
| green rust | lépidocrocite |
| γ = 120° | — |
La deuxième transformation topotactique envisagée, dénommée topo2, concerne le passage de l’hydroxyde ferreux β-Fe(OH)2 à la gœthite α-FeO(OH). La Fig. 5 explicite les étapes de la transformation. L’oxydation du fer ferreux par l’oxygène dissous s’accompagne du départ de la moitié des hydrogènes. La coupure de liaisons Fe–OH et Fe–O est compensée par l’établissement d’une liaison intra-feuillet, comme dans la transformation précédente topo1, et d’une liaison inter-feuillet. À l’inverse de la GR(Cl), il n’y a pas d’anions dans l’espace inter-feuillet susceptibles de faire écran à une liaison inter-feuillet et, de plus, la distance entre les feuillets (4,601 au lieu de 7,95 Å) est beaucoup plus courte. Par un réajustement coopératif des atomes, on débouche alors sur la structure de la gœthite, qui est tridimensionnelle. Le schéma réactionnel s’écrit :
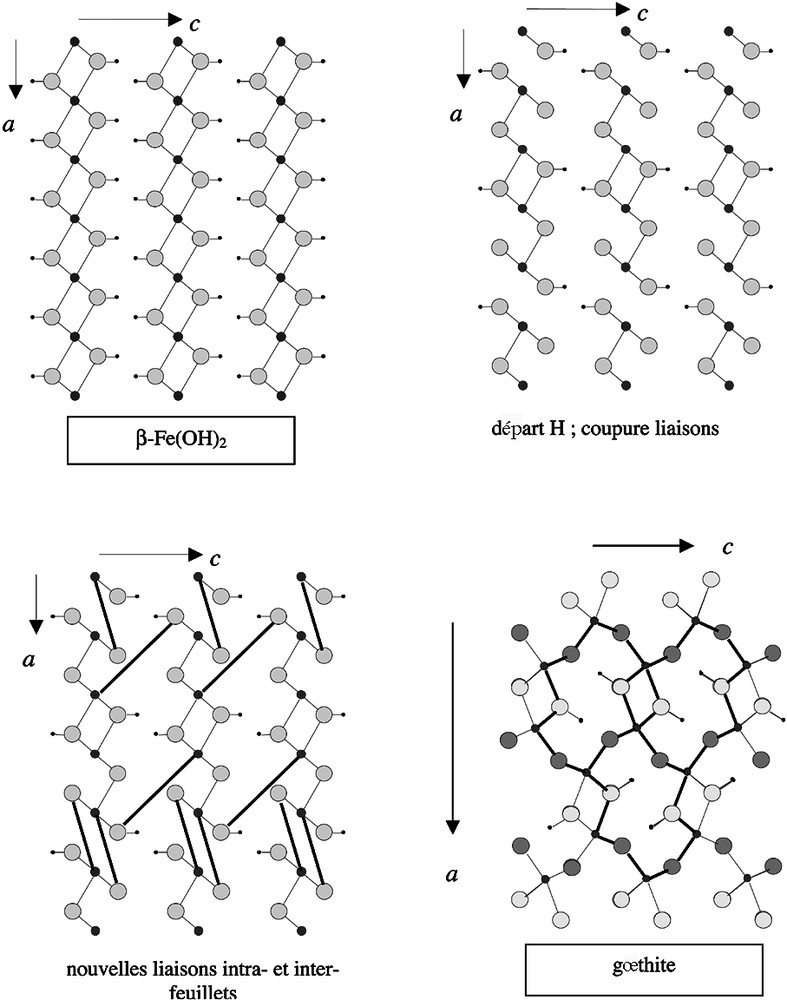
Transformation topo 2 β-Fe(OH)2 → gœthite.
Les relations existant entre les paramètres sont reportées dans le Tableau 3. Bien qu’elles soient relativement simples, la transformation induit toutefois un bouleversement assez important de la structure de départ.
Hypothèse de transformation topotactique β-Fe(OH)2→ gœthite.
| β-Fe(OH)2 | α-FeO(OH) Pnma |
| white rust, WR | gœthite |
| γ = 120° | — |
La troisième hypothèse, désignée par topo3, concerne la transformation donnant naissance à la gœthite à partir de la lépidocrocite. Elle est décrite sur la Fig. 6, où sont représentés les octaèdres en projection suivant l’axe b. Les relations entre les paramètres sont reportées dans le Tableau 4. On peut associer par paires les octaèdres FeO4(OH)2 dans la lépidocrocite. Deux liaisons Fe–O se rompent par polyèdre. Ces liaisons sont remplacées par deux nouvelles liaisons Fe–OH, l’une d’entre elles établissant une connexion avec un octaèdre appartenant à un autre feuillet, à une distance de 4,01 Å. Cette transformation donne naissance aux environnements FeO3(OH)3, caractéristiques de la gœthite, qui est obtenue après un réajustement coopératif de l’ensemble des atomes de la structure. Les relations entre les paramètres de mailles sont relativement simples (Tableau 4).

Transformation topo 3 lépidocrocite → gœthite.
Hypothèse de transformation topotactique lépidocrocite → gœthite.
| γ-FeO(OH) Cmcm | α-FeO(OH) Pnma |
| lépidocrocite | gœthite |
5 Interprétation des résultats expérimentaux obtenus lors de l’oxydation de sels ferreux en présence d’ions chlorure
Comme nous l’avons vu précédemment, le facteur déterminant est le pH. S’il est proche de 7, il se forme de la GR(Cl). En s’oxydant rapidement, elle donne naissance à la lépidocrocite par la réaction topo 1. Parallèlement, une autre réaction topotactique pourrait se produire si la vitesse d’oxydation est lente. En effet, la désintercalation progressive des ions Cl– permettrait le rapprochement des feuillets et, avant que les feuillets de la lépidocrocite ne se soient organisés, des liaisons inter-feuillets pourraient s’établir et orienter la structure vers celle de la gœthite, par la réaction topo 2. Il ne faut pas exclure également la mise en œuvre de la réaction topotactique topo 3, qui transforme progressivement la lépidocrocite en gœthite plus stable. Selon la vitesse d’oxydation des ions ferreux de la GR(Cl), on obtiendrait donc, soit la lépidocrocite presque pure si la vitesse d’oxydation est très élevée, soit un mélange de lépidocrocite et de gœthite, ou bien essentiellement de la gœthite si la vitesse est très faible. Il n’est pas exclu non plus qu’une réaction entre les ions Fe2+ résiduels non oxydés de GR(Cl) et le solide formé FeO(OH) puisse aboutir à la formation de magnétite FeIIFeIII2O4 [11].
Si le pH est plus élevé, supérieur à 9, il ne se forme pas de GR(Cl), mais de l’hydroxyde ferreux β-Fe(OH)2 ; on n’obtient pas de lépidocrocite. En revanche, par la réaction topo 2, on obtiendrait de la gœthite, qui pourrait ensuite réagir avec l’hydroxyde résiduel pour également donner naissance à la magnétite. De plus, lorsque le pH est très élevé, la solubilité de l’hydroxyde ferreux est plus importante, de par la formation vraisemblable de complexes du type Fe(OH)n(n–2)–. L’oxydation du fer ferreux se produirait alors en solution et on aboutirait à la formation directe du composé stable, à savoir la gœthite.
6 Conclusion
Les mécanismes de formation des oxy-hydroxydes du fer trivalent sont complexes et ont suscité de nombreux travaux, dont la plupart sont controversés. Les interprétations les plus communément admises pour expliciter les résultats expérimentaux obtenus font appel à des réactions de reconstruction par dissolution et recristallisation [1]. Ce type de réaction peut en effet se produire quand la solubilité des phases solides n’est pas insignifiante et quand il existe une différence de solubilité notable entre elles, ce qui n’est pas évident pour les hydroxydes et oxy-hydroxydes de fer. Sans les rejeter systématiquement, ces réactions de reconstruction ne sont pas en mesure d’expliciter l’obtention de tel ou tel produit dans telle ou telle condition de synthèse, à l’inverse des hypothèses de transformations topotactiques que nous proposons. L’obtention de la lépidocrocite de structure feuilletée (rare pour ce type de composé) à partir de la green rust, elle-même possédant une structure feuilletée, ne peut s’expliquer que par une transformation topotactique ; sinon, on ne voit pas pourquoi la gœthite plus stable ne serait pas obtenue directement par reconstruction. Les trois hypothèses de transformations topotactiques que nous proposons permettent d’interpréter de façon satisfaisante les principaux résultats expérimentaux obtenus.
Lorsque la température augmente par rapport à la température ambiante, les oxy-hydroxydes de fer se transforment, par déshydratation, en oxydes γ-Fe2O3 (maghémite), α–Fe2O3 (hématite) et Fe3O4 (magnétite), qui sont les oxydes les plus courants. Étant donné l’importance de ces composés dans la corrosion des aciers, nous poursuivrons ce travail par l’étude, d’un point de vue structural, des réactions de déshydratation donnant naissance aux oxydes de fer.



