1 Introduction
Le genre Phelline, représentatif de la famille des Phellinaceae est endémique en Nouvelle-Calédonie. Cinq espèces, parmi les douze espèces de Phelline connues ont été étudiées dans notre laboratoire [1–7]. La poursuite de l’étude des constituants alcaloïdiques des feuilles de P. comosa Labill. var. robusta (Baill.) Loesner [6,7] a conduit à l’isolement et à la détermination des structures d’autres alcaloïdes nouveaux appartenant au groupe de l’homoérythrinane. Les constituants de ce groupe ont un précurseur biogénétique de type 1-phényléthyl-1,2,3,4-tétrahydroisoquinoléine commun avec les alcaloïdes apparentés à la céphalotaxine, en particulier avec l’harringtonine connue pour son activité antileucémique [8,9].
La poudre de feuilles a été extraite selon un protocole classique, après humidification de la plante par une solution aqueuse de carbonate de sodium à 10%, pour éviter l’utilisation d’ammoniaque responsable dans certains cas de la formation d’artefacts [5,10]. Trois alcaloïdes nouveaux ont été isolés et caractérisés en plus des seize bases déjà décrites [6,7].
2 α-hydroxycomosivine 1
Les données physiques et spectrales du premier de ces composés s’accordent avec une structure 2α-hydroxycomosivine 1 (Fig. 1 ). En effet, le spectre de masse montre un pic moléculaire M+ à m/z = 375. Les fragmentations observées, comparées à celles de la schelhammerine 2 [8], de l’homoérythratine 3 [4] et de la 2-épi-homoérythratine 4 [1], sont typiques des alcaloïdes Homoérythrina, présentant une double liaison en position 1,6, et des groupes hydroxyle et méthoxyle, respectivement en position 2 et 3 (pics à m/z = 317, 194, 181). Le spectre de RMN du proton (400 MHz, CDCl3) montre un singulet fin à 6,47 ppm, indiquant la présence d’un proton aromatique dépourvu de couplage benzylique, et donc en faveur d’une position 15, et celles de trois groupes méthoxyles portés par le noyau benzénique, respectivement à 3,87, 3,78 et 3,76 ppm. Ce spectre signe également la présence d’une double liaison trisubstituée (signal à 5,79 ppm). Des expériences 2D permettent d’identifier les principaux protons, en particulier le proton axial en C-4 qui résonne sous forme d’un pseudotriplet à 1,92 ppm (J ~ J′ = 12 Hz), caractéristique d’une configuration pseudoaxiale de l’hydrogène en position 3 et les constantes de couplages de ce proton à 3,21 ppm (J3ax,4ax = 12 Hz, J3ax,4éq = 3 Hz) corroborent les données précédentes. La position allylique du groupe hydroxyle se trouve confirmée et la faible valeur de J3ax,2éq (~ 3 Hz) exclut une configuration pseudoaxiale pour l’hydrogène en C-2 (δ = 4,37 ppm). Le faible effet nucléaire Overhauser observé entre le proton en C-3 et le proton aromatique confirme la position 15 de ce dernier [11]. Une configuration du carbone spiro C-5, identique à celle de la comosivine 5, est déduite de la comparaison de leurs courbes de dichroïsme circulaire (DC), montrant un effet Cotton positif à 243 nm. Tous ces éléments permettent l’attribution de la structure 2α-hydroxycomosivine 1 à cet alcaloïde. Les quelques données décrites pour un constituant du bois de Phelline comosa auquel cette formule a été assignée [12,13] divergent des caractéristiques spectrales de l’alcaloïde 1, notamment des données de RMN 1H obtenues, pour comparaison, dans le benzène deutérié. En particulier, des différences significatives sont observées pour les déplacements chimiques du proton aromatique (6,67 vs 6,79 ppm) et du proton en C-1 (5,83 vs 5,35 ppm).
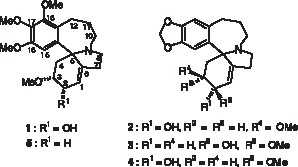
Alcaloïdes 1 à 5.
3 1,6α-époxyrobustivine 6
Les caractéristiques spectrales d’un nouvel alcaloïde 6 (M+. à m/z = 361) indiquent une structure étroitement apparentée à celle de la 1,6α-époxycomosivine 7 [6]. Le Tableau 1 montre les similitudes des déplacements chimiques des divers protons. Les constantes de couplage sont aussi presque identiques dans ces deux alcaloïdes et les déplacements chimiques élevés des protons des cycles oxiranes (H-1: δ = 3,79 ppm dans les deux cas) s’expliquent par la proximité du noyau aromatique [4]. La principale différence concerne le déplacement chimique du proton en C-3. Ces données, jointes à l’absence de groupe méthoxyle aliphatique s’accordent avec la structure 1,6α-époxyrobustivine 6 (Fig. 2 ).
RMN 1H des alcaloïdes 6 et 7 (CDCl3, δ ppm/TMS)
| δ | H-1 | H-2 | H-3 | Hax-4 | Héq-4 | H-7 | H-8 | H-10 | H-11 | H-12 | H-15 | MeO-3 | MeO–Ar |
| 6 | 3,79 | 2,40 | 3,46 | 1,86 | 2,50 | 2,28 | 3,02 | 3,46 | 1,76 | 3,46 | 6,55 | _ | 3.89 |
| 2,03 | 1,80 | 2,83 | 3,32 | 1,58 | 2,57 | 3.83 | |||||||
| 3.79 | |||||||||||||
| 7 | 3,79 | 2,29 | 3,01 | 1,81 | 2,54 | 2,29 | 2,96 | 3,48 | 1,78 | 3,48 | 6,55 | 3,16 | 3,89 |
| 2,05 | 1,83 | 2,82 | 3,32 | 1,58 | 2,59 | 3,82 | |||||||
| 3,78 |
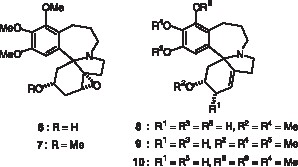
Alcaloïdes 6 à 10.
4 18-des-O-méthylholidinine 8
Un nouvel alcaloïde diphénolique 8 a été isolé sous forme de cristaux incolores. Ses caractéristiques spectrales indiquent une structure étroitement apparentée à celles de la comosivine 5 et de l’holidinine 9, monophénol isolé de P. sp. aff. P. lucida, dont la structure a été certifiée par analyse aux rayons X [14]. Ceci suggère que ces alcaloïdes ne diffèrent que par la substitution du noyau aromatique. Cette hypothèse a été vérifiée par méthylation de l’alcaloïde 8 en solution dans le méthanol par un excès de diazométhane dans l’éther. Cette réaction conduit à un composé majoritaire (35%), identifié par comparaison de ses données spectrales à l’athrocupressine 10 [11], et à deux composés minoritaires : la comosivine 5 (12%) et l’holidinine 9 (3%). Ce résultat s’explique par la difficile méthylation de l’athrocupressine 10, dont la fonction phénol en C-18 est très peu réactive, probablement pour des raisons stériques [11], et permet d’assigner les positions 16 et 18 aux deux groupes hydroxyles phénoliques de 8. La courbe de DC de 10 confirme la configuration du carbone spiro C-5.
5 Conclusion
Ainsi, dix-neuf alcaloïdes ont été caractérisés à ce jour dans les extraits de P. comosa Labill. var. robusta (Baill.) Loesner, dont onze n’avaient pas été décrits auparavant. Comme les autres alcaloïdes isolés du genre Phelline, ils appartiennent tous au groupe de l’homoérythrinane qui a fait l’objet d’une revue par I.R.C. Bick et S. Panichanun [15]. Ils sont nombreux et largement répandus dans le règne végétal. Il est surprenant qu’ils aient été trouvés dans des familles aussi différentes que Convallariaceae [8,15], Cephalotaxaceae [16,17], Taxodiaceae [11,18], Meliaceae [19] et, plus récemment, Podocarpaceae [20].
6 Partie expérimentale
6.1 Isolement des alcaloïdes
Les feuilles de Phelline comosa Labill. var robusta (Baill.) Loesner ont été collectées sur le mont Oungone, en Nouvelle-Calédonie. Un spécimen portant la référence Radjibaly–La Barre 126 a été déposé à l’herbier du centre ORSTOM de Nouméa.
La plante pulvérisée (0,8 kg) a été humidifiée par une solution aqueuse de Na2CO3 à 10% avant d’être extraite par le dichlorométhane selon un protocole classique. Le totum alcaloïdique (6,0 g) a été chromatographié sur colonne de silice (éluant : CH2Cl2 contenant des proportions variables de méthanol). La fraction éluée par un mélange CH2Cl2–MeOH 97:3 a été soumise à une autre chromatographie sur colonne de silice (éluant : heptane–Et2O–MeOH 4:16:1) pour donner un mélange de 2α-hydroxycomosivine 1 (30,0 mg) et de l’alcaloïde 6 (172 mg) séparés par CCE (éluant : AcOEt). La fraction éluée par un mélange CH2Cl2–MeOH 24:1 a été purifiée par CCE de silice (éluant : AcOEt–MeOH 49:1) pour fournir l’alcaloïde 8 (82 mg).
6.2 Alcaloïde 1
F : 124 °C. [α]D : +146 (c = 0,54, CHCl3). IR (CHCl3, cm–1) : 3610, 3450, 3000, 2940, 2900, 1635, 1610, 1520, 1500, 1485. UV [EtOH, λmax nm (ε)] : 210 (33750), 275 (2100), 280 (2100). DC [EtOH, λmax nm (Δε)] : 229 (–1,9), 243 (+5,7). RMN 1H (400 MHz, CDCl3) : 6,47 (s, 1 H, H-Ar), 5,79 (m, 1 H, H-1), 4,37 (m, 1 H, H-2), 3,87 (s, 3 H, MeO–Ar), 3,78 (s, 3 H, MeO–Ar), 3,76 (s, 3 H, MeO–Ar), 3,50 (m, 2H, Ha-10, Ha-12), 3,31 (s, 3 H, MeO-3), 3,24 (m, 1 H, Hb-10), 3,21 (m, 1 H, H-3), 2,80, 2,76 (2 m, 2H, H2-8) 2,63, 2,60 (2 m, 2 H, Hb-12, Ha-7), 2,51 (dd, 1 H, J4éq,4ax = 12, J′4éq,3 = 3 Hz, Héq-4), 2,31 (m, 1 H, Hb-7), 1,92 (dd, J = J′ = 12 Hz, Hax-4), 1,73, 1,62 (2 m, 2 H, H2-11). RMN 13C (75.0 MHz, CDCl3) : 151,87, 149,81 (Cq, Ar), 147,52, 141,42, 136,70, 128,85 (C-6, Cq, Ar), 118,47 (C-1), 110,53 (C-15), 76,85 (C-3), 69,95 (C-5), 63,61 (C-2), 61,37, 60,87 (MeO–Ar), 56,35, 56,28 (MeO–Ar, MeO–C-3), 50,37 (C-10), 46,07 (C-8), 32,44 (C-4), 28,11 (C-7), 25,81 (C-12), 23,37 (C-11). SM (IE) m/z : 375 (M+.), 344, 317 (M–CH3OCH=CH2), 301, 194 (100%), 181, 162. SMHR calc. pour C21H30NO5 (MH)+ : 376,2124; trouvé : 376,2143.
6.3 Alcaloïde 6
[α]D : +99 (c = 0,68, CHCl3). UV [EtOH, λmax (ε)] : 207 (35 700), 283 (1275). IR : 3575, 3400, 2910, 2830, 1590, 1394, 1305. RMN 1H (400 MHz, cf. Tableau 1). RMN 13C (75.0 MHz, CDCl3) : 151,81, 149,90, 141,42, 137,24, 129,44 (Cq, Ar), 108,75 (C-15), 70,57 (C-5), 67,15 (C-6), 64,44 (C-3), 61,34 (MeO–Ar), 60,87 (MeO–Ar), 57,43 (C-1), 56,24 (MeO–Ar), 49,78 (C-10), 45,82 (C-8), 36,05 (C-4), 33,36 (C-2), 27,95 (C-7), 25,72 (C-12), 22,70 (C-11). SM (IE) m/z : 361 (M+.), 344, 181, 180, 167, 166 (100%). SMHR calc. pour C20H27NO5 (M+.) : 361,1889, trouvé : 361,1897.
6.4 Alcaloïde 8
F : 140 °C. [α]D : + 111 (c = 0,54, MeOH). UV [EtOH, λmax (ε)] : 208 (29 600), 276 (1242); milieu alcalin : 293 (15100). IR (nujol) : 3425, 3100 (large), 1595, 1480, 1440, 1360, 1325. RMN 1H (400 MHz, CDCl3) : 6,39 (s, 1 H, H–Ar), 5,50 (m, 1 H, H-1), 3,87 (s, 3 H, MeO-Ar), 3,51 (2 m, 2 H, Ha-12, Ha-10), 3,30 (m, 1H, H-3), 3,25 (s + m, 4 H, MeO-3, Hb-10), 2,78 (dd + m, 3 H, Héq-4, H2-8), 2,58 (m, 2 H, Hb-12, Ha-2), 2,45 (m, 1 H, Ha-7), 2,30 (m, 1 H, Hb-7), 2,02 (m, 1 H, Hb-2), 1,76 (m, 1 H, Ha-11), 1,56 (dd + m, 2H, Hax-4). RMN 13C (50.0 MHz, CDCl3 + ε CD3OD) : 147,0, 145,3, 141,7 (Cq, Ar), 117,0, 110,8 (CH), 74,2 (C-3), 70.0 (C-5), 60,6 (MeO–Ar), 55,8 (MeO-3), 50,5 (C-10), 46,8 (C-8), 37,7 (C-4), 32,0 (C-2), 27,5 (C-7), 25,3 (C-12), 23,1 (C-11). SM (EI) m/z : 331 (M+.), 300, 273, 272, 180 (100%). SMHR (ESI): calc. pour C19H26NO4 (MH)+ : 332,1862, trouvé : 332,1899.


