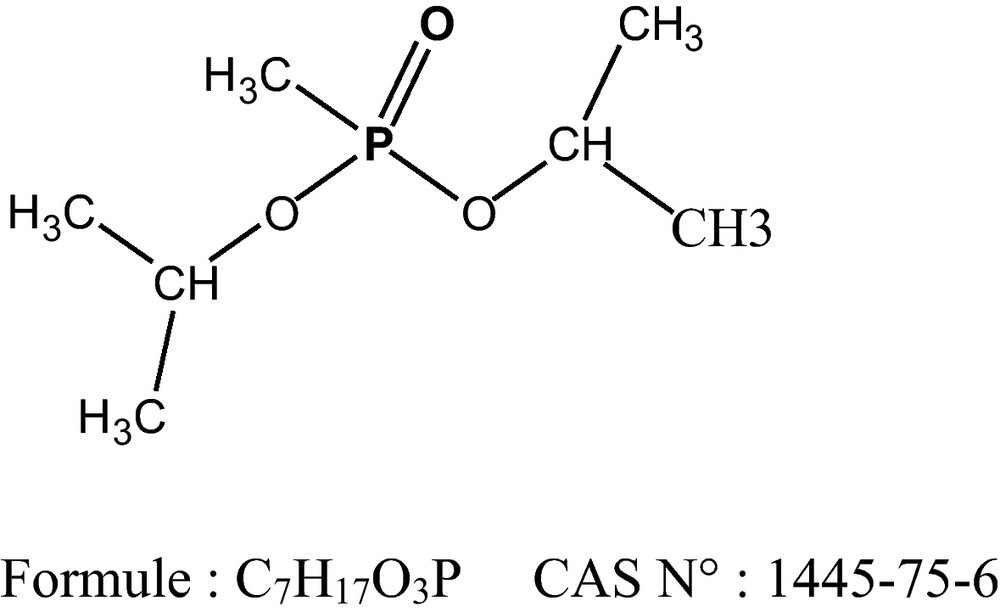
1 Introduction
Les organophosphorés (OP) sont employés comme pesticides (POP) et également comme armes chimiques neurotoxiques (NOP) [1–3]. Outre leurs similitudes structurales, ces deux classes de composés présentent des effets toxiques similaires [4,5]. Ils sont doués de propriétés anticholinestérasiques et peuvent nuire au système nerveux par la modification de la concentration d’une enzyme appelée cholinestérase, qui régule la transmission de l’influx nerveux. Les intoxications aiguës par les OP sont potentiellement létales et responsables d’une forte mortalité [6].
L’un des secteurs fortement exploré actuellement pour se rendre compte du risque de ces produits est le développement de nouvelles techniques de détection. Différents types de détecteurs sont décrits dans la littérature [7–9], de la simple coloration révélatrice à la détection par analyse classique. La plupart des détecteurs de neurotoxiques s’appuient sur le changement de couleur des réactifs, ou apparition de phénomènes : de fluorescence, de chimiluminescence, électrique, acoustique ou colorimétrique [10,11].
Dans le cas des OP, la méthode la plus attractive et qui demeure toujours exploitable est la détection par inhibition enzymatique [12]. Bien que cette méthode soit de mise en œuvre facile, sensible et de réponse rapide, elle présente l’inconvénient, dû au fait que l’enzyme peut être inhibée par des composés, tels que des ions métalliques ou d’autres composés organiques ou inorganiques [13].
La détection enzymatique des OP neurotoxiques est possible grâce au principe de l’inhibition de l’enzyme acétylcholinestérase ou butyrylcholinestérase. L’efficacité potentielle de cette technique peut être évaluée par des méthodes électrochimiques utilisant les transducteurs électrochimiques (ampérométriques, potentiométriques et conductimétriques) ou par des réactions spécifiques colorimétriques [14–16].
L’activité de la cholinestérase est due à la présence sur la molécule de deux centres actifs, l’un anionique et l’autre estérasique. Les forces électrostatiques mises en jeu permettent au centre anionique d’attirer l’azote de l’acétylcholine chargée positivement et les liaisons ainsi formées s’associent aux forces de Van der Waals. Ces dernières sont liées au caractère et au nombre de radicaux alkyls sur l’azote lesquels jouent un rôle prépondérant dans la stabilité du complexe présenté par le schéma suivant [17] :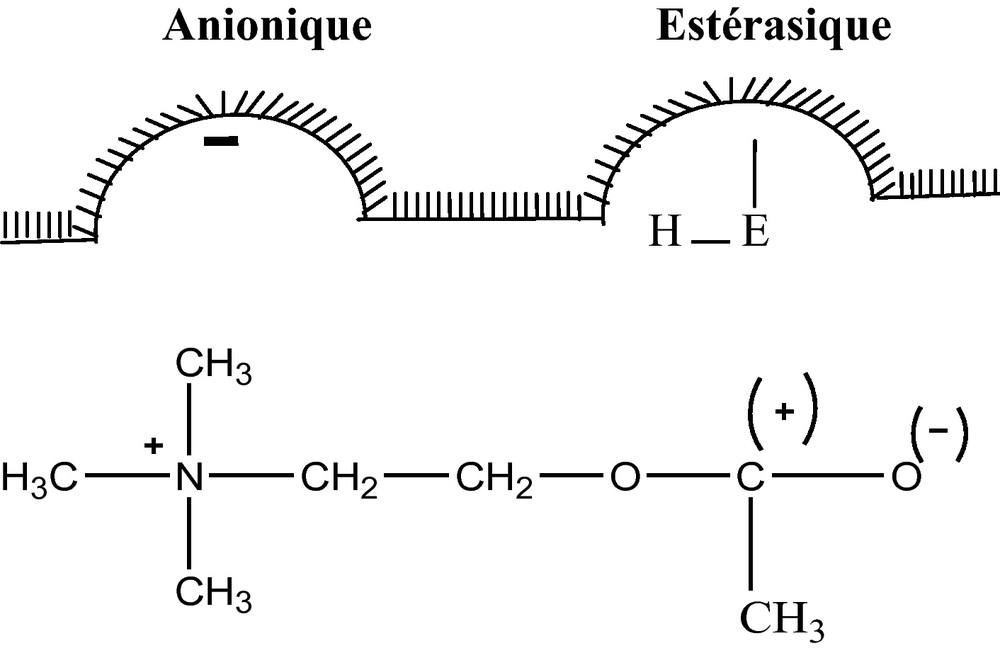
Schéma d’interaction du centre actif de la cholinestérase avec l’acétylcholine.
Le centre estérasique se compose d’un groupement basique (nucléophile) E et un groupement acide désigné par H. Le groupement nucléophile assure la formation du complexe enzymatique tandis que le groupement acide est indispensable pour le déroulement de la réaction d’hydrolyse. Le mécanisme d’hydrolyse de l’acétylcholine peut être représenté par la réaction ci-dessous :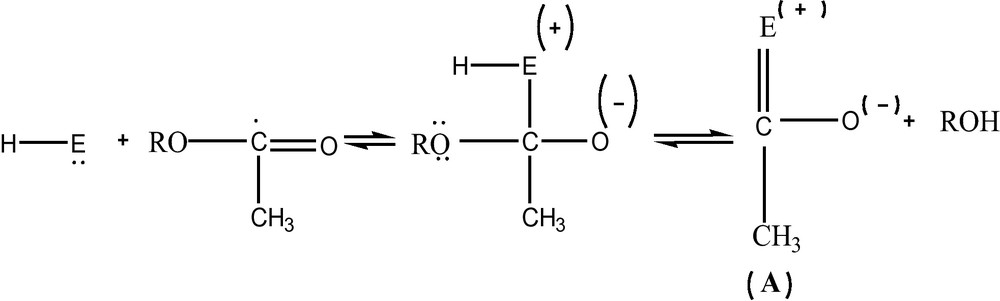
R représente le résidu de la choline. À ce stade, il se forme l’acétyl (A) et la choline. L’acétyl est considéré comme un composé peu stable et par conséquent se décompose par réaction avec l’eau. Ainsi, il se forme le groupement actif H---E et l’acide acétique selon la réaction suivante [17] :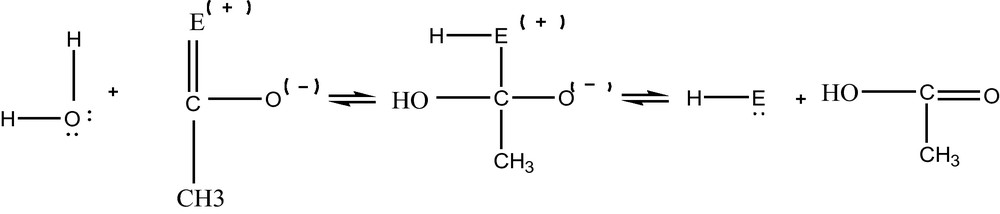
De façon analogue a lieu l’interaction entre la cholinestérase et les OP, ce qui conduit à l’inhibition de l’enzyme par réaction de phosphorylation en donnant un complexe phosphoryl stable (F) :
La révélation de l’activité enzymatique est réalisée avec la méthode d’Ellman qui utilise un substrat artificiel, l’acétylthiocholine, dont l’hydrolyse conduit à la formation de thiocholine. Cette dernière forme un dérivé coloré avec le DTNB (5-5’-dithiobis-[2 nitrobenzoate]) selon l’équation bilan suivante [18] :
En présence d’OP, l’enzyme est inhibée, et la réaction d’hydrolyse de l’acétylthiocholine n’a pas lieu, par conséquent aucune coloration ne se développe.
Dans le cadre du présent travail, nous procédons à la synthèse et purification de quelques OP de toxicité variable, suivie d’une adaptation de technique spectrométrique relative à la cinétique d’inhibition de l’enzyme butyrylcholénistérase. L’optimisation de la réaction considérée a été établie par un modèle mathématique dont l’objectif est de démontrer l’effet des OP étudiés, pris séparément ou en mélange sur l’activité de l’enzyme.
2 Travail expérimental
Le travail expérimental a consisté en la synthèse et la purification des OP : triisopropylphosphate, diisopropylmethylphosphanate, l’isopropyldimethylphosphate. Le neurotoxique amiton a été délivré par le laboratoire de composés biologiquement actifs de l’Institut de technologie de Saint Petersburg. Ces OP ont été soumis à des tests d’inhibition de la butyrylcholinestérase d’activité spécifique 0,4 E/mg, l’enzyme extraite du sérum de cheval est fournie par la Société par Action « Gosniikhimanalit » Saint Petersburg (Fédération de Russie). La vitesse de réaction d’inhibition enzymatique a été suivie par spectrophotométrie UV à l’aide d’un spectrophotomètre SF-26 dans la gamme spectrale allant de 230 et 700 nm. L’optimisation du processus a été établie sur la base d’un modèle mathématique utilisant le plan factoriel d’expériences pour les différents toxiques seuls ou en mélanges. Le traitement des spectres et l’expression des résultats cinétiques ont été effectués à l’aide de logiciels MS Excel et origin Pro8.
2.1 Préparation des organophosphorés
2.1.1 Synthèse du triisopropylphosphite
Dans un ballon tricol, on introduit 0,1 mol d’isopropanol et 0,1 mol de sodium, ce mélange est agité pendant quelques heures à température ambiante, puis on augmente la température jusqu’à 30 °C. Au précipité ainsi formé et refroidi à 10 °C, on ajoute 15 mL de pentane, le trichlorure de phosphite est additionné minutieusement de façon à maintenir cette température. Le mélange réactionnel est ensuite porté à 30° C et y est maintenu durant 15 minutes. Après filtration du mélange, le triisopropylphosphite est isolé par distillation sous vide sous forme d’un liquide incolore, ayant une température d’ébullition de 75 à 78 °C à 14 mm Hg [19].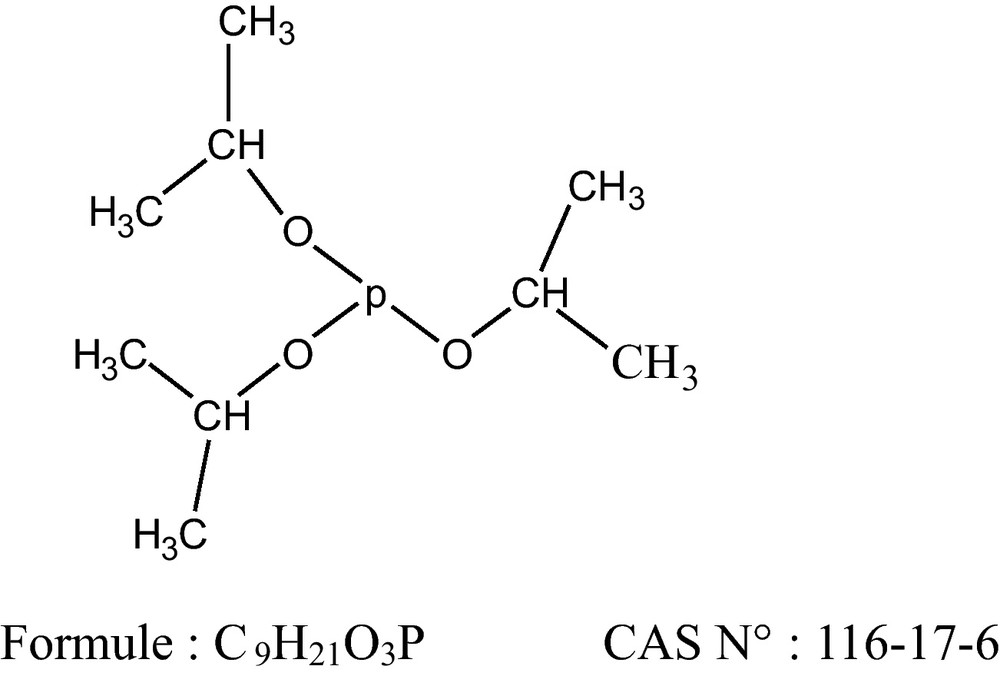
2.1.2 Synthèse du diisopropylméthylphosphonate
Dans un ballon tricol, on mélange goutte à goutte une solution l’iodure de méthyle (0,1 mol) avec le triisopropylphosphate (0,01 mol). L’agitation est maintenue durant 30 minutes à 35 °C. À la fin de la réaction, le mélange est distillé sous vide. Le produit obtenu est un liquide incolore, sa température d’ébullition est de 63 °C à 0,5 mm Hg [20].
2.1.3 Synthèse du disopropylméthylphosphonite
Dans un ballon tricol, on introduit 0,4 mL d’isopropanol et 0,2 mol de triéthylamine. Le mélange est refroidi jusqu’à 1 °C. Ensuite on ajoute goutte à goutte du trichlorure de phosphore sous agitation pendant six heures. Le chlorure d’isopropyle est évacué sous flux d’azote. À la fin de la réaction, le mélange est filtré et la fraction du diisopropyliméthylphosphonite est isolée par distillation à une température d’ébullition de 77 °C à 20 mm Hg [21].
2.1.4 L’amiton
Le neurotoxique amiton a été délivré par le laboratoire de composés biologiquement actifs de l’Institut de technologie de Saint Petersburg. Le produit a été utilisé sous sa forme thionique (fluide de couleur jaunâtre).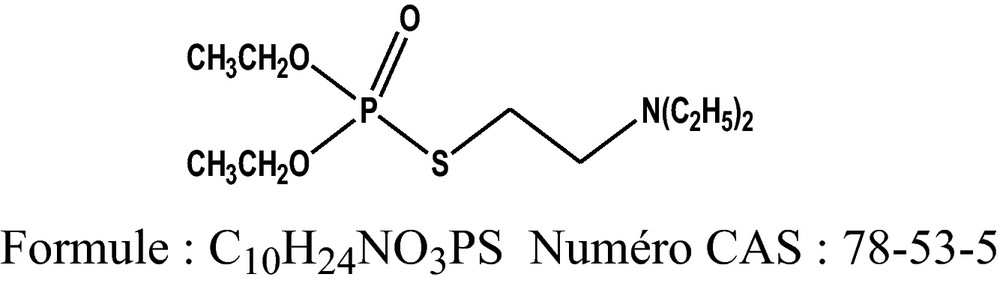
2.2 Étude cinétique de la réaction d’inhibition enzymatique
2.2.1 Principe de la méthode
Les mesures ont été effectuées dans des cuvettes spectrophotométriques. Dans une cuvette de référence, on verse 1,0 mL de la solution de la cholinestérase, 0,5 mL d’eau distillée et 0,2 mL d’une solution à 0,05 % de bleu de bromothymol. Dans une autre cuvette, on verse 1 mL d’acétylcholinestérase et 0,5 mL de l’inhibiteur (1 mM). Les deux cuvettes sont chauffées à une température de 37 °C pendant une minute. Ensuite, on ajoute dans chaque cuvette 0,2 mL de la solution de l’acétylcholine à 0,5 %.
La cholinestérase hydrolyse le substrat d’acétylcholine en acide acétique et en choline. Suite à l’augmentation de la concentration de l’acide formé, il en résulte la variation du pH de la solution et également de sa densité optique. L’activité cholinestérasique est déterminée à partir de la densité optique de la solution réactionnelle à la longueur d’onde de 405 nm. Le spectre de l’indicateur coloré est obtenu à une longueur d’onde de 430 nm. Le signal augmente graduellement en fonction de la concentration de l’acide acétique dans la solution de l’indicateur (Fig. 1).
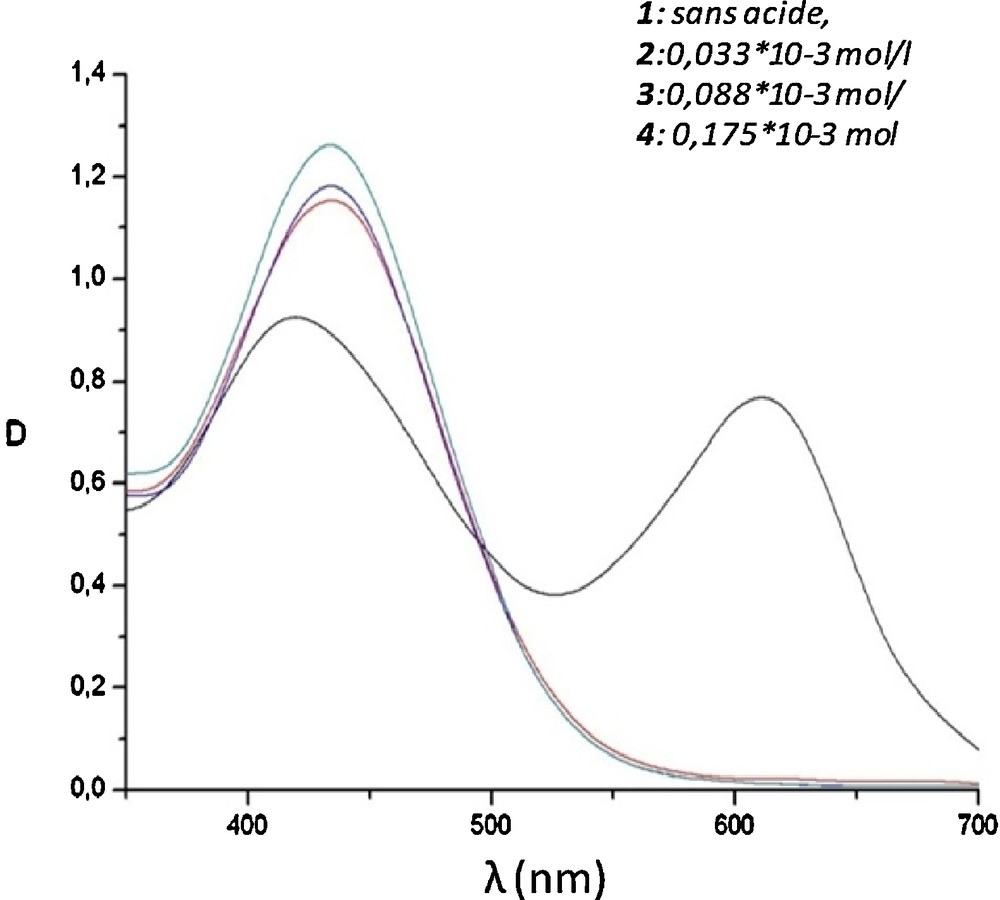
Spectres de l’indicateur et de la solution à diverses concentrations de l’acide acétique.
À partir de la courbe d’étalonnage (Fig. 2), on procède à la détermination de la concentration de l’acide dans la solution étudiée en fonction du temps. La Fig. 3 illustre cette variation dans le cas de la réaction avec le diisopropylméthylphosphonite et d’une manière analogue, on obtient la relation dans le cas des autres composés.
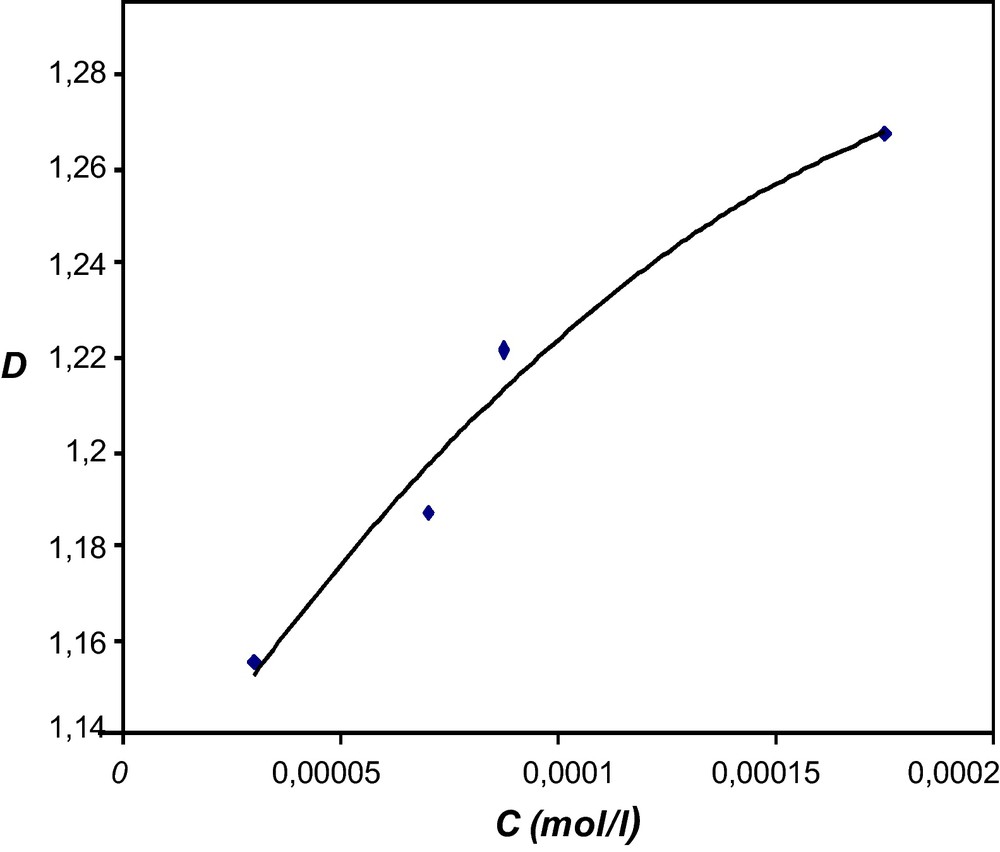
Variation de la densité optique en fonction de la concentration de l’acide dans la solution.

Variation de la concentration de l’acide en fonction du temps.
2.2.2 Détermination des valeurs cinétiques
Les droites cinétiques sont déterminées en fonction de la variation de la concentration de l’acide acétique au cours du temps de réaction. L’ordre de la réaction est déterminé par la méthode graphique. Pour les divers ordres partiels de réaction la relation prend la forme suivante : 1/C = kt + 1/C0 (C0 : concentration initiale de l’acide, C : concentration réactionnelle de l’acide, k : constante de vitesse et t : temps de réaction).
En se basant sur les équations du Tableau 1, le tracé des courbes relatives à la variation de la concentration de l’acide acétique a montré que la plus grande linéarité est obtenue dans le cas de l’équation : ln C = lnC0–kt. Par conséquent la réaction est d’ordre 1. Les valeurs des constantes de vitesses ainsi calculées (k = 1/t.ln C0/C) sont rapportées dans le Tableau 2.
Expressions des équations cinétiques des réactions.
| Ordre de réaction | Équation cinétique |
| 1 | ln C = lnC0 – kt |
| 2 | 1/C = kt + 1/C0 |
| 3 | 1/C2 = kt + 1/C02 |
Constantes de vitesse des différentes réactions enzymatiques étudiées.
| Solution | k, S−1 | Solution | k, S−1 |
| 0 | 0,00077 | II + III | 0,000154 |
| I | 0,000231 | II + IV | 0,0001359 |
| II | 0,000578 | III + IV | 0,0001925 |
| III | 0,000257 | I + II + III | 0,000154 |
| IV | 0,00021 | I + II + IV | 0,000165 |
| I + II | 0,0004621 | I + III + IV | 0,00021 |
| I + III | 0,0003301 | II + III + IV | 0,000144 |
| I + IV | 0,000165 | I + II + III + IV | 0,0001155 |
2.2.3 Optimisation du processus enzymatique
La vitesse de la réaction est proportionnelle à la variation de la densité optique de la solution et par conséquent, à l’activité de la cholinestérase. Pour donner une évaluation quantitative de l’influence d’une substance ou d’un mélange de substances en cas de synergie d’action sur la vitesse de la réaction, on se sert du plan factoriel complet. La base de l’établissement du modèle est la méthode par l’analyse de régression. Le nombre de combinaisons de niveaux de facteurs détermine le nombre de points expérimentaux du plan et est calculé selon la formule N = 2k où N : le nombre d’expériences, k = le nombre de facteurs, 2 représente le nombre de niveaux de variation de chaque facteur. En se servant du plan factoriel d’expériences, on peut déterminer le coefficient de l’équation de régression en utilisant les trois premiers termes de l’équation suivante [22] :
Y = fonction de réponse (vitesse de réaction) ; k = le nombre de variables d’entrée ; xi = variables (facteurs qui régulent les paramètres de l’équation), b0, b1, bi : coefficients.
Le coefficient de régression est déterminé selon la formule :
Les valeurs calculées des coefficients de régression sont données dans le Tableau 3.
Valeurs calculées des coefficients de régression.
| b0 | 2,671 × 10−04 | b23 | −2,419 × 10−05 |
| b1 | −3,804 × 10−05 | b24 | 1,431 × 10−06 |
| b2 | −2,857 × 10−05 | b34 | 7,076 × 10−05 |
| b3 | −7,249 × 10−05 | b123 | −3,852 × 10−05 |
| b4 | 1,853 × 10−04 | b124 | −2,012 × 10−05 |
| b12 | 2,363 × 10−05 | b134 | −4,519 × 10−05 |
| b13 | 4,581 × 10−05 | b234 | 1,558 × 10−05 |
| b14 | 3,468 × 10−05 | b1234 | 2,351 × 10−05 |
Après calcul, détermination des coefficients et vérification selon les critères de Student et de Fischer, l’équation de régression prend la forme suivante :
Puisque, les valeurs calculées du critère de Fischer ne dépassent pas la valeur tabulée, on considère que le modèle est adéquat. Les données obtenues sont représentées sous forme d’histogramme selon la Fig. 4.
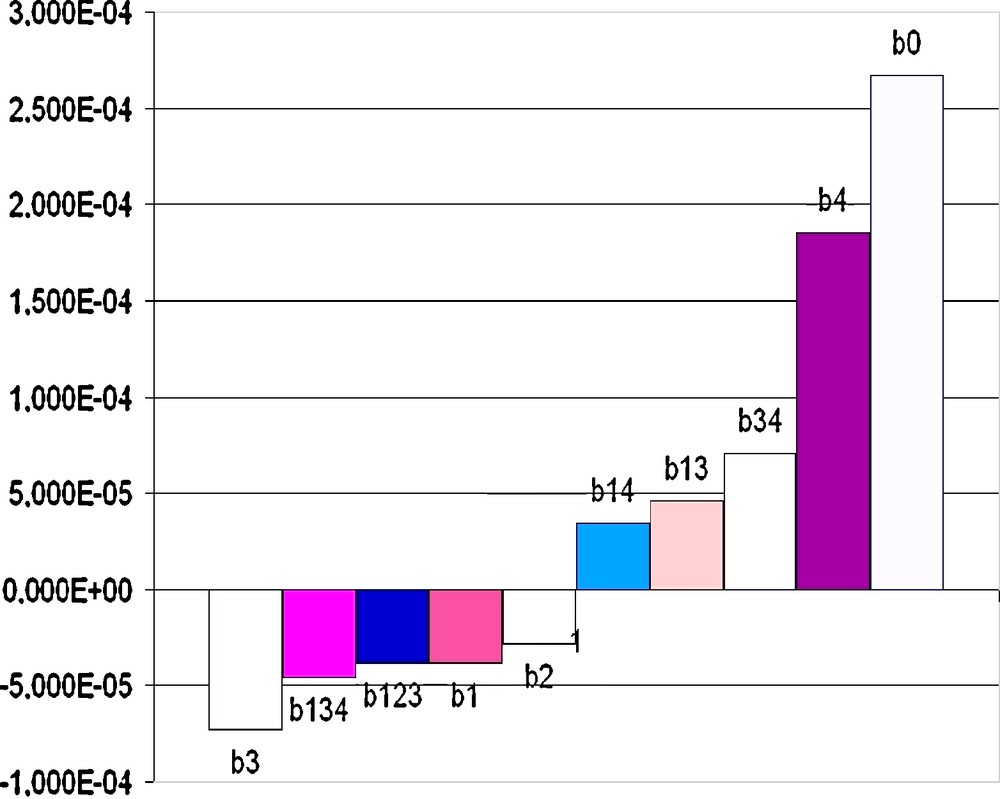
Histogramme de l’estimation de l’équation de régression.
La valeur du coefficient témoigne de l’influence d’un OP ou de plusieurs sur la vitesse de la réaction d’inhibition. Selon les valeurs négatives de certains coefficients, on peut en déduire que le composé correspondant se manifeste comme inhibiteur du processus d’hydrolyse. Ainsi, parmi une série de composés testés, celui qui atténue le plus l’activité de la butyrylcholénistérase est l’amiton. De même, le mélange constitué de l’amiton, du diisopropylméthylphosphate, et du triisopropylphosphite inhibe l’enzyme de façon remarquable.
3 Conclusion
Dans le cadre de ce travail, un certain nombre d’OP ayant différentes activités anticholinestérases ont été testés sur l’enzyme butyrylcholinstérase. Notre contribution a concerné l’adaptation d’un modèle de relation entre la vitesse d’inhibition de l’enzyme et l’influence de l’organophosphoré sur l’activité cholinestérasique.
L’analyse des résultats obtenus à l’aide du plan factoriel, a montré l’adéquation du modèle. L’équation de régression a permis d’estimer l’évolution quantitative de l’influence d’une substance toxique ou de plusieurs en cas de synergie d’action sur la vitesse de la réaction.
La méthode proposée présente l’avantage de pouvoir évaluer rapidement l’activité enzymatique et pourrait servir de base pour d’autres études dans le domaine de la détection des neurotoxiques, par indication biochimique indépendamment de la quantité de la substance.
Remerciements
Ce travail a été réalisé à l’Institut de technologie de Saint Petersburg (Fédération de Russie). Nous exprimons nos remerciements et notre profonde reconnaissance au personnel du laboratoire des composés biologiquement actifs pour son soutien scientifique et au professeur Stanislav Ramch du laboratoire de photochimie et des colorants organiques pour sa contribution matérielle durant la réalisation de ce travail.