Le XIXe siècle a été une période particulièrement féconde pour la chimie grâce aux méthodes analytiques fiables qui ont permis aux chimistes de découvrir et caractériser de nombreux éléments : un symbolisme simple permettait de les représenter tandis qu’une masse particulière leur était attachée, le poids atomique. Ces deux caractéristiques permirent à Jacob Berzélius de proposer, en 1818, une première table de poids atomiques comprenant 47 des 49 substances connues à cette époque [2]. Vers 1850, cette liste s’était enrichie et comportait déjà 63 éléments posant le problème de leur gestion, de la connaissance de leurs propriétés et de leur classification.
Dans la deuxième partie du XIXe siècle, on observe qu’une majorité de chimistes préconisait la recherche de corrélations entre les propriétés des éléments et leurs poids atomiques. Pour mettre de l’ordre dans toutes ces nouvelles notions et répondre aux questions qu’elles suscitaient, un congrès international fut organisé à Karlsruhe en 1860. Parmi les recommandations prises à Karlsruhe on note essentiellement la distinction entre atomes, molécules, et équivalents et l’adoption de la notion d’atomicité (valence) émise en 1852 par Edouard Frankland [3]. Ce dernier avait postulé que chaque élément dispose d’une capacité d’échange avec les autres éléments, ce qu’il appela capacité de saturation ou atomicité. Il s’agissait en fait du concept de valence tel que formulé ensuite, pendant les années 1854–1858, par Friedrich August Kékulé qui avait validé ainsi son intérêt pratique [4].
Dès lors la classification des éléments pouvait être abordée en disposant de deux paramètres : le poids atomique, propriété mesurable des éléments en connexion avec presque toutes leurs propriétés chimiques et physiques, et l’atomicité (ou mieux dit : la valence). A cette époque, la valence était définie pour chaque élément par un chiffre correspondant au nombre maximum d’atomes univalents qui, en l’absence d’autres éléments, se combinent directement avec lui, ou encore comme le nombre de liaisons formées par l’élément considéré, sans que l’on distingue les divers types de liaisons. Le premier chimiste, qui a utilisé ces 2 paramètres dans un essai de classification, fut Lothar Meyer qui, en 1864, composa une table de 28 éléments, rangés par leur valence en 6 familles, table qu’il compléta en 1868 (mais qui ne fut publiée qu’en 1870) où les éléments ayant la même valence sont dans des colonnes où ils apparaissent classés en fonction de leurs poids atomiques. Il a constaté que si, entre autres propriétés, les volumes atomiques des éléments étaient tracés en fonction de leurs poids atomiques, une série de pics était produite correspondant à une périodicité des relations entre ces deux familles de paramètres [5].
Mais le mérite d’avoir réalisé le premier tableau périodique revient à Dmitri Mendeleïev dont la table, parue dès 1869, rassemble tous les éléments connus à cette époque (soit 63) ordonnés par poids atomique croissant et rangés en lignes horizontales ; les éléments ayant des propriétés voisines étant placés, en respectant les périodicités observées dans ces propriétés, dans des colonnes où ils partagent aussi la valence [6]. Cette présentation avait différents mérites, en particulier celui de corriger les valeurs de quelques poids atomiques et de prévoir l’existence d’éléments non encore découverts. Pour des pédagogues cette présentation constituait un progrès considérable dans la façon d’enseigner la chimie.
La classification de Mendeleïev n’a pas reçu de la part des chimistes français l’accueil qu’elle méritait ! C’est presque avec indifférence qu’elle fut accueillie, considérée comme une tentative supplémentaire d’établir une bonne classification pour l’enseignement de la discipline [7, 8]. Cela devait durer longtemps puisque l’enseignement secondaire dut attendre 1978 pour la voir enfin inscrite, timidement, dans les programmes pédagogiques en chimie, et enfin les nouveaux programmes de 1992 (B.O. du 24 septembre 1992) pour qu’une vraie démarche pédagogique lui soit consacrée [9].
Pourtant tout au long du XIXe siècle, alors que l’enseignement de la chimie se développait il est bien établi que les objectifs didactiques ont favorisé la recherche d’une classification des substances chimiques. Ainsi Mendeleïev cherche un moyen d’enseigner à ses élèves les éléments connus à cette époque, mais …il n’a jamais révisé en ce sens son livre « Les principes de la chimie » ! Wurtz qui avait affirmé que « la théorie atomique et la classification de MendeleÏev se renforçaient mutuellement », utilisait toujours, en 1879, la vieille classification en métaux, métalloïdes et composés organiques. Heureusement quelques chimistes, dont les élèves de Wurtz, Edouard Grimaux, Armand Gautier, Edmond Wilm, et Maurice Hanriot, qui ont été les premiers à utiliser la classification de Mendeleiev, n’épargnèrent pas leurs efforts pour l’introduire dans le système éducatif français.
Il est vraisemblable que cette situation trouve en partie son origine dans le déroulement de la bataille que se livraient les équivalentistes et les atomistes. Victor Grignard, prix Nobel de chimie en 1912, rapporta qu’il lui fut impossible, pendant ses études, d’obtenir des renseignements sur la notation atomique. Paul Sabatier, qui partagea le prix Nobel de chimie 1912 avec Grignard, critiqua violemment le monopole de l’enseignement des équivalents dans l’enseignement supérieur.
Dans la deuxième partie du XIXe siècle les chimistes français étaient divisés quant à la façon de représenter la nature des corps composés et celle de leur structure à l’aide des symboles appropriés [10]. La plupart des chimistes répondaient différemment à la question : à quel rapport proportionnel fallait-il donner la préférence dans les formules, aux rapports en poids, conduisant à la notation en équivalents, ou aux rapports en volume, conduisant à la notation atomique ? Parmi ceux qui étaient favorables à la notation atomique on trouve : Wurtz, Friedel, Naquet, Armand Gautier, Schutzenberger, etc…, tandis que Berthelot, Sainte Claire Deville, Troost et Jungfleisch étaient à la tête des partisans de la théorie des équivalents !
Paul Sabatier, nommé dans la chaire de chimie de la Faculté des Sciences de Toulouse dès 1884, en remplacement d’Edouard Filhol, dispensait un enseignement moderne, adoptant la théorie atomique et abandonnant la notation des équivalents chimiques que Berthelot l’avait obligé à retenir pour rédiger sa thèse. Il utilisait la classification périodique de Mendeleïev et publia, dès 1890, un mémoire dans les Annales de la faculté des sciences de Toulouse intitulé « Sur la classification des corps simples par la loi périodique ». Pour lui, cette loi devait être la base de toute classification naturelle en chimie et il l’introduisit dès 1890–1895 dans ses leçons de chimie minérale où elle constituait le canevas de son cours. A partir de cette date Berthelot cessa de présenter ses notes à l’Académie des sciences [11].
⁂
Dans le mémoire de 1890, Paul Sabatier rappelle que Mendeleïev et Lothar Meyer ont montré « que les diverses propriétés des corps simples sont des fonctions périodiques de leurs poids atomiques ». Si on choisit le mode de représentation graphique, en prenant pour abscisses les poids atomiques, on obtient des courbes très variées mais ayant toutes la forme oscillatoire caractérisée par une succession de maxima et de minima, changeant d’une courbe à l’autre, « les différences d’amplitude des oscillations conduisent à la notion de grandes et petites périodes ».
Courbes des densités
La configuration graphique la plus usitée dans l’enseignement pour représenter la loi des périodicités est celle de la représentation graphique des volumes atomiques en fonction des poids atomiques (courbe dite de Lothar Meyer). Paul Sabatier préfère utiliser la courbe des poids spécifiques qui conduit à des résultats plus marqués, avec des variations analogues mais inverse de celle des volumes atomiques « les maxima de ces derniers se trouvant être précisément les minima de la courbe des densités » (Figure 1).
Variation des poids spécifiques en fonction des poids atomiques des éléments.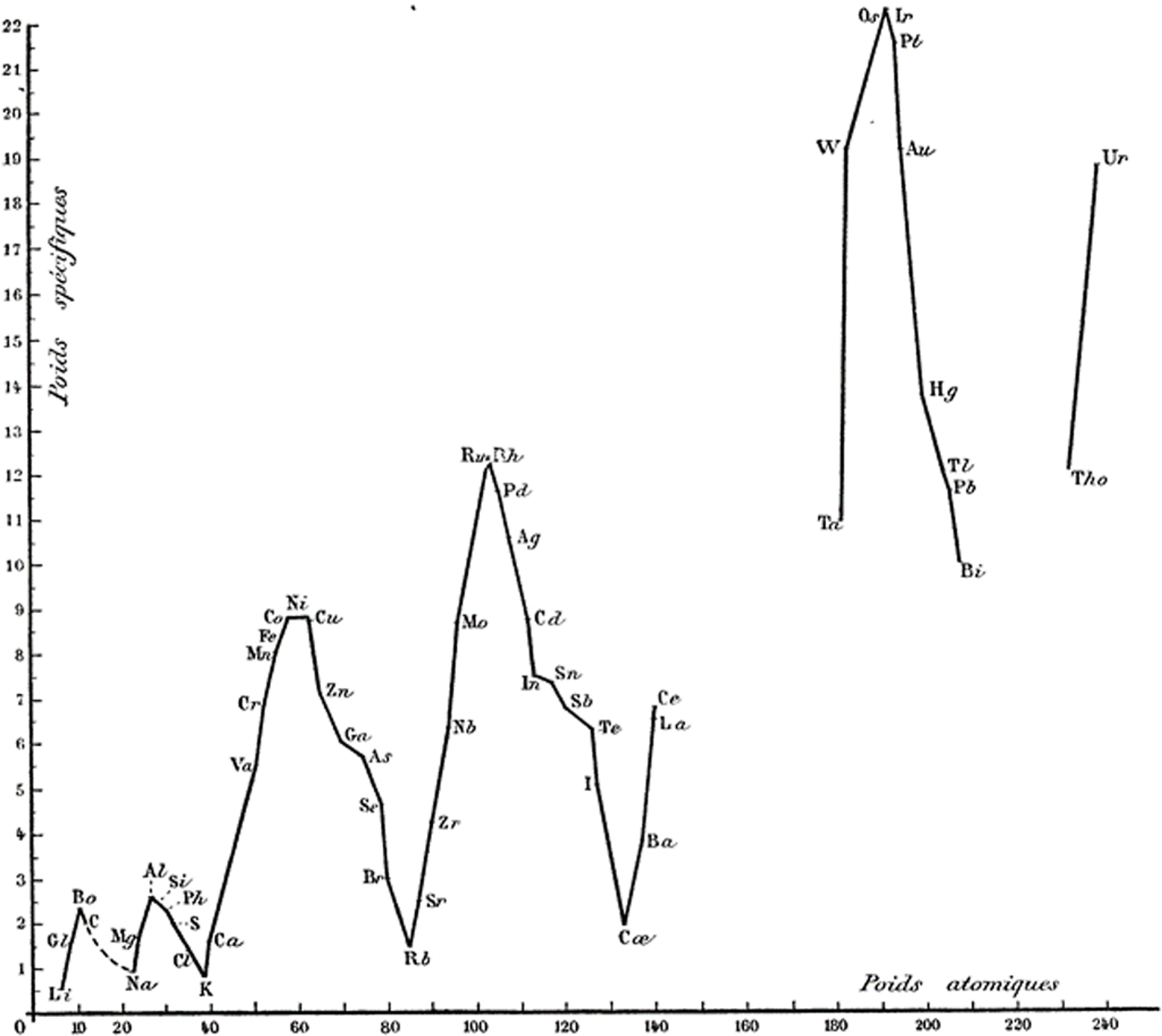
L’analyse de la courbe (Figure 1, page B2 de l’article de Sabatier) montre :
- que les minima sont occupés par les métaux alcalins,
- que les éléments suivants : B, Al, Ni, Cu, Ru, Os, occupent les maxima
L’auteur justifie aussi les relations avec l’ensemble des deux branches isolées à droite, aux ordonnées les plus grandes, par l’existence, probable, dans les lacunes, d’un minimum et d’un maximum pour la première et d’un minimum pour la seconde.
Principes de la classification
Après avoir indiqué qu’il se sert de la classification périodique dans ses leçons, dont les avantages sont appréciés par les étudiants « qui acceptent beaucoup mieux la monographie des éléments ainsi groupés d’une manière rationnelle et un peu inattendue » il dévoile les bases qu’il a choisies pour établir cette classification « et la rendre visible dans son ensemble par une construction graphique très simple ».
Sabatier choisit pour chaque corps simple sa valence maxima par rapport à l’hydrogène ou par rapport à des résidus hydrocarbonés monovalents (CnH2n+1) ou encore par rapport à l’oxygène. Les tableaux suivants (Tableaux 1, 2 et 3) illustrent ce qui précède : les valences maxima des divers éléments sont indiquées par rapport aux trois références retenues. A cela il a ajouté une dernière colonne où il inscrit les valences maxima par rapport au chlore en le considérant seul ou en relation avec des résidus hydrocarbonés.
Les notes en bas des tableaux sont très intéressantes en ce sens qu’il s’agit, en utilisant les nomenclatures et connaissances de l’époque, de discussions sur les valeurs rapportées, justifiées à partir des structures chimiques des composés, admises ou adoptées par l’auteur après inventaires des diverses possibilités structurales. Retenons à titre d’exemple :
- la trivalence de l’aluminium, « mieux établie par le travail de Combes, qui a obtenu le corps Al(CH3COCH2COCH3)3, qui bout à 315° sans décomposition (densité trouvée, 8,43 ; calculée, 8,47) ». Puis, abandonnant la tétravalence de ce même élément, telle que déduite de la formule Al2Cl6 à température peu élevée, en constatant que « la densité de vapeur diminue quand la température s’élève, et ne se fixe que lorsqu’elle correspond au poids moléculaire réel AlCl3 ».
- les discussions concernant les composés semblables aux sels d’ammonium quaternaires, par exemple avec l’antimoine et l’arsenic.
Toujours avec les notes en bas de tableau, retenons les précisions de Paul Sabatier relatives aux éléments qu’il cite et dont il donne à la fois le nom des découvreurs en rappelant que Mendeleïev les avait prévus :
(page B7 de l’article original de Sabatier) : Représentation graphique des valeurs des valences maxima V0 des éléments par rapport à l’Oxygène, en fonction des poids atomiques.
- le Scandium, découvert par Nilson en 1879, prévu par Mendeleïev ;
- le Germanium, découvert par Winkler en 1885, prévu par Mendeleïev.
Valences maxima par rapport à l’Oxygène
La représentation graphique des valeurs des valences maxima V0 des éléments par rapport à l’Oxygène, en fonction des poids atomiques, met en évidence des variations périodiques très régulières, comme le montre la partie supérieure de la Figure 2. En réunissant les points on obtient une courbe continue qui se compose de dix branches ou fractions de branches à peu près parallèles.
Les deux premières fractions de branches, Li–Az (N) et Na–Cl sont isolées, et correspondent aux deux premières dentelures de la courbe des densités, alors que les branches suivantes semblent réunies deux à deux par l’intermédiaire de branches secondaires. En comparant toujours à la courbe des densités on constate des correspondances avec les grandes périodes qui suivent.
La seule irrégularité apparait avec les métaux très rares compris entre le cérium et le tantale. Une explication à ce phénomène réside, comme Sabatier le signale, dans le fait que plusieurs de ces métaux seraient « des mélanges de deux métaux ayant des poids atomiques extrêmes ». Cette explication est confortée par le fait que :
- le didyme est un mélange de praséodyme et de néodyme, séparés en 1885 par Carl Auer Freiherr Von Weisbach,
- et le décipium, un mélange de samarium et d’autres éléments des terres rares, caractérisé en 1879 par Lecoq de Boisbaudran.
(Page B.4 de l’article original de Sabatier.) Valences maxima des éléments de poids atomiques compris entre 7 et 51
| Corps simples. | Poids atomique. | Grandeur de la valence maxima vis-à-vis de | |||
|---|---|---|---|---|---|
| H. | Résidu hydrocarboné. | O. | Cl seul ou avec résidu hydrocarboné. | ||
| Lithium… | 7 | » | 1 | 1 | 1 |
| Glucinium… | 9 | » | 2 | 2 | 2 |
| Bore… | 11 | » | 3 | 3 | 3 |
| Carbone… | 12 | 4 | 4 | 4 | 4 |
| Azote(1)… | 14 | 3 | 3 | 5 | 5 |
| Oxygène… | 16 | 2 | » | » | |
| Fluor… | 19 | 1 | » | » | |
| Sodium… | 23 | » | 1 | 1 | 1 |
| Magnésium… | 24 | » | 2 | 2 | 2 |
| Aluminium… | 27 | » | 3(2) | 3 | 3(3) |
| Silicium… | 28 | 4 | 4 | 4 | 4 |
| Phosphore… | 31 | 3 | 3(4) | 5 | 5 |
| Soufre… | 32 | 2 | 2(5) | 6 | 4 |
| Chlore… | 35,5 | 1 | 1 | 7 | » |
| Potassium… | 39 | » | 1 | 1 | 1 |
| Calcium… | 40 | » | » | 2 | 2 |
| Scandium(6)… | 44 | » | » | 3 | 3 |
| Titane… | 48 | » | » | 4 | 4 |
| Vanadium… | 51 | » | » | 5 | 5 |
(1) Avec le chlore seul, on ne dépasse pas AzCl3, non plus qu’avec H seul, ou avec des résidus forméniques, on ne peut aller au delà de AzR3, mais on obtient normalement les composés AzR4Cl. (2) La molécule de l’aluminium-méthyle est bien Al(CH3)3 d’après Quincke. La trivalence a été encore mieux établie par le travail de Combes (Bulletin de la Société chimique, t. I, 1889), qui a obtenu le corps Al(CH2–CO–CH2–CO–CH3)3 qui bout à 315° sans décomposition (densité trouvée, 8,43; calculée, 8,47). (3) La molécule du chlorure d’aluminium est à température peu élevée représentée par Al2Cl6, ce qui conduirait à la tétravalence; mais la densité de vapeur diminue quand la température s’élève, et ne se fixe que lorsqu’elle correspond au poids moléculaire réel AlCl3. (4) On ne peut dépasser PhR3; mais on peut avoir des corps du type PhR4I. (5) Avec les résidus hydrocarbonés employés seuls, on ne peut aller au delà du type R2S, comme le sulfure d’éthyle (C2H5)2S, mais on peut préparer des corps mixtes du type R3IS. (6) Métal découvert par Nilson en 1879, et prévu antérieurement par Mendeleeff.
(Page B.5 de l’article original de Sabatier.) Valences maxima des éléments de poids atomiques compris entre 52 et 126
| Corps simples. | Poids atomique. | Grandeur de la valence maxima vis-à-vis de | |||
|---|---|---|---|---|---|
| H. | Résidu hydrocarboné. | O. | Cl seul ou avec résidu hydrocarboné. | ||
| Chrome… | 52,5 | » | 2(1) | 6 | 4 |
| Manganèse… | 55 | » | » | 7 | 4 |
| Fer… | 56 | » | » | 6 | 4 |
| Cobalt… | 56 | » | » | 6 | 4 |
| Nickel… | 58,5 | » | » | 4 | 2 |
| Cuivre(2)… | 63 | » | 1(1) | 1–2 | 1–2 |
| Zinc… | 65 | » | 2 | 2 | 2 |
| Gallium… | 70 | » | 3 | 3 | 3 |
| Germanium(3)… | 72 | » | 4 | 4 | 4 |
| Arsenic… | 75 | 3 | 3(4) | 5 | 5(5) |
| Sélénium… | 79 | 2 | 2 | 6 | 4(6) |
| Brome… | 80 | 1 | 1 | 7 | 3 |
| Rubidium… | 85 | » | 1 | 1 | 1 |
| Strontium… | 87 | » | » | 2 | 2 |
| Yttrium… | 89 | » | » | 3 | 3 |
| Zirconium… | 90 | » | » | 4 | 4 |
| Niobium… | 94 | » | » | 5 | 5 |
| Molybdène… | 96 | » | » | 6 | 5 |
| Ruthénium… | 103,5 | » | » | 8 | 4 |
| Rhodium… | 104 | » | » | 6 | 4 |
| Palladium… | 106 | » | » | 4 | 4 |
| Argent… | 108 | » | 1(7) | 1 | 1 |
| Cadmium… | 112 | » | 2 | 2 | 2 |
| Indium… | 113 | » | 3 | 3 | 3 |
| Étain… | 117 | » | 4 | 4 | 4 |
| Antimoine… | 120 | 3 | 3(8) | 5 | 5 |
| Tellure… | 126 | 2 | 2 | 6 | 4(9) |
(1) Dans les combinaisons avec les carbures acétyléniques. (2) Le cuivre donne deux séries complètes de composés, les uns dus à la monovalence, les autres à la bivalence. (3) Métal découvert par Winkler en 1885, prévu par Mendeleeff. (4) On aurait pu obtenir également le composé (CH3)5As, mais ce résultat est contestable, le corps obtenu ne pouvant être volatilisé sans décomposition. Normalement on ne dépasse pas AsR3, mais avec les halogènes on peut préparer des produits du type AsR4I ou AsRCl4. (5) Avec le chlore seul on ne dépasse pas AsCl3. (6) On a préparé SeCl4 et aussi Se(C2H5)2Cl2, et analogues, mais avec les résidus forméniques seuls, on n’a pu dépasser le type SeR2. (7) Dans les combinaisons acétyléniques. (8) Normalement, on ne dépasse pas SbR3, mais on peut préparer des corps du type SbR4Cl. (9) On a préparé TeCl4 et aussi Te(C2H5)2Cl2 et Te(CH3)3I; mais avec les résidus forméniques seuls on ne dépasse pas TeR2.
(Page B.6 de l’article original de Sabatier.) Valences maxima des éléments de poids atomiques compris entre 127 et 240
| Corps simples. | Poids atomique. | Grandeur de la valence maxima vis-à-vis de | |||
|---|---|---|---|---|---|
| H. | Résidu hydrocarboné. | O. | Cl seul ou avec résidu hydrocarboné. | ||
| Iode… | 127 | 1 | 1 | 7 | 3(1) |
| Cœsium… | 133 | » | 1 | 1 | 1 |
| Baryum… | 137 | » | » | 2 | 2 |
| Lanthane… | 138 | » | » | 3 | 3 |
| Cérium(2)… | 140 | » | » | 4 | 3 |
| Didyme… | 142 | » | » | 3 | 3 |
| Samarium… | 150 | » | » | 3 | 3 |
| Holmium… | 160? | » | » | 3 | 3 |
| Terbium… | 163? | » | » | 3 | 3 |
| Erbium… | 166 | » | » | 3 | 3 |
| Décipium… | 170 | » | » | 3 | 3 |
| Ytterbium… | 172 | » | » | 3 | 3 |
| Tantale… | 182 | » | » | 5 | 5 |
| Tungstène… | 184 | » | » | 6 | 6(3) |
| Osmium… | 195 | » | » | 8(4) | 6 |
| Iridium… | 195 | » | » | 6 | 4 |
| Platine… | 195 | » | » | 4 | 4 |
| Or(5)… | 196 | » | 1(6) | 1–3 | 1–3 |
| Mercure(7)… | 200 | » | 2 | 1–2 | 1–2 |
| Thallium(8)… | 204 | » | 3 | 1–3 | 1–3 |
| Plomb(9)… | 206 | » | 4(10) | 2–4 | 2–4 |
| Bismuth… | 208 | » | 3 | 5 | 3 |
| Thorium… | 232 | » | » | 4 | 4 |
| Urane… | 240 | » | » | 6 | 6 |
(1) Dans le trichlorure d’iode. (2) Le cérium forme deux séries de composés : les uns dus à la tétravalence, les autres dus à la trivalence; ces derniers sont analogues des composés des divers métaux de la gadolinite. (3) La densité de vapeur du perchlorure de tungstène indique le poids moléculaire WCl6. On n’a obtenu aucune combinaison avec des résidus forméniques seuls, mais on a préparé (CH3)4WCl2. (4) La densité de vapeur de l’anhydride osmique correspond bien au poids moléculaire OsO4. (5) L’or donne deux séries distinctes de composés : les aureux dus à la monovalence, les auriques dus à la trivalence. (6) Dans les combinaisons acétyléniques. (7) Le mercure donne deux séries de composés dus à la monovalence et à la bivalence. (8) Les composés thalleux sont dus à la monovalence et ressemblent beaucoup aux composés des alcalis monovalents. Les combinaisons thalliques sont issues de la trivalence. (9) La plupart des sels de plomb proviennent de sa bivalence. (10) Dans le plomb tétraméthyle (CH3)4Pb, qui bout à 110° et le plomb tétréthyle (C2H5)4Pb qui bout à 200°.
Valences par rapport à l’hydrogène et aux résidus hydrocarbonés
Une relation peut être trouvée pour un petit nombre d’éléments dont on peut établir la valence relative par rapport à l’hydrogène :
Avec les résidus hydrocarbonés, la possibilité d’obtenir des combinaisons volatiles sans décomposition permet de fixer la valence de l’élément (Exemple Tableau 1 : l’Aluminium).
Quand l’hydrure existe aussi, la valence VR par rapport aux résidus hydrocarbonés est égale à la valence par rapport à l’hydrogène :
Valences maxima par rapport aux halogènes
Deux situations se présentent suivant la valeur de Vo des éléments :
- Vo < ou = 4 alors : VCl = Vo = VR et la valence a une valeur constante. (Exemple Tableau 2 : le Gallium)
- Vo > 4 VCl est intermédiaire entre Vo et VR (Ex. : Tableau 2 : le Chrome), ou bien égal à Vo (Ex. : Tableau 2 : l’antimoine)
Dans les combinaisons mixtes contenant à la fois du chlore et des résidus hydrocarbonés monovalents, la valence des éléments est égale à ce qu’elle est pour le chlore seul.
Représentation graphique
La Figure 2 est complétée par la représentation, à côté des valences Vo des valeurs des valences VR mais portées en ordonnées négatives (partie basse de la courbe). On forme alors 5 dentelures régulières qui mettent bien en évidence l’inégalité des branches de la variation de Vo :
- dans une première catégorie, il correspond à ces dernières une branche de VR ; on observe ici des séries pour lesquelles le caractère électronégatif, nul au début (cas des métaux alcalins) « s’introduit progressivement [….] et devient très élevé dans les derniers corps qui présentent au plus haut degré les caractères métalloïdiques » Cette première catégorie comprend tous les éléments désignés sous le nom de métalloïdes, qui sont les seuls à donner des combinaisons gazeuses à la température ordinaire et qui forment un groupe homogène.
- dans la deuxième catégorie, on trouve les corps pour lesquels il n’y a pas de correspondance entre les courbes Vo et VR ; ici le caractère reste constamment métallique et électropositif à l’exception des corps de valences élevées qui donnent lieu à des peroxydes de fonction électronégative très marquée.
Classification en familles naturelles
Tout ce qui précède nous amène donc à diviser les corps simples en deux grands groupes formés chacun de plusieurs séries. Dans ces séries, à l’intérieur d’un même groupe, on constate une relation entre la variation de la valence et celles des propriétés physiques et chimiques. On peut en déduire que les corps de même valence dans les diverses séries d’un même groupe seront analogues dans l’ensemble de leurs caractères.
On peut former ainsi des familles naturelles « en rapprochant des corps qui occupent des points semblables de branches semblables » (Tableau 4), d’où (en donnant à l’hydrogène une place spéciale) la succession suivante de familles naturelles :
(Page B.12 de l’article original de Sabatier.) Succession des familles naturelles des éléments
| Rang. | Familles. | Caractères électrochimiques. | VR. | Vo. | Valences simultanées importantes par rapport à O. |
|---|---|---|---|---|---|
| 1 | H… | Électropositif… | 1 | 1 | » |
| 2 | Fl, Cl, Br, I… | Très électronégatifs… | 1 | 7 | 5 |
| 3 | O, S, Se, Te… | Très électronégatifs… | 2 | 6 | 4 |
| 4 | Az, Ph, As, Sb, Bi… | Électronégatifs… | 3 | 5 | 3 |
| 5 | C, Si, Ge, Sn, Ph… | Peroxydes électronégatifs… | 4 | 4 | 2 |
| 6 | Bo, Al, Ga, In, Tl… | Caractère mixte, plutôt électropositif (sauf pour Bo)… | 3 | 3 | 1 pour Tl. |
| 7 | Gl, Mg, Zn, Cd, Hg… | Électropositifs avec caractère mixte… | 2 | 2 | 1 pour Hg. |
| 8 | Li. Na, K, Rb, Cœ… | Très électropositifs… | 1 | 1 | |
| 9 | Ca, St, Ba… | Id… | » | 2 | |
| 10 | Sc, Yt, La, Di et autres métaux de la gadolinite… | Électropositifs… | » | 3 | |
| 11 | Ti, Zr, Ce, Th… | Caractère mixte… | » | 4 | 3 pour Ce. |
| 12 | Va, Nb, Ta… | Id… | » | 5 | |
| 13 | Cr, Mo, Tu… | Caractère mixte (peroxydes très électonégatifs)… | » | 6 | 2 et 3 pour Cr. |
| 14 | Mn, Fe, Ce, Ni, (Cu)… | Électropositifs… | » | » | |
| 15 | Ru, Rh, Pd… | Caractère mixte… | » | » | |
| 16 | Os, Ir, Pt, (Au)… | Id… | » | » | |
| 17 | Cu, Ag. Au… | Électropositifs… | 1 | » | |
Les familles 14, 15, 16 sont formées de corps très semblables entre eux.
Les 3 éléments de transition, cuivre, argent, or forment la famille 17.
Tous les métalloïdes forment les 3 premières familles.
Plusieurs familles avaient déjà été formées (exemple : familles 2, 3, 4, 8, 9, 14), mais on voit aussi figurer des corps considérés comme très dissemblables !
« La classification nouvelle a obligé à des rapprochements inattendus, et a ainsi révélé des similitudes qu’on n’avait pas soupçonnées. Elle n’est certainement pas parfaite ; mais telle qu’elle est, elle nous semble néanmoins meilleure que les classifications semi-naturelles, semi-artificielles, dont l’usage a prévalu jusqu’à présent ».
Lacunes du tableau des corps simples
Trois corps nouveaux ont été découverts depuis l’époque où Mendeleïev a énoncé le principe de périodicité, corps qui ont occupé certaines des places libres du tableau, confirmant les prévisions du savant russe. Au scandium et au germanium, déjà cités, s’est également ajouté le gallium trouvé par M. Lecoq de Boisbaudran en 1875. Pour Paul Sabatier, les vides qui subsistent encore devraient aussi être comblés, ainsi :
- entre le cérium et le tantale, la périodicité des courbes permet d’envisager l’existence d’une période complète de dix-sept éléments inconnus (figurée en pointillés dans la Figure 2). Bien qu’il existe dans cet intervalle la pléiade « plus ou moins réelle » (!) des métaux issus des terres rares, ces métaux très semblables entre eux, « ne pourraient visiblement s’adapter au trajet d’une grande période »… et Sabatier de conclure « L’avenir seul nous renseignera sur ce point » .
- et, de façon plus générale, il ajoute : « Il y aurait sans doute deux éléments semblables au manganèse, c’est-à-dire heptavalents par rapport à l’oxygène, dont les poids atomiques seraient voisins de 100 et de 190. Entre le bismuth et l’urane, il manque un corps de la famille du soufre (212) (le polonium (209) découvert en 1898), du chlore (215) (l’astate (210) découvert en 1940), du potassium (222) (le francium (223), découvert en 1939), du calcium (226) (le radium (226), découvert en 1898), du scandium (228) (sans doute l’actinium (227) découvert en 1899), du vanadium (235) (sans doute un élément de la famille des actinides).
Conclusions de l’article
« La variation périodique des propriétés des corps simples est certainement un puissant argument en faveur d’une matière unique diversement condensée ; elle indiquerait seulement que cette condensation a lieu selon une oscillation assez régulière. Nous n’apercevons pas pourquoi, s’il en est ainsi, cette régularité n’est pas parfaite. Néanmoins, telle qu’elle est, avec ses imperfections et ses obscurités, la loi périodique ne saurait être négligée, et elle nous parait devoir être la base de toute classification rationnelle des éléments »



 CC-BY 4.0
CC-BY 4.0