Abridged English version
1 Introduction
Silicon is the most common element of the lithosphere after oxygen. The dissolved silicon in rivers can be useful to quantify chemical weathering rates. However, values can be misinterpreted if the role of biota, and particularly plants are neglected. The aim of this review is to point out the role of plants in the silicon transfer from the continents to the ocean at time scales at which environmental changes affecting sustainable development are concerned.
2 Silicon in plants
Silicon is generally considered as a non-essential element for the biota because no SiOC or SiC bonds have been demonstrated so far. Silicon is yet beneficial for the growth of many plants because it has many important effects in relation to biotic and abiotic stresses (Fig. 1). The amount of silicon accumulated in plants is highly variable and is a function of plant species and soil type (Table 1).
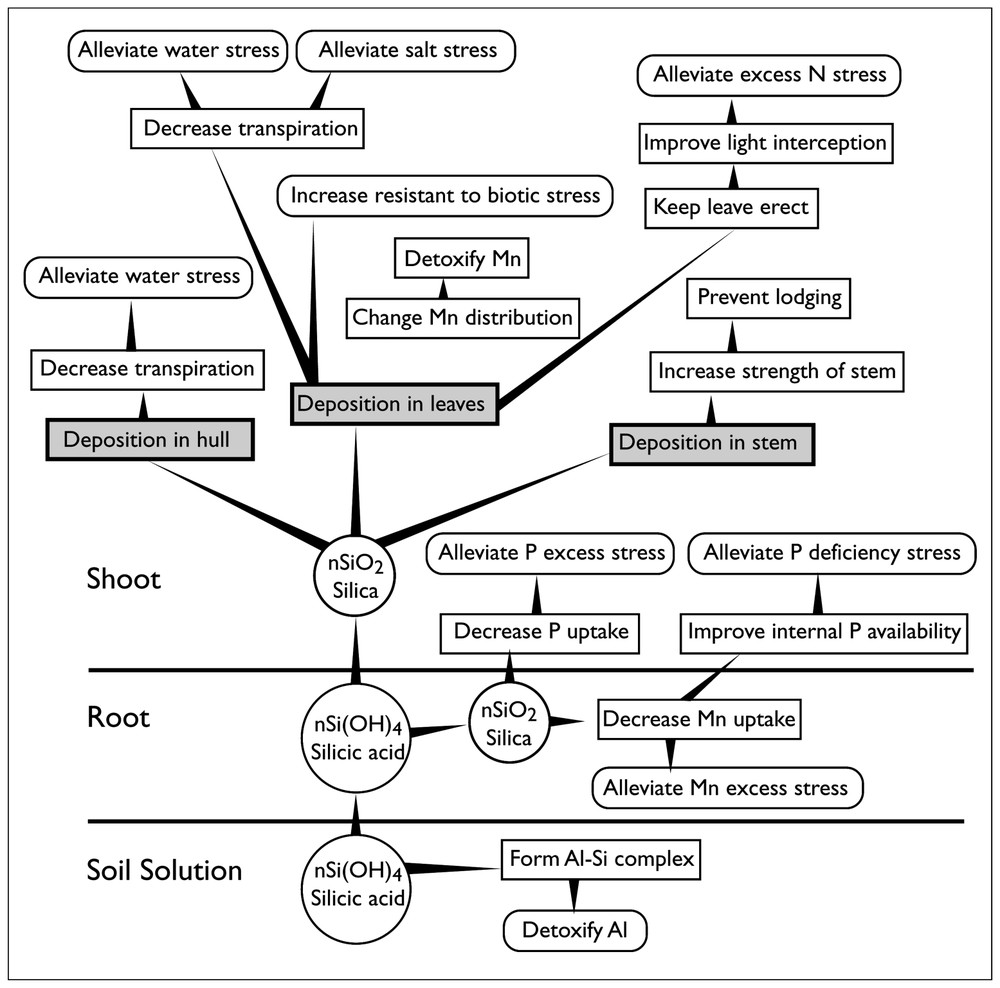
Rôles du silicium dans les plantes [33].
Roles of silicon in plants [33].
Proportion de Si et d'autres éléments dans quelques compartiments de la surface de la terre [15,18]
Abundance of silicon and of other elements of some compartments in the Earth's surface [15,18]
| Element | Lithosphere (%) | Biota (%) | Crop plants (%) |
| Si | 27,7 | 0,03 | 0,1–10 |
| O | 47,4 | 24,9 | – |
| H | 1,5 | 49,8 | – |
| C | 0,48 | 24,9 | – |
| N | 0,03 | 0,27 | 0,5–6 |
| Ca | 4,1 | 0,07 | 0,1–6 |
| K | 2,1 | 0,05 | 0,8–8 |
| Mg | 2,3 | 0,03 | 0,05–1 |
| P | 1,0 | 0,03 | 0,15–0,5 |
| S | 0,26 | 0,17 | 0,1–1,5 |
| Al | 8,2 | 0,02 | 0,00001–0,05 |
The experiments of Lovering and Angel [29,30] about 40 years ago demonstrated that Si accumulated in plants may be significant enough to affect the weathering processes and soil formation. Man activity, through the intensive cropping of Si accumulative plants (e.g., sugar cane) is also responsible for a significant decrease of Si in soils within a few decades.
Most of the silicon in the plants forms opal-A particles called phytoliths. The role of phytoliths and soil silicates as a source of dissolved silicon in soil solutions can be estimated using a steady-state approach of the biogeochemical cycle of silicon. For example, in the rain forest ecosystem of Congo (Brazzaville), Alexandre et al. [1] showed that 74% of the dissolved silica in the soil solution originated from the dissolution of phytoliths.
3 Biogenic silicon in soils
In soils, biogenic silica particles are frequent. They are mostly represented by phytoliths, which are far more common than diatoms and sponges spicules. Phytolith particles do not weather at the same rates. If the production of phytoliths is higher than their dissolution rates, they may accumulate in soil. Such a case is described on the volcanic island of La Réunion (Indian Ocean), where a 15-cm-thick phytolith horizon has been favoured by the presence of Si-accumulating bamboos and easily available Si from trachytic ashes [37]. Natural and anthropogenic (ground cleaning) fires are also a factor that increases the release and concentration of phytoliths in soils.
The biogenic silica also plays a role in the neoformation of soil minerals. Lucas et al. [32] show that the input of silica released by plants in the topsoils is responsible for the neoformation of kaolinite in Brazilian latosols. The role of phytoliths in other formations such as silcrete is not yet evidenced.
4 Biogenic silica in streams
Riverine dissolved silica is the major source of nutrients for marine diatoms that plays a major role (1) in the ocean biology and (2) in the control of CO2 level. Several authors have recently shown that the flux of dissolved silicon follows a decreasing trend in some rivers equipped with dams. According to Humborg et al. [24], the decrease of silica is linked to a lower rate of chemical erosion after immersion of vegetated areas. The statement that plants increase the chemical weathering rates by a factor of 2 to 8 has been demonstrated in several watershed studies. Several mechanisms can explain the role of plants in increasing weathering rates: (1) the increase of acidity around roots and below the litter, which favours the hydrolysis of silicates and the liberation of chemical elements in soils; (2) the release of silicon from the decomposing organic matter is more rapid than the chemical alteration of soil and parent rock minerals. In order to determine whether the dissolved silica has a biogenic (phytoliths) or non-biogenic (soil minerals) origin, several tracers are currently developed. The first one uses the stable isotopes of silicon and the second one uses the Ge/Si ratios. For instance, Derry et al. [11] have used Ge/Si for tracing the silica in volcanic soils of Hawaii. They show that dissolved silicon in some waters is controlled by phytoliths rather than primary minerals.
1 Introduction
Le silicium représente, après l'oxygène, l'élément le plus abondant de la lithosphère. Dans le cycle biogéochimique du silicium [38], les mécanismes d'altération des silicates fournissent le silicium dans les eaux du sol, puis des rivières pour alimenter les océans [47]. Les teneurs en silicium dissous mesurées dans les cours d'eaux peuvent être utilisées pour quantifier les taux d'altération chimique. Cependant, les mesures peuvent être mal interprétées si l'on ne tient pas compte du biota, en particulier des plantes. Or, dans le cycle biogéochimique terrestre du silicium, le rôle des plantes est encore mal quantifié. Cette revue a pour objectif de montrer le rôle des plantes dans les transferts du silicium des continents jusqu'aux océans, aux échelles de temps concernant les changements qui interviennent dans les problématiques liées au développement durable (101 à 104 ans).
2 Le silicium dans les plantes
Contrairement à la lithosphère, le silicium ne constitue pas un élément majoritaire dans le biota, à quelques exceptions près (certaines algues comme les diatomées et les Equisetaceae). Le silicium est souvent considéré comme un élément non essentiel pour le biota, car aucune liaison de type SiOC ou SiC n'a été observée jusqu'à présent [18]. Cette notion d'essentialité est néanmoins contestée [15,16], car le silicium est souvent bénéfique pour la croissance de nombreuses plantes [33]. La Fig. 1 montre les effets bénéfiques sur des plantes soumises à différents stress. Les interactions entre le silicium et d'autres éléments comme l'aluminium, le manganèse, le phosphore ou l'azote sont nombreuses. En particulier, le silicium des solutions du sol peut jouer le rôle de désintoxication vis-à-vis de l'aluminium dans le cas d'écosystèmes soumis aux pluies acides.
Dans les plantes terrestres, les teneurs en silicium sont supérieures à la moyenne établie pour la biosphère (Tableau 1). La teneur en silicium varie d'un facteur 100 en fonction du type de plantes et du milieu de croissance. Les valeurs de Si mesurées sont équivalentes à celles de certains macro-nutriments comme le calcium, le magnésium ou le phosphore. Ma et al. [33] ont analysé les teneurs en Si de 147 espèces d'angiospermes qu'ils ont fait croı̂tre sur un sol de même nature. Les résultats montrent que les plantes ont un comportement spécifique vis-à-vis de Si. Les plantes contenant plus de 1 % de Si sont considérées comme accumulatrices.
Une partie des éléments pompés par les plantes est stockée dans la biomasse, alors qu'une autre partie est réinjectée dans le sol par les retombées annuelles de débris morts. Les travaux de Lovering et Engel [29,30] ont montré que les quantités de Si mobilisées par les plantes peuvent jouer un rôle important dans les processus d'altération et de formation des sols :
A forest of silica-accumulator plants averaging 2.5 per cent of silica and 16 tons dry weight new growth per year would extract about 2000 tons of silica per acre in 5000 years-equivalent to the silica in 1 acre foot of basalt[29].
La productivité en Si en fonction des écosystèmes n'est pas une relation bien établie, car les études de biomasse et de litières prenant en compte le Si sont encore trop peu nombreuses. La productivité annuelle des principaux écosystèmes à la surface des continents est intimement liée aux conditions climatiques [10]. Les forêts tropicales sont les plus productives, avec 20 t ha−1 an−1 de matière sèche produite. Dans la forêt amazonienne, Lucas et al. [32] montrent que chaque année, 41 kg ha−1 de Si biogène sont réinjectés dans le sol. Les cultures de plantes accumulatrices de silicium, comme la canne à sucre ou le riz, peuvent entraı̂ner un appauvrissement rapide du stock de silicium des sols. Les valeurs de Si recyclé par la canne à sucre peuvent dépasser les 100 kg ha−1 par récolte [4]. En Australie, par exemple [5], trente ans de culture de canne à sucre ont entraı̂né une diminution du Si facilement soluble (extractible par 0,01 M CaCl2) de plus de la moitié par rapport aux valeurs mesurées dans les zones non cultivées (respectivement 5,3 et 13,1 mg kg−1). L'utilisation d'amendement silicaté est ainsi une pratique courante depuis les années 1950, en particulier au Japon [28].
Absorbé sous forme soluble (H4SiO4) par les racines, le silicium précipite dans les parties aériennes de la plante sous la forme de particules d'opale A, amorphe en DRX, de formule SiO2
Une approche du cycle biogéochimique peut permettre de quantifier le rôle des plantes dans les bilans d'altération. Markewitz et Richter [34] ont déterminé les flux de silice dans l'écosystème expérimental de la forêt de Calhoun (Caroline du Sud, USA). Le flux de silice dissoute entre la plante et le sol est de 17,26 kg ha−1 an−1. Alors que le flux de Si accumulé dans la biomasse atteint 2,32 kg ha−1 an−1 et que la quantité de Si redéposée avec la matière organique sur le sol est de 11,95 kg ha−1 an−1, les auteurs en concluent que les plantes augmentent les taux d'altération chimique de 82 %. Cette approche n'est applicable que dans le cas où les vitesses de dégradation des matières organiques sont lentes et ne peut donc pas être appliquée aux forêts tropicales humides, par exemple. C'est pourquoi, une autre approche du cycle biogéochimique, utilisée par Bartoli [3] et Alexandre et al. [1] prend en compte la vitesse de dissolution de la silice biogène.
Dans cette approche, on postule que l'écosystème est à l'état stationnaire ; on peut déduire le flux de Si dissous des minéraux du sol (Fm) grâce à l'équation suivante :
Bartoli [3] compare le cycle du silicium dans deux écosystèmes forestiers tempérés, développés sur des grès triasiques situés à des altitudes de 600 m, sous une pluviométrie annuelle de 1200 à 1400 mm : l'un sous forêt de décidus (sur sol brun), l'autre sous forêt de conifères (sur podzol). Le modèle biogéochimique montre que l'écosystème de forêt décidue est caractérisé par des flux Fm et Fs faibles par rapport à Fp et à Fs : 85 % du silicium soluble des eaux du sol proviennent du compartiment biologique. Inversement, l'écosystème forestier de conifères se caractérise par un faible cycle biologique et un flux élevé de Si (85 %) provenant de l'altération de la silice non biogène. Une approche semblable a été utilisée par Alexandre et al. [1] dans un écosystème constitué d'une forêt tropicale développée sur latosols au Congo : environ 74 % du silicium dissous dans le sol sont issus de l'altération des phytolithes.
3 La silice biogène dans les sols
Différentes catégories de particules de silice biogène se rencontrent dans les sols [7]. Les phytolithes sont les plus fréquentes. Parmi les autres particules, on rencontre surtout des diatomées et des spicules d'éponges. Ces particules peuvent également être fournies aux sols par des apports atmosphériques [48].
Dans les sols, les phytolithes peuvent, soit se dissoudre, soit être préservés de l'altération. Dans les latosols du Congo, Alexandre et al. [1] montrent qu'environ 5 kg ha−1 an−1 de phytolithes sont stockés dans le sol. En effet, les phytolithes ne se dissolvent pas tous à la même vitesse. L'origine de ces différences de solubilité n'est pas connue dans le détail, mais plusieurs hypothèses sont évoquées : (1) les morphotypes offrant une grande surface spécifique s'altèrent plus vite ; (2) certains phytolithes sont protégés de l'altération dans des agrégats organo-minéraux ; (3) il se produit une altération par des bactéries spécifiques aux types de phytolithes [49]. Alexandre et al. [1,2] montrent que la distribution des phytolithes dans le sol est bien corrélée avec celle du C organique : dans les deux cas, on observe une diminution, puis une stabilisation de la quantité de phytolithes avec la profondeur. Il est alors possible de modéliser le comportement de la silice biogène grâce à un modèle bi-compartimental classiquement appliqué pour la matière organique des sols : un premier compartiment de phytolithes contient les particules qui se dissolvent rapidement et un deuxième compartiment contient des particules stables, qui migrent vers le bas du profil, donnant ainsi une distribution constante avec la profondeur.
Si la productivité de phytolithes est très supérieure à la vitesse de dissolution, un puits de silice biogène peut se former. Un cas de figure remarquable a été décrit sur des andosols de l'ı̂le de la Réunion [37]. Sous la litière, un horizon d'environ 15 cm d'épaisseur, presque entièrement constitué de phytolithes, s'est déposé en moins de 4000 ans. La comparaison des morphotypes rencontrés dans le sol avec ceux qui sont extraits de différentes plantes actuelles montre que l'horizon riche en phytolithes résulte d'un recyclage de silicium par des forêts de bambous particulièrement accumulatrices en silice (jusqu'à 58 mg g−1 dans les tiges). Ce puits de silice biogène dans le sol s'explique par la combinaison de plantes hyperacumulatrices et de roches parentales très siliceuses et rapidement altérables [39].
Dans les latosols brésiliens, Alexandre et al. [2] ont montré que les phytolithes sont de bons traceurs des changements forêts/savanes au cours de l'Holocène, malgré les nombreuses difficultés qui viennent perturber l'interprétation de l'archivage des sols (mécanismes de dénudation, colluvionnement, bioturbation, dissolution et translocation sélectives). Les phytolithes qui résistent à l'altération peuvent être utilisés comme proxies des changements de végétation enregistrés au cours du développement des sols [44]. Herbauts et al. [21] ont montré que les pratiques de brûlis (essartage) entraı̂nent des accumulations importantes de phytolithes de graminées dans les 20 premiers centimètres des sols. Grâce à l'utilisation de techniques spectroscopiques, Pironon et al. [46] ont montré que les accumulations de phytolithes des sols de l'ı̂le de la Réunion [37] résultaient de paléoincendies non anthropiques. Les incendies ont donc un impact sur le cycle biogéochimique du silicium, car ils constituent une cause possible de puits de silice biogène dans les sols. Cependant, les cendres riches en phytolithes accumulées le long des pentes peuvent être également rapidement lessivées par la pluie [20].
La silice biogène peut avoir un impact sur la néoformation de silicates des sols. Il y a 40 ans, Erhart [17] suggérait : « Au cours de cette migration vers le bas [...] cette silice hydratée peut intervenir dans la formation des minéraux argileux. » Cette hypothèse a été démontrée 30 ans plus tard par Lucas et al. [32], qui montrent que le recyclage du silicium par les plantes est la principale source de Si responsable de la néoformation de l'horizon superficiel de kaolinite de certains latosols du Brésil. Parce que l'opale A, amorphe, est la forme de silice la plus soluble du système Si–H2O [13], certains auteurs ont suggéré que le silicium issu de la dissolution des phytolithes pourrait constituer une source possible de silicium pour expliquer les silicifications de surface, en particulier les silcrètes [7,35], mais les preuves manquent.
4 La silice biogène dans les eaux
D'après des études récentes [23,25], les flux de silicium des rivières sont en diminution et de sévères conséquences sur l'environnement sont à craindre. Le silicium des rivières constitue la source majeure de nutriments pour les diatomées marines qui jouent deux rôles environnementaux fondamentaux : premièrement, comme puits de carbone, et deuxièmement, comme éléments majeurs dans la chaı̂ne alimentaire. Cette baisse du silicium dissous dans les rivières serait la conséquence de la construction de barrages. Plusieurs mécanismes sont proposés : (1) l'eutrophisation qui retient les nutriments dans les lacs artificiels et provoque des blooms de diatomées d'eaux douces consommatrices de silicium [22], (2) la submersion des surfaces, préalablement recouvertes par les sols et la végétation, qui serait responsable d'une baisse des taux de silicium dissous issu de l'altération chimique [24]. Le rôle des plantes dans les bilans d'exportation de silicium est démontré quantitativement par les travaux de Drever et Zobrist [14], et de Moulton et al. [40]. Ces auteurs ont montré que les flux de silicium exporté de zones végétalisées étaient environ deux à huit fois plus importants que dans les zones dépourvues de végétation. Plusieurs mécanismes permettent d'expliquer cette augmentation du silicium dissous dans les rivières en présence de végétation : (1) les fortes teneurs en CO2 et la production d'acides et composés à caractère fortement complexant dans la rhizosphère favorisent l'altération des minéraux du sol et le lessivage du silicium [26] ; (2) la silice recyclée par les plantes s'altère plus vite que les autres formes siliceuses des sols [31]. Est-il possible de déterminer si le silicium transporté dans les eaux provient de la dissolution de minéraux silicatés des sols ou de la silice biogène, phytolithes en particulier ? Le traçage de l'origine du silicium dissous fait l'objet de plusieurs études prometteuses, basées sur l'utilisation de traceurs géochimiques et isotopiques. La première approche utilise les isotopes stables du silicium 28Si et 30Si. Les valeurs de δ30Si des eaux de rivières sont plus positives que celles des roches ignées, suggérant ainsi qu'il existe un fractionnement isotopique lors de l'altération [9,12]. Cette hypothèse a été testée par Ziegler et al. [50], qui montrent expérimentalement que la précipitation de phytolithes ainsi que la néoformation d'aluminosilicates provoquent bien un fractionnement des isotopes du Si, mais d'autres travaux seront nécessaires pour déterminer si les valeurs sont suffisamment discriminantes pour tracer les sources du silicium. Une autre approche est basée sur l'utilisation des rapports Ge/Si. Les eaux de rivières, dans divers environnements géologiques, tendent à s'aligner le long d'une courbe de mélange entre un pôle 1, caractérisé par des teneurs en Si élevées et un rapport Ge/Si faible, qui serait contrôlé par l'altération de minéraux primaires, et un pôle 2, caractérisé par des teneurs en Si faible et un rapport Ge/Si élevé, qui serait contrôlé par l'altération des minéraux secondaires des sols, enrichis préférentiellement en Ge [41]. Derry et al. [11] ont appliqué cette approche aux chronoséquences des roches volcaniques d'Hawaii et montrent que des eaux caractéristiques du pôle 1 sont contrôlées, non pas par les silicates des roches parentales, mais par les phytolithes. Bien que d'autres études soient nécessaires pour confirmer les résultats de Derry et al. [11], cette approche montre que la silice biogène recyclée par les plantes peut avoir un impact important sur les bilans globaux de silicium.
Le silicium dissous transporté par les rivières peut s'insolubiliser et sédimenter avant de rejoindre les océans. Les organismes siliceux comme les diatomées, les algues et les éponges sont susceptibles de réguler le silicium dissous [6,8,19,27]. L'impact des blooms de diatomées dans les environnements tempérés est bien établi. Par exemple, le long de la Seine, on enregistre des variations des teneurs en silicium, inversement corrélées aux teneurs en chlorophylle, indicatrices du développement planctonique [19]. Dans les bassins amazoniens, le cycle du silicium apparaı̂t entièrement contrôlé par l'activité biologique, depuis le sol jusqu'aux rivières et aux sédiments [6]. Cependant, le manque de données ne permet pas actuellement d'effectuer un bilan quantitatif fiable de l'impact des processus biologiques sur le cycle terrestre du silicium.
5 Conclusion
L'importance du rôle des plantes dans le cycle du silicium a été soulignée par plusieurs études, en milieu tropical aussi bien qu'en milieu tempéré, qui ont établi l'impact qualitatif et quantitatif des plantes sur la cinétique et le résultat de l'altération. Le rôle des plantes dans la régulation du cycle global du Si est actuellement posé dans des questions environnementales globales, comme celle de l'abaissement inquiétant des teneurs en Si dissous en amont des barrages. Or, les études réalisées sont encore trop fragmentaires, limitées dans l'espace et le temps, ou insuffisamment détaillées. Il importe de les compléter et de mettre au point de nouveaux traceurs. Parmi les nouvelles techniques, l'étude des phytolithes, celle des rapports Ge/Si et celle des isotopes stables de Si apparaissent particulièrement prometteuses.
Remerciements
Ce travail a bénéficié du soutien du Programme national sur les sols et l'érosion. A. Alexandre, S. Kirman et deux relecteurs anonymes ont contribué à l'amélioration du manuscrit.



Vous devez vous connecter pour continuer.
S'authentifier