1. Les services rendus à l’homme par la biosphère se dégradent car elle perd sa biodiversité
J’ai tenu pour cet article à utiliser le terme de biosphère plutôt que celui de biodiversité ou d’écosphère pour les raisons suivantes : le terme de biosphère, introduit pour la première fois par le géologue Eduard Suess en 1885 [Suess 1885], représente l’ensemble des organismes vivants et les milieux dans lesquels ils vivent. Il renferme donc à la fois la notion de biodiversité qui représente la diversité des organismes vivants, incluant sa diversité taxonomique et sa diversité génétique ; et celle d’écosystème qui représente un ensemble formé par une communauté d’êtres vivants qui interagissent entre eux et avec leur environnement. Les termes d’écosystème et de biodiversité sont apparus des décennies plus tard (1935 et 1986 respectivement) et ont progressivement supplantés celui de biosphère, sans doute par commodité dans les débats publics, permettant de discuter de façon plus précise des différents enjeux environnementaux auxquels l’homme était confronté (services écosystémiques, espèces menacées, ressources génétiques, etc…). L’équivalent du GIEC (Groupe intergouvernemental d’experts sur l’évolution du climat) pour la biosphère est d’ailleurs intitulé Plate-forme Intergouvernementale pour la Biodiversité et les Services Ecosystémiques (IPBES, Intergovernmental Science-Policy Platform for Biodiversity and Ecosystem services). La plupart des exemples que je citerai dans cet article concerneront le milieu terrestre. Pour un état des lieux plus spécifique au milieu marin voir par exemples Gattuso et al. [2018], Hoegh-Guldberg and Bruno [2010].
La biosphère rend un nombre très important de services à l’homme que l’on pourrait qualifier de vitaux tant sa santé, son alimentation et son bien-être en dépendent. On distingue généralement quatre grands types de services rendus à l’homme par la biosphère : les services d’approvisionnement (alimentation, eau, matière première, énergie), les services de régulation (qualité de l’air, fertilité des sols, contrôle des inondations et des épidémies, etc…), les services culturels (identités culturelles, valeurs esthétiques et spirituelles, source d’inspiration artistique et scientifique), et les services de soutien qui sont le fondement de tous les écosystèmes et de leurs services (habitats favorables pour les espèces animales et végétales participant aux services écosystémiques et préservation de leur diversité).
La plupart des services rendus à l’homme par la biosphère n’ont fait que se détériorer au cours des cinquante dernières années, et en particulier les services de pollinisation, de ressources génétiques, de régulation des maladies vectorielles, et de fertilité des sols [Díaz et al. 2019]. La détérioration de ces services est en très grande partie due au fait que la biosphère perd sa biodiversité, en termes de nombre d’espèces et d’écosystèmes, et de diversité génétique [Díaz et al. 2019; Oliver et al. 2015a]. Le taux d’extinction des espèces est actuellement au moins dix fois supérieur à ce qu’il a été au cours des dix derniers millions d’années et il ne fait qu’augmenter [Díaz et al. 2019]. Cette perte de diversité touche aussi bien les espèces sauvages que domestiquées par l’homme [Díaz et al. 2019; FAO Commission on Genetic Resources for Food and Agriculture 2019]. Ce déclin rapide de la biodiversité signifie que la plupart des objectifs des accords internationaux en matière d’environnement et de bien-être des populations humaines (Objectifs d’Aïchi de la Convention sur la Biodiversité, Objectifs de développement durable 2030 des Nations Unis) ne seront pas atteints sur la base des trajectoires actuelles [Díaz et al. 2019]. Ce déclin portera également atteinte aux objectifs spécifiés dans l’Accord de Paris adopté lors de la COP21 (21e Conférence des Parties de la Convention-cadre des Nations Unies sur les changements climatiques).
2. Le changement climatique est actuellement la troisième cause de perte de biodiversité
Les causes premières de pertes de biodiversité sont actuellement la destruction des habitats naturels par les activités humaines, les prélèvements directs pour l’alimentation, la santé et la création de biens matériels, et le changement climatique qui se loge à la troisième place devant la pollution et les invasions biologiques [Díaz et al. 2019]. Le changement climatique exacerbe actuellement les effets des autres pressions exercées par l’homme sur la biosphère et il est devenu la cause majeure des changements observés sur la biosphère au cours des dernières décennies [Field et al. 2014]. Ces changements sont principalement une modification des cycles de développement des êtres vivants, qui a des conséquences majeures sur leur croissance, leur survie et leur reproduction, une modification des aires de répartition géographique des espèces, et une modification des échanges de flux d’eau, de gaz et d’énergie entre la biosphère et l’atmosphère [Pecl et al. 2017].
Le changement climatique modifie le déroulement du cycle annuel de développement des espèces végétales mais aussi animales, et notamment celui des animaux dits « poïkilothermes » qui ne régulent pas leur température corporelle (par exemples reptiles, amphibiens, poissons, insectes, crustacés, mollusques) [Cleland et al. 2007; Menzel 2003; Parmesan and Yohe 2003]. Les dates d’apparition, au cours de l’année, des différents événements qui rythment le cycle annuel de développement de ces espèces, comme par exemple l’apparition des nouvelles feuilles ou des fleurs chez les plantes, l’éclosion des œufs, etc… sont très étroitement dépendantes des conditions météorologiques qui ont prévalu plusieurs semaines voire plusieurs mois avant l’apparition de ces événements [Bronson 2009; Chuine and Régnière 2017]. Le réchauffement climatique a avancé la reprise d’activité des êtres vivants au printemps de l’ordre de deux à trois jours par décennie, et a retardé leur fin d’activité à l’automne de l’ordre de un à deux jours par décennie (Figure 1) [Menzel et al. 2006; Parmesan and Yohe 2003; Walther et al. 2005]. Mais si les tendances observées étaient jusqu’ici linéaires, les études récentes montrent que depuis les années 1990s, les tendances à la précocité au printemps ont ralenti chez les plantes [Fu et al. 2015]. Ce ralentissement de la tendance à la précocité de la reprise d’activité des plantes au printemps serait dû au réchauffement de l’hiver [Asse et al. 2018], comme l’avaient prédit les modèles [Chuine et al. 2016; Morin et al. 2009; Vitasse et al. 2011] et les résultats expérimentaux [Morin et al. 2010]. En effet, les plantes pérennes ont besoin d’un certain nombre de jours de froid pendant l’hiver pour lever la dormance de leurs bourgeons et pour fleurir (initiation florale) [Anderson et al. 2010; Campoy et al. 2011]. Cette dormance hivernale, qui correspond à un état d’inactivité physiologique régulée par des facteurs internes, est une adaptation des plantes extratropicales pour survivre à la mauvaise saison (l’hiver sous nos latitudes) dont les conditions de températures ne sont pas compatibles avec l’activité cellulaire. C’est notamment grâce à cette adaptation que les plantes peuvent résister au gel pendant cette période. Si les conséquences de ce manque de froid hivernal sont pour le moment un ralentissement de la précocité printanière, les modèles prévoient que ce manque de froid provoquera d’ici quelques années un retard dans la reprise d’activité de la végétation puis dans quelques décennies une impossibilité à reprendre cette activité normalement [Chuine et al. 2016].
Illustration de l’effet du changement climatique sur les cycles de développement des êtres vivants. Bleu : période de repos hivernal, vert : période d’activité et de croissance ; orange : période de préparation au repos hivernal. Pendant la période de repos hivernal, la plupart des plantes et les bourgeons des arbres sont en dormance, de nombreux animaux sont en diapause, hivernation ou hibernation : l’activité physiologique est réduite à son minimum. La reprise d’activité se fait au printemps, et elle se fait plus tôt qu’auparavant (−15 à 30 jours selon les espèces depuis les années 1950s). La fin de la période d’activité qui permet la préparation à la période de repos hivernal arrive en automne et un peu plus tard qu’auparavant (8 à 15 jours selon les espèces depuis les années 1950s). Ces décalages des cycles de développement au cours de l’année ont entraîné des dommages sur la végétation, et notamment les cultures fruitières, qui sont liés aux gels tardifs, car les jeunes feuilles sortent des bourgeons avant les derniers gels de printemps. Ils ont aussi provoqué une augmentation du stress hydrique pendant l’été car la végétation puise l’eau du sol plus tôt et plus longtemps qu’auparavant. Enfin, le cycle de chaque espèce est modifié d’une certaine façon et différemment des autres espèces si bien que les cycles qui étaient synchronisés, comme cela est souvent le cas dans les chaînes trophiques, ne le sont plus, et de nombreuses espèces se retrouvent ainsi privées de leur ressource alimentaire principale.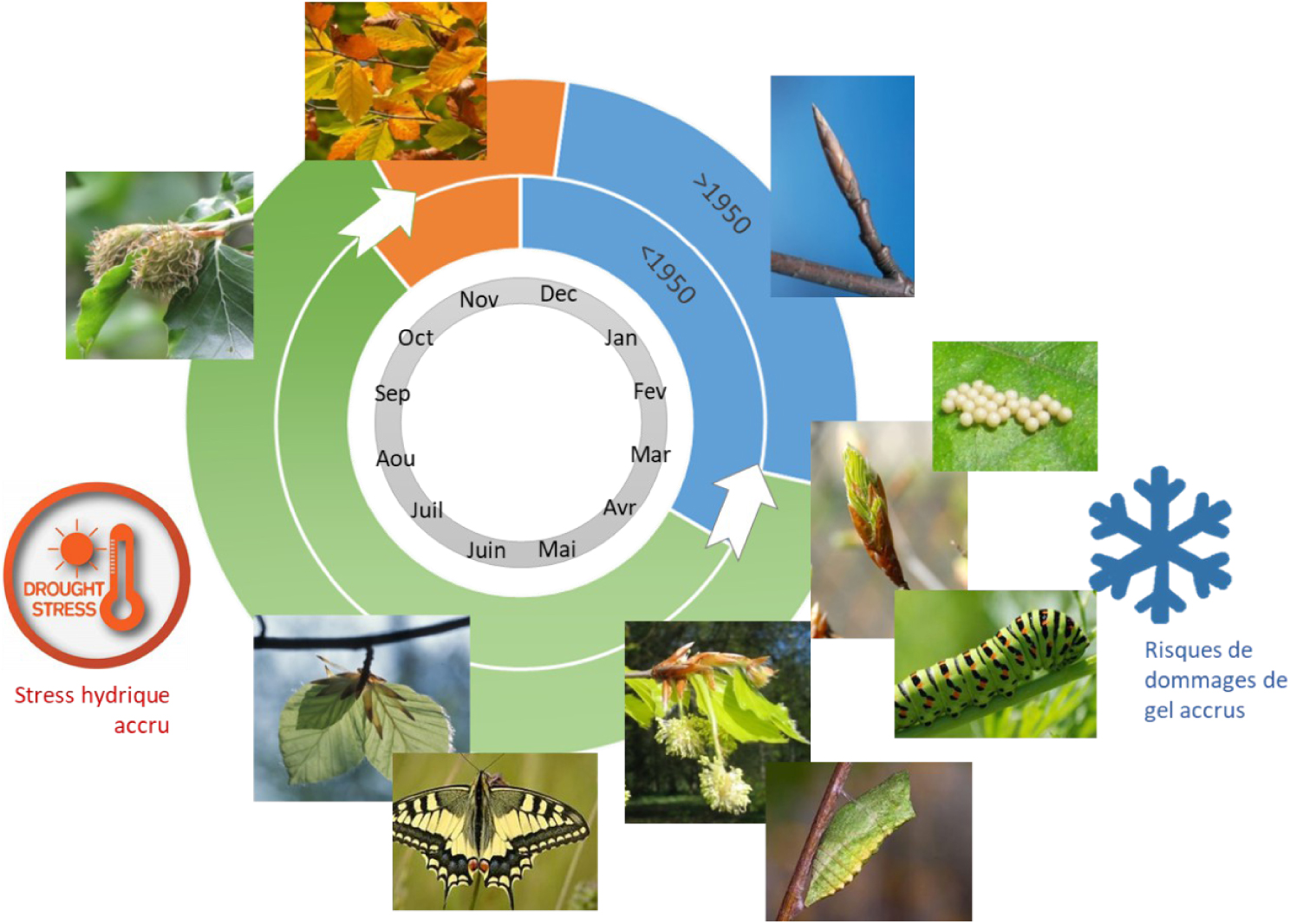
Ces modifications du cycle annuel de développement des êtres vivants ont de nombreuses conséquences en cascades, certaines positives mais beaucoup négatives. Chez les plantes pérennes, ces modifications se traduisent par un allongement de la période de croissance [Menzel and Fabian 1999], en partie responsable de l’augmentation de la productivité des forêts jusqu’au début des années 2000 [Delpierre et al. 2009; Myneni et al. 1997; Piao et al. 2007]. En revanche, chez les plantes annuelles, le cycle annuel de croissance est raccourci car le développement est accéléré. Ce raccourcissement du cycle chez les annuelles engendre une baisse de la quantité de fleurs et de graines produites, et ce même quand les conditions d’alimentation en eau sont optimales, car celle-ci dépend en général de la croissance qui a pu être effectuée avant la mise à fleur [Asseng et al. 2011; Ferris et al. 1998; Wardlaw and Wrigley 1994; Wheeler et al. 1996]. Les modifications du cycle annuel de développement des êtres vivants ont également d’autres conséquences telles qu’une augmentation des dommages de gels tardifs car la végétation démarre sa croissance avant l’arrivée des derniers gels de printemps (Figure 1) [Lenz et al. 2013; Vitasse et al. 2018], ce qui a engendré ces dernières années des pertes de récolte importantes pour les viticulteurs et arboriculteurs fruitiers. L’allongement de la période d’activité a également pour conséquence une augmentation du stress hydrique, car la végétation épuise les réserves en eau du sol plus rapidement, puisqu’elle commence à puiser l’eau plus tôt et elle puise plus longtemps (pour les espèces pérennes, notamment les arbres) (Figure 1) [Carnicer et al. 2011; Jump et al. 2017]. Ce phénomène vient s’ajouter dans certaines régions à des sécheresses estivales accrues et répétées, du fait d’une baisse des précipitations et de l’augmentation de l’évapotranspiration due à l’augmentation de température [IPCC 2013; Sheffield et al. 2012].
Ces modifications dans les cycles de développement des organismes vivants impactent également les interactions entre espèces, notamment au sein des chaînes trophiques (chaînes alimentaires) dans lesquelles les relations de type proie-prédateur, hôte-parasite, plante-pollinisateur, ou encore plante-herbivore sont déterminées par le stade de développement de chacune des espèces en interaction (voir pour revue Renner and Zohner, 2018). Par exemple, le stade chenille d’une espèce de papillon qui se nourrit exclusivement de jeunes feuilles, devra être parfaitement synchrone avec le stade jeune feuille pour la survie de cette espèce de papillon (Figure 1). Or, les cycles de développement ne sont pas modifiés de la même façon chez les différentes espèces car celles-ci ne sont pas sensibles de la même façon à la température (Figure 2). Les cycles se désynchronisent et les chaînes alimentaires se rompent [Renner and Zohner 2018]. En conséquence, au-delà d’une modification des réseaux d’interactions trophiques [Gilman et al. 2010; Walther 2010], ces désynchronisations de cycles entre espèces provoqueront aussi des extinction d’espèces [Cahill et al. 2013]. On estime qu’en moyenne sur dix chaînes trophiques six espèces pourraient disparaître du fait de cette désynchronisation [Koh et al. 2004].
Variation des performances des espèces selon la température. La performance représente ici aussi bien celle d’un processus physiologique, que la croissance, la survie ou la fécondité d’une espèce. Les courbes de performance peuvent revêtir des formes variées mais présentent toutes un optimum thermique, et décroissent fortement quand la température est trop basse ou trop élevée. L’optimum thermique est généralement variable entre espèces, entre individus d’une même espèce et aussi entre processus physiologiques. Les courbes de réponse à la température peuvent généralement varier dans une certaine mesure à très court terme grâce aux processus d’acclimatation chez un même génotype/individu, et à plus long terme grâce à l’adaptation génétique chez une espèce/population. Les êtres vivants peuvent supporter de sortir de leur zone thermique optimale mais pour un temps d’autant plus limité qu’ils sont loin de l’optimum. D’après la figure TS 3.A du rapport du WG 2 de l’[IPCC 2014].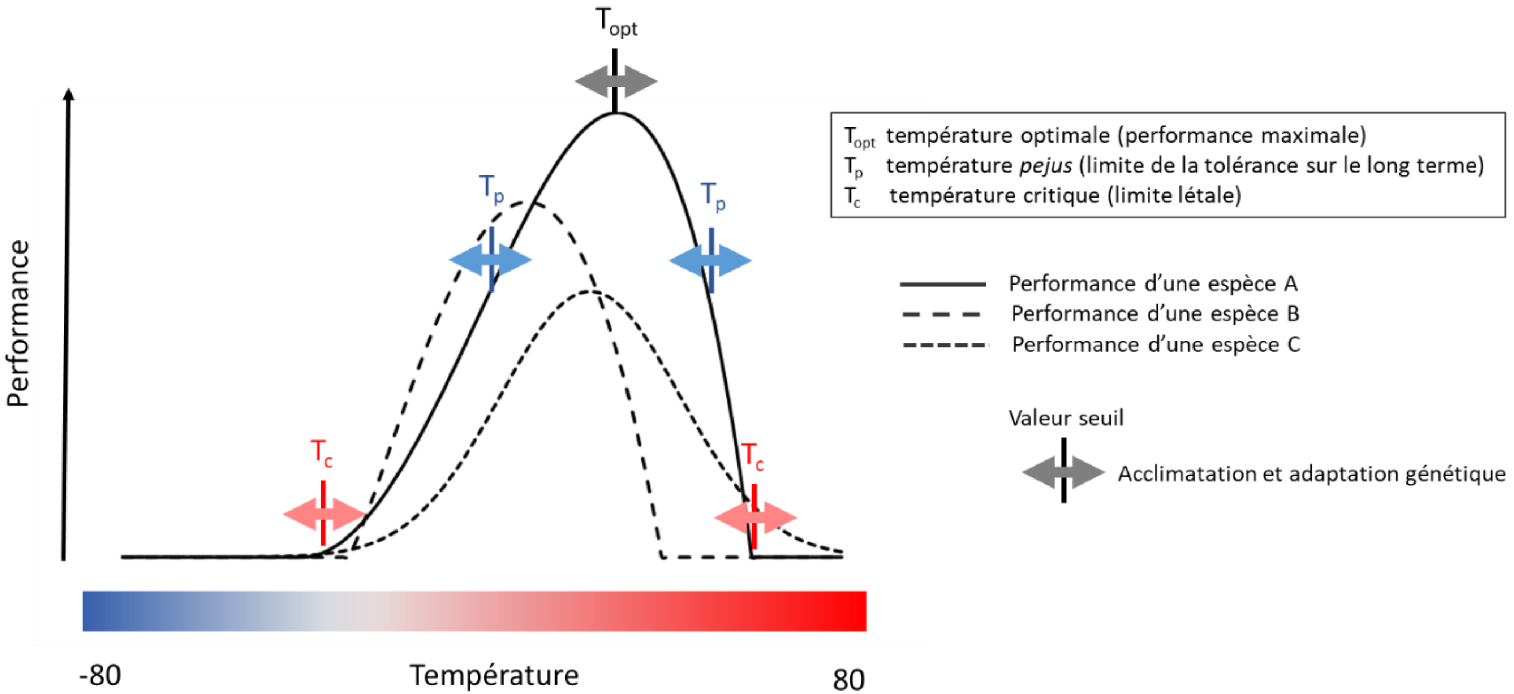
Le second impact majeur du changement climatique sur la biosphère, qui découle en partie du précédent, est une modification de la répartition géographique des espèces [Parmesan and Yohe 2003; Walther et al. 2002]. Les espèces remontent vers les sommets des montagnes [Lenoir et al. 2008; Morueta-holme et al. 2015], et vers les pôles [Beaugrand et al. 2003; Brommer et al. 2012; Hickling et al. 2006], comme par exemple la chenille processionnaire qui remonte vers le Nord de la France à la vitesse moyenne de 5.5 km/an et vers les sommets à la vitesse de 5m/an [Battisti et al. 2005]. Ces déplacements d’espèces se font à des vitesses variables selon leur capacité de migration. Les organismes sessiles tels que les plantes sont capables de migrer à une vitesse maximale variant de quelques mètres à trente kilomètres par décennie, selon les caractéristiques de leurs graines qui déterminent leurs agents de dispersion (gravité, vent, eau, animaux). En comparaison, les grands mammifères, les insectes ailés et les organismes marins pélagiques peuvent migrer de plusieurs centaines, voire milliers de kilomètres par décennie. Ces changements de répartitions géographiques se traduisent également par des extinctions locales d’espèces dans les marges chaudes des aires de répartition de nombreuses espèces [Parmesan and Yohe 2003; Walther 2003]. Les espèces qui vivent dans des espaces limités aux régions polaires et aux étages subalpins se retrouvent particulièrement vulnérables, car leur habitat rétrécit inexorablement [Callaghan et al. 2004; Engler et al. 2011], de même que les espèces endémiques qui ont des aires de répartition très restreintes [Dirnböck 2011; Malcolm et al. 2006].
L’une des raisons fondamentales à tous ces effets du changement climatique sur les êtres vivants est que leur activité physiologique ne peut avoir lieu que dans une gamme de températures assez restreinte, d’à peine quelques dizaines de degrés (Figure 2). Les performances des organismes vivants sont nulles quand la température devient trop basse ou trop élevée et elles sont optimales à un niveau de température intermédiaire. Bien que l’on ne sache pas encore très bien expliquer pourquoi l’efficacité des processus biologiques à l’échelle de la cellule, de l’organe ou de l’organisme varie ainsi avec la température, l’effet de la température sur les structures moléculaires joue probablement un rôle important [Schulte 2015]. En ce qui concerne le développement des plantes des milieux extratropicaux par exemple, nous savons que la plupart d’entre elles ont besoin de températures froides pour lever la dormance des graines et des bourgeons, et pour fleurir, signe que la mauvaise saison de l’hiver est passée, et que la croissance peut reprendre [Anderson et al. 2010; Campoy et al. 2011]. Nous savons aussi, qu’une fois cette dormance levée, plus il fait chaud plus la croissance cellulaire est rapide jusqu’à atteindre un optimum thermique qui peut varier entre 20 et 30 °C selon les espèces [Anderson et al. 2010]. Passé cet optimum, les performances de croissance diminuent même en conditions d’hydratation optimale jusqu’à atteindre un seuil thermique létal au-delà duquel les protéines et acides nucléiques sont dénaturés et les membranes cellulaires désorganisées, causant des dommages cellulaires irréparables et la mort de l’organisme. Les animaux poïkilothermes (qui ne régulent pas leur température corporelle) dépendent également des conditions extérieures pour leur développement. Les vitesses de développement embryonnaire et larvaire dépendent de la température extérieure selon une relation présentant un optimum [Cossins and Bowler 1987; Gillooly et al. 2002] (Figure 2). Chaque processus biologique dépendant de la température possède son propre optimum thermique qui varie entre espèces et entre individus d’une même espèce. L’agrégation de l’ensemble de ces processus permettant aux organismes de vivre et se reproduire se traduit par une relation des taux de survie et de fécondité à la température qui possède également un optimum thermique et qui varie entre espèces et entre individus.
Nous sommes actuellement très loin de connaître quels sont les optimums thermiques et les seuils thermiques létaux de toutes les espèces. Néanmoins, force est de constater que ces seuils thermiques létaux sont de plus en plus souvent atteints. Il apparaît par exemple que le fonctionnement de la végétation devient fortement compromis dans de nombreuses régions du globe à cause des canicules et sécheresses qui se répètent et battent régulièrement des records [Field et al. 2014]. Quand les conditions deviennent trop sèches et trop chaudes, la végétation va dans un premier temps passer de puits de carbone à source de carbone car elle va respirer davantage qu’elle ne photosynthétise [Bonan 2008; Chapin et al. 2008]. Et si ces conditions deviennent trop fréquentes ou trop intenses, elle va dans un deuxième temps dépérir et mourir [Carnicer et al. 2011; Jump et al. 2017]. La disponibilité en eau est tout aussi cruciale au fonctionnement cellulaire, voire davantage, que les conditions de température. La croissance cellulaire nécessite chez les plantes un certain niveau d’hydratation des cellules et lors d’un épisode de sécheresse, c’est l’un des processus biologiques qui va s’arrêter en premier [Cosgrove 1986; Lempereur et al. 2016]. Or la disponibilité en eau est elle aussi beaucoup affectée par le changement climatique, d’une part, parce que le régime de précipitation a changé dans de nombreuses régions (nette diminution dans le Sud de la France par exemple) ; et d’autre part, parce que l’augmentation de la température augmente l’évaporation des sols et la transpiration de la végétation. Au-delà des problèmes de disponibilité en eau, la canicule de juin 2019 a révélé que, même en conditions hydriques non stressantes, des températures trop élevées pouvaient occasionner des dommages importants sur la végétation. Celle canicule a en effet occasionné des dommages sans précédent sur le feuillage de nombreuses espèces, y compris des espèces méditerranéennes particulièrement résistantes aux fortes chaleurs et à la sécheresse telles que le chêne vert (Figure 3). Bien que les causes de ces dommages n’aient pas encore été analysées, l’hypothèse avancée est qu’ils seraient dus à la précocité exceptionnelle de la canicule à laquelle les plantes n’étaient pas préparées, beaucoup d’entre elles n’ayant pas encore parachevé la mise en place des différentes structures protectrices de leurs feuilles, telles que la cuticule.
Photographies de feuilles de chênes verts au lendemain de la canicule du 29 juin 2019 sur le site expérimental du CNRS à Puéchabon (Hérault). Les feuilles ont blanchi en quelques heures avant de devenir brunes au bout de quelques jours. Le chêne vert est une espèce méditerranéenne adaptée aux canicules et sécheresses. Les dommages occasionnés par la canicule de juin 2019 sont inédits et sans doute dus à la précocité exceptionnelle de la canicule qui est arrivée avant que les feuilles aient achevé leur développement et notamment la mise en place des structures de protection telle que la cuticule. Photos : Jean-Marc Limousin and Jean-Marc Ourcival, CNRS.
3. Les effets du changement climatique sur la biosphère ont des conséquences sur le bien-être des populations humaines et leurs activités, les services écosystémiques, et le climat lui-même
Au-delà des conséquences pour les espèces elles-mêmes, les effets du changement climatique sur la biosphère ont également des conséquences sur les services écosystémiques, sur le bien-être des populations humaines et sur le climat lui-même.
La biosphère subit les modifications de l’atmosphère mais celle-ci est également impactée en retour par la biosphère de nombreuses façons. La végétation terrestre est en effet une composante importante du système climatique [Chapin et al. 2008; Marland et al. 2003]. Elle échange avec l’atmosphère des flux d’énergie, d’eau et de gaz, principalement le dioxyde de carbone et l’oxygène [Bonan 2008; Chapin et al. 2008]. Ces flux mettent en jeu de nombreux processus physiques, biochimiques et physiologiques avec des schémas de régulation et des boucles de rétroaction complexes. Toute modification de la végétation ou de son fonctionnement entraîne donc des modifications de ces flux qui affectent la température de surface, l’hygrométrie de l’air, l’albédo, mais aussi les stocks de carbone [Bonan 2008; Chapin et al. 2008]. Par exemple, l’augmentation de l’abondance des ligneux dans la toundra de l’arctique à cause du changement climatique diminue l’albédo de surface, et, par voie de conséquence, le bilan radiatif de surface et donc à terme la température de surface, amplifiant ainsi le réchauffement déjà plus prononcé aux hautes latitudes [Chapin 2005]. Cet effet d’amplification se rajoute à celui de la réduction de la surface neigeuse aux hautes latitudes qui diminue également l’albédo de surface.
Le réchauffement et l’augmentation de la concentration atmosphérique en dioxyde de carbone provoquent une augmentation de l’activité photosynthétique des plantes qui consomme le dioxyde de carbone et produit de l’oxygène. Mais le réchauffement augmente aussi la respiration des plantes qui consomment donc davantage d’oxygène [Grace and Rayment 2000; Ryan 1991]. Le bilan net en carbone peut donc être très variable selon les régions en fonction des conditions climatiques. Il est positif dans les régions qui reçoivent encore suffisamment de précipitation, mais il devient de plus en plus souvent négatif dans les régions soumises à des sècheresses de plus en plus longues et intenses [Allard et al. 2005]. Ceci est dû au fait que la plupart des plantes ne peuvent plus réaliser la photosynthèse quand elles manquent d’eau. En effet, la plante absorbe le dioxyde de carbone de l’air en ouvrant des structures appelées stomates, en général disposées sur la face inférieure des feuilles, mais lorsqu’ils sont ouverts, les stomates libèrent également de l’oxygène (produit par la photosynthèse) et de l’eau. Ces interactions complexes entre conditions climatiques et fonctionnement de la végétation sont extrêmement importantes à prendre en compte dans notre évaluation du rôle de la végétation, et notamment des forêts, dans l’atténuation du changement climatique [Richardson et al. 2010; Wood et al. 2012]. Ainsi, les effets du changement climatique sur le fonctionnement de la végétation ont des effets-retours à la fois positifs et négatifs sur le climat lui-même, et il est nécessaire d’avoir une connaissance complète des nombreuses interactions en jeu pour mettre en œuvre des solutions d’atténuation du changement climatique basées sur la nature.
Le changement climatique modifie profondément l’un des services écosystémiques les plus essentiels à l’homme qui est le service d’approvisionnement (en denrées alimentaires, matières premières, eau potable et médicaments). Cet effet s’opère au travers des changements de répartition géographiques des espèces, en particulier des espèces marines (ressources halieutiques) ; mais aussi des performances des espèces, notamment exploitées par l’homme, en terme de croissance et reproduction, c’est-à-dire pour l’homme de productivité. L’impact du changement climatique sur les grandes cultures a été jusqu’ici plutôt négatif avec des baisses de rendements, notamment pour le blé, le riz et le maïs qui sont les trois plus importantes cultures dans le monde (http://www.fao.org/) [Field et al. 2014; Lobell et al. 2011; Schlenker and Roberts 2009]. Ces baisses de rendement sont dues en partie à l’accélération et au raccourcissement du cycle annuel de développement évoqué précédemment. Dans ce cas précis des plantes cultivées (mais cela est aussi valable pour les animaux domestiqués), les pertes de diversité génétique dues à la réduction du nombre de variétés cultivées, pour ne garder que les plus productives et les plus intéressantes pour la commercialisation [FAO Commission on Genetic Resources for Food and Agriculture 2019; Wolff 2004], freinent maintenant la sélection de variétés mieux adaptées aux nouvelles conditions climatiques [Wolkovich et al. 2018] et altèrent les capacités des agroécosystèmes à résister aux aléas climatiques [Forest et al. 2015] et aux aléas naturels tels que les ravageurs et agents pathogènes [Ekroth et al. 2019; White et al. 2020]. En effet, la diversité taxonomique et la diversité génétique permettent en général une meilleure résilience des communautés animales et végétales aux aléas [Oliver et al. 2015b]. Cette résilience est en général la résultante d’une redondance et d’une complémentarité entre les différentes espèces, variétés, et génotypes, dans l’exploitation des ressources (eau, lumière, nutriments), et dans les capacités de défense contre les ravageurs et pathogènes, et capacités de résistance aux aléas climatiques [Allan et al. 2011; Downing et al. 2014]. La diversité taxonomique et la diversité génétique permettent aussi sur le long terme de ralentir l’adaptation génétique des ravageurs et pathogènes à leurs hôtes [White et al. 2020]. L’utilisation des interactions positives entre espèces, variétés/races et génotypes représente l’un des principes fondamentaux de l’agroécologie.
Les effets de la redistribution des espèces à la surface de la Terre, du fait du changement climatique, sur le fonctionnement des écosystèmes et sur la recomposition des communautés sont moins bien documentés et compris. Néanmoins, nous savons que cette redistribution des espèces perturbe les chaînes trophiques de la même manière que la modification des cycles annuels de développement mentionnés précédemment. Par exemple, l’arrivée récente du crabe royal, redoutable prédateur d’échinodermes et de mollusques, sur les fonds marins de l’antarctique, jusqu’ici inaccessibles aux crustacés à cause de la température trop basse de l’eau, a profondément modifié l’équilibre de cet écosystème probablement inchangé depuis des millions d’années [Aronson et al. 2015].
Enfin, les modifications de répartition géographique d’espèces dues au changement climatique peuvent aussi affecter le bien-être et la santé humaine. Par exemple, le changement climatique modifie l’aire de répartition géographique de nombreux vecteurs de pathogènes comme par exemple le moustique anophèle dont la répartition est en augmentation du fait du changement climatique. Cette espèce étant vecteur de la malaria, la population exposée à la malaria est en augmentation [Siraj et al. 2014].
4. Le changement climatique risque de devenir la première cause de perte de biodiversité et les moyens d’adaptation sont limités
Les projections des modèles prévoient que les effets négatifs du changement climatique sur la biodiversité vont augmenter, dans certains cas de façon exponentielle [Bellard et al. 2012; Díaz et al. 2019]. Même si les phénomènes d’extinction seront majoritairement locaux (disparition de l’espèce d’une région), le taux d’extinction totale augmentera également [Bellard et al. 2012; Thomas et al. 2004]. Même pour un réchauffement climatique limité à 2 °C, les modèles prévoient que la répartition géographique de la majorité des espèces terrestres va diminuer de façon conséquente, et que 5% des espèces seront en risque d’extinction totale, et ce pourcentage passerait à 16 avec un réchauffement de 4 °C [Díaz et al. 2019]. Les modèles prévoient également des changements considérables du fonctionnement des écosystèmes et de leur nature, même pour 3 °C de réchauffement dans les régions boréales et 4 °C de réchauffement dans les régions tempérées [Heyder et al. 2011]. Ils prévoient également une aggravation forte des dépérissements forestiers dans la zone tempérée-boréale [Heyder et al. 2011]. Enfin, ils prévoient que les milieux marins seront tout autant affectés que les milieux terrestres avec une augmentation des taux d’extinction d’espèces dans les mers subpolaires, tropicales, et semi-fermées, et un renouvellement de 60% de la biodiversité locale qui affectera les services rendus à l’homme par les écosystèmes marins [Cheung et al. 2009]. Dans ces conditions, les capacités des aires protégées à conserver les espèces menacées seront grandement affectées [Díaz et al. 2019; Monzón et al. 2011].
Cependant, la plupart des projections ne prennent pas en compte les capacités d’adaptation des espèces au changement climatique, car très peu de modèles en sont actuellement capables. Les moyens d’adaptation des espèces au changement climatique sont essentiellement de trois ordres : la migration, la plasticité phénotypique et l’adaptation génétique [Aitken et al. 2008; Davis and Shaw 2001; Lavorel et al. 2017]. Les espèces peuvent échapper au changement climatique en se déplaçant vers les territoires dont le climat reste ou devient favorable à leur survie et reproduction, et échapper ainsi à l’extinction totale (Figure 4). Mais si l’on compare la vélocité du changement climatique à celle des espèces, on se rend compte que beaucoup d’espèces ne peuvent pas migrer aussi vite que le climat, et en tout premier lieu les plantes (Figure 4). Par exemple, la vélocité du changement climatique selon le scénario RCP 8.5 est supérieure à soixante-dix kilomètres par décennie alors que les vitesses maximales de migration connues chez les plantes sont de l’ordre de trente kilomètres par décennie, quand les vitesses moyennes sont de un à deux kilomètres par décennie [Field et al. 2014]. Ainsi, sans migration assistée d’individus ou de propagules (par exemple des graines) par l’homme, de nombreuses espèces seront en risque d’extinction totale avant d’avoir pu s’extirper des régions qui ne pourront plus assurer leur survie. Cependant la migration assistée par l’homme a un coût important et ne pourra être mise en œuvre que pour un nombre très limité d’espèces. En dehors des programmes de conservation d’espèces en voie d’extinction, la migration assistée est actuellement testée en foresterie sur des espèces d’intérêt économique [Aitken and Bemmels 2016].
Impacts du changement climatique sur les aires de répartition des espèces. A. Projection de la répartition potentielle du hêtre en 2100 d’après le scénario climatique A1Fi et le modèle d’aire de répartition PHENOFIT. Rouge : aire dont les conditions climatiques ne pourront plus assurer la survie de l’espèce, jaune et vert : aire dont les conditions climatiques permettent la survie de l’espèce (vert : conditions plus favorables qu’avant; jaune : conditions moins favorables qu’avant), bleu : aire dont le climat permet la survie de l’espèce et dont l’espèce était auparavant absente. Illustration adaptée de Saltré et al. [2015]. B. Vitesses maximales auxquelles les espèces peuvent migrer et vélocité du climat selon les différents scénarios. Figure adaptée de la figure SPM5 du rapport du groupe de travail n°2 du GIEC [Field et al. 2014].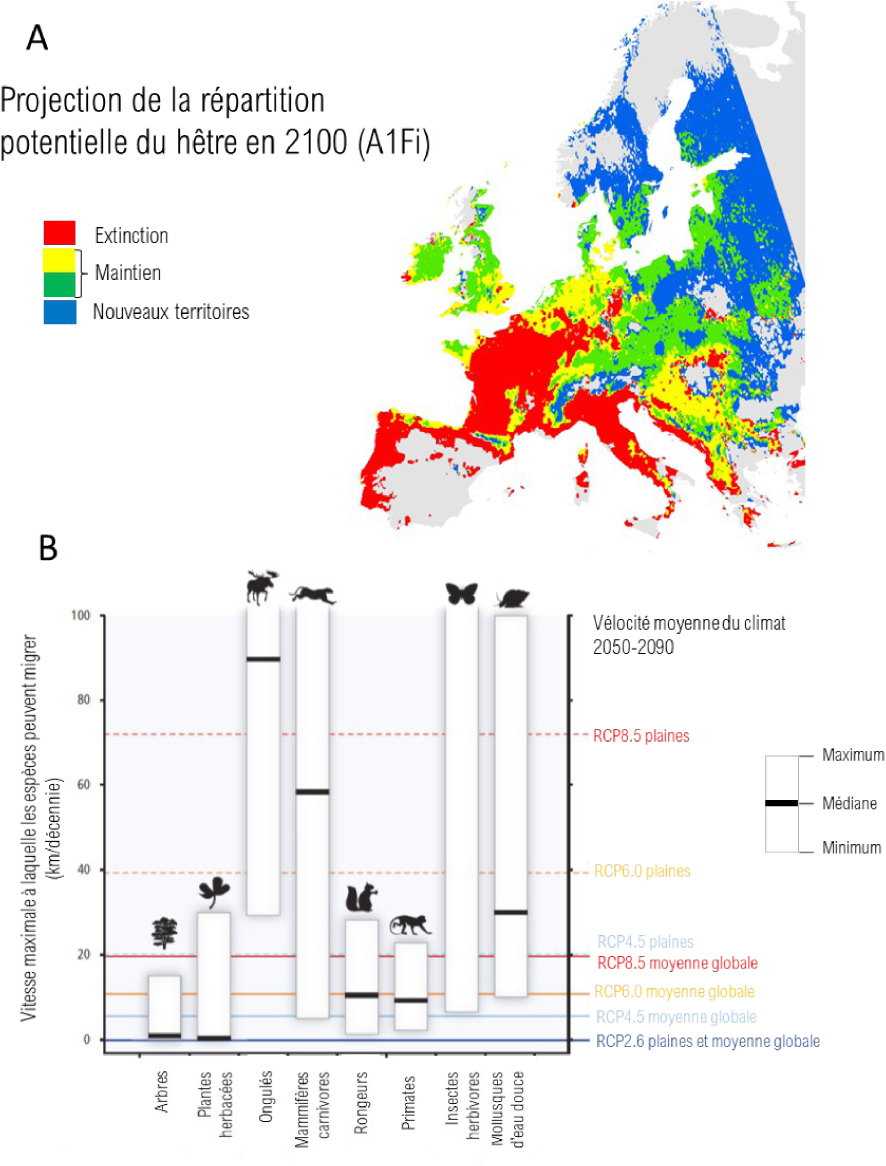
Un autre moyen d’adaptation des espèces au changement climatique est ce qu’on appelle la plasticité phénotypique, lorsque celle-ci est adaptative [Merilä and Hendry 2014]. La plasticité phénotypique adaptative est la capacité à maintenir un certain niveau de performances quand les conditions changent, ceci grâce à une modification de l’expression des gènes (Figure 3). Par exemple la vitesse de croissance des bourgeons au printemps change en fonction de la température, et la date d’éclosion des bourgeons sera d’autant plus précoce que le printemps aura été chaud. Mais cette plasticité n’est pas toujours adaptative. En utilisant des modèles capables de décrire la plasticité de la date de débourrement, ainsi que la relation entre la date de débourrement et les performances de l’arbre, Duputié et al. [2015] ont montré que dans les conditions climatiques futures, la plasticité de la date de débourrement sera très majoritairement avantageuse chez le chêne et aidera cette espèce à se maintenir dans une certaine mesure dans les nouvelles conditions climatiques, alors qu’elle sera désavantageuse chez le pin sylvestre qui risque de disparaitre d’une grande partie de l’Europe de l’ouest car la plasticité aura atteint ses limites chez cette espèce.
Enfin, l’adaptation ultime au changement climatique est l’évolution génétique sous l’effet de la sélection naturelle engendrée par le changement climatique lui-même. Le changement climatique exerce une pression de sélection très forte sur les êtres vivants. L’existence d’adaptations génétiques locales chez des organismes à grande aire de répartition et ayant des flux de gènes élevés (qui tendent au contraire à homogénéiser génétiquement les populations) en sont une des preuves [Alberto et al. 2013]. Les preuves scientifiques d’évolution génétique sous l’effet du changement climatique se multiplient [Merilä and Hendry 2014]. Un des exemples les plus faciles à comprendre est celui de l’évolution de la durée du jour induisant l’entrée en diapause hivernale (état temporaire de réduction forte de l’activité physiologique et métabolique) chez le moustique. En cinq ans, la durée du jour induisant la diapause chez ce moustique a diminué d’une heure en réponse au changement climatique, permettant au moustique de poursuivre son activité plus longtemps à l’automne qu’auparavant [Bradshaw and Holzapfel 2008]. Cette évolution génétique de la sensibilité du moustique à la durée du jour pour entrer en diapause s’explique par le fait que les températures plus chaudes à l’automne permettent au moustique de poursuivre son activité et sa reproduction, et qu’il devient donc avantageux de rentrer en diapause plus tard. Ainsi, les gènes présents dans les populations de moustiques qui induisaient une entrée en diapause plus tard que les autres gènes présents en répondant à une durée du jour plus courte ont été sélectionnés et se sont propagés dans les populations. Mais le moustique a un temps de génération extrêmement court. Il est capable de faire plusieurs générations par an. La sélection naturelle est donc très efficace chez cette espèce car la sélection opère plusieurs fois par an. La sélection naturelle sera également d’autant plus efficace que la diversité génétique dans les populations sera élevée et que les tailles de population seront élevées. Mais toutes les espèces ne remplissent pas ces conditions. Beaucoup d’espèces ont des temps de génération très longs, comme par exemple beaucoup de grands mammifères et les arbres. Par ailleurs, la diversité génétique est souvent faible chez les espèces rares [Gitzendanner and Soltis 2000] et elle a eu tendance globalement à diminuer chez les espèces domestiquées par l’homme [FAO Commission on Genetic Resources for Food and Agriculture 2019] [Wolff 2004] et les espèces dont la superficie des habitats a été beaucoup réduite par les activités humaines [Allentoft and Brien 2010]. Nos capacités à prévoir à quelle vitesse les espèces vont réussir à s’adapter génétiquement au changement climatique sont actuellement très faibles car nous sommes encore loin de comprendre les bases génétiques sous-jacentes aux réponses évolutives au changement climatique (mais voir [Gauzere et al. 2020]). L’homme a cependant deux moyens à sa disposition pour accélérer la sélection naturelle dans les populations naturelles : augmenter la diversité génétique dans les populations en procédant à des flux de gènes assistés, et augmenter les superficies des habitats des espèces afin d’augmenter les tailles de population par exemple en restaurant les habitats dégradés ou en augmentant les surfaces des aires protégées. Ces moyens d’intervention, comme la migration assistée, ont des coûts importants. Néanmoins, le second levier d’action, à savoir augmenter les superficies des habitats des espèces, rentre déjà dans certaines préconisations relatives aux Objectifs de Développement Durable que la France a ratifiés, et il sera sans doute le plus efficient et le plus durable.
5. Conclusion
Le changement climatique affecte profondément la biosphère de très nombreuses manières, car les conditions climatiques déterminent les performances des organismes vivants, leur capacité à se reproduire et à survivre. Ces modifications des performances des organismes vivants modifient en conséquence le fonctionnement des écosystèmes, la répartition géographique des espèces, et la biodiversité. Le changement climatique est actuellement la troisième cause de perte de biodiversité et risque de devenir à court terme la première. Les moyens d’adaptation au changement climatique sont limités pour de très nombreuses espèces. Ainsi, au-delà de la nécessaire réduction drastique des émissions de gaz à effet de serre pour limiter le réchauffement climatique, il est également nécessaire d’agir fortement sur les autres causes de perte de biodiversité et de mettre en œuvre des solutions fondées sur la nature. Les solutions fondées sur la nature sont des actions visant à protéger, gérer de manière durable et restaurer des écosystèmes naturels ou modifiés pour relever directement les défis de société de manière efficace et adaptative, tout en assurant le bien-être humain et en produisant des bénéfices pour la biodiversité [UICN 2018]. Seules ces solutions permettront de restaurer et de maintenir les processus écologiques et les processus évolutifs qui permettront aux espèces de faire face efficacement et durablement au changement climatique. De plus, les mesures d’atténuation du changement climatique et de protection de la nature peuvent être synergiques (par exemple enrayer la déforestation, reboiser de manière raisonnée, améliorer la santé des sols, les pratiques agricoles, etc …).



 CC-BY 4.0
CC-BY 4.0