1. Introduction
Il y a plus d'un demi-siècle, Hench et al. [1971] ont développé la première composition de verre bioactif, appelée plus tard Bioglass 45S5. Ce matériau est généralement considéré comme le point de départ de l'ensemble du domaine des matériaux bioactifs [Jones 2013], qui comprend, outre les verres, d'autres matériaux tels que la vitrocéramique [Vogel et Höland 1987], la céramique et même certains métaux tels que le titane prétraité [Kim et al. 1997]. Bioglass 45S5 se compose de 46,1 SiO2, 2,6 P2O5, 26,9 CaO et 24,4 Na2O (en pourcentages molaires ; composition souvent citée en pourcentages pondéraux : 45 SiO2, 6 P2O5, 24,5 CaO et 24,5 Na2O). Larry Hench a sélectionné les composants pour de bonnes raisons : Na, Ca et P sont tous des éléments physiologiques naturellement présents dans le corps humain, et Si est un élément essentiel présent dans le corps à de faibles concentrations. Son raisonnement était qu'un matériau composé de ces éléments s'intégrerait bien au corps et ne serait pas encapsulé dans du tissu fibreux interfacial [Hench 2006]. C'était le point de départ naturel, et les résultats ultérieurs lui ont prouvé qu'il avait raison : Bioglass 45S5 est devenu le premier matériau synthétique à former une liaison intégrée avec les tissus du corps humain, y compris non seulement les os [Hench et Paschall 1973], mais aussi les tissus mous [Hench 1991]. Il a en outre été montré que les ions, en particulier les espèces de silice solubles, libérés du verre stimulaient la prolifération des ostéoblastes [Xynos et al. 2000] et régulé à la hausse divers gènes ostéoblastiques, y compris certains impliqués dans le métabolisme et l'homéostasie osseuse [Xynos et al. 2001]. L'intégration avec les tissus corporels est possible grâce à une couche de surface d'apatite biomimétique qui se forme lorsque Bioglass 45S5 est en contact avec des solutions physiologiques, et à laquelle les cellules corporelles, telles que les ostéoblastes, adhèrent et prolifèrent [Hench et Paschall 1973].
Malgré le raisonnement compositionnel de Hench, le développement du Bioglass 45S5 peut être décrit, dans une certaine mesure, comme une supposition éclairée. Larry Hench lui-même a souvent raconté comment ses recherches sur la recherche de compositions de verre adaptées aux matériaux d'implants ont été déclenchées par une rencontre fortuite avec un colonel de l'armée américaine [Hench 2006]. Ce colonel savait par expérience pendant la guerre du Vietnam que de nombreux soldats blessés perdaient leurs membres simplement parce que leur corps rejetait les matériaux d'implants disponibles à l'époque, et il a mis au défi Larry Hench d'utiliser ses connaissances en science du verre pour développer un matériau qui serait accepté par le corps humain. Larry Hench a relevé ce défi et, après avoir assuré la liaison avec des collègues du domaine médical, a demandé avec succès un financement de l'armée américaine et s'est lancé dans un projet de recherche qui aboutirait au Bioglass 45S5. Il n'y avait cependant aucun travail antérieur sur lequel s'appuyer, aucun autre matériau synthétique connu, inorganique ou organique, connu pour se lier chimiquement aux tissus corporels. Aujourd'hui, des chercheurs de nombreux domaines, notamment la biologie cellulaire, la médecine, la biomédecine ou la dentisterie, recherchent activement des verres bioactifs. Néanmoins, ce sont des scientifiques et des ingénieurs en matériaux tels que Larry Hench lui-même, un ingénieur en céramique, que nous devons remercier pour avoir développé les premiers verres bioactifs [Hench 2006].
L'optimisation du verre bioactif reste un sujet d'actualité, même cinquante ans après les premières études réussies. La raison du succès du développement des compositions de verre bioactif est enracinée dans leur nature vitreuse, car les verres sont d'excellents solvants pour presque tous les éléments. Les propriétés du verre dépendent des éléments inclus, de leurs concentrations et de la structure atomique résultante. Aujourd'hui, le développement de nouveaux implants bioactifs à base de verre est hautement interdisciplinaire et en partie guidé par notre meilleure compréhension des rôles de divers éléments dans les processus cellulaires. Les premiers verres bioactifs étaient constitués de cinq éléments Na, Ca, Si, P et O ; aujourd'hui, plus de 30 éléments ont été étudiés pour leurs effets thérapeutiques potentiels dans les verres destinés aux implants [Hoppe et al. 2011 ; Hupa et Karlsson 2017].
Les verres bioactifs de type Hench sont des verres de silicate contenant souvent de plus petites quantités d'un deuxième formateur de verre, de phosphate ou de borate. Essentiellement, le choix des principaux composants vitrifiants dans les verres bioactifs repose sur notre compréhension de la chimie et de la technologie des verres silicate sodocalcique conventionnels. En outre, les progrès récents de la biologie moléculaire ont encouragé les chercheurs à explorer si les dopants peuvent apporter des avantages supplémentaires pour la régénération tissulaire. Cependant, l'augmentation du nombre d'éléments dans les verres bioactifs nécessite une compréhension détaillée de la structure du verre et de son impact sur les propriétés pour trouver et optimiser la composition la plus appropriée pour une application clinique spécifique.
Les compositions de verre bioactif sélectionnées doivent non seulement fournir les propriétés souhaitées pour le dispositif lorsqu'elles sont en contact avec le corps humain, mais le choix de la composition doit également permettre une production économique et fiable du matériau. Cette revue discute des différentes approches adoptées lors du développement et de l'optimisation des compositions de verre bioactif. L'accent est mis sur l'impact des techniques d'analyse structurelle pour fournir une compréhension de la structure du verre bioactif au niveau atomique et de la modélisation de la composition en tant qu'outil puissant pour adapter de nouvelles compositions de verre bioactif.
2. Développement du verre basé sur des séries statistiques
Lors de l'optimisation des compositions de verre bioactif pour une application particulière, des études expérimentales approfondies sont nécessaires pour confirmer que les compositions, qui sont généralement multicomposantes, sont adaptées à l'usage, en particulier en ce qui concerne les interactions matériau/tissu. Cela comprend des études telles que la dégradation in vitro, la minéralisation et la libération d'ions [Nommeots-Nomm et al. 2020], diverses études sur la culture cellulaire [Jablonská et al. 2020] et, in fine, des expérimentations animales et des études cliniques. Outre ces propriétés chimiques et biomédicales, les propriétés physiques du verre doivent également être prises en compte, et le traitement à haute température du verre dans la forme de produit souhaitée est un défi supplémentaire. Par exemple, les verres bioactifs dérivés de la fusion utilisés cliniquement sont sujets à la dévitrification en raison de leur faible teneur en formateurs de réseau de verre. Ici, l'intérêt actuel pour le développement de constructions poreuses tridimensionnelles (généralement appelées « échafaudages ») et de produits à base de fibres qui imitent la structure des tissus tels que la matrice extracellulaire a appelé à des compositions de verre bioactif qui permettent un traitement flexible à haute température sans compromettre les propriétés de bioactivité. Une fois que les expériences ont été effectuées sur un ensemble suffisamment grand d'échantillons, les routines d'optimisation informatisées offrent un moyen de trouver des compositions qui satisfont un ensemble de propriétés prédéterminées [Vedel et al. 2009 ; Westerlund et al. 1983], et des modèles statistiques ou autres décrivant les relations propriété/composition sont des outils utiles pour l'optimisation de la composition.
Les propriétés des verres bioactifs ont été caractérisées dans de nombreuses études. Les études systématiques in vivo de Hench et de ses collègues ont identifié des plages de composition dans le système Na2O–CaO–P2O5–SiO2 qui se sont chimiquement liées aux os et aux tissus mous [Hench et Wilson 1984]. En outre, plusieurs études systématiques discutent de l'impact de la substitution progressive d'un élément à un autre sur les propriétés des verres bioactifs commerciaux bien connus tels que le Bioglass 45S5 [Blochberger et al. 2015 ; O’Donnell et al. 2010 ; Tylkowski et Brauer 2013] ou BonAlive S53P4 [Massera et al. 2012 ; Massera et Hupa 2014 ; Wang et al. 2017]. Ces études avec des analyses structurelles (discutées plus loin ci-dessous) visent à identifier l'effet d'un composant en verre particulier sur les propriétés du verre bioactif. L'effet des substitutions ioniques est discuté en détail dans la section 4.
Pour l'optimisation du verre par analyse de régression, aucun changement systématique (tel que le remplacement d'un élément par un autre) n'est nécessaire. Au lieu de cela, un ensemble suffisamment grand de compositions est nécessaire pour décrire mathématiquement la relation composition/propriété. Ici, ces séries compositionnelles sont décrites comme « statistiques », car elles comprennent la variation de plusieurs composants ou potentiellement de tous les composants. Dans cette approche, l'impact de chaque composant sur les propriétés du verre a été estimé en utilisant des fonctions linéaires de la composition molaire dans certaines limites de composition. Étant donné que chaque constituant a un effet spécifique sur chaque propriété, la prédiction des performances globales du verre exige que toutes les propriétés pertinentes puissent être exprimées en fonction de la composition. Au fil des ans, plusieurs relations composition/propriétés ont été développées pour diverses propriétés des verres sodocalciques conventionnels, comme décrit dans divers manuels [Musgraves et al. 2019 ; Scholze 1991].
Dans le groupe de Kaj Karlsson à l'Université Abo Akademi de Turku, en Finlande, cette approche de régression a été utilisée avec succès dans la conception de verres bioactifs. Andersson et al. [1990] ont utilisé 16 compositions statistiquement sélectionnées dans le système 46-65,5 SiO2, 15–30 Na2O, 11–25 CaO, 0–8 P 2 O5, 0–3 Al 2O 3 et 0–3 B2O3 (en % en poids) pour étudier l'impact de la composition de verre sur la liaison osseuse lorsqu'elle est implantée dans le tibia de rat pendant huit semaines. De plus, le type de contact osseux a été évalué pour chaque composition. De plus, ils ont mesuré la perte de poids in vitro et analysé la qualité des couches superficielles riches en silice et en hydroxyapatite formées lors de l'immersion in vitro. Sur la base de ces caractéristiques, les verres ont été divisés en groupes de capacité de liaison osseuse comparable, qui a été évalué par une valeur numérique (allant de 1 à 6) et appelé le nombre de réaction (RN). Cette approche a permis de quantifier les combinaisons de propriétés pour réaliser un modèle de dépendance à la composition pour la bioactivité. Andersson et al. ont utilisé l'analyse de régression des observations pour décrire RN en fonction de la composition du verre donnée en pourcentages pondéraux (1). L'idée était d'utiliser ce calcul pour sélectionner des compositions prometteuses supplémentaires sans avoir à passer par l'ensemble complet des caractérisations expérimentales pour de grands ensembles de compositions de verre. Au lieu de cela, seules les compositions donnant des valeurs RN de 5 ou plus ont été supposées répondre aux critères de bioactivité et de liaison osseuse et seraient testées expérimentalement.
| (1) |
Brink et ses co-auteurs ont utilisé une approche similaire d'une série statistique de 26 compositions dans le système Na2O–K2 O-MgO-CaO-B 2O3–P2O5–SiO2 pour établir l'impact de la composition du verre sur le traitement à haute température [Brink 1997a] et les propriétés in vivo [Brink et al. 1997] de verres bioactifs. Les premiers verres bioactifs ont spontanément cristallisé lors d'un traitement à haute température, ce qui a rendu difficile le frittage des verres en échafaudages poreux ou l'étirage de fibres continues. On a supposé que K2O et MgO amélioraient les propriétés de travail à chaud de ces verres de silicate bioactif (39–70 % en poids de SiO2), similaires à ce qui est connu pour les verres silico-sodo-calciques conventionnels. Al2O3 n'a pas été inclus dans cette série car il avait été démontré que des teneurs d'environ 2 % en poids dans le verre induisaient des effets indésirables sur la liaison osseuse [Andersson et al. 1993]. Les verres ont été étudiés dans le tibia de lapin pendant 8 semaines, après quoi la liaison osseuse a été évaluée et la présence de couches de surface riches en silice et en hydroxyapatite a été étudiée. Ces observations in vivo ont été notées par des valeurs numériques de 1 à 4, appelées indice d'activité de surface (ISA) et incluses par la suite dans une analyse de régression en fonction de la composition du verre en pourcentages pondéraux (2) [Brink et al. 1997].
| (2) |
Plus tard, plusieurs autres modèles de régression de propriétés/composition ont été publiés pour décrire les propriétés physiques et in vitro de verres bioactifs supplémentaires [Arstila et al. 2008 ; Vedel et al. 2008 ; Zhang et al. 2009]. Vedel et al. [2009] ont utilisé ces modèles pour optimiser de nouveaux verres bioactifs aux propriétés prédéfinies. Ici, des verres bioactifs 45S5, S53P4 et 13–93 et certains des nouveaux verres optimisés ont été implantés dans le fémur de rat jusqu'à 8 semaines. Certains résultats de ces études in vivo ont ensuite été discutés par Fagerlund et al. [2013] et ont montré qu'en général, la libération d'ions in vitro à partir des verres et les valeurs calculées d'ARN et d'AIS étaient corrélées avec la formation de la couche réactionnelle observée in vivo. Ces résultats suggèrent que les modèles de régression fournissent des informations précieuses pour l'optimisation de la composition.
Une critique des modèles RN et ISA décrits ci-dessus est qu'ils sont basés sur la composition en pourcentages pondéraux. Si nous voulons relier les résultats de ces études à la structure du verre atomique, l'utilisation de modèles basés sur la composition molaire du verre (c'est-à-dire les pourcentages molaires) serait beaucoup plus perspicace. Cela pourrait même nous permettre de comprendre pourquoi les différents composants du verre affectent l'équation de régression comme ils le font. Cependant, l'idée de ces modèles de régression était de les utiliser dans une routine informatisée pour l'optimisation de la composition, où l'utilisation de modèles basés sur le poids ne présentait aucun inconvénient par rapport aux modèles basés sur les pourcentages molaires. Un point supplémentaire à considérer est que ces modèles ne sont valables que pour la gamme de composition couverte par les composants inclus dans l'élaboration du modèle de régression. Cela soulève la question de savoir si de tels modèles sont vraiment prédictifs ou seulement descriptifs : s'ils semblent bien fonctionner pour décrire la relation composition/propriété des verres inclus, il reste à confirmer dans chaque cas s'ils sont également utiles pour nous aider à concevoir et sélectionner de nouvelles compositions bioactives. Un autre inconvénient de ces approches de régression relativement simples est qu'elles se concentrent sur une seule propriété du verre par équation. Si nous voulons combiner plusieurs propriétés à la fois, par exemple la bioactivité avec un bon traitement à haute température, des approches de régression plus sophistiquées peuvent offrir des avantages. À notre connaissance, cependant, aucune étude de ce type n'a été réalisée sur les verres bioactifs.
L'augmentation des quantités de données disponibles pour décrire les propriétés du verre affectant la fabrication du verre ainsi que les performances du verre dans l'application finale ouvre la voie à une optimisation améliorée de la composition. Des approches plus modernes pour optimiser les compositions de verre utilisent l'apprentissage automatique et l'intelligence artificielle pour concevoir de nouvelles compositions de verre et même des produits [Mauro 2018 ; Venugopal et al. 2021 Jusqu'à présent, cette approche n'a pas été beaucoup utilisée dans le domaine des verres bioactifs. Dans une étude, le comportement de dissolution des verres phosphatés pour des applications biomédicales a été décrit à l'aide de réseaux de neurones artificiels, ANN [Brauer et al. 2007). Comme ANN génère uniquement des modèles de boîtes noires, l'interprétation d'une ANN n'est pas nécessairement facile. Pour cette raison, Echezarreta-Lopez et Landin [2013] ont utilisé une approche de logique neurofluzzy, qui combine les capacités d'apprentissage adaptatif ANN avec la représentation de logique floue à travers des règles simples telles que IF… PUIS les règles. Leur étude, qui constitue à notre connaissance la seule étude portant sur les verres bioactifs à base de silicate, a étudié les facteurs affectant l'activité antibactérienne du verre bioactif. Les auteurs ont collecté des données de la littérature, les combinant dans une grande base de données qu'ils ont ensuite analysée en utilisant la logique neurofuzzy. Leurs résultats montrent que, sur la base des données disponibles, l'activité antibactérienne du verre bioactif est principalement déterminée par la libération de cations de métaux alcalins du verre dans le milieu de culture et l'augmentation concomitante du pH. Les conditions microbiologiques telles que les milieux de culture et le temps n'ont pas eu d'impact significatif sur les résultats, à condition qu'elles soient adaptées à la culture des espèces bactériennes étudiées.
L'apprentissage automatique est un outil prometteur pour comprendre, concevoir et optimiser les verres bioactifs. L'une des raisons pour lesquelles il est utilisé avec parcimonie réside probablement dans le fait que de grands ensembles de données sont nécessaires. Dans les études sur les verres bioactifs, des ensembles relativement petits de différentes compositions sont généralement étudiés. Cela signifie que pour des analyses significatives utilisant des outils d'apprentissage automatique, les résultats de nombreuses études différentes doivent être combinés. Malheureusement, les conditions expérimentales lors de l'étude des verres bioactifs, en particulier pour les expériences d'immersion in vitro et de culture cellulaire, varient considérablement, ce qui soulève des doutes quant à la comparabilité réelle des résultats. Pour cette raison, les membres du comité technique 04—Bioglasses de la Commission internationale du verre ont récemment présenté une méthode unifiée pour effectuer des expériences d'immersion acellulaire sur des verres bioactifs [Maçon et al. 2015). Idéalement, des approches plus standardisées pour caractériser d'autres propriétés du verre seront adoptées par la communauté du verre bioactif dans un proche avenir.
3. Les analyses structurelles comme fondement de nouvelles stratégies de conception
Pendant longtemps, les analyses structurelles détaillées ont été contraintes par le manque d'ordre périodique, c'est-à-dire cristallin, des verres dans leur structure. De nos jours, cependant, nous disposons de plusieurs outils analytiques pour étudier la configuration atomique des verres. En particulier, les progrès de la spectroscopie par résonance magnétique nucléaire (RMN) à l'état solide ont permis d'obtenir un aperçu détaillé de la structure du verre à courte portée et, dans une certaine mesure, à moyenne portée. Un avantage clé de la spectroscopie RMN à l'état solide est que le procédé examine un noyau spécifique à la fois (des exemples typiques dans la recherche sur le verre étant 29Si, 31P ou 11B pour analyser les réseaux de verre mais aussi 19F ou 23Na), ce qui signifie que même dans les compositions à plusieurs composants, telles que celles de nombreux verres bioactifs, l'interprétation des données peut être beaucoup plus facile que, par exemple, pour la spectroscopie vibrationnelle. Combiné avec d'autres outils d'analyse structurelle, y compris les spectroscopies Raman et infrarouge (IR) [Sawangboon et al. 2020] ainsi que des expériences de diffraction des rayons X et des neutrons [Martin et al. 2012] mais aussi la simulation informatique [Christie et al. 2011], nous pouvons maintenant avoir un aperçu de la façon dont les atomes de nombreux systèmes de verre bioactif sont organisés. Cela nous permet d'établir des relations structure/propriété en plus des relations composition/propriété discutées ci-dessus.
L'une des premières études structurelles sur les compositions de verre bioactif par spectroscopie RMN à l'état solide a été réalisée par Lockyer et al. 1995 : Leur principale conclusion était que le phosphate ne faisait pas partie d'un réseau de phosphosilicate (ou « squelette ») du verre mais était présent sous forme de groupes orthophosphates isolés. Cela a ensuite été confirmé par des études de spectroscopie RMN à l'état solide très détaillées utilisant du Bioglass 45S5 enrichi en 17O et 29 Si [Pedone et al. 2010], bien que peu de spectroscopie RMN [Fayon et al. 2013] et des études de simulation informatique [Tilocca et Cormack 2007] ont trouvé de petites quantités de liaisons Si-O-P.
À peu près au même moment, Hill [1996], un scientifique des polymères de formation, visait à trouver un moyen de prédire si une composition de verre particulière serait bioactive ou non, et il a publié son point de vue sur la façon dont la bioactivité était liée non seulement à la composition du verre, mais aussi à la structure. Il a noté que le degré de polymérisation du réseau de silicate, qu'il a appelé « connectivité réseau » (NC), était particulièrement utile pour prédire la bioactivité d'un silicate ou d'un verre de phosphosilicate donné. Il convient de noter que dans la publication de Hill, les valeurs calculées de la NC sont incorrectes, très probablement parce que, au moment de la rédaction, Hill n'était pas au courant de l'étude de spectroscopie RMN à l'état solide de Lockyer et al. [1995] montrant que le phosphate présent dans les verres bioactifs était principalement de l'orthophosphate. Hill a donc supposé que tout le phosphate faisait partie du réseau de silicate connecté via des liaisons Si-O-P. Depuis lors, les calculs de NC en tenant compte ont été décrits à plusieurs reprises dans la littérature [Brauer et al. 2009 ; Brauer 2015 ; Hill et Brauer 2011].
Le raisonnement derrière l'approche de connectivité réseau est que les verres de silicate peuvent être décrits comme des polymères inorganiques, et que leurs propriétés, par exemple, leurs propriétés thermiques ou leur tendance à la cristallisation, sont déterminées dans une large mesure par le degré de polymérisation du réseau ou NC. Un réseau de silicate plus perturbé avec de fortes concentrations d'atomes d'oxygène non pontants (NBO) causées par de fortes concentrations de modificateurs facilite également l'intrusion d'eau, permettant ainsi le processus initial d'échange d'ions qui est une exigence pour la libération d'ions et la formation d'une couche superficielle d'apatite des verres bioactifs. L'importance de la NBO dans ce processus a été visualisée de manière impressionnante par des simulations informatiques [Tilocca et Cormack 2011]. Expériences de libération dynamique d'ions [Fagerlund et al. 2013] a mis en évidence des différences prononcées entre les verres bioactifs et les compositions de silicate conventionnelles et a illustré comment les verres à NC plus élevé (en raison de la teneur plus élevée en silice) libèrent moins d'ions mais les libèrent également plus lentement. Bien qu'il ne soit pas possible de définir une valeur seuil claire dans la NC au-dessus de laquelle la libération d'ions et la bioactivité sont entièrement entravées, les deux diminuent considérablement à mesure que la NC augmente [Brauer 2015].
Lors de la réalisation de substitutions ioniques dans un verre bioactif, le maintien d'une connectivité réseau constante permet de maintenir la bioactivité. Il permet également d'étudier l'impact des substitutions sur la bioactivité sans que cela ne soit affecté par les modifications de la NC. Ceci est plus facilement réalisé en effectuant des substitutions sur une base atomique (ou molaire) [O'Donnell et Hill 2010]. Sur la base de ce principe, une version partiellement substituée au strontium de Bioglass 45S5 a été développée, qui a ensuite été commercialisée sous le nom de StronBone™ [Jones et al. 2016 ; O’Donnell et al. 2010]. La nécessité de maintenir une NC constante a également été illustrée dans des études sur l'augmentation des teneurs en phosphate dans les verres bioactifs afin d'augmenter le taux de formation de couche superficielle d'apatite in vitro [Hill et Brauer 2011 ; O’Donnell et al. 2008, 2009] et sur l'incorporation de fluorure afin d'optimiser les verres bioactifs pour les applications de santé dentaire et bucco-dentaire [Brauer et al. 2009 ; Gentleman et al. 2013]. En combinaison [Mneimne et al. 2011], ces études ont abouti au développement d'un verre bioactif (BioMin®) pour application dans les dentifrices [Jones et al. 2016].
La figure 1 montre la dépendance compositionnelle et structurelle du contact osseux in vivo des verres bioactifs dans le système Na2O–K2O–MgO–CaO–B2O3–P2O5–SiO2 à 8 semaines d'implantation dans le tibia de lapin [Brink et al. 1997]. Si nous regardons l'ensemble des données (Figure 1 a), nous observons une tendance à la diminution du contact osseux avec l'augmentation de la fraction molaire de silice et la diminution de la fraction molaire de modificateur. Un certain écart par rapport à cette tendance est susceptible d'être causé par les effets structurels du bore présent dans certains verres, qui peuvent être présents dans une coordination triple et quadruple et, par conséquent, affectent le degré global de polymérisation du réseau. Si nous ne regardons que les compositions sans borate (Figure 1b), la tendance est plus claire. La figure 1c illustre comment le contact osseux in vivo diminue avec la NC (calculé pour les verres sans borate uniquement, car aucune information structurelle n'était disponible pour les verres contenant du borate). Les grandes barres d'erreur proviennent des variations du type de modificateur présent ainsi que de la variation normale au cours des études impliquant des systèmes vivants. Dans la figure 1d, la variation des réactions de surface du verre bioactif pendant l'immersion dans un fluide corporel simulé (SBF, une solution de test acellulaire, dont la composition est similaire aux composants inorganiques du plasma sanguin) est également en corrélation avec le NC du verre [Brink 1997b] : les verres avec le NC le plus élevé n'ont montré aucune réaction de surface significative, tandis qu'avec le NC décroissant, la formation de couche de gel de silice et de phosphate de calcium a été observée. Cette couche de gel de silice est une couche superficielle de silicate appauvri en ions, tandis que la libération d'ions calcium et phosphate du verre (avec les ions présents dans la solution à tester, le SBF, et une augmentation concomitante du pH) provoque la précipitation de couches superficielles de type apatite cristalline biomimétique [Nommeots-Nomm et al. 2020.
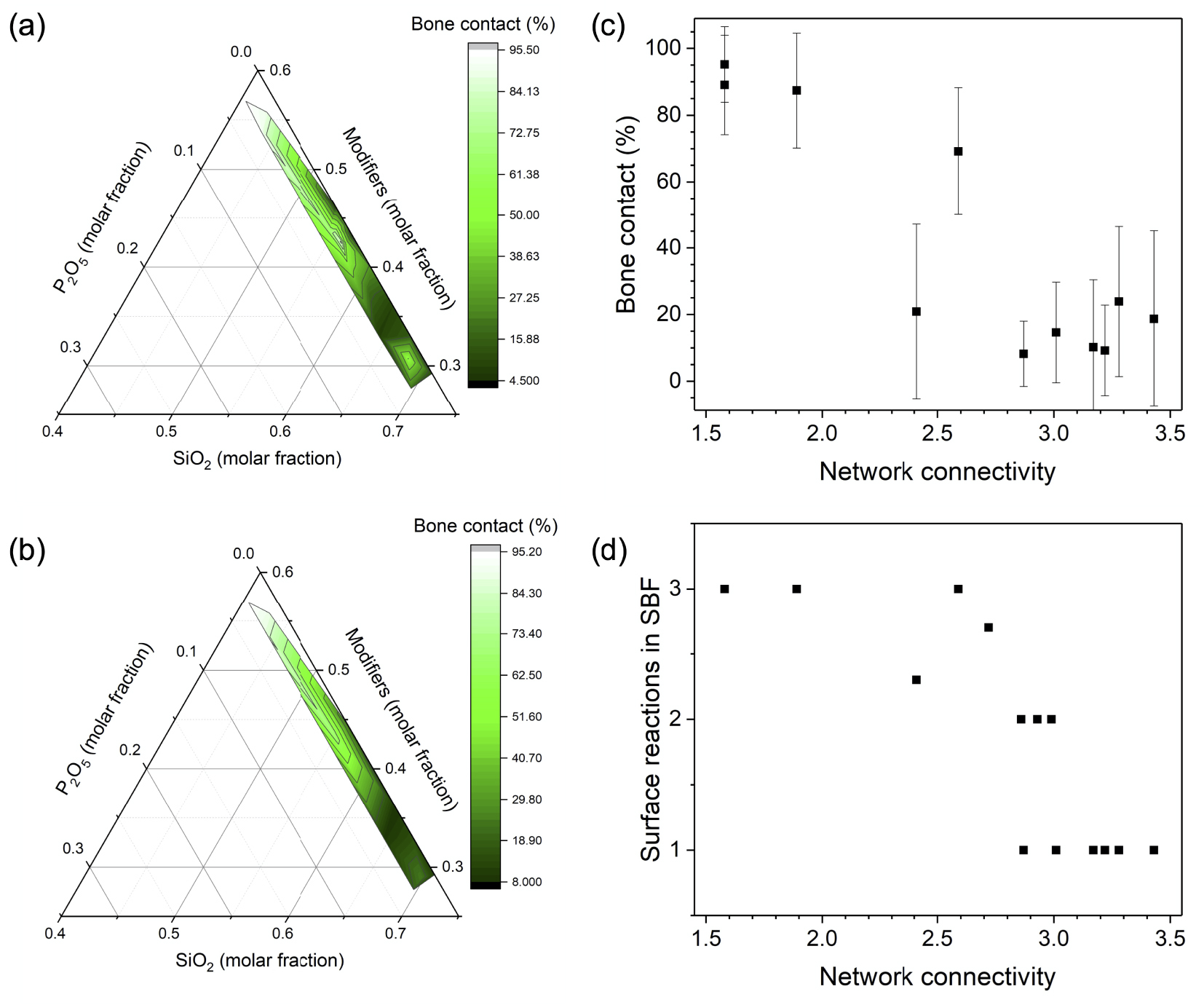
(a) Tracé ternaire du contact osseux in vivo (%) sur la composition molaire pour les verres bioactifs étudiés par Brink et al. [1997], (b) tracé ternaire du contact osseux in vivo (%) sur la composition molaire pour les verres bioactifs sans borate étudiés par Brink et al. [1997], (c) contact osseux in vivo (%) et (d) réactions de surface dans les fluides corporels simulés (SBF) vs connectivité réseau pour les verres bioactifs sans borate étudiés par Brink [1997b] (1 : surface de verre ne montrant aucun changement significatif après immersion dans les SBF (verres inertes), 2 : surfaces de verre constituées de couche de gel de silice, 3 : surfaces de verre complètement recouvertes de phosphates de calcium et étapes intermédiaires).
Aujourd'hui, en plus des enquêtes classiques sur la structure du verre, la théorie des contraintes topologiques fournit un outil supplémentaire pour décrire les relations structure/propriété dans les verres et pour personnaliser les compositions pour diverses applications fonctionnelles [Bauchy 2019 ; Smedskjaer et al. 2011]. La théorie a été inspirée par les connaissances sur la stabilité des fermes mécaniques ainsi que par les travaux de Zachariasen sur la structure en verre [Phillips et Thorpe 1985 ; Zachariasen 1932]. La théorie des contraintes topologiques réduit le réseau de verre à des nœuds (les atomes présents dans la structure de verre) qui sont contraints par des tiges (les liaisons chimiques entre les atomes, c'est-à-dire les contraintes chimiques). La rigidité du réseau qui en résulte permet de prédire diverses propriétés telles que la température de transition vitreuse ou la durabilité chimique [Mascaraque et al. 2017a, b]. La cinétique de dissolution du verre de silicate a également été étudiée en combinant la théorie des contraintes topologiques et l'apprentissage automatique [Liu et al. 2019], mais jusqu'à présent, aucune étude de ce type ne semble avoir été réalisée sur des verres bioactifs.
Un problème avec les enquêtes structurelles est que les résultats sont plus difficiles à interpréter pour les verres multicomposants, et la plupart des verres bioactifs ont tendance à contenir un nombre relativement élevé d'oxydes différents, y compris plusieurs formateurs de verre (en plus de SiO2 typiquement P2O5 mais souvent aussi B2O3) plus de nombreux modificateurs. Pour de nombreuses études, l'accès à des équipements hautement spécialisés est nécessaire, généralement disponibles dans des installations centralisées uniquement, y compris des expériences de diffraction des neutrons ou de diffraction des rayons X synchrotron, mais aussi des expériences RMN bidimensionnelles, ces dernières nécessitant souvent l'utilisation de matières premières enrichies en isotopes, ce qui augmente le coût des expériences. Cela signifie que si les études structurelles peuvent nous fournir une compréhension détaillée de la façon dont la structure atomique du verre et les propriétés macroscopiques sont liées, le nombre de compositions actuellement analysées est encore limité.
4. L'influence des modificateurs : aspects structurels et fonction thérapeutique
Les verres bioactifs sont connus pour contenir des concentrations relativement importantes de modificateurs de réseau par rapport aux concentrations présentes dans les verres de silicate conventionnels. Bien que la quantité de modificateurs présents affecte la NC, comme indiqué ci-dessus, le type de modificateurs présents détermine également les propriétés du verre bioactif. L'oxyde de calcium est un modificateur de réseau typique, et les ions calcium sont connus pour influencer la fonction des ostéoblastes (cellules osseuses). L'oxyde de sodium est présent dans la plupart des compositions de verre bioactif, mais sa fonction principale n'est pas biologique ou médicale, mais d'abaisser les températures de fusion et de traitement. Pour maintenir ces températures basses, des concentrations généralement élevées ont été utilisées, qui sont cependant connues pour augmenter la tendance à la cristallisation du verre.
Pour les verres avec un degré constant de polymérisation du réseau, les variations de l'intensité du champ modificateur (ou « rapport charge/taille ») déterminent de nombreuses propriétés. Par exemple, la plus grande intensité de champ du Ca2+ par rapport au Na+ (les deux ions ayant des rayons ioniques très similaires) réduit la mobilité au sein du réseau de verre et, par conséquent, augmente la transition vitreuse et les températures de fusion et réduit la tendance à la cristallisation pour les verres plus riches en calcium. C'est la raison pour laquelle les verres d'une composition située dans la région CaO–SiO2 du diagramme de phase montrent des tendances à la cristallisation plus faibles que les verres situés dans la région Na2O–2 CaO–SiO2 [Arstila et al. 2008 ; Vedel et al. 2007]. De même, les verres conçus pour un traitement amélioré à haute température, tels que le 13–93 [Brink 1997a], contiennent souvent du Mg2+ en plus des ions Ca2+. Les deux ions ont la même charge, mais les ions magnésium sont plus petits que les ions calcium, ce qui entraîne une plus grande intensité de champ.
De nos jours, cependant, les substitutions ioniques (figure 2) dans les verres bioactifs se concentrent davantage sur l'élargissement de la gamme thérapeutique des verres plutôt que sur l'amélioration des propriétés de base du verre [Hoppe et al. 2011]. L'idée est qu'en incorporant des ions possédant des propriétés thérapeutiques spécifiques, on peut élargir le spectre thérapeutique des verres bioactifs. Les éléments ajoutés pour les effets thérapeutiques comprennent le strontium pour traiter l'ostéoporose [Gentleman et al. 2010 ; O’Donnell et al. 2010], le cobalt pour stimuler la formation des vaisseaux sanguins [Azevedo et al. 2015], le lithium pour améliorer la régénération des tissus durs [da Silva et al. 2017] ou du zinc pour activer la formation osseuse [Aina et al. 2007]. Plusieurs éléments ont également été ajoutés pour induire des effets antibactériens autour de l'implant en verre bioactif en dissolution, par exemple, l'argent [Jones et al. 2006] ou le zinc. La figure 2 résume les éléments étudiés en tant que composants dans les verres bioactifs, soit en tant que composants principaux formant la structure vitreuse principale, soit en tant que dopants ajoutés pour être libérés à l'intérieur du corps, fournissant des effets thérapeutiques spécifiques. Mais il n'y a pas que les oxydes métalliques qui sont ajoutés pour optimiser les propriétés du verre bioactif. Fluorure [Mneimne et al. 2011] ou de chlorure [Chen et al. 2015] ont été incorporés dans des verres bioactifs pour une utilisation dans les soins bucco-dentaires.
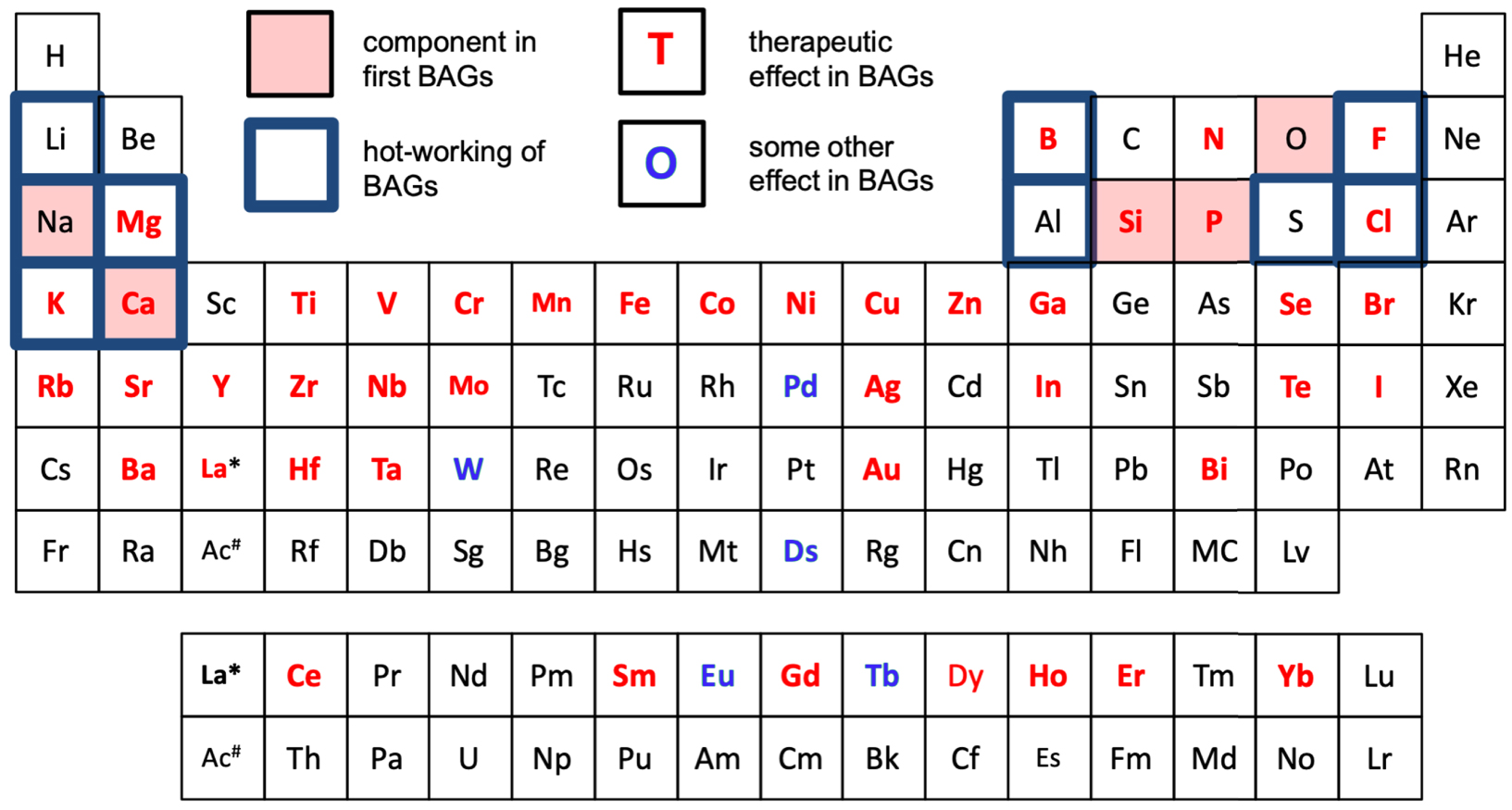
Tableau périodique résumant les éléments étudiés en tant que composants dans les verres bioactifs (BAGs) : principaux éléments, utilisés par exemple pour contrôler les propriétés thermiques (boîtes bleues) et éléments ajoutés pour leur effet thérapeutique spécifique sur les processus de cicatrisation des tissus (lettres rouges). De plus, les éléments utilisés comme dopants pour autre chose qu'un effet thérapeutique direct sont marqués (lettres bleues). Les références utilisées pour construire la figure ne sont pas données en raison du grand nombre d'articles traitant de l'optimisation de la composition et du dopage thérapeutique des verres bioactifs.
Dans les compositions libérant des ions, un équilibre doit être déterminé entre l'obtention d'un effet thérapeutique et l'absence de problèmes de toxicité généraux ou locaux. Les concentrations d'ions libérés doivent être suffisamment importantes pour activer les processus cellulaires souhaités sur une période de temps critique. D'autre part, des concentrations trop élevées peuvent induire des effets indésirables. Comme certains éléments explorés sont classés comme toxiques à certaines concentrations, la fenêtre thérapeutique peut être étroite et l'optimisation de la composition du matériau à implanter dans le corps humain est difficile. Le dopage avec des éléments de transition ou des métaux lourds, par exemple, va à l'encontre de l'idée originale de Larry Hench de composer des verres bioactifs d'éléments abondants dans le corps humain, mais peu d'études in vitro ont montré des résultats prometteurs. Néanmoins, l'utilisation physiologique ou médicale réelle doit rester au moins douteuse jusqu'à ce que des études in vivo ou cliniques aient fourni des informations fiables sur l'impact de la composition de verre bioactif sur les effets de régénération tissulaire souhaités. Jusqu'à présent, la plupart des études cliniques ont été réalisées pour les compositions Bioglass 45S5 et BonAlive S53P4 uniquement.
5. Conclusions
Alors que Larry Hench a souvent décrit son développement du premier verre bioactif comme une supposition éclairée, nous montrons comment les connaissances fondamentales et la compréhension de la science du verre ont été essentielles pour développer et optimiser les compositions de verre bioactif et favoriser leur utilisation clinique. Divers outils ont été utilisés au fil des ans, notamment la modélisation de régression, les analyses structurelles et l'apprentissage automatique. L'optimisation de la composition pour identifier les verres appropriés comme matériaux d'implant nécessite une compréhension interdisciplinaire de la science du verre et de la biomédecine. De plus, le transfert d'une composition prometteuse vers des applications cliniques nécessite une connaissance approfondie du travail réglementaire nécessaire. Néanmoins, les outils d'optimisation des propriétés du verre sont un premier pas important vers de nouveaux biomatériaux, et ils peuvent même offrir des moyens réalisables de minimiser les travaux expérimentaux et les études animales.
Conflits d’intérêts
Les auteurs n'ont aucun conflit d'intérêts à déclarer.




 CC-BY 4.0
CC-BY 4.0