Abridged English version
Morocco is the world leader in rock phosphate production. Industrial processing of its mines generates chemical wastes that are discharged directly into the Atlantic Ocean at Jorf Lasfar (JL), 120 km south of Casablanca, without any treatment. In order to evaluate the adverse effects of these wastes on the recipient media, we collected mussels (Mytilus galloprovincialis) from Jorf Lasfar and Oualidia (OL), located 70 km south from JL. Oualidia does not host any platform of rock phosphate processing. For this purpose, mussels samples were dried (1 g), hammer-milled, mineralized in the laboratory, and completed to 20 ml. Metal concentrations were assayed on the obtained solutions. To evaluate eventual effects of mussel pollutants on mammals, we used the technique of mice cramming with mussel powder during a period of five days. The brain, heart, liver, kidneys, and entire body of mice were weighed after the test. Concentrations of heavy metals, Cd, Cr, and Pb, were determined in main organs (liver and kidneys).
Results indicated that metal concentrations in mussels depended on the collection date. Concentrations of Cd were higher at JL than at OL, 80–199 versus 23 μg/g mussel dry weight. Cramming mice with mussel powder obtained in either location did not increase Cd, Cr, or Pb concentrations in mice liver or kidneys. However, it increased urea and glucose in urine and reduced relative kidney weight in all animals. Mice body weight was significantly reduced by mussels collected at Oualidia. This body weight reduction was accompanied by increase creatinuria. Extrapolating these results to man could not be convincing, unless toxicological, and epidemiological studies are conducted on a large scale. However, these mussels should not be recommended for human consumption.
1 Introduction
Les activités de production industrielle génèrent des déchets de diverse nature qui, déversés dans l'environnement marin, sont susceptibles de nuire à l'écosystème. Cette pollution des écosystèmes marins est à mettre en relation avec la production de toxines marines de diverses natures. Dans certaines conditions de pollution marine, des micro-algues peuvent produire des toxines qui se concentrent dans les moules, dont la consommation engendre des intoxications chez l'homme [1,2]. Les toxines marines (l'acide okadaïque et ses dérivés) sont impliquées dans la peroxydation lipidique et l'inhibition de la synthèse d'ADN et des protéines [3,4]. Des études de cytotoxicité sur des cellules intestinales humaines (Caco-2) [5,6] ont montré que des métaux lourds, en particulier le Cd, et des toxines marines ont un effet synergique dans la peroxydation lipidique et dans la modification des bases puriques et pyrimidiques (m5dC, 8-OH-dG). Plusieurs chercheurs ont déjà utilisé les souris pour évaluer la toxicité globale des extraits de moules [7,8].
Au Maroc, plusieurs épisodes d'intoxication consécutifs à la consommation de fruits de mer ont déjà été observés, en 1971 à Casablanca, Safi, Mohammédia, Rabat, etc. [9], en 1975 à Casablanca, Safi et Kenitra, en 1982 à Agadir (51 cas d'intoxication et deux décès) [10] ; plus récemment, en 1994, plusieurs intoxications ont entraîné 23 hospitalisations et quatre décès [8]. Les intoxications ont été le plus souvent rattachées aux toxines algales, avec peu d'attention accordée aux métaux lourds [1,2]. L'objectif de ce travail est d'élucider l'effet de la pollution chimique sur les taux en métaux lourds (Cd, Cr, Pb) des moules (Mytilus galloprovincialis) issues de deux sites situés sur la côte atlantique marocaine, Jorf Lasfar (JL), site potentiellement pollué par les rejets chimiques des traitements des phosphates bruts, et Oualidia (OL), site situé à 70 km au sud de JL (Fig. 1), puis d'évaluer la toxicité de ces moules sur des souris après un traitement de quelques jours par voie orale, en mesurant certains paramètres biologiques tels que l'urée, la créatinine et le glucose dans les urines, ainsi que le poids relatif des organes et le gain de poids corporel pendant le traitement.
Localisation des sites d'étude (Jorf Lasfar et Oualidia) sur la côte atlantique marocaine.
2 Matériel et méthodes
2.1 Prélèvement d'échantillons
Les moules entières avec leurs coquilles (JL : poids total de chaque moule : , taille : ; OL : poids total de chaque moule : , taille : ) ont été prélevées à marée basse sur les deux sites (août 2001, mars 2002, mai 2002, septembre 2002, novembre 2002 et février 2003), puis transportées immédiatement au laboratoire dans une glacière à 4 °C et conservées ensuite à jusqu'à utilisation.
2.2 Préparation des moules
Les moules, décongelées, dépourvues de coquille, lavées à l'eau bidistillée et égouttées, sont pesées, puis séchées dans une étuve portée à 60 °C pendant au moins 72 h, jusqu'à obtention d'un poids constant.
2.3 Gavage des souris
Les animaux utilisés sont 35 souris Swiss mâles (élevage Depré, Saint-Doulchard, France), de poids moyen , réparties en sept lots de cinq souris, acclimatées pendant une semaine aux conditions expérimentales du laboratoire avant gavage. Ce dernier a été réalisé avec la poudre de moules provenant des deux sites : JL et OL. Une suspension (solution mère, SM) a été préparée comme suit : 300 mg de moules séchées et finement broyées dans un mortier sont mis en suspension dans 10 ml d'eau ultra pure passée à l'ultra thurax, . Des dilutions sont ensuite effectuées au et au . Les suspensions préparées, SM, SM/2 et SM/10, sont ensuite administrées chacune à un lot de souris par sonde gastrique, une fois toutes les 24 h pendant cinq jours. Le lot témoin a été traité dans les mêmes conditions avec de l'eau ultra pure.
2.4 Prélèvements d'organes et d'urine
Juste après le dernier gavage, les souris sont placées dans des cages métaboliques pendant 24 h afin de collecter l'urine sans contamination fécale. Les animaux sont alors pesés et sacrifiés par décapitation. Les organes (cœur, rein, foie et cerveau) sont prélevés et pesés. Les échantillons (urine et organes) sont immédiatement stockés à jusqu'à utilisation.
2.5 Dosage des métaux lourds
À 0,5 g de moules séchées ou à 1 g d'organes de souris (foie, rein), on ajoute 10 ml d'acide nitrique (HNO3) concentré Merck (Parc tertiaire de la Meinau, Strasbourg ; qualité Suprapur) et 4 ml d'acide sulfurique (H2SO4) concentré Merck (Parc tertiaire de la Meinau, Strasbourg ; qualité Suprapur) dans un matras. Le mélange est mis au repos pendant 12 h, puis placé dans un digesteur à micro-ondes (Maxidigest, Prolabo, France), muni d'un système d'addition d'eau oxygénée pour minéralisation. Le volume de chaque minéralisat est complété à 20 ml avec de l'eau ultra pure, puis l'échantillon est analysé par absorption atomique [11,12]. Un essai à blanc sans moule est traité puis analysé dans les mêmes conditions, avec un spectromètre d'absorption atomique électrothermique Varian A 300 équipé d'un système de correction Zeeman.
2.6 Dosages biochimiques
Différents dosages ont été réalisés dans les urines des souris : créatinine par le kit Merck (Merckotest 1.03385.0001), glucose par le kit Merck (Granutest 100–12 193®), urée par le kit BioMérieux (Uréa-Kit S 180) et protéines par la méthode de Bradford [13]. La détermination de ces paramètres biochimiques n'a pu être réalisée dans le plasma, car les volumes plasmatiques sont trop faibles.
2.7 Statistiques
Les résultats sont présentés sous forme de moyennes ± SEM (erreur standard sur la moyenne) et analysés pour les différences significatives en utilisant un test non paramétrique, Wilcoxon Rank Sum Test pour .
3 Résultats et discussion
Le dosage des métaux lourds, et plus particulièrement celui du Cd, du Pb et du Cr, a été réalisé sur une période de trois années (août 2001, mars 2002, mai 2002, septembre 2002, novembre 2002 et février 2003) dans les poudres de moules prélevées au hasard dans les deux sites, JL (site potentiellement pollué par les rejets chimiques des traitements des phosphates) et OL (centre agricole important situé à 70 km au sud du site JL). Les résultats obtenus (Tableau 1) ont montré que, quelle que soit la période de prélèvement, les teneurs en Cd et en Cr chez Mytilus galloprovincialis sont nettement plus élevées dans le site JL que dans le site OL, alors que pour le Pb aucune différence significative n'a été observée.
Concentration en métaux lourds dans les moules
| Période de prélèvement | Cd | Pb | Cr | |||
| (OL) | (JL) | (OL) | (JL) | (OL) | (JL) | |
| Août 2001 | 18,8 ± 3,80 | 109,7 ± 20,00 | 0,4 ± 0,1 | 0,42 ± 0,21 | 6,87 ± 0,50 | 8,75 ± 0,65 |
| Mars 2002 | 23,2 ± 5,20 | 80 ± 15,00 | 0,5 ± 0,1 | 0,75 ± 0,02 | 7,5 ± 0,21 | 16,9 ± 5,62 |
| Mai 2002 | 17,7 ± 3,90 | 199,1 ± 28,00 | 0,5 ± 0,2 | 0,37 ± 0,11 | 10 ± 0,31 | 18,75 ± 4,24 |
| Septembre 2002 | 11,7 ± 3,30 | 128,6 ± 27,70 | 0,2 ± 0,1 | 0,47 ± 0,11 | – | – |
| Novembre 2002 | 16,7 ± 3,82 | 133,7 ± 32,72 | 0,3 ± 0,1 | 0,39 ± 0,3 | – | – |
| Février 2003 | 17,5 ± 2,53 | 147,5 ± 22,11 | 0,3 ± 0,1 | 0,25 ± 0,03 | 7,5 ± 1,25 | 16,25 ± 4,25 |
Durant toute la période d'étude allant d'août 2001 à février 2003 (Tableau 1), les concentrations en Cd ont varié de à de poids sec dans le site OL et de à de poids sec dans le site JL. Ces teneurs sont très élevées par rapport à celles déjà obtenues auparavant dans ce même site (JL), qui étaient de 19,3 μg/g de poids sec [14], et de 8 μg/g de poids sec [15]. Cette différence de concentrations pourrait s'expliquer, soit par l'augmentation de la contamination industrielle survenue au cours de ces dernières années, soit par la procédure de minéralisation utilisée par Chafik et al. [15], qui ne détruit pas aussi complètement les matières organiques que notre méthode et qui sous-estime donc très largement les concentrations en métaux [12].
En revanche, les concentrations en Pb dans les moules restent stationnaires pendant toute la période d'étude (août 2001 à février 2003 ; voir Tableau 1) et, quel que soit le site de prélèvement, elles varient de à de poids sec pour le site OL et de à de poids sec pour le site JL. Elles restent faibles par rapport à celles déjà obtenues dans des moules prélevées en France, à Arcachon [5]. Nous nous sommes également intéressés au dosage du chrome, connu, comme le cadmium, pour ses effets cancérogènes [16,17]. D'une manière générale nous avons observé des teneurs en chrome plus importantes dans le site JL que dans le site OL (Tableau 1). Ces concentrations varient de à de poids sec pour le site OL et de à de poids sec pour le site JL. C'est à nouveau le site JL qui présente les concentrations en chrome les plus élevées. Le chrome peut aussi provenir des eaux de lavage des phosphates ou de l'activité des tanneurs qui viennent laver les peaux dans l'océan.
Les concentrations en Cd et en Cr sont plus élevées dans le site JL que dans le site OL. La concentration est environ deux fois plus importante pour le Cr et de 3 à 11 fois plus pour le Cd. Ces concentrations sont nettement supérieures à celles décrites dans la littérature [18,19].
Cette accumulation en métaux lourds dans les moules indique qu'il y a pollution du site JL par les rejets des déchets des minerais de phosphate dans les eaux marines, surtout en ce qui concerne le Cd, qui est un sous-produit des minerais de phosphates.
Compte tenu des concentrations élevées en métaux et surtout celles en Cd dans les moules et du fait de la biodisponibilité du Cd chez les humains, qui est estimée à 5 ou 6 % de la dose administrée [20] et tenant compte des effets néfastes des métaux lourds [5,6,14,19], nous avons décidé d'étudier l'effet de ces métaux combinés in vivo. Ainsi, nous avons administré à des souris différentes quantités de poudre de moules provenant des deux sites d'étude, pendant cinq jours consécutifs. Les animaux ont ensuite été sacrifiés et les métaux (Cd, Cr et Pb) dosés dans le foie et les reins.
Aucune variation significative des concentrations des métaux n'a été observée dans le foie et les reins des animaux en fonction de la quantité de poudre de moules administrée (Tableau 2). Les doses journalières consécutives durant les cinq jours de gavage n'ont pas suffi à augmenter la concentration tissulaire dans le foie et les reins. Ceci n'est pas complètement surprenant. En effet, lors des premières expositions à des métaux tels que le Cd induisant la synthèse des métallothionéines (protéines fortement soufrées de faible poids moléculaire) qui ont une forte affinité pour ces métaux, le complexe avec le Cd peut se former. Cette fixation joue un rôle de détoxication jusqu'à ce que les capacités des organes à synthétiser cette protéine soient dépassées. Les métaux vont alors s'accumuler et entraîner des lésions dans les organes. Il se pourrait que cela soit le cas ici. Une expérience sur une plus longue période permettra de connaître la réalité de cet effet in vivo. Il est cependant intéressant de voir que les urines contenaient des concentrations significativement plus élevées chez les souris traitées en comparaison avec les témoins recevant l'eau ultra pure, indiquant une élimination accrue sans doute à cause des métallothionéines (résultats non illustrés) [20–24].
Concentration de métaux lourds dans le foie et les reins des souris
| Métal | Quantité de métal dans la poudre(⁎) (μg) | μg de métal/g de foie frais | μg de métal/g de rein frais | |||
| OL | JL | OL | JL | OL | JL | |
| Cd | 0 | 0 | 0,95 | 0,95 | 1,15 | 1,15 |
| 0,17 | 1,50 | 1,06 | 0,78 | 1,15 | 0,97 | |
| 0,86 | 7,50 | 1,02 | 0,98 | 1,05 | 1,05 | |
| 1,73 | 15 | 1,10 | 1,18 | 1,02 | 1,20 | |
| Moyenne ± écart type | ||||||
| Pb | 0 | 0 | 1,17 | 1,17 | 0,87 | 0,87 |
| 0,004 | 0,004 | 1,06 | 0,86 | 0,92 | 0,81 | |
| 0,019 | 0,019 | 1,09 | 0,95 | 1,05 | 0,70 | |
| 0,038 | 0,038 | 0,95 | 0,82 | 0,62 | 0,71 | |
| Moyenne ± écart type | ||||||
| Cr | 0 | 0 | 0,67 | 0,67 | 0,73 | 0,73 |
| 0,075 | 0,143 | 0,85 | 0,70 | 0,81 | 0,81 | |
| 0,38 | 0,713 | 0,64 | 0,95 | 0,90 | 0,90 | |
| 0,78 | 1,425 | 0,78 | 0,82 | 0,72 | 0,52 | |
| Moyenne ± écart type |
(⁎) Calculée à partir de la quantité totale de poudre ingérée.
Le fait que la concentration en métaux n'a pas augmenté dans les organes pourrait aussi être dû à la quantité faible de moules administrée (1,5–15 mg/j) ainsi qu'à la durée de gavage relativement courte (cinq jours).
L'effet induit par l'ingestion des moules issues des deux sites étudiés sur les poids corporels des souris par rapport à des témoins est présenté sur la Fig. 2. D'une manière générale, les moules issues du site OL ont provoqué une nette diminution du poids corporel des souris étudiées. Cette diminution est plus accentuée pour les doses de 7,5 et 15 mg de moules par jour, ( et , respectivement). De même, le poids relatif moyen des reins a baissé chez les souris gavées avec la poudre de moules issue des deux sites, de 20 à 41 % pour les moules de JL et de 27 à 39 % pour les moules d'OL (Tableau 3), alors que les poids relatifs des autres organes (foie, cœur et cerveau) ne varient pas de manière significative. Il pourrait s'agir d'une atrophie sélective des reins. Cela devrait correspondre à une néphropathie en cours d'évolution. Le Cd est connu pour induire l'apoptose, ceci pourrait expliquer la réduction rapide du poids des reins. Mais comme le rein a des capacités à compenser la fonction rénale, une évaluation plus précise de celle-ci est nécessaire pour mettre en évidence la néphrotoxicité. De même, un traitement plus long aurait sans doute montré des lésions plus nettes, voire l'accumulation des métaux dans les tissus étudiés [20,24].
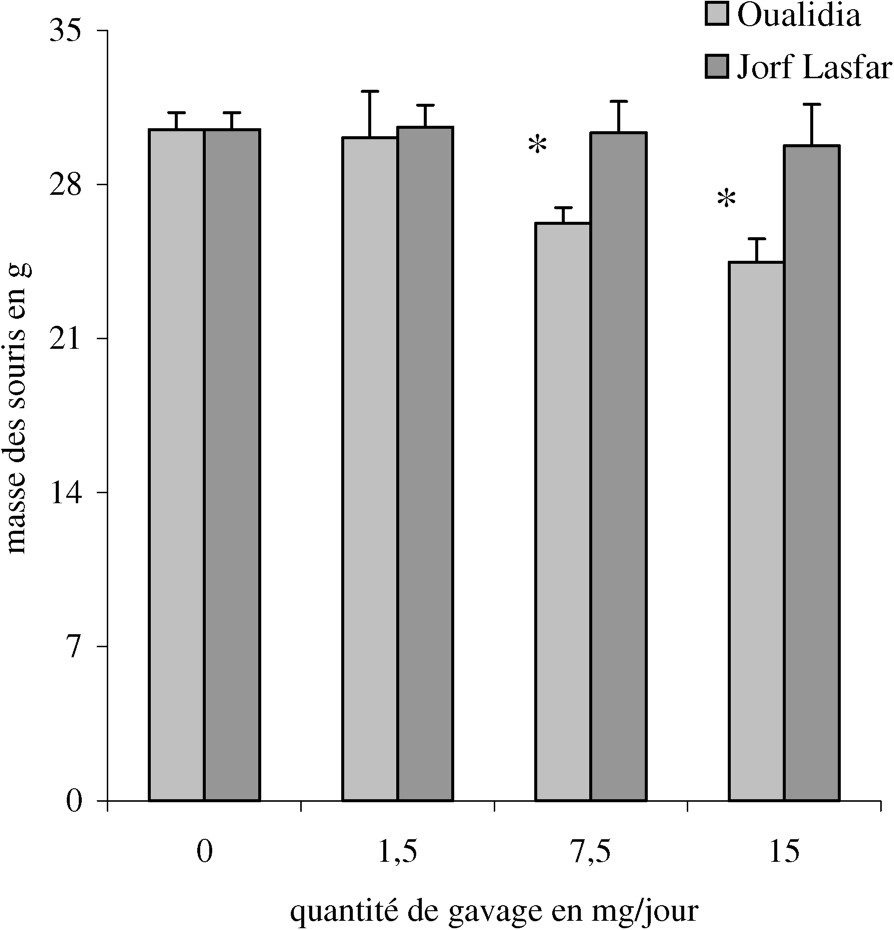
Effet de l'ingestion des moules sur le poids corporel des souris. Les souris ont reçu par une sonde gastrique 1,5, 7,5 et 15 mg de poudre de moules séchées en suspension dans l'eau, tandis que les témoins ont reçu de l'eau ultra pure, comme décrit dans le § Matériel et méthodes. Les barres d'erreur correspondent à la SEM (erreur standard sur la moyenne). * Significativement différent à p=0,005.
Influence de l'administration des moules sur le poids relatif des organes
| Quantité de poudre de moules administrée par jour (en mg) | 0 | 1,5 | 7,5 | 15 | |||
| Contrôle | (OL) | (JL) | (OL) | (JL) | (OL) | (JL) | |
| Poids relatif du foie par rapport au contrôle | |||||||
| 100 | 87 ± 2 | 105 ± 34 | 88 ± 12 | 92 ± 12 | 85 ± 35 | 85 ± 12 | |
| Poids relatif du cœur par rapport au contrôle | |||||||
| 100 | 116 ± 11 | 108 ± 16 | 119 ± 16 | 123 ± 15 | 122 ± 22 | 118 ± 16 | |
| Poids relatif des reins par rapport au contrôle | |||||||
| 100 | 66 ± 24 | 69 ± 10 | 61 ± 13 | 80 ± 18 | 73 ± 15 | 58,8 ± 12 | |
| Poids relatif du cerveau par rapport au contrôle | |||||||
| 100 | 96 ± 6 | 94 ± 10 | 92 ± 13 | 96 ± 20 | 87,5 ± 13 | 92,4 ± 10 |
Les résultats btenus dans ces études semblent être à l'opposé de nos prédictions, vu la proximité du site JL de l'origine de la pollution chimique par le Cd et l'éloignement du site OL des rejets de déchets de traitement des phosphates.
L'augmentation de l'urée de 249, 345 et 330 % par rapport au témoin pour les lots de souris traitées respectivement avec 1,5, 7,5 et 15 mg par jour de poudre de moules pendant cinq jours peut s'expliquer par l'apport inhabituel de protéines métabolisées en urée. Si la teneur en urée ne varie pas en fonction de la dose chez les souris gavées avec les moules de JL, elle augmente fortement pour la dose 1,5 mg de moules administrées par jour et moins fortement pour les doses 7,5 et 15 mg.
Les résultats du dosage de la créatinurie montrent que les teneurs totales en créatinine augmentent en fonction de la quantité de poudre de moules d'OL administrée. En revanche, avec les moules du site JL, on note une variation moins importante du taux de créatinine urinaire chez les souris traitées avec les faibles quantités de moules (Tableau 4) (Fig. 3).
Effet de l'ingestion de moules par des souris sur certains paramètres biochimiques urinaires
| Créatinurie (g/l) | Protéinurie (g/l) | Uréurie (g/l) | Glucosurie (g/l) | |||||
| Site | (OL) | (JL) | (OL) | (JL) | (OL) | (JL) | (OL) | (JL) |
| Contrôle | 0,62±0,21 | 0,62±0,21 | 2,93±0,26 | 2,93+0,26 | 0,22±0,03 | 0,22±0,03 | 0,15±0,01 | 0,15±0,01 |
| SM/10 | 0,34±0,07 | 0,29±0,13 | 2,85±0,13 | 3,30+0,12 | 0,49±0,15 | 0,79±0,13 | 0,32±0,13 | 0,32±0,06 |
| SM/2 | 0,69±0,2 | 0,44±0,07 | 3,07+0,35 | 3,81±0,30 | 0,69±0,02 | 0,32±0,13 | 0,37±0,03 | 0,24±0,02 |
| SM | 0,90±0,11 | 0,6±0,2 | 3,80+0,46 | 3,98±0,61 | 0,66±0,13 | 0,42±0,14 | 0,24±0,16 | 0,24±0,01 |

Effet de l'ingestion de moules sur le taux de créatinine urinaire. La poudre de moules a été administrée pendant cinq jours successifs à des souris, à différentes concentrations par rapport au témoin traité avec de l'eau ultra pure. Les barres d'erreur correspondent à la SEM (erreur standard sur la moyenne). * Significativement différent à p=0,005.
Nos résultats ont montré que la créatinurie moyenne des souris gavées est comprise entre 0,69 et 0,90 g/l d'urine pour les doses 7,5 et 15 mg de poudre de moules administrée contre 0,62 g/l d'urine pour le témoin. Sachant que la créatinine résulte du métabolite de substance azotée non protéique au cours du métabolisme musculaire [25], ces résultats concordent avec ceux observés dans l'évolution du poids corporel des souris traitées. L'explication la plus probable est l'existence d'une protéolyse provoquée par l'ingestion des moules toxiques. Une telle situation provoquerait une libération d'acides aminés libres (arginine et glycocolle), transformés en créatine puis en créatinine, qui est éliminée dans les urines [26].
L'analyse des résultats du dosage des protéines urinaires (Tableau 4) a montré une augmentation globale des teneurs totales en protéines urinaires des souris gavées par les moules issues des deux sites. Cette augmentation varie de 4 à 30 % par rapport au témoin pour les souris gavées avec les moules OL et de 30 à 36 % par rapport au témoin pour les souris gavées avec les moules de JL avec des quantités respectives de 7,5 et 15 mg.
Le dosage du glucose urinaire a montré une augmentation significative de la glucosurie par rapport au témoin chez les souris traitées par les moules issues des deux sites, et ceci pour toutes les doses administrées. Cette glucosurie ne semble pas être proportionnelle à la quantité de moules administrée aux souris. Elle varie de 135 à 326 % et de 120 à 230 % par rapport au témoin pour les souris gavées respectivement par les moules d'OL et de JL. Cette augmentation de glucosurie pourrait s'expliquer par une atteinte rénale tubulaire.
Les souris traitées avec les moules du site OL ont présenté une pilo-érection (signe d'intoxication), leur sang avait une couleur brune et coagulait rapidement par rapport aux témoins et aux souris gavées avec les moules de JL. Ces réactions sont totalement différentes de celles observées chez des souris soumises à l'action de toxines de type PSP [7,8]. Ceci laisse supposer la présence de toxines de nature différente dans les moules issues du site OL et, éventuellement, de substances pouvant altérer l'hémoglobine, telles que les substances méthémoglobinisantes. Des études plus poussées sont en cours pour, d'une part, isoler, identifier et caractériser cette ou ces toxines marines et, d'autre part étudier, les effets du traitement sur des rats pendant des périodes plus longues avec des quantités de moules plus importantes.
Nos résultats ont montré des teneurs dans le site JL en métaux lourds (Cd, Pb et Cr) très élevées par rapport à celles décrites dans la littérature ou à celles d'OL. Les actions combinées de ceux-ci en particulier la cytotoxicité, la peroxydation lipidique peuvent expliquer en partie les effets toxiques observés.
Il est probable qu'il y avait dans les deux sites, en plus des métaux toxiques, des toxines organiques autres que les toxines marines ; leurs proportions relatives n'ont pas été déterminées, mais il semble que le site OL est plus pollué que le site JL.
4 Conclusion
Les résultats obtenus montrent des concentrations très élevées en Cd dans les moules du site JL par rapport à celles indiquées dans la littérature. Les concentrations trouvées dépassent largement les normes internationales [27]. Le dosage des métaux lourds (Cd, Cr et Pb) dans le foie et les reins des souris traitées avec les moules issues des deux sites ne montre pas d'accumulation de métaux, malgré les concentrations élevées en Cd dans les moules du site JL. Chez les souris gavées avec les moules du site OL, on observe une baisse significative du poids corporel ainsi qu'une augmentation de créatinurie en relation avec la quantité de poudre de moules par gavage. En revanche, chez les souris gavées avec les moules du site JL, on n'observe aucune variation significative, ni dans le poids corporel, ni dans le taux de créatinine. L'augmentation des concentrations en glucose, en urée et en protéines a été observée dans les urines de toutes les souris gavées par les moules issues des deux sites. Le dérèglement des paramètres biochimiques dans les urines pourrait s'expliquer par une atteinte rénale, même en l'absence de concentrations élevées en métaux néphrotoxiques dans les organismes à cause de la durée brève (cinq jours) du traitement.
Les résultats obtenus nous poussent à émettre l'hypothèse que la consommation de ces moules peut entraîner une toxicité chez le consommateur. Cependant, l'extrapolation à l'homme des résultats de ces études ne peut être effectuée que si des investigations épidémiologiques à grande échelle et sur une longue période sont réalisées.
Acknowledgments
Ce travail a été réalisé dans le cadre d'une action intégrée franco-marocaine 210/SVS/99 et a bénéficié du soutien financier de l'Académie nationale de médecine (prix E.-Taub 2001 au Prof. E.E. Creppy) et de l'Agence universitaire de la francophonie. Nous remercions les Drs D. Sanchez, T.A. Mobio et M. Derkaoui pour leur aide.


