Abridged English version
Oil content, total protein SDS-PAGE profiles, unsaturated fatty acids (mono-unsaturated fatty acids MUFA: C18:1, polyunsaturated fatty acids PUFA: C18:2, C18:3), and tocopherols content were followed during maturation of seeds by two varieties of rapeseed (Brassica napus L.), i.e. Hybridol and Pactol, widely produced in Tunisia. The relationship between UFA and tocopherols was described.
The oil content increases during the maturation of seeds, but decreases at the end of maturation of Hybridol and Pactol. Some differences between SDS-PAGE total protein profiles were found. The major proteins revealed were 35, 25, 15 and 10 kDa. In the two varieties, the rapeseed oil presented a high content of oleic acid (C18:1 > 60%). Linoleic (C18:2 > 16%) and linolenic acids (C18:3 > 8%) were also presented in a noticeable content, although decreasing with the maturation stage.
Some authors found that some amount of linolenic acid is required for good-flavour compounds. This is due to the formation of oxidation products, which are important flavour compounds. The rate of oxidation of fats and oil is affected by many factors such as light, exposure to oxygen, the presence of antioxidants (tocopherols) and the degree of unsaturation of these fatty acids. In fact, polyunsaturated fatty acids (PUFAs) with a long chain are especially sought after. The great stability of vegetable oils, in conditions of oxidation, is due to the presence of an elevated rate of natural antioxidants, most of which important are tocopherols. These components are essential for protection of PUFAs in plants and animals deterioration.
In these studies, α and γ tocopherols contents increase during maturation of seeds of two varieties of rapeseed although decreasing at the end of maturation. The maximum of α and γ tocopherols contents corresponded to the sixth stage of maturation (one week before the end of Hybridol maturation). On the contrary, for Pactol, the maximum of tocopherol isomers accumulation corresponded to the fifth stage of maturation (two weeks before the end of maturation). This stage corresponds to the most active phase of lipid accumulation during Pactol-seed maturation.
It is noted that γ tocopherol content was more elevated than α isomer (2 to 4 times) for Hybridol and Pactol. Rapeseed oil presents a relationship between tocopherols and PUFAs. The effect from either of these tocopherols seems to depend not only on the degree of unsaturation of the oil, but also on a multitude of chemical and physical factors that control oxidation. We think that tocopherols content and fatty acid compositions are linked because PUFAs enter in phospholipids structure that constitutes the biological membrane.
1 Introduction
Le colza (Brassica napus L.) est l'une des plantes oléagineuses les plus cultivées dans le monde [1]. C'est une oléagineuse qui présente une source importante et potentielle d'huiles insaturées à finalité alimentaire [2]. L'huile de colza renferme 60% d'acide oléique, 20% d'acide linoléique et 9,6% d'acide linolénique, ces deux derniers étant particulièrement importants dans l'alimentation humaine, puisque leurs dérivés sont nécessaires à l'élaboration des membranes des cellules nerveuses et à la biosynthèse des prostaglandines [3]. La grande stabilité des huiles végétales, dans les conditions d'oxydation, est due à la présence d'un taux élevé d'antioxydants naturels dont les plus importants sont les tocophérols [4,5] et qui se présentent sous quatre formes isomériques : et γ [6]. Les tocophérols protègent contre l'oxydation naturelle des acides gras, en particulier les acides gras polyinsaturés (AGPI). On a signalé qu'une molécule de tocophérol peut protéger 103 à 106 molécules d'AGPI [7]. Certains auteurs ont démontré, en utilisant des analyses statistiques appropriées, que, chez les huiles végétales, il y a une corrélation positive entre l'α tocophérol et l'acide linoléique (C18:2) et probablement entre le γ tocophérol et l'acide linolénique (C18:3). Il y a une indépendance complète entre les teneurs en tocophérols et les taux des acides gras saturés (C16:0 et C18:0) et monoinsaturés (C16:1 et C18:1) [8]. L'huile de colza étant hautement insaturée et présentant des taux appréciables d'AGPI, elle peut être une cible d'oxydation naturelle. Dans cette étude, nous avons suivi l'évolution des teneurs en acides gras insaturées, des peroxydes et des tocophérols dans le but de comprendre les corrélations qui peuvent exister entre ces composés.
2 Matériel et méthodes
2.1 Conduite des cultures
Les semis ont été réalisés dans une parcelle expérimentale à l'Institut national de recherche agronomique de Tunis (Inrat) et dans les conditions naturelles de culture. La parcelle a été subdivisée en deux blocs, un pour chaque variété. Notre choix à été porté sur deux variétés double zéro « 00 » et cultivées en Tunisie : Hybridol et Pactol. Les plantes ont été irriguées à l'eau du robinet. Les prélèvements ont été commencés dès l'apparition des premières siliques (soit 30 j après la floraison) jusqu'à la maturation complète des graines, à raison d'un prélèvement tous les huit jours pour chaque variété.
2.2 Extraction des lipides totaux
On a utilisé deux méthodes pour l'extraction des lipides totaux : la méthode de Folck et al. [9], qui a été utilisée pour l'analyse des tocophérols et acides gras totaux et la méthode Soxhlet [10] utilisée pour déterminer la teneur en huile et l'indice de peroxyde.
2.3 Détermination de l'indice de peroxyde
Elle a été réalisée selon la méthode officielle AOCS Cd 8–53 (92) (American Oil Chemist's Society). Cette méthode consiste d'abord à préparer un mélange acide acétique/chloroforme dans les proportions 3v/2v. Une solution d'iodure de potassium (KI) est obtenue en dissolvant 13,33 g de KI dans 10 ml d'eau distillée dans un flacon brun. Une solution de thiosulfate de sodium (0,1 N) a été utilisée pour le titrage. Une solution d'amidon de patate a été obtenue en dissolvant 1 g d'amidon dans 200 ml d'eau distillée (la solution a été portée à ébullition pendant quelques secondes, puis mise au réfrigérateur).
On a dissout 5 g d'huile dans 30 ml du mélange acide acétique/chloroforme. On a ajouté 0,5 ml de la solution de KI, puis on a agité pendant 1 min exactement. La réaction a été arrêtée par l'addition de 30 ml d'eau distillée. La titration a été réalisée par la solution de thiosulfate de sodium 0,1 N en présence de quelques gouttes d'amidon de pomme de terre.
2.4 Analyse des tocophérols
Dans une série de tubes en verre, on a mis 100 μl d'huile, on lui a ajouté 100 μl de standard interne rétinol–acétate et 200 ml d'eau physiologique (eau salée 0,9%). On a agité pendant 5 min, puis on a ajouté 200 μl d'hexane et on a centrifugé à 4000 rpm pendant 5 min. On a récupéré la phase supérieure, on l'évaporée, puis reprise dans 50 μl d'éthanol. On a injecté 20 μl de l'échantillon.
Le système chromatographique utilisé est une chaîne HPLC (type : Shimadzu) composée par une pompe LC-7A, un injecteur Rheodyne 127 menu d'une boucle de 20 μl, d'un détecteur UV (290 nm) et d'un intégrateur C-R6A Chromatopac. La colonne contient une phase stationnaire de silice greffé par des groupements octa-décyl (C18) Lichrospher 100 RP-18 (5 μm, ) Merck 50883. La phase mobile est constituée de méthanol pur. Les conditions chromatographiques sont les suivantes : débit, 1,5 ml min−1, température, 40 °C.
2.5 Analyse des acides gras
Pour la méthylation des acides gras, nous avons utilisé la technique de Metcalfe et al. [11], modifiée par Lechevallier [12]. Les esters méthyliques des acides gras ont été analysés par chromatographie en phase gazeuse (CPG) à l'aide d'un chromatographe HP 4890 muni d'un détecteur à ionisation de flamme (FID) et équipée d'une colonne capillaire supelcowaxTM 10. Les températures de la colonne, du détecteur et de l'injecteur sont, respectivement, 200, 250 et 230 °C.
2.6 Électrophorèse des protéines totales par SDS-PAGE
2.6.1 Extraction des protéines totales
Les graines (0,2 g) ont été broyées à l'aide d'un mortier, en présence de glace, dans le tampon d'extraction (Tris HCl: 100 mM pH 7,5 ; benzamidine 0,1 mM ; DTT 0,1 mM) à raison de 3 ml pour 1 g de graines. L'homogénat est ensuite placé dans un tube Eppendorf puis centrifugé à 8000 rpm/15 min à −4 °C (centrifugeuse de type Sigma). La phase lipidique a été enlevée et la phase aqueuse a été récupérée, ensuite divisée, préférentiellement, sur trois tubes Eppendorf conservés au congélateur.
2.6.2 Électrophorèse par SDS-PAGE
La méthode que nous avons utilisée est l'électrophorèse sur plaque en mini gel et en présence de SDS selon la technique décrite par Laemmli [13]. Le gel de séparation est une solution de polyacrylamide à 10%, le gel de concentration est à 3%.
3 Résultats et discussion
3.1 Évolution des teneurs en huile et du PMG
La Fig. 1 montre que chez les deux variétés, la teneur en huile augmente au cours du temps, puis marque une légère diminution à la fin de la maturation des graines des deux variétés. Les meilleures teneurs obtenues correspondent aux stades V et VI, soit deux et une semaine avant la maturation complète des graines, respectivement pour Hybridol et Pactol. La Fig. 2 montre que la deuxième composante du rendement (PMG) évolue progressivement au cours du temps, ce qui confirme la différence entre les profils électrophorétiques des protéines totales représentés par la Fig. 3. Les électrophorégrammes montrent bien que les protéines les plus représentées ont les masses moléculaires 35, 25, 15 et 10 kDa. Ces protéines correspondent probablement aux protéines majeures de réserve des graines de colza : la cruciférine, la napine et l'oléosine [14]. Les oléosines sont des protéines alcalines de poids moléculaire de 15–26 kDa. Essentiellement rencontrées au niveau des graines, elles jouent un rôle très important dans la stabilisation des TAG dans la matrice des oléosomes. Elles sont connues aussi comme un site spécifique de liaison des lipases au cours de la germination [15]. La relation entre l'accumulation des lipides et celle des protéines est encore ambiguë. En effet, certains auteurs ont suggéré que l'accumulation des lipides de réserve commence plusieurs semaines avant celle des protéines de réserve, alors que leur mobilisation ne commence qu'après celle des protéines. Il pourrait exister un mécanisme commun contrôlant la régulation de la synthèse et de la mobilisation des protéines majeures du colza et qui serait différent de celui mis en jeu dans la synthèse et la mobilisation des lipides de réserve [14].

Évolution des teneurs en huile au cours de la maturation des graines de colza (moyenne de trois répétitions).
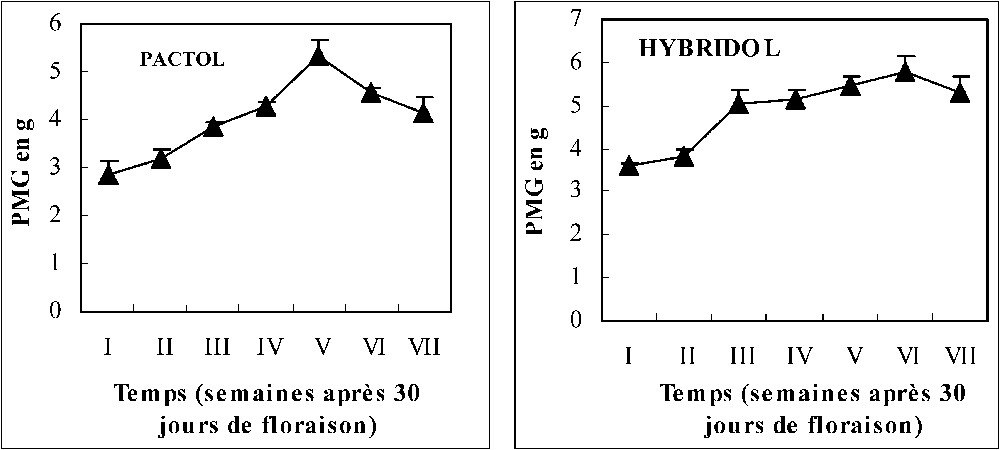
Évolution du PMG au cours de la maturation des graines de colza (moyenne de trois répétitions).
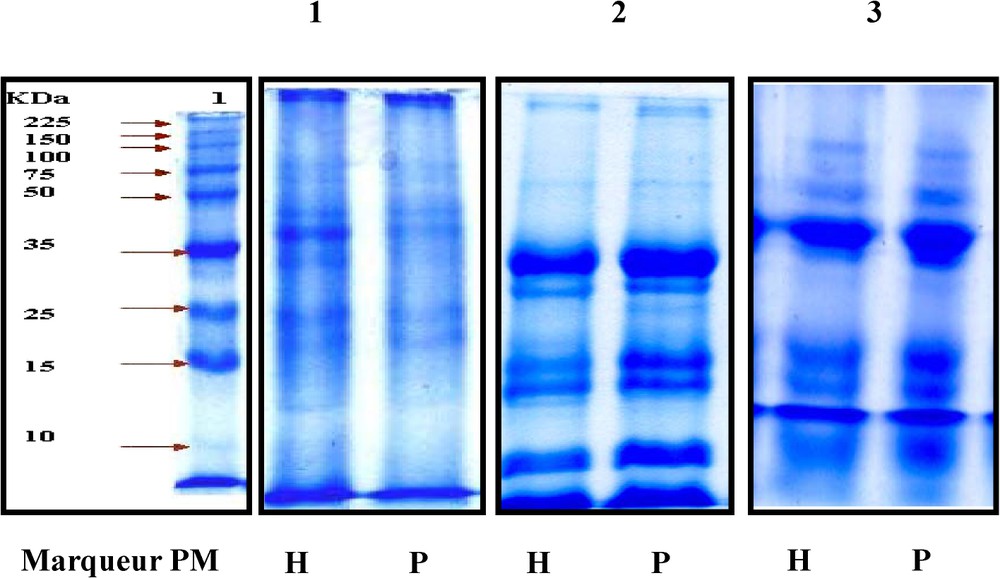
Évolution des profils électrophorétiques (SDS-PAGE) des protéines totales au cours de la maturation des graines de colza. PM : Poids moléculaire ; H : Hybridol ; P : Pactol. 1 : Début de la maturation ; 2 : mi-maturation ; 3 : fin de la maturation.
3.2 Évolution des teneurs acides gras insaturés
La Fig. 4 montre que les teneurs de l'acide oléique (C18:1) évoluent progressivement au cours de la maturation des graines des deux variétés et présentent un maximum d'accumulation aux stades V et VI, respectivement pour Hybridol et Pactol. Ceci est probablement dû à la précocité de Pactol. Le C18:1 est l'acide gras le plus présent dans l'huile de colza, dont la teneur dépasse 60% pour Hybridol et Pactol. C'est un acide gras qui est présent dans la structure des triacylglycérols (TAG) et des glycérophospholipides (PL). Les AGPI (C18:2 et C18:3), dont les teneurs sont appréciables (16% et 8% respectivement), présentent un maximum d'accumulation à la mi-maturation, puis marquent une diminution à la fin de la lipogenèse. On explique ce phénomène par le fait que ces acides gras, en plus de l'acide oléique, entrent dans la constitution des phospholipides qui forment la structure des membranes cellulaires nouvellement formées. On a noté qu'au début de la maturation, la masse des acides gras insaturés ne représente qu'une faible fraction de la masse d'huile. Cette masse manquante est représentée effectivement par celle des acides gras saturés (C16 et C18 en particulier) et ceci est dû au fait que les réactions d'élongation et de désaturation sont très lentes à ce stade.

Évolution des teneurs en acides gras insaturés au cours de la maturation des graines de colza (moyenne de trois répétitions).
3.3 Évolution de l'indice de peroxyde
L'indice de peroxyde est par définition le nombre d'équivalents d'oxygène contenu dans 1 kg de produit et oxydant l'iodure de potassium avec libération d'iode. L'indice de peroxyde est une mesure de vieillissement d'une huile, cet indice augmente avec le temps. En effet, c'est au contact de l'oxygène de l'air qu'une huile s'oxyde et vieillit. Nous avons déterminé ce paramètre, d'une part, pour s'assurer de l'intégrité des huiles après les procédures d'extraction et de conservation et, d'autre part, parce que les phénomènes d'oxydation de l'huile engendrent, à côté de composés volatils responsables de flaveurs désagréables, des acides oxydés, qui se trouvent sous forme libre ou sous forme de glycérides.
Les niveaux de peroxydes évalués ne dépassent pas les 10 milliéquivalents d'oxygène actif par kilogramme d'huile chez les deux variétés. Ses valeurs indiquent un bon état de l'huile de deux variétés étudiées. Nous pouvons confirmer que tous les composés identifiés se trouvent naturellement dans l'huile de colza et ne sont pas des produits de dégradation de cette huile. La Fig. 5 montre bien que l'évolution des peroxydes suit l'allure générale de celle des tocophérols. En effet, durant la phase la plus active de l'accumulation des lipides (deux et une semaine avant la maturation complète des graines pour Pactol et Hybridol respectivement), le niveau des peroxydes augmente, ce qui entraîne l'élévation des teneurs en tocophérols qui participent à freiner et même à inhiber le processus d'oxydation des lipides, en particulier au cours de cette phase sensible d'accumulation. On signale que les tocophérols ne sont pas les seuls composés qui puissent protéger une huile contre l'oxydation naturelle des acides gras insaturés.
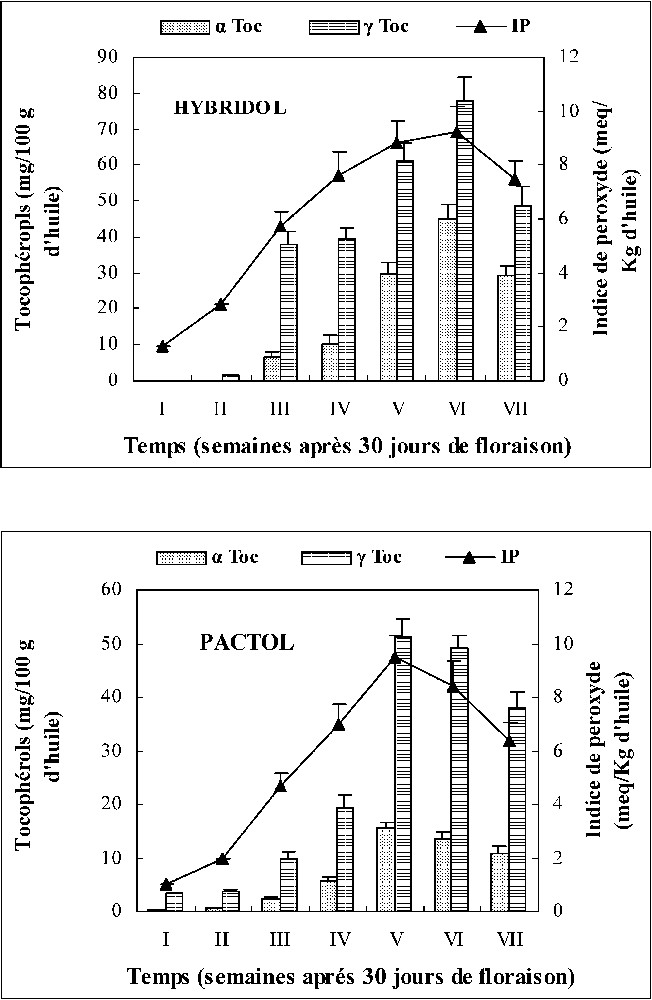
Évolution des teneurs en peroxydes et en α et γ tocophérols au cours de la maturation des graines des deux variétés de colza (moyenne de trois répétitions).
3.4 Évolution des tocophérols en relation avec celle des acides gras insaturés
L'oxydation des acides gras est affectée par plusieurs facteurs, comme la lumière, la présence d'antioxydants et de pro-oxydants et le degré d'insaturation de ces acides gras. En effet, les acides polyinsaturés à longue chaîne, parce qu'ils se prêtent aux réactions radicalaires, sont particulièrement visés [16]. L'acide linolénique (C18:3), par exemple, a un taux d'oxydation 25 fois plus élevé que celui de l'acide oléique et deux fois plus rapide que celui de l'acide linoléique [17]. La grande stabilité des huiles végétales, dans les conditions d'oxydation, est due à la présence d'un taux élevé d'antioxydants naturels, dont les plus importants sont les tocophérols [5]. La Fig. 5 qui représente l'évolution des tocophérols au cours de la maturation des graines des deux variétés de colza montre que les teneurs en γ tocophérols sont relativement plus importantes que celles des α tocophérols et que le maximum d'accumulation a été observé aux stades V et VI, respectivement, pour Pactol et Hybridol. L'allure générale de l'évolution des tocophérols au cours du temps rappelle celle des acides gras insaturés. Cette probable corrélation positive est très importante, puisque l'huile de colza est hautement insaturée et présente des taux très élevés d'AGPI, lesquels sont des cibles potentielles d'oxydation naturelle. Les tocophérols protègent essentiellement contre l'oxydation de ces AGPI [18,19]. Ils « balaient » les radicaux libres et contribuent à la défense anti-oxygène et exercent leur effet antioxydant par de nombreux mécanismes biochimiques et biophysiques. En effet, une molécule de tocophérol peut protéger 103 à 106 molécules d'AGPI [6,8]. Les corrélations étudiées (r à 5%) entre AGPI et tocophérols au cours de la maturation des graines de colza sont 96% et 98% respectivement pour Hybridol et Pactol. L'étude de ces corrélations nous a permis donc de supposer que les AGPI induisent le taux des tocophérols dans les graines des deux variétés de colza au cours de la maturation. Mais on note que, bien que les quantités de ces deux composés évoluent de façon coordonnée sous le contrôle d'un phénomène commun situé en amont dans le métabolisme, il est possible que l'un de ces composés ne contrôle pas l'autre.
Chez les huiles végétales, dont le colza, il y a une corrélation positive entre l'α tocophérol et l'acide linoléique (C18:2) et probablement entre le γ tocophérol et l'acide linolénique (C18:3) [8].
4 Conclusion
Cette étude nous a permis de suggérer que la récolte du colza soit réalisée avant la maturation complète des graines. En effet, on a trouvé que les meilleurs rendements en huile, en graines et les meilleures teneurs en acide oléique et en tocophérols ont été obtenus au stade V pour Pactol, soit deux semaines avant la maturation complète des graines, et au stade VI pour Hybridol, c'est-à-dire une semaine avant la fin de la maturation. On a trouvé aussi que l'évolution des tocophérols est concomitante à celle des acides gras insaturés et des peroxydes au cours de la lipogenèse, ce qui prouve qu'il existe une corrélation étroite entre ces deux composés et que les tocophérols protégent les acides gras polyinsaturés contre les agressions oxydatives, surtout que ces acides gras entrent dans la structure des phospholipides qui forment les bicouches des membranes biologiques. Bien que les quantités de ces deux composés évoluent de façon coordonnée sous le contrôle d'un phénomène commun situé en amont dans le métabolisme, il est possible que l'un de ces composés ne contrôle pas l'autre.


