Abridged English version
Loranthaceae are stem semiparasites widely spread over all continents, represented by 77 genera and 950 species. Among the seven genera and the 30 species occurring in Gabon, Phragmanthera capitata (Sprengel) Balle is very common, attacking many woody species such as rubber tree, Hevea brasiliensis, cocoa, avocado, citrus species. Almost all African rubber plantations are parasitized by this species. In the largest rubber plantation from Gabon (Mitzic, 5010 ha), 75% of the trees have been reported to be attacked by P. capitata.
Despite the large distribution of Loranthaceae, their damaging effect has never been precisely assessed. According to the main effect of Loranthaceae usually acknowledged, i.e., the tapping of water and mineral salts from the host, it is commonly suggested, but still not confirmed, that mistletoes provoke a decrease in host production. However, some authors reported that when host plants are entirely leafless, either naturally during the winter period for hosts of Viscum album or experimentally, as is the case for hosts of Arceuthobium americanum, epiphytic parasites could provide some nutrients to the host, mimicking a symbiosis. In the case of rubber trees that are regularly treated by a chemical, ethephon, which stimulates latex production, the presence of parasitic Loranthaceae could steadily stimulate host metabolism, increasing latex production. Therefore, before proposing very costly and/or time consuming control methods, it is necessary to estimate the real impact of P. capitata on rubber production in Gabon.
For this study, several interactions between latex production and various parameters (occurrence of parasite, location of rubber trees in plots, clonal and seasonal effects, trunk circumference) were investigated on three clones of 22-year-old rubber trees (GT1, PB 235 and RRIM 600). All data were analysed by means of statistical tools (mean comparison, generalized linear models, ANOVA), thanks to the STATISTICA 6.0 software (Statsoft Inc., Tulsa).
Firstly, a statistical analysis carried out on healthy and parasitized trees showed that latex production is positively correlated to the trunk circumference, the largest trees being the most frequently attacked and at the same time the most productive. On the other hand, tree location in plots had no significant impact on latex production. Concerning the season, all clones produced higher amounts of latex during the rainy season, the PB 235 clone being the most affected by drought.
In addition, the real impact of parasitism on latex production was studied among trees of equivalent circumferences belonging to three samples, each one taken from the different clones and characterized by equal numbers of parasitized and healthy trees. The U test (Mann–Whitney) applied for this study showed that the latex production of the parasitized trees does not differ significantly from that of the healthy trees, whatever the clone and the month.
Then, unlike the first idea suggesting that mistletoe could stimulate latex production, the U test showed that the parasite has no significant effect on the latex production of the three clones studied. The greatest latex production of the parasitized trees is explained by the fact that parasite affects preferentially the most robust trees. As a result, the eradication of Phragmanthera capitata from the Mitzic plantation, which would be time-consuming and expensive, is not urgent at present. However, one should be aware of risks in the long term, as rubber trees could not tolerate parasitism for too long. Therefore, new control strategies should be proposed in the future.
1 Introduction
Les Loranthaceae sont de petits arbrisseaux épiphytes chlorophylliens, qui vivent en hémiparasites sur les branches d'arbres et d'arbustes, sauvages ou cultivés. Ils sont fixés sur leur hôte par un système d'absorption, ou suçoir, qui est un véritable pont structural et physiologique [1] permettant le prélèvement de l'eau et des substances minérales nécessaires pour leur développement [1–6]. Bien que chlorophylliennes, certaines espèces ont une activité photosynthétique très réduite par rapport à celle de leur hôte [7–11], ce qui les oblige à détourner des matières organiques de leur hôte via les suçoirs. D'autres, en revanche, produisent suffisamment d'hydrates de carbone et ne dépendent donc pas des matières organiques de leur hôte [12–14]. Les fruits des Loranthaceae sont des baies consommées par les oiseaux, qui assurent ainsi la dissémination des graines [15–18].
La famille des Loranthaceae, largement répandue dans le monde, comprend 77 genres et 950 espèces [19]. Sept genres et une trentaine d'espèces sont signalés au Gabon [19]. Parmi ces dernières, Phragmanthera capitata (Sprengel) Balle est majoritaire dans la plupart des plantations d'hévéa en Afrique, notamment au Gabon, au Cameroun, en Côte-d'Ivoire et au Nigeria [20–24]. Les Loranthaceae attaquent également d'autres essences cultivées, telles que cacaoyers, avocatiers, agrumes, réduisant leur rendement [25,26]. Dans les conditions écologiques extrêmes du Sahel, elles parasitent fortement les peuplements de karité, pouvant même entraîner leur mort [17,18,27].
Pour la majorité des auteurs [1–6], le détournement trophique effectué par les plantes parasites épiphytes serait responsable d'importantes pertes économiques, qui n'ont toutefois jamais été chiffrées. Pour d'autres auteurs, qui considèrent que les hôtes du Viscum album, naturellement défoliés pendant l'hiver [28], ou artificiellement dénudés pour Arceutobium americanum [29,30], continuent à vivre pendant plusieurs années, l'interaction se rapprocherait plutôt d'une symbiose. Le parasite pourrait fournir quelques substances nutritives à l'hôte totalement dénudé. Enfin, dans le cas de l'hévéa, qui est régulièrement traité à l'éthéphon, substance qui augmente la productivité des arbres [31–36], on pourrait imaginer que la présence d'un hémiparasite épiphyte puisse continuellement stimuler le métabolisme de l'hôte, augmentant ainsi sa production en latex.
L'une des préoccupations du milieu hévéicole africain est de savoir si la présence des Loranthaceae sur les hévéas, actuellement en exploitation, affecte réellement ou non leur rendement [22]. Au Gabon, la suppression mécanique des branches parasitées, entreprise dans les années 1990, n'a pas abouti à des résultats satisfaisants à cause d'un niveau d'infestation très élevé [37] et des multiples risques physiques encourus par les ouvriers.
Il s'avérait donc indispensable d'évaluer l'incidence de ces parasites sur le rendement des hévéas avant de proposer une quelconque méthode de lutte. La présente étude a donc été entreprise dans cette optique, afin de préciser quantitativement l'impact de Phragmanthera capitata sur la production en caoutchouc de trois clones d'hévéa cultivés dans la plantation industrielle de Mitzic, au Gabon.
2 Matériel et méthodes
2.1 Présentation de la plantation
La plantation industrielle de Mitzic (lat. 0°50′N, long. 11°50′E, alt. 550 m), la plus grande du Gabon (5010 ha), est organisée en 14 secteurs, notés de A à N, séparés par des marécages et constitué pour chacun de plusieurs parcelles. Chaque parcelle renferme des arbres appartenant à un même clone et plantés la même année, sauf les parcelles AA01 et AA02, qui sont des champs expérimentaux constitués de quatre répétitions renfermant chacune six clones. Chaque clone, GT 1, PB 235, PR 261, PB 217, RRIM 600 et AVROS 2037, observé dans la parcelle AA01, est représenté par 80 individus, dans chaque répétition, alors que dans la parcelle AA02, les clones RRIM 712, IRCA 130, IRCA 109, IRCA 111, GT 1 et RRIC 100, sont représentés par 108 individus. Dans les deux types de disposition, les arbres sont répartis en plusieurs lignes, en nombres variables. La distance entre deux lignes est de 7,5 m (espace inter-ligne). À l'intérieur des lignes, les arbres sont espacés de 2,4 m (espace intra-ligne).
2.2 Choix des clones
Les observations ont été effectuées de mars à septembre 2003 dans différentes parcelles de la plantation puis, poursuivies de mai à décembre 2004, dans des parcelles d'hévéa, âgés de 22 ans, comportant des arbres sains et parasités appartenant aux trois clones : GT 1, PB 235 et RRIM 600. Les clones GT 1 et PB 235 ont été choisis pour leur forte représentation dans la plantation et le clone RRIM 600 pour sa forte productivité.
2.3 Méthode d'étude
Afin d'estimer le degré d'infestation des hévéas, les prospections ont été effectuées dans les parcelles 1/0, 3/1, 3/9, 4/2, 5/12, 7/5, AA01 et AA02, soit 13 649 arbres observés, en notant pour chaque arbre parasité, le nombre de touffes du parasite.
Pour étudier l'effet du parasitisme sur le rendement, 30 arbres sains et 30 arbres parasités âgés de 22 ans, en pleine productivité, ont été choisis au hasard pour chaque clone et identifiés par des marqueurs de couleurs différentes, soit 60 arbres par clone et donc 180 arbres pour les trois clones concernés. Les arbres parasités retenus comportaient de 4 à 20 touffes de Loranthaceae, d'un diamètre voisin de 1 m. Le numéro de la ligne dans la parcelle et la position de chaque arbre à observer dans la ligne ont été notés. La circonférence du tronc de chaque arbre a été mesurée au-dessus de l'encoche, à 1,7 m du sol. La longueur de l'encoche, fraction de la circonférence du tronc concernée par l'incision afin de permettre l'écoulement du latex, a été également mesurée. Dans cette exploitation, c'est la saignée en « demi-spirale descendante » qui est pratiquée, c'est-à-dire que l'incision, pratiquée de haut en bas, concerne la moitié de la circonférence de l'arbre. Les arbres des différents clones ont tous subi quatre traitements par une solution d'éthéphon (acide chloro-2-éthylphosphorique) à 2,5%, appliquée sur l'encoche. Ce produit, le plus utilisé dans le processus de stimulation et connu sous le nom d'éthrel, pénètre dans les tissus de l'hévéa, où il est progressivement décomposé en éthylène, C2H4 [35]. Afin de comparer le rendement des individus sains et parasités, leur latex (coagulum), récolté tous les cinq jours, système dit « J 5 » par les exploitants, a été pesé individuellement, durant la période d'août à décembre 2004. Les interactions entre la production de latex et les différents paramètres tels que la circonférence du tronc, la longueur de l'encoche et les variations saisonnières ont été analysées. L'emplacement des arbres ou « effet ligne » a été étudié en comparant la productivité des arbres situés sur différentes lignes, de 1 à 5, avec des effectifs compris entre 30 et 40 arbres.
L'impact réel du parasitisme a été étudié sur des arbres sains et parasités, dont les circonférences ont été réparties en trois classes : 500–700 mm (I1) pour le clone RRIM 600 ; 550–800 mm (I2) pour le clone PB 235 et 700–1000 mm (I3) pour le clone GT 1. Ces intervalles comportent, statistiquement (, Tableau 1), autant d'arbres sains que d'arbres parasités.
Comparaison des effectifs d'arbres sains et d'arbres parasités dans les intervalles I1, I2 et I3 (test t). P : proportion d'individus sains observés ; : effectif des individus sains ; : effectif des individus parasités ; N : effectif total. La valeur critique correspond au risque α=0,05. Si , les différences sont significatives ; t : valeur observée de t obtenue selon la formule suivante :
| N | P | t | |||
| I1 | 20 | 16 | 36 | 0,55 | 0,6 |
| I2 | 14 | 14 | 28 | 0,50 | 0,0 |
| I3 | 15 | 19 | 34 | 0,44 | 0,7 |
Le test U de Mann–Whitney a été appliqué pour comparer la productivité des arbres sains et des arbres parasités appartenant aux intervalles ainsi définis. La quantité U est décrite approximativement par une loi normale [38] en utilisant le test de l'écart réduit Z, comportant l'effectif des arbres parasités () et celui des arbres sains (), selon la formule suivante :
2.4 Relevés pluviométriques
Les précipitations ont été mesurées journellement et regroupées mensuellement durant les périodes d'observation (Tableau 2). Le Gabon connaît quatre saisons : deux saisons sèches, la grande de fin mai à début septembre, la petite de début décembre à la fin janvier, et deux saisons des pluies, la grande, de début février à fin avril, la petite de fin septembre à fin novembre.
Pluviométrie mensuelle (en mm) du site d'étude (SIAT-Gabon, plantation de Mitzic). 01 à 12, mois des années 2003 et 2004
| 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | 11 | 12 | |
| 2003 | 115,4 | 219,9 | 200,6 | 203,7 | 43,8 | 7,7 | 14 | 96,4 | 137 | 418,9 | 410,2 | 92,3 |
| 2004 | 108,3 | 111,3 | 74,4 | 118,1 | 81,4 | 0 | 0 | 3 | 97,4 | 234,5 | 249,9 | 56,1 |
3 Résultats
3.1 Niveau d'infestation des parcelles
Les résultats de la prospection, effectuée dans la plantation industrielle de Mitzic, sur plus de 13 000 arbres au total dans les différentes parcelles et sur divers clones d'hévéa, sont rapportés dans le Tableau 3. Le pourcentage d'infestation (le nombre d'arbres parasités sur le nombre total d'arbres ×100) varie de 19 à 87% selon les parcelles. Ce résultat montre que le niveau d'infestation peut être très élevé dans cette plantation.
Infestation des hévéas (en %) selon le clone et le type de parcelles, plantation industrielle de Mitzic
| Clone | Identification de la parcelle | Nombre d'individus observés | % d'infestation |
| AVROS 2037 | 4/2 | 1606 | 87 |
| PB 235 | 3/1 | 1733 | 84 |
| GT1 | 1/0 | 1091 | 82 |
| PR 261 | 5/12 | 3348 | 50 |
| PB 260 | 7/5 | 736 | 19 |
| RRIM 600 | 3/9 | 1009 | 37 |
| POLYCLONE | AA01 | 1793 | 76 |
| POLYCLONE | AA02 | 2333 | 26 |
3.2 Influence de quelques paramètres sur la production de latex
3.2.1 État et circonférence du tronc des arbres
La Fig. 1 montre la production moyenne de latex, par arbre, sain ou parasité, âgé de 22 ans et par saignée, tous clones et toutes saisons confondus. Les arbres parasités présentent, en moyenne, une production plus élevée pour l'ensemble des clones. Le test de Student ( ; ; ) montre, entre les valeurs moyennes, une différence significative : chaque arbre parasité produit, en moyenne, 275 g de latex par saignée, contre 192 g pour les individus sains.

Production moyenne, en g, par arbre, sain ou parasité, et par saignée, tous clones et toutes saisons confondus. P : arbres parasités ; S : arbres sains ; □ : moyenne ; : erreur-type. Les barres verticales représentent l'intervalle de confiance à 95%.
En examinant cette production selon les types de clones (Fig. 2), il ressort que, quel que soit le clone, les arbres parasités sont toujours plus productifs que les sains. De plus, tous clones confondus (Fig. 3), les troncs des arbres parasités ont des circonférences moyennes significativement plus importantes, 728 mm, que celles des individus sains, 631 mm.
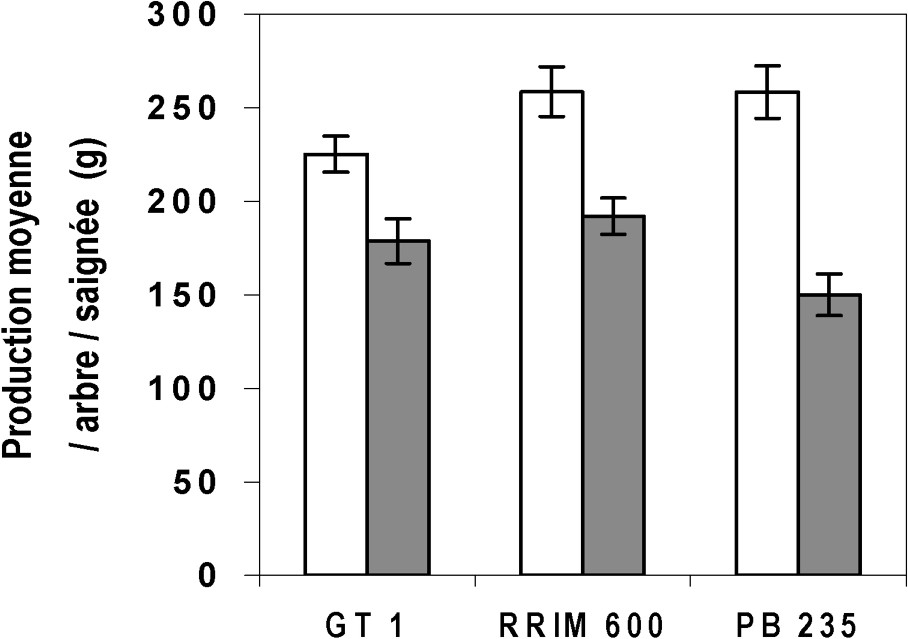
Production moyenne, en g, par arbre, sain ou parasité, et par saignée, selon les clones, toutes saisons confondues. : Production moyenne, en gramme, par arbre parasité et par saignée ; : production moyenne, en gramme, par arbre sain et par saignée. Les barres verticales représentent ± les erreurs-types.

Comparaison des circonférences, en millimètres, des troncs des arbres âgés de 22 ans, sains et parasités, tous clones confondus. Mêmes explications que pour la Fig. 1.
Ces deux résultats, production moyenne de latex et circonférence moyenne du tronc, plus élevées chez les arbres parasités, suggèrent un effet positif du parasite sur la production de l'hévéa. Avant d'entreprendre une étude détaillée de ce lien (chapitre 3.3), d'autres paramètres, pouvant influencer la production en latex, ont été examinés.
3.2.2 Autres paramètres pouvant influencer la production en latex
L'influence d'autres paramètres, position de l'arbre, circonférence du tronc, longueur de l'encoche, effet saisonnier et nature du clone sur la production de latex, a été étudiée.
3.2.2.1 Emplacement de l'arbre.
La Fig. 4 montre la relation entre la production moyenne en latex, par arbre, sain ou parasité âgé de 22 ans et par saignée, tous clones confondus, et la position des lignes de 1 à 5, dans les parcelles indiquées dans le Tableau 3.

Recherche d'un effet ligne sur la production (ANOVA). ▪ Production moyenne, en gramme, par arbre, sain ou parasité, et par saignée tous clones et toutes saisons confondus, en fonction de la ligne de la parcelle de 1 à 5. Les barres verticales représentent l'intervalle de confiance à 95%.
Certaines lignes produisent plus que les autres, mais les effectifs étant inégaux, les intervalles de confiance sont plus ou moins importants. Cependant, le modèle linéaire ne montre aucun lien significatif entre la production et la position des lignes. L'hypothèse d'une absence d' « effet ligne » sur la production n'est pas rejetée ( ; ). L'emplacement des arbres n'est donc pas un paramètre qui influence sensiblement la production de latex. Aucun des arbres retenus n'était dans un bas-fond.
3.2.2.2 Circonférence du tronc, longueur de l'encoche et production de latex.
La Fig. 5 montre l'existence d'un lien entre la circonférence du tronc des hévéas et la production moyenne, par arbre, sain ou parasité, et par saignée ( ; ), tous clones confondus. Que l'arbre soit sain ou parasité, la production moyenne, par arbre et par saignée, augmente en fonction de la circonférence du tronc. Le lien entre la circonférence du tronc et la production des arbres a d'ailleurs déjà été établi par les relations d'allométrie [39].

Lien entre la production moyenne, en gramme, par arbre, sain ou parasité, et par saignée, tous clones et toutes saisons confondus, et la circonférence du tronc, en millimètre. P=0,66 C−220,58 : droite de régression au sens des moindres carrés ; : coefficient de corrélation entre la production moyenne, en g, par arbre, sain ou parasité, et par saignée, tous clones et toutes saisons confondus, et la circonférence du tronc, en millimètre. La surface délimitée par l'ellipse représente la densité de probabilité de 95% pour une variable normale.
La Fig. 6 présente le même type de relation entre la longueur de l'encoche et la production moyenne par arbre et par saignée ( ; ). Les corrélations totales indiquent l'existence d'un lien entre la production moyenne, par arbre et par saignée et la circonférence du tronc, entre cette production et la longueur de l'encoche et entre la circonférence du tronc et la longueur de l'encoche, soit respectivement les coefficients de corrélation : ; et . Ces valeurs sont supérieures à la valeur de r critique, . Mais l'examen des corrélations partielles, lien entre deux variables, la troisième étant fixée [38], montre que :
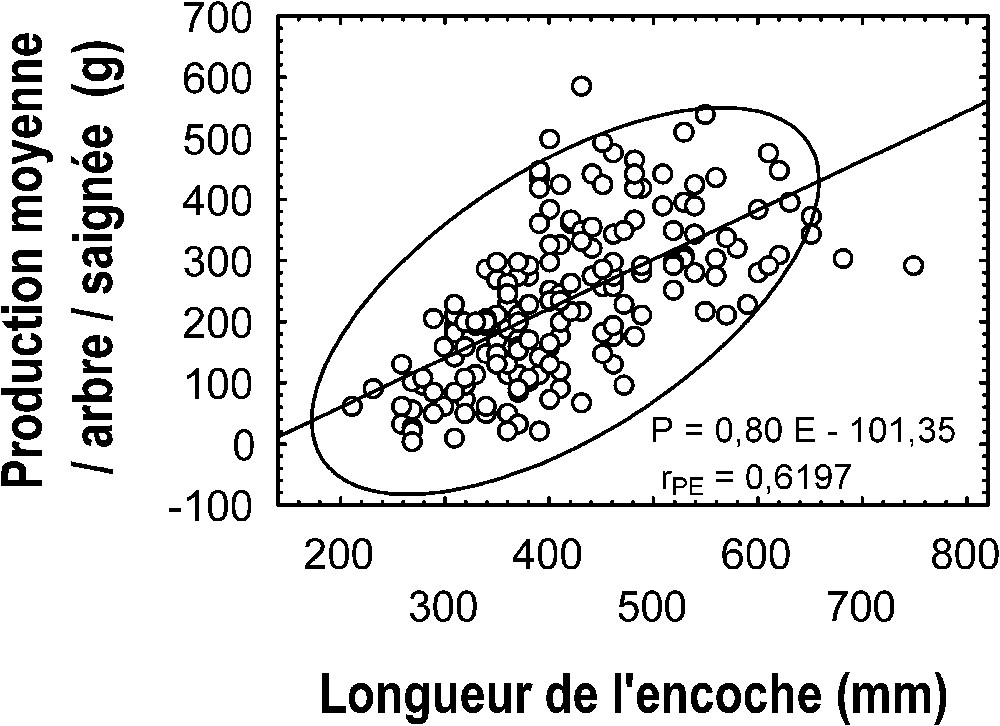
Lien entre la production moyenne, en gramme, par arbre, sain ou parasité, et par saignée, tous clones et toutes saisons confondus, et la longueur de l'encoche, en millimètre. P=0,80E−101,35 : droite de régression au sens des moindres carrés ; : coefficient de corrélation de la production moyenne, en gramme, par arbre, sain ou parasité, et par saignée, tous clones et toutes saisons confondus, et la longueur de l'encoche, en millimètres.
- • , le coefficient de corrélation entre la production moyenne, par arbre et par saignée et la longueur de l'encoche, la variable circonférence du tronc étant fixée, ne diffère pas significativement de zéro ;
- • , le coefficient de corrélation de la production moyenne, par arbre et par saignée et la circonférence du tronc, la variable longueur de l'encoche étant fixée, diffère significativement de zéro . Le lien entre la longueur de l'encoche et la production moyenne, par arbre et par saignée, est donc probablement indirect, en conséquence de la relation étroite qui existe entre la longueur de l'encoche et la circonférence du tronc (), le panneau de saignée couvrant toujours la moitié de la circonférence du tronc en saignée descendante demi-spirale. En revanche, l'existence d'un lien direct entre la circonférence du tronc et la production moyenne, par arbre et par saignée, est confirmée.
3.2.2.3 Nature du clone et effet saisonnier.
Le Tableau 4 et la Fig. 7 récapitulent respectivement l'effet saisonnier et l'effet clonal sur la production des trois clones, GT 1, PB 235 et RRIM 600. En août (grande saison sèche), la production moyenne, par arbre, sain ou parasité et par saignée, tous clones confondus, est faible (Tableau 4, 130,78 g) et on enregistre les plus bas minimum (2 g) et maximum (410 g). Cette production augmente à partir de septembre jusqu'en novembre (fortes précipitations, cf. Tableau 2), où elle devient maximale (Tableau 4, 299,26 g). En décembre (petite saison sèche), la production diminue (196,26 g). Le test t, pour les échantillons appariés, puisqu'il s'agit des mêmes arbres, confirme le lien entre la production et la saison (Tableau 4), la production de latex différant toujours significativement d'un mois à l'autre ().
Variation de la production moyenne, en g, par arbre, sain ou parasité, et par saignée, selon les mois, tous clones confondus (test t pour des échantillons appariés). p : probabilité de se tromper en rejetant l'hypothèse d'une absence d'effet saisonnier sur la production. Si p<0,05, les différences sont significatives. |t| : valeur absolue de t
| Moyenne | Minimum | Maximum | Écart-type | |t| | p | |
| août | 130,78 | 2 | 410 | 82,57 | ||
| septembre | 155,38 | 1,77 | 449,75 | 98,91 | 4,28 | 0 |
| octobre | 272,45 | 5 | 715 | 159,83 | 15,29 | 0 |
| novembre | 299,26 | 6 | 784,0 | 176,13 | 16,23 | 0 |
| décembre | 196,26 | 7 | 662,5 | 127,14 | 8,93 | 0 |
| septembre | 155,38 | 1,77 | 449,75 | 98,91 | ||
| octobre | 272,45 | 5 | 715 | 159,83 | 12,78 | 0 |
| novembre | 299,26 | 6 | 784,0 | 176,13 | 13,75 | 0 |
| décembre | 196,26 | 7 | 662,5 | 127,14 | 5,48 | 0 |
| octobre | 272,45 | 5 | 715 | 159,83 | ||
| novembre | 299,26 | 6 | 784,0 | 176,13 | 5,16 | 0 |
| décembre | 196,26 | 7 | 662,5 | 127,14 | 10,13 | 0 |
| novembre | 299,26 | 6 | 784,0 | 176,13 | ||
| décembre | 196,26 | 7 | 662,5 | 127,14 | 14,98 | 0 |
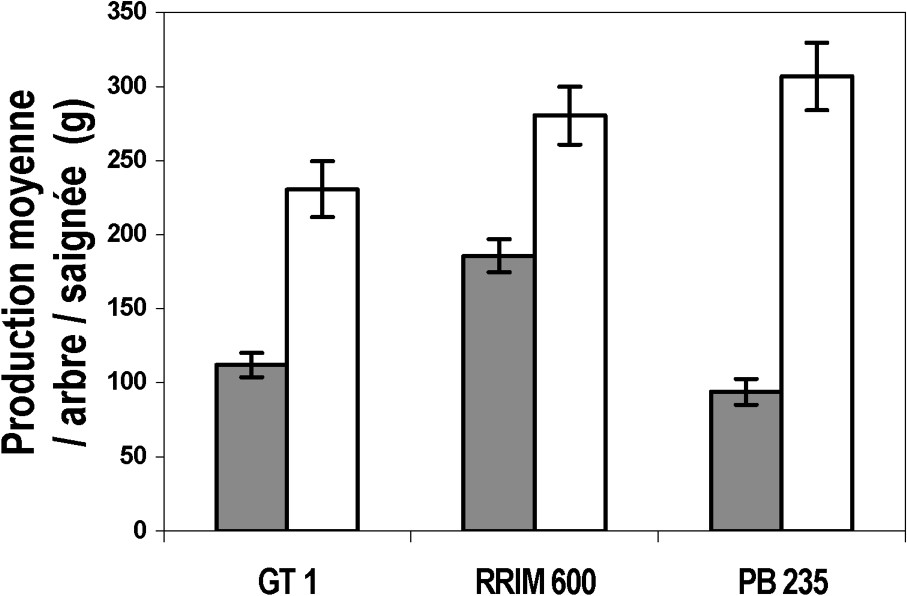
Production moyenne, en gramme, par arbre, sain ou parasité, et par saignée, selon les clones et les saisons. : production moyenne, en gramme, par arbre, sain ou parasité, et par saignée en octobre (saison des pluies) ; : production moyenne, en g, par arbre, sain ou parasité, et par saignée en août (saison sèche). Les barres verticales représentent ± les erreurs-types.
Toutes saisons et tous arbres, sains ou parasités, confondus (Fig. 8), les rendements entre les trois clones ne montrent aucune différence significative (test t, ). Cependant, en août, durant la grande saison sèche (cf. Fig. 7), le clone PB 235 a une faible production, représentant quasiment la moitié de celle du clone RRIM 600. En revanche, durant la saison des pluies (cf. Fig. 7), particulièrement en octobre (test t, ), le rendement du clone PB 235 est élevé. Par rapport à PB 235 (cf. Fig. 7), les clones GT 1 et RRIM 600, bien que moins productifs, en saison des pluies, ont des rendements plus élevés en saison sèche.
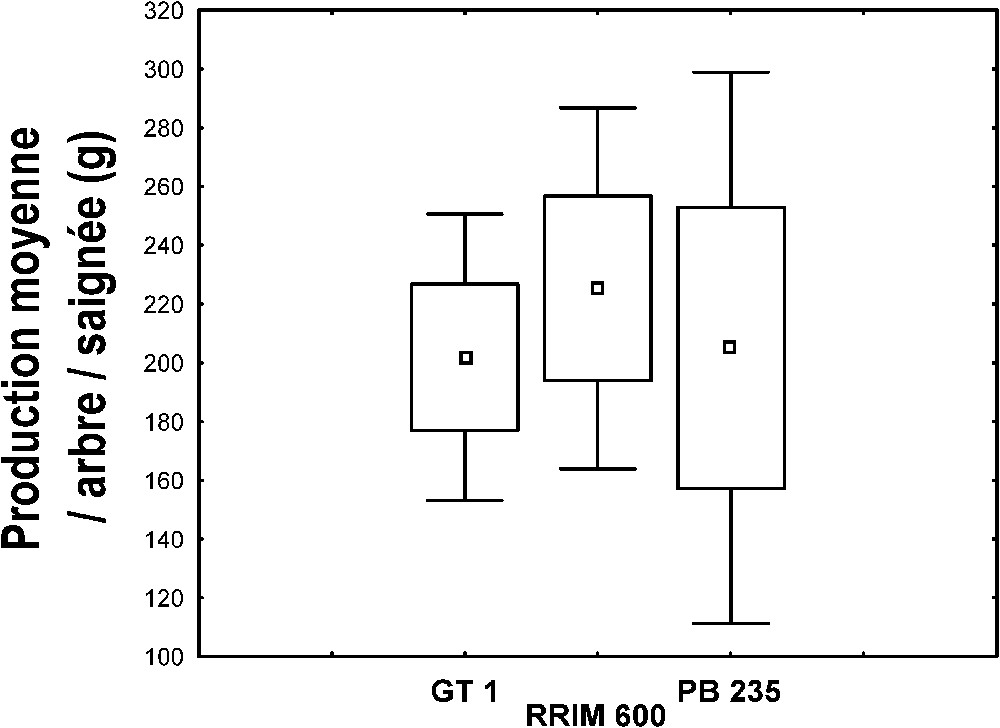
Production moyenne, en gramme, par arbre, sain ou parasité, et par saignée, selon les clones, toutes saisons confondues. Mêmes explications que pour la Fig. 1.
3.3 Impact réel du parasite sur la production
Les observations précédentes indiquent un lien, non seulement entre la production de latex et l'état des hévéas, sains ou parasités, mais aussi entre la production et d'autres paramètres, comme la circonférence du tronc, la saison et la nature du clone. Cette nouvelle donnée nous amène à comparer, pour chaque clone, la production moyenne, par arbre, sain ou parasité, et par saignée, selon les classes de circonférences précisées dans le paragraphe Matériel et méthodes, et selon les mois.
Les résultats du test U (Mann–Whitney, Tableau 5) montrent que, pour des circonférences comparables, la production des arbres sains ne diffère pas significativement de celle des arbres parasités, quel que soit le clone et le mois (, Tableau 5). Ces données suggèrent donc que le parasite n'a pas d'effet significatif sur la production en latex des trois clones d'hévéa.
Comparaison de la production moyenne mensuelle, en g, par arbre, sain et parasité appartenant aux mêmes classes de circonférences. Test U(Mann–Whitney). : effectif des arbres parasités ; : effectif des arbres sains. Les valeurs de Z sont calculées à partir de la formule donnée dans la partie Matériel et méthodes ; p : probabilité de se tromper en rejetant l'hypothèse d'une absence d'effet du parasite sur la productivité. Si p<0,05, les différences sont significatives
| août | septembre | octobre | novembre | décembre | ||
| RRIM 600 | U | 155 | 146 | 133 | 102 | 137 |
| Z | −0,15 | −0,42 | −0,85 | −1,83 | −0,73 | |
| p | 0,88 | 0,67 | 0,40 | 0,06 | 0,47 | |
| PB 235 | U | 96 | 80 | 92 | 95 | 80 |
| Z | −0,09 | −0,82 | −0,27 | −0,13 | −0,82 | |
| p | 0,94 | 0,42 | 0,80 | 0,91 | 0,42 | |
| GT 1 | U | 134 | 138 | 121 | 103 | 90 |
| Z | −0,29 | −0,15 | −0,74 | −1,35 | −1,82 | |
| p | 0,78 | 0,89 | 0,47 | 0,17 | 0,07 |
4 Discussion
Les résultats concernant la production, la circonférence du tronc des arbres et la longueur de l'encoche sont en accord avec les travaux ayant établi le lien entre ces trois facteurs [22,39–41]. En effet, les gros arbres produisent plus de latex. Les plus gros arbres, les plus productifs, étant les plus parasités, on pourrait penser à un effet stimulant du parasitisme, non seulement sur leur développement, mais également sur leur rendement. Cependant, pour des arbres sains et parasités ayant des circonférences comparables, le test statistique U ne montre aucune différence significative entre leurs productivités. Les arbres aux troncs les plus gros, présentant aussi une hauteur supérieure, sont des supports potentiels pour les oiseaux disséminateurs des graines de Loranthaceae, ce qui pourrait expliquer une plus forte fréquentation et donc un niveau d'infestation plus élevé. Des observations [42], effectuées sur le couple Acacia acuminata/Amyema preissii, aboutissent à une conclusion semblable : le niveau de parasitisme des gros arbres est dû à une forte fréquentation par les oiseaux disséminateurs.
La biologie générale des plantes parasites montre que ces plantes, qui détournent à leur profit l'eau et les sels minéraux [1–6], ont également une production d'hydrates de carbone déficiente [9–11,14,43]. Dans ces conditions, on peut s'attendre à ce que la photosynthèse de l'hôte soit affectée, non seulement par cette spoliation trophique, mais également par la compétition qui peut s'installer entre les feuillages des deux partenaires pour la lumière. Des travaux effectués dans d'autres pays africains (Cameroun, Ghana) ont montré l'effet négatif de ces plantes parasites sur les arbres fruitiers, tels les avocatiers, les cacaoyers, les agrumes... [25,26,44] sans pour autant avoir chiffré ces pertes. On sait que l'impact des parasites épiphytes sur leurs hôtes dépend des espèces [12]. En ce qui concerne Phragmanthera, l'hypothèse qui peut être émise est que l'espèce capitata est peu dépendante des hydrates de carbone de l'hôte. Si tel n'était pas le cas, les conséquences du parasitisme sur les hévéas seraient plus sévères, et comparables à celles observées sur les arbres parasités par Arceutobium americanum [45–49], entraînant une perte considérable de bois.
L'usage de l'éthéphon pour lutter chimiquement contre les Viscaceae et les Loranthaceae [50,51] n'a aucun effet sur Phragmanthera capitata puisque, bien que l'encoche soit régulièrement badigeonnée pour stimuler la production, le parasite est toujours présent.
Nos résultats confirment l'effet saisonnier sur la production de latex déjà établi chez l'hévéa [52,53]. Pendant la période humide, l'extrait sec du latex est plus bas [54]. La production plus élevée en saison humide, octobre et novembre, est due à une plus grande disponibilité en eau, permettant une chute de la viscosité du latex et une prolongation de l'écoulement [55]. Pour le clone GT 1, par exemple [54], la durée de l'écoulement, qui est de 140 à 230 min après la saignée, en période humide, passe à 75 à 150 min en période sèche.
La production de latex peut aussi être contrôlée par la teneur en saccharose [53,56], précurseur de la biosynthèse du caoutchouc [57]. La sensibilité à la sécheresse du clone PB 235 est due à une plus faible teneur en saccharose que chez le RRIM 600 et le GT 1 [56]. La teneur en saccharose est liée aux conditions climatiques, une faible luminosité entraînant sa diminution [53,57]. Au Gabon, les saisons sèches sont caractérisées par de faibles précipitations, une baisse de la température et de la luminosité. Chez le clone PB 235, qui a une forte activité métabolique [53,57–61], le saccharose est un facteur limitant la production pendant cette période.
5 Conclusion
Si apparemment le parasitisme par Phragmanthera capitata semble stimuler la croissance des hévéas et leur production, une étude détaillée des principaux facteurs susceptibles d'affecter ces deux paramètres révèle qu'il n'en est rien. Le parasite n'a pas d'effet significatif sur la production du caoutchouc des clones GT 1, PB 235 et RRIM 600, pour des arbres de circonférences comparables. La forte production globale en latex des arbres parasités est due au fait que le parasite attaque préférentiellement les arbres les plus vigoureux, donc les plus productifs. La mise en œuvre de méthodes de lutte lourdes afin d'éradiquer le Phragmanthera capitata des plantations d'hévéa n'est pas préconisée pour l'instant, car les clones d'hévéa utilisés au Gabon supportent le parasite et maintiennent un bon niveau de production en latex. Cependant, les risques à long terme ne sont pas à exclure. En effet, certains clones, très sensibles au Phragmanthera capitata, comme le GT 1 et le PB 235 [23,24], et actuellement les plus représentés dans la plantation industrielle de Mitzic, risquent de voir leur production de latex compromise par le parasite après une ou deux autres décennies d'exploitation. L'exploitation d'une plantation d'hévéa ayant une durée de vie de 30 ans et parfois un peu plus [35] dans la plantation de Mitzic, cette échéance correspondrait à la fin de l'exploitation naturelle des parcelles, et la perte économique serait donc négligeable. Malgré leur sensibilité aux parasites phanérogamiques, les clones PB 235 et GT 1 présentent des caractères secondaires très intéressants, comme la résistance à la casse des branches due au vent [62,63]. Ainsi, en l'absence de clones totalement résistants aux Loranthaceae (Engone Obiang, commun. pers.), pour une gestion durable des plantations, la pratique actuelle d'utilisation d'un panel de clones diversifié devra être poursuivie. Quoi qu'il en soit, les plantations d'hévéa, au Gabon, devraient être protégées car, tout en produisant du latex, elles servent aussi à lutter contre la déforestation et la dégradation des sols.
Remerciements
Nous tenons à remercier le Cirad et la société SIAT Gabon pour leur appui technique et financier, le Pr. Paul Posso de l'Institut de recherche en écologie tropicale, à Libreville, pour son appui logistique au Gabon, M. Bernard Jeune, du laboratoire de cytologie expérimentale et morphogenèse végétale de l'université Pierre-et-Marie-Curie (Paris-6) et M. Marc Salomon, pour la réalisation des traitements statistiques.


