Abridged English version
Hexachlorobenzene (HCB) is a chlorinated aromatic hydrocarbon extensively used in the past as antifungal for the storage of crops.
Although its production was prohibited in many countries, this dioxin-like compound is still present in the environment as a by-product of various chemical processes. The HCB is known for its high chemical stability and persistence, and global water and air pollution is still observed at faraway locations from the production or utilization sites.
Humans or animals' chronic exposure to HCB induces various adverse effects on health. HCB has been reported to be hepatotoxic, immunotoxic, and genotoxic; it is even at the origin of diseases, such as porphyria, and of endocrine disturbances in thyroid and reproductive functions.
This study was conducted to determine the effects of a subchronic exposure to various doses of HCB on liver and thyroid functions in Meriones unguiculatus, a rodent, which, in the wild state, lives near farms where pesticides are regularly used.
Animals maintained at 12L/12D in room with controlled temperature () were provided with commercial rat food and water ad libitum. Daily doses of 0, 1.6, 4 and 16 mg HCB/kg BW in olive oil were administered by force-feeding between 9 and 10 AM over a period of 30 days. At the end of the experiment, the animals were decapitated.
After having been weighed, livers were fixed for histological analysis and plasma samples were frozen at −30 °C before ASAT, ALAT, TT4, and TT3 determinations.
While no modification in body weight was noted in HCB-treated animals compared to controls, high doses of HCB led to a pronounced hepatic hypertrophy with a dose effect. The relative weight (liver/body%) increases with increased HCB doses. Liver histological studies revealed many cytomorphological alterations with a dose effect: centrolobular congestion and some cellular necrosis (1.6 mg HCB), centrolobular and periportal vein congestion, more cellular necrosis and cytoplasmic vacuolization (4 mg HCB), same histological modifications, but more pronounced, with important vacuolization and disappearance of cellular junction (16 mg HCB).
Concerning transaminase activities, only the highest dose of HCB induces modifications in ALAT activity with a significantly higher level in males ( vs. in controls, ) compared to females ( vs. in controls, ). However, for ASAT activity, no significant variation is observed.
Plasma thyroid hormones levels are only affected in the group receiving the highest dose of HCB (16 mg/kg BW). This effect seems sex-dependent: TT4 decreased significantly only in males ( vs. in controls, ), while a strong diminution of TT3 was noted in females ( vs. in controls, ).
It can be concluded that the best index for environmental pollution by HCB (or PCBs) is the relative weight of the liver, with a clear dose effect. Plasma thyroid hormones or transaminase activities seem to be modified only with high doses of pollutant and are not a good indicator of a slight pollution.
The existence of sex-dependent differences in the plasmatic rates of thyroid hormones seems well to emerge. A combined effect of the thyroid function with the reproductive axis should be then envisaged and would deserve to be thorough.
1 Introduction
Les biphényles polychlorés (BPC) constituent une classe d'hydrocarbures aromatiques chlorés dont les propriétés physicochimiques remarquables expliquent le grand intérêt qu'elles représentent pour l'industrie.
Ces produits sont réputés pour leur inertie vis-à-vis des réactifs chimiques et de la chaleur, leur ininflammabilité, leur constante diélectrique élevée et leur résistivité. Ces propriétés, jointes à leur faible coût de revient, expliquent l'importance et la variété de leurs utilisations.
Paradoxalement, ce sont ces mêmes propriétés, à l'origine de leur succès industriel, qui leurs sont reprochées de nos jours, car elles sont aussi la cause de leur persistance dans l'environnement, de leur accumulation dans la chaîne alimentaire et, par conséquent, des retombées néfastes qu'ils auront sur la santé en général.
L'hexachlorobenzène (HCB) appartient à la famille des pesticides chlorés ayant été largement utilisés dans l'agriculture en tant qu'agent antifongique au cours de l'entreposage de grains tels que le blé, l'orge, le seigle et l'avoine [1]. C'est à la suite d'un empoisonnement accidentel survenu dans l'est de la Turquie que le HCB a été considéré comme nocif vis-à-vis de l'environnement et de la santé humaine [2]. D'après la FAO [3], la fabrication, l'utilisation et l'importation de ce fongicide sont interdites par la quasi-totalité des pays développés. Cependant, à cause de son prix bon marché, le HCB continue à être utilisé dans les pays moyennement avancés, car il permet d'assurer la protection des récoltes. Par ailleurs, le HCB persiste encore à l'heure actuelle dans l'environnement, puisqu'il est introduit dans plusieurs procédés industriels [4] ou rejeté en tant que sous-produit de fabrication [5].
Le déplacement de ce pesticide sur de très grandes distances constitue une source continue de sa redistribution dans le monde entier. En effet, les retombées humides représentent le principal mécanisme de son transport entre l'atmosphère et les systèmes aquatiques et terrestres où il se dépose [6].
De nombreux travaux ont clairement mis en évidence la toxicité du HCB sur de plusieurs fonctions physiologiques chez les animaux de laboratoire. Au niveau du foie, le HCB est dit porphyrigène [7]. Il perturbe également certaines fonctions endocriniennes, dont l'activité thyroïdienne [8–10].
Chez l'homme, on note essentiellement une porphyrie ainsi que des anomalies neurologiques, dermatologiques ou orthopédiques. D'autres symptômes ont été signalés : hypertrophie du foie, de la glande thyroïde et des ganglions lymphatiques, ainsi que des cas de coliques et de faiblesse sévère généralisée [11].
Les principales classifications évaluent à des degrés différents le risque cancérigène de ce pesticide. Ainsi en 1987, le CIRC [12] le classe dans le groupe B (pouvoir cancérigène établi de façon suffisamment probante chez les animaux, mais insuffisamment chez l'homme), alors qu'en 1994 l'OMS le classe dans la catégorie A (produit extrêmement cancérigène) [13].
Dans ce travail nous nous sommes proposés d'étudier certains aspects de la toxicité subchronique du HCB sur le mérion, Meriones unguiculatus, rongeur qui vit, à l'état sauvage, aux abords des exploitations agricoles et pourrait ainsi être un marqueur biologique d'une contamination de l'environnement par ce pesticide. Nous avons ainsi abordé quelques aspects de l'hépatotoxicité sur la morphologie, l'aspect cyto-architectural et fonctionnel du parenchyme hépatique. Par ailleurs, et en vue d'étudier la variabilité des mécanismes de réponse de la glande thyroïde à ce pesticide, nous avons exploré son impact sur les taux plasmatiques de la thyroxine totale (TT4) et de la triiodothyronine totale (TT3) plasmatiques.
2 Matériels et méthodes
2.1 Animaux
Meriones unguiculatus est connu sous le nom de gerbille ou de mérion de Mongolie. Tous les mérions qui ont servi à notre étude proviennent d'un élevage réalisé au sein de notre animalerie. Les animaux sont maintenus dans des conditions de température, d'hygrométrie et d'éclairement contrôlés (, , 12L/12D). Ils reçoivent un régime alimentaire standard équilibré sous forme de granulés d'origine SICO (Sfax, Tunisie). La nourriture et l'eau sont fournies ad libitum.
L'étude a porté sur des mérions choisis dans une fourchette d'âge et de poids aussi étroite que possible. Les animaux sont repartis en deux groupes : mâles et femelles, de poids corporel variant entre 69 et 90 g.
2.2 Protocole expérimental
Chaque groupe est composé de quatre lots recevant respectivement 0 (témoin), 1,6 (lot I), 4 (lot II) ou 16 (lot III) mg de HCB/kg de poids corporel et par jour. Les doses sont administrées quotidiennement entre 9 et 10 h du matin par gavage en mélange dans de l'huile d'olive. Le traitement a duré 30 j.
À la fin du traitement, les mérions sont sacrifiés, par décapitation, entre 9 h et 11 h du matin. Le sang artério-veineux, récupéré dans des tubes héparinés, est rapidement placé dans de la glace pilée, puis centrifugé pendant 15 min à 3000 tr/min. Le plasma, reparti en plusieurs aliquotes, est conservé à −30 °C jusqu'aux différentes déterminations. Pour chaque animal, le foie est pesé, des fragments sont rapidement prélevés et fixés en vue de l'examen histologique.
Le dosage de la thyroxine totale (TT4) et de la triiodothyronine totale (TT3) ont été réalisés par RIA en utilisant des kits Immunotech (T4 totale RIA-IM 1447-IM 3286 et T3 totale RIA-IM 1699-IM 3287). Tous les échantillons sont dosés en double. Les coefficients de variation intra-essais et inter-essais sont respectivement, pour la TT4 et la TT3, de 5,1% et 8,6% () et de 3,3% et 8,6% ().
Un kit Elitech, ASSL-0400, ASSL-0420, ASSL-0500 a servi pour le dosage plasmatique de l'aspartate aminotransférase (ASAT) et de l'alanine aminotransférase (ALAT). Ce dosage a été réalisé à l'aide d'un automate système intégré de diagnostic des tests de chimie clinique à l'hôpital régional de Bizerte (service de biologie médicale, unité de biochimie).
2.3 Statistiques
Les résultats expérimentaux sont exprimés sous forme de moyenne arithmétique, accompagnée de l'erreur standard (). La comparaison entre les moyennes est réalisée à l'aide du test F de Fisher. La significativité des résultats est estimée par une analyse de variance (ANOVA).
3 Résultats
3.1 Évolution du poids corporel
Le traitement au HCB ne semble pas perturber significativement la croissance générale des mérions. Aucune différence de l'évolution pondérale n'a été remarquée entre les différents lots : () ; lot () ; lot II = 73,17 g ± 2,7 () ; lot III = 70,48 ().
3.2 Effet du HCB sur le foie
3.2.1 Masse hépatique
Chez le mérion mâle, l'intoxication au HCB entraîne une hypertrophie hépatique, constatée de visu lors des sacrifices, et ce essentiellement chez les lots II et III, traités respectivement avec 4 et 16 mg de HCB/kg/jour. Chez les animaux du lot II, le rapport hépato-somatique est augmenté par rapport au lots T et I (respectivement vs. et , ). L'hépatomégalie s'accentue considérablement chez les animaux du lot III, traités par la dose la plus forte (16 mg de HCB/kg/jour). Chez ce groupe, le poids relatif du foie est presque triplé par rapport à celui des témoins et ceux du lot I (respectivement vs. et , ). Un effet dose-dépendant est également observé entre les lots II (4 mg de HCB/kg/j) et III (16 mg de HCB/kg/j).
Les mêmes observations sont enregistrées chez les femelles. L'hépatomégalie se manifeste également à partir de la dose 4 mg de HCB/kg/jour ( vs. et ). Cette hypertrophie hépatique s'accentue chez les animaux traités avec 16 mg de HCB/kg/jour. Chez ce groupe, le poids relatif du foie augmente d'environs 170% par rapport aux témoins non exposés au HCB (Fig. 1).
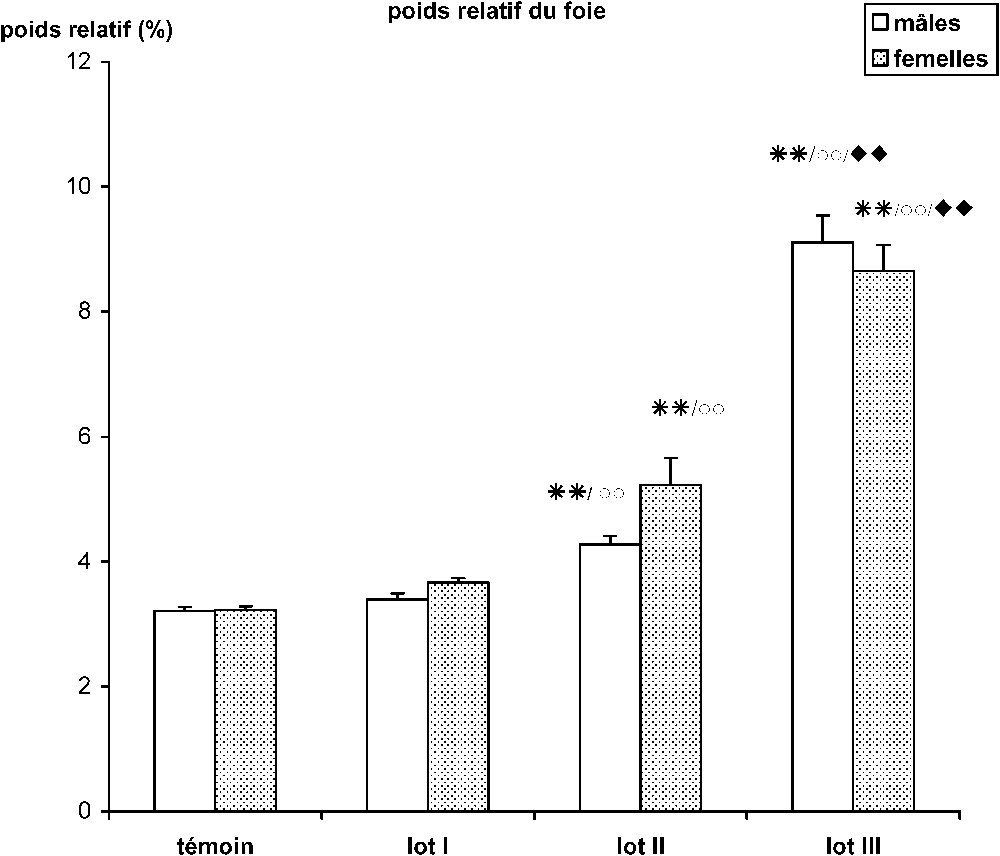
Effet des différentes doses de HCB sur le poids relatif du foie chez le mérion après 30 jours de traitement. ** : p<0,01 lots II et III vs. lot T. ○○ : p<0,01 lots II et III vs. lot I. ⧫⧫ : p<0,01 lot III vs. lot II.
3.2.2 Observations histologiques
Chez le mérion témoin, la structure hépatique (Fig. 2A) montre des cellules polyédriques (hépatocytes), avec un noyau rond comportant une chromatine dispersée à la périphérie et un nucléole bien visible. Les hépatocytes forment des travées bien agencées autour de la veine centrolobulaire. On note aussi la présence de cellules hépatiques en division et de cellules binucléées. Les hépatocytes stockent des quantités notables de glycogène et traitent de grandes quantités de lipides ; ces deux métabolites disparaissent partiellement durant les préparations histologiques de routine, laissant ainsi des zones intra-cytoplasmiques irrégulièrement colorées.

Coupes histologiques du foie de mérions traités avec différentes doses (B : 1,6 ; C et E : 4 ; D : 16 mg/kg/j) de HCB pendant 30 j. H : hépatocytes ; Hb : hépatocyte binucléé ; Vcl : veine centrolobulaire ; Ccl : Congestion centrolobulaire ; Vp : veine porte ; Cpp : congestion périportale ; Vd : vasodilatation ; Nz : nécrose zonale ; V : vacuolisation ; IF : infiltrat inflammatoire.
La coloration rose caractéristique du cytoplasme (éosinophile) est due à la présence de très nombreuses mitochondries, avec de très fines granulations basophiles liées à de nombreux ribosomes libres et au réticulum endoplasmique granulaire. Le noyau des hépatocytes à structure basophile est coloré en bleu violacé.
La dose de 1,6 mg de HCB/kg/j entraîne des modifications histologiques caractérisées par l'apparition de quelques cas de nécrose cellulaire et de congestion centrolobulaire (Fig. 2B).
Le traitement par une dose plus forte (4 mg de HCB/kg/j) entraîne, en plus de la congestion centrolobulaire, une congestion périportale (autour des vaisseaux de l'espace porte entourant le lobule hépatique) (Fig. 2C), l'apparition de vacuoles cytoplasmiques fréquentes et l'abondance de foyers nécrotiques accompagnés d'infiltrats inflammatoires (Fig. 2E).
Chez les mérions traités avec 16 mg de HCB/kg/j, les mêmes lésions hépatiques citées précédemment sont observées, mais à un degré plus important. En effet, les nécroses cellulaires deviennent zonales, la vacuolisation cytoplasmique persiste et les vacuoles deviennent plus fréquentes et de plus grande taille. À ce stade, on note une dislocation des cellules hépatiques, avec perte de jonctions cellulaires. Ainsi, les hépatocytes sont de plus grande taille et l'agencement des cellules en travées autour de la veine centrolobulaire n'est plus visible. On observe aussi chez ces animaux traités par 16 mg de HCB une vasodilatation, accompagnée d'une altération de la paroi vasculaire (Fig. 2D).
3.2.3 Étude des transaminases hépatiques
L'effet du HCB sur l'activité plasmatique de l'ALAT ne se manifeste que chez les mérions exposés à la dose la plus forte (16 mg de HCB/kg/j). En effet, chez ces animaux, la teneur plasmatique de cette transaminase passe de chez les témoins à chez les mâles et de à chez les femelles (Fig. 3A). Le traitement au HCB ne semble pas affecter l'activité plasmatique de l'ASAT chez les femelles ; en revanche, il entraîne une augmentation significative de la concentration plasmatique de cette enzyme chez les mérions mâles recevant 16 mg de HCB/kg/j ( vs. chez les témoins, ) (Fig. 3B).
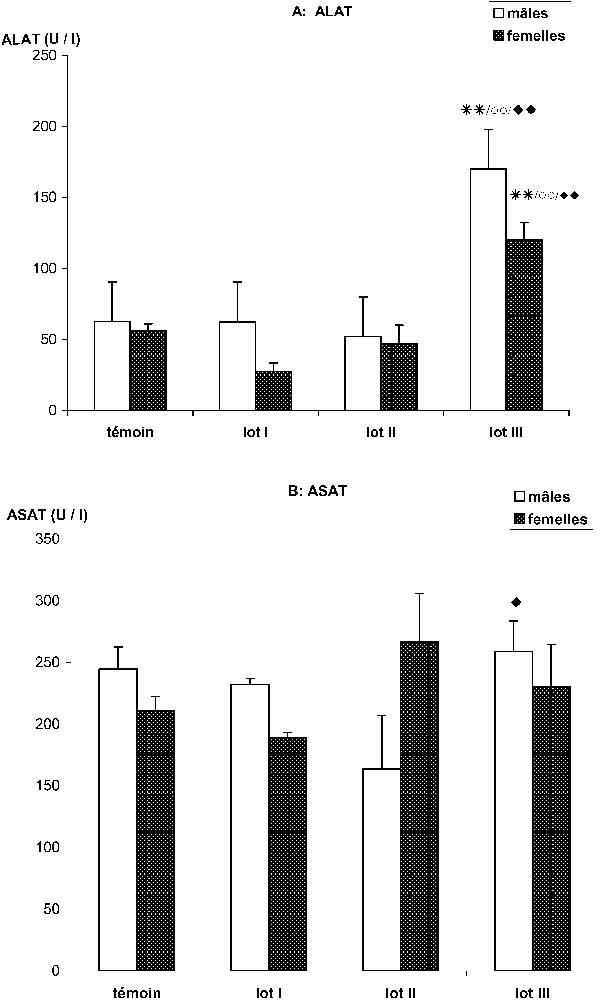
Effet de l'intoxication subchronique avec différentes doses de HCB (lot I : 1,6 ; lot II : 4 et lot III : 16 mg/kg/j) sur la concentration plasmatique des transaminases chez Meriones unguiculatus. (A) ALAT (U/l). Lot III vs. lot témoin. ** p<0,01. Lot III vs. lot I, ○○ p<0,01. Lot III vs. lot II, ⧫⧫ p<0,01. (B) ASAT (U/l). Lot III vs. lot II, ⧫ p<0,05 (chez les mâles).
3.3 Effet du HCB sur les taux plasmatiques des hormones thyroïdiennes
Chez les mérions mâles, le traitement au HCB provoque une baisse de la TT4 plasmatique essentiellement chez les animaux du lot III comparés aux témoins ( vs. , ). Les mérions femelles présentent des variations comparables, mais non significatives (Fig. 4A).
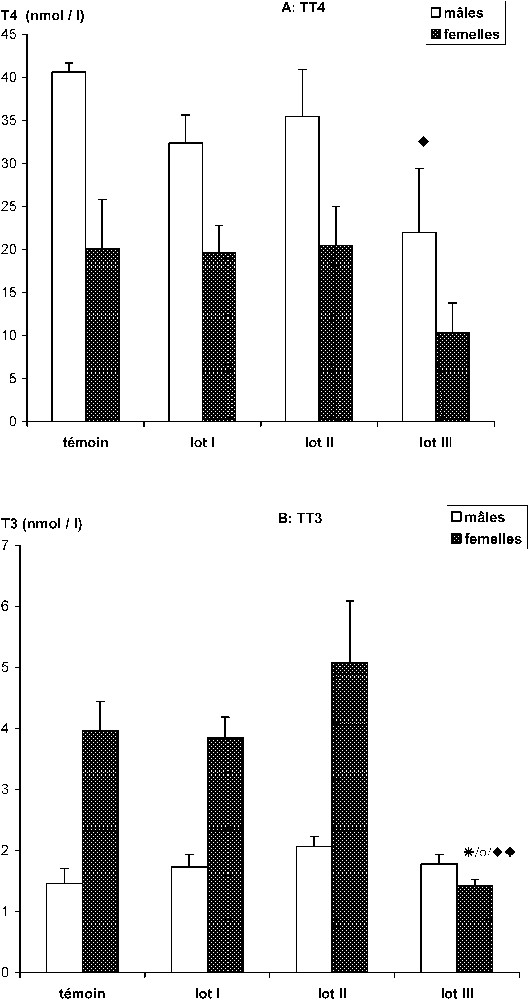
Effet de l'intoxication subchronique avec différentes doses de HCB (lot I : 1,6 ; lot II : 4 et lot III : 16 mg/kg/j) sur la concentration plasmatique des TT4 et TT3 chez Meriones unguiculatus. (A) TT4 (nmole/l). Lot III vs. lot témoin. ⧫ p<0,05 (chez les mâles). (B) TT3 (nmole/l). Lot III vs. lot témoin. ⧫⧫ p<0,01. Lot III vs. lot I. * p<0,05. Lot III vs. lot II. ○ p<0,05 (chez les femelles).
En revanche, chez les mâles le HCB ne semble pas affecter la concentration plasmatique de la TT3 (T : ; lot I : ; lot II : ; lot III : ) ; en revanche, il entraîne une diminution de cette hormone chez les femelles soumises à la plus forte dose (Fig. 4B). Dans ce cas, la diminution est significative par rapport au lot témoin et au lot I (respectivement vs. et , ), et hautement significative comparativement aux animaux du lot II ( vs. , ).
4 Discussion
L'hépatomégalie, signalée par plusieurs auteurs, est un phénomène très précoce qui suit l'agression par le HCB [14–16]. Dans notre étude, une augmentation hautement significative dose-dépendante du poids relatif du foie est constatée chez les animaux ayant reçu des doses de 4 mg/kg/jour et de 16 mg/kg/jour ; elle concerne les deux sexes.
L'exposition de rats à de plus fortes doses de HCB (30 à 250 mg/kg/j), pendant de courtes durées, entraîne en plus de l'hépatomégalie, une modification précoce du métabolisme de l'hème [4,17].
L'effet toxique des faibles doses de HCB est perceptible dans les cas d'intoxications chroniques. Chez le rat Fischer, une intoxication par 0,7 mg de HCB/kg/j pendant 15 semaines entraîne une augmentation du poids du foie [15,18,19]. Le traitement par des doses très faibles de l'ordre de 5 μg/kg/j pendant 90 jours est susceptible de faire apparaître cette manifestation chez la caille du Japon [20,21].
Les altérations histologiques observées dans notre étude sont caractérisées par l'apparition d'une nécrose dose-dépendante, des infiltrats inflammatoires, une congestion et des destructions des parois vasculaires, une perte des jonctions intercellulaires, une augmentation des cellules binucléées, l'apparition de nodules de régénération et une vacuolisation cellulaire chez les deux sexes.
Des altérations histologiques similaires ont été observées après traitement subaigu de rats Wistar au HCH [22] et au DDT [23]. La réponse hépatique à ces xénobiotiques impliquerait un mécanisme à la fois cytotoxique et régénératif [23].
Les transaminases sont considérées comme un bon indicateur de la cytolyse hépatique. Ainsi, des taux élevés des enzymes du foie, notamment l'ASAT et l'ALAT, sont fréquemment attribués aux effets métaboliques et/ou toxiques de différentes drogues comme les psychotropes [24], l'alcool [25], et les agents polluants tels que les résidus de l'industrie pétrolière (benzène, xylènes, oxydes d'éthylène...) [26]. D'après nos résultats, le traitement chronique des mérions par le HCB entraîne une élévation des taux plasmatiques de l'ALAT chez les animaux traités par la dose de 16 mg/kg/j. Ce résultat est confirmé par l'étude histologique, qui montre, chez ces mêmes animaux, une prédominance des nécroses zonales avec abondance des infiltrats inflammatoires. L'absence ou la légère élévation des transaminases dans les autres lots serait le corollaire d'une cytolyse moins importante contrastant avec l'hépatomégalie, qui ne pourrait être expliquée par le seul mécanisme régénératif. Un effet directement mitogène du HCB pourrait être suspecté. Cet effet mitogène direct ainsi que l'induction enzymatique sont connus pour un certain nombre de carcinogènes non génotoxiques [27,28]. De même, la plupart des inducteurs enzymatiques laissent apparaître des signes d'hyperplasie hépatocellulaires avant même que ne soit détecté un quelconque signe distinct de toxicité hépatique durant les premiers jours d'exposition [27,29].
En cas de nécrose, la régénération cellulaire compensatrice constitue l'un des mécanismes qui peuvent aboutir à l'hypertrophie de l'organe [29,30].
Le traitement au HCB semble modifier l'activité thyroïdienne en rapport avec le sexe uniquement chez les animaux traités par la plus forte dose (lot III : 16 mg/kg/j). On note, en effet, une baisse significative des taux plasmatiques de la T4 chez les mâles ( chez les sujets traités vs. chez les témoins) et de la T3 chez les femelles ( chez les sujets traités vs. chez les témoins).
La baisse du taux plasmatique de TT4 suite à l'administration répétée de HCB pourrait être expliquée par divers mécanismes impliquant le foie. En effet, cet organe joue un rôle régulateur dans la physiologie thyroïdienne. D'une part, il réalise la synthèse des protéines de transport et constitue une réserve de thyroxine libre épargnant le capital hormonal et jouant le rôle d'un système « tampon » qui empêche les variations trop brutales de la teneur plasmatique en T4 libre ; d'autre part, il prend en charge la conjugaison des hormones thyroïdiennes.
Selon Sopena de Kracoff et al. [31], la réduction significative du taux de la T4 survenant après 8 j de traitement par le HCB résulterait de l'induction des enzymes hépatiques intervenant dans la dégradation des hormones thyroïdiennes. La diminution du taux sérique de la T4 et la baisse non significative de celui de la T3, après huit semaines de traitement, aussi bien chez le mâle que chez la femelle de rat Wistar, traduirait l'augmentation du métabolisme hépatique de la T4 sans altération de la synthèse des hormones thyroïdiennes [32,33]. De même, Rozman et al. [34] montrent que le traitement par le HCB à raison de 0,1% du régime alimentaire pendant 55 jours induit tout un système enzymatique hépatique, essentiellement le cytochrome P450, le cytochrome b5 et la UDP-glucuronyl transférase, qui intervient dans le métabolisme de la T4. Ces mêmes auteurs suggèrent que le traitement par le HCB active le récepteur cytosolique aryl-hydrocarbone, qui pourrait être impliqué dans l'altération de l'homéostasie thyroïdienne.
Van Raaij et al. [35] suggèrent que la réduction du taux de la T4 n'est pas la résultante d'un effet direct du HCB, mais pourrait être due à l'action de deux métabolites de ce pesticide : le pentachlorophénol (PCP) principal métabolite du HCB, et la tétrachlorohydroquinone (TCHQ), qui seraient respectivement les plus incriminés dans les diminutions respectives de la T4 et de la T3.
D'après nos résultats, la diminution du taux plasmatique de TT4 n'est pas dose-dépendante, mais traduirait plutôt un effet de seuil. En effet, cette baisse est plus marquée à la suite de l'intoxication des mérions par 16 mg de HCB/kg/jour pour les deux sexes, mais seulement statistiquement significative chez le mâle. Une réponse compensatrice de la glande chez les animaux traités par des faibles doses de HCB [36,37] expliquerait l'absence d'effets chez les lots I et II.
Concernant la T3, nos résultats indiquent aussi un effet seuil au niveau de la dose la plus forte (16 mg), mais seulement chez la femelle, alors qu'aucune variation n'est observée chez le mâle, suggérant la présence d'un dimorphisme sexuel. Ces résultats concordent avec ceux rapportés par Smith et al. [38], mais cela ne semble pas être le cas général, puisque Foster et al. [39] n'observent ce résultat que consécutivement à l'induction de l'ovulation.
En conclusion, cette étude a permis de mettre en évidence la toxicité du HCB particulièrement sur les fonctions hépatique et thyroïdienne chez Meriones unguiculatus. L'augmentation du poids relatif du foie d'une manière dose-dépendante apparaît être un bon marqueur pour des pollutions par des faibles doses et pourrait être utilisée dans les zones agricoles, et même dans des zones plus éloignées des sources directes de polluants. L'existence d'une réponse différente chez le mâle et la femelle, certainement liée aux hormones sexuelles, semble bien se dégager et mériterait d'être approfondie.


