Abridged English version
The Mediterranean stone pine Pinus pinea L. (gymnosperm, Pinaceae) is much appreciated for its seeds, widely used in a lot of traditional dishes, such as cakes. Seeds have a significant chemical composition and a nutritive value, since they are highly oleaginous and rich in vitamins, in potassium and in phosphorus. Nevertheless, literature data on storage proteins of this species are very limited; there has been no report concerning the storage proteins of Pinus pinea.
In this study, we report the fractionation and the characterization by SDS-PAGE of the proteins of Pinus pinea L., and particularly a protocol designed to extract all the categories of storage proteins (albumins, globulins, prolamins, and glutelins), based on their solubility. Mature seeds, sampled from seven Mediterranean populations (from Tunisia, Spain, France, Greece, Italy, Morocco, and Turkey) were used.
Seeds contain 25% proteins on a dry-weight basis. P. pinea accumulates globulins as major proteins (75% of total storage proteins), composed of several subunits of 10 to 150 kDa, as revealed by SDS-PAGE. Globulins' profiles are comparable for all populations, and no variability among these populations was revealed.
The albumin fraction (15%) represents three subunits of 14, 24, and 46 kDa. As for glutelins, the least soluble, they are represented in small proportions (10%). Their constitutive units have frequent PM of 43 kDa. Prolamins also represent very small proportions (1 to 2%).
1 Introduction
Outre la valeur industrielle de son bois, le pin pignon est apprécié pour sa production fruitière. Les graines sont oléagineuses et particulièrement riches en lipides, 45–50% du poids sec de la graine [1], en vitamines et en sels minéraux [2]. Les protéines de réserve constituent actuellement l'aliment de base de l'homme. Le besoin protéique journalier avoisine 0,8 g de protéine/jour/kg, soit environ 56 g de protéines par jour pour un homme de 70 kg [3]. Les protéines de réserve végétales fournissent plus de la moitié des protéines totales et sont constituées d'un mélange, en proportions variables, de diverses catégories de protéines réparties depuis fort longtemps par Osborne [4] en classes ou groupes sur la base de leur solubilité : les albumines sont solubles dans l'eau et les globulines dans les solutions salines. Les prolamines sont solubles dans les alcools dilués comme l'éthanol à 70% ou l'isopropanol à 55%. Les glutélines et les protéines résiduelles sont partiellement solubles dans les solutions acides ou alcalines diluées.
Les différences en proportions entre ces diverses fractions protéiques illustrent souvent la valeur nutritive des graines. Les légumineuses sont plus riches en albumines et en globulines, tandis que les céréales sont riches en prolamines et glutélines. Par ailleurs, les légumineuses ont des teneurs plus élevées en protéines (20 à 40% du PS), alors que les céréales n'en contiennent, en général, pas plus de 10 à 15% [5]. Enfin, les albumines et les globulines sont plus riches en lysine, acide aminé essentiel, tandis que les prolamines et les glutélines sont plus riches en acides aminés soufrés. Allona et al. [6,7] ont étudié les caractéristiques des globulines de Pinus pinaster et indiquent qu'elles appartiendraient à la famille des globulines 7S. De plus, ces mêmes auteurs [8] ont pu purifier et caractériser les globulines de faible PM, qui présentent une structure dimérique, c'est-à-dire qu'elles sont constituées d'une grande et d'une petite sous-unité, liées par des ponts disulfure. Elles sont riches en arginine et en cystéine.
Les graines de pin pignon sont employées depuis l'Antiquité comme produit culinaire dans les régions méditerranéennes. Au Moyen-Orient et en Tunisie, elles sont utilisées en pâtisserie.
Dans ce travail, nous envisageons d'étudier le fractionnement et la caractérisation par SDS-PAGE des protéines de réserve de Pinus pinea L. en vue d'illustrer la valeur nutritive des graines de cette espèce.
2 Matériel et méthodes
2.1 Matériel végétal
Des graines mûres de pin pignon ont été utilisées dans cette étude. Les graines locales proviennent de la population Bechateur (37°26′N, 9°89′E), une population côtière du Nord de la Tunisie (BE). Afin d'ouvrir les cônes mûrs récoltés, la technique de Franclet a été utilisée ; elle préconise leur trempage pendant 15 secondes dans de l'eau bouillante, afin de provoquer des ruptures dans les joints de résine scellant les écailles. Les cônes, sortis de l'eau bouillante, sont placés directement dans une enceinte de séchage par l'air chaud et sec ; ils s'ouvrent ainsi rapidement et simultanément.
Les graines de pin pignon provenant du Maroc et de populations européennes ont été fournies par l'unité de recherches forestières méditerranéennes d'Avignon (Inra). Elles proviennent de six pays (Fig. 1) :
Localisation géographique des populations étudiées.
- – Espagne (population « Cordillera Central », E2) ;
- – France (population « Saint-Aygulf », F2) ;
- – Grèce (population « Grèce Agios », G2) ;
- – Italie (population « Feniglia », I) ;
- – Maroc (population « Mezzine », M1) ;
- – Turquie (population « Izmir », T2).
2.2 Analyse des protéines de réserve
2.2.1 Extraction des différentes classes de protéines de réserve du pin pignon
Afin d'extraire toutes les classes des protéines de réserve du pin pignon, nous avons mis au point un protocole de fractionnement des différentes catégories de protéines, se basant sur leurs différences de solubilité [4]. Puis la concentration en protéines de chaque fraction est déterminée par la méthode de Bradford [9]. L'ensemble des étapes du fractionnement est résumé dans la Fig. 2.
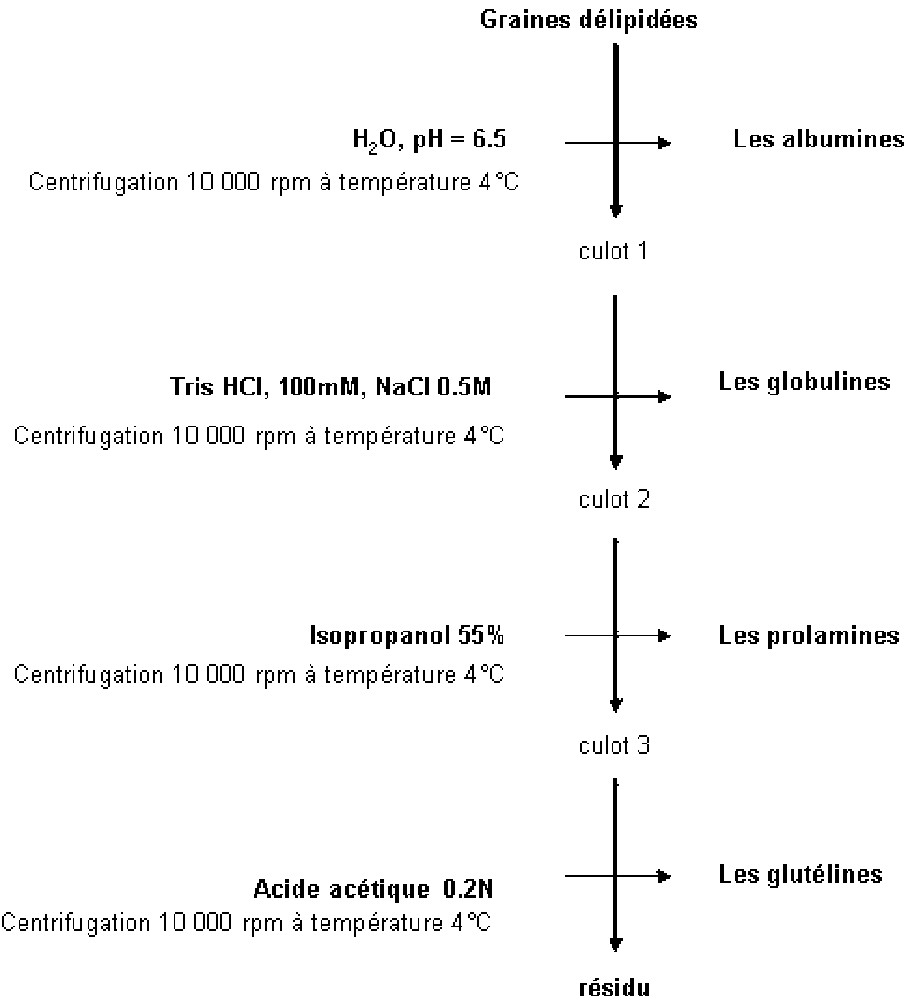
Protocole expérimental de l'extraction des différentes classes de protéines de réserve des graines de pin pignon.
Les graines, préalablement délipidées au Soxhlet, sont broyées énergétiquement dans de l'eau distillée à raison de 0,1 g/10 ml de tampon. L'homogénat est centrifugé à 10 000 rpm à 4 °C pendant 20 min. Un aliquote du surnageant, qui contient les albumines solubles, est récupéré pour le dosage des protéines.
Ensuite, le premier culot est homogénéisé de nouveau dans une solution de Tris HCl 100 mM, NaCl 0,5 M de pH = 8,1, pour l'extraction de la fraction globulines, après centrifugation dans les mêmes conditions que précédemment. De même, le culot 2 est repris dans une solution d'isopropanol à 55% ; après homogénéisation et centrifugation, les prolamines sont récupérées. Enfin, le culot 3 servira pour l'extraction des glutélines par une solution d'acide acétique 0,2 N.
2.2.2 Dosage des protéines par la méthode de Bradford
L'estimation des quantités de chaque catégorie de protéines est réalisée selon la méthode de dosage de Bradford [9].
À 50 μl d'extrait de protéines sont ajoutés 50 μl d'eau distillée et 2 ml de réactif de bleu de Coomassie, préparé comme suit : 100 mg de poudre de bleu de Coomassie G 250 sont dissous dans 50 ml d'éthanol absolu, puis on y ajoute 100 ml d'acide orthophosphorique à 85%. Le mélange résultant est ajusté avec de l'eau distillée à un volume final de 1000 ml, puis filtré et conservé à froid (4 °C).
Après stabilisation de la couleur pendant 5 min, la densité optique du mélange est déterminée à 595 nm à l'aide d'un spectrophotomètre (LKB – Spectronic 20D+).
Les concentrations sont déterminées par référence à une gamme étalon à base de BSA, dont la concentration varie de 0 à 150 μg, préparée dans les mêmes conditions opératoires que les échantillons.
2.2.3 Électrophorèse des protéines sur gel de polyacrylamide
La méthode utilisée dans ce travail est l'électrophorèse verticale sur plaque en mini-gel de polyacrylamide (80 × 85 mm) contenant 12 puits, décrite par Laemmili (1970). Dans cette méthode, on admet que les complexes SDS protéines (conditions dénaturantes) possèdent une même charge globale négative. Dans ce cas, seul le paramètre encombrement moléculaire intervient dans la vitesse de migration et, donc, dans la séparation des protéines.
2.2.3.1 Composition et préparation des gels.
Les gels de polyacrylamide sont constitués de deux zones. Ils sont coulés entre deux plaques en verre. La partie supérieure constitue le gel de concentration, dont le rôle est de rassembler les protéines, déposées, en haut du gel de séparation. Dans cette zone, la concentration en acrylamide est de 3% et la concentration des protéines est possible grâce au pH de la solution tampon du gel, qui est égal à 6,8, très voisin du pHi de la glycine. La partie inférieure, qui possède la proportion la plus importante, constitue le gel de séparation où la concentration en acrylamide est de 10%. Cette concentration détermine la réticulation de l'acrylamide. Le gel est préparé dans une solution tampon de pH 8,6. La polymérisation des gels a lieu en présence d'un catalyseur tel que le Temed et d'un activateur comme le persulfate d'ammonium.
2.2.3.2 Préparation des échantillons et migration des protéines.
Nous avons effectué des électrophorèses en présence de SDS dans un tampon de migration de pH = 8,6. L'électrophorèse dure environ 2 h sous une différence de potentiel de 120 V et un ampérage de 20 mA, jusqu'à migration complète du bleu de bromophénol.
Au préalable, les extraits de chaque catégorie de protéines sont précipités à −20 °C dans l'acétone (1:4, v/v). On ajoute 1 ml d'acétone à 250 μl d'échantillon. Le mélange ainsi obtenu est conservé pendant 30 min à 1 h à −20 °C, puis centrifugé à 10 000 rpm pendant 15 min. Par la suite, l'acétone est éliminée. Le culot protéique est porté pendant 15 min à 37 °C, puis repris dans 100 μl de tampon de charge.
Pendant les dépôts, les échantillons de protéines sont maintenus à chaud au bain-marie, afin d'empêcher la cristallisation des sels ; qui gênerait la migration des molécules protéiques.
L'évaluation des masses moléculaires des polypeptides séparés est possible par référence à des marqueurs de masses moléculaires connues (Promega, Madison, États-Unis), déposés dans les mêmes conditions opératoires.
2.2.3.3 Révélation des protéines.
Après électrophorèse, les protéines sont fixées et colorées dans une solution de bleu de Coomassie Brillant R-250 (Sigma) à 0,25% (m/v). Après coloration, l'excès de colorant est retiré à l'aide d'une solution formée d'un mélange de méthanol, d'acide acétique et d'eau distillée (3:1:6, v/v/v). Les gels sont ensuite rincés abondamment à l'eau.
2.3 Analyse statistique des données
L'analyse de la variance et la comparaison multiple des moyennes (test de Student) ont été utilisées dans cette étude.
De plus, pour évaluer les informations fournies par les teneurs des différentes classes protéiques, l'analyse en composante principale (ACP) a été appliquée sur les teneurs des trois classes majeures (albumines, globulines et glutélines). L'ACP est une technique d'emploi commun qui permet de visualiser les données et de trouver d'autres vraies dimensions d'un échantillonnage. L'ACP génère un ensemble de nouvelles variables (axes), de nouvelles combinaisons linéaires des variables originelles, afin que la valeur maximale de la variance contenue dans l'échantillonnage (information) soit concentrée dans les premiers composants principaux [10].
3 Résultats
3.1 Teneurs en protéines de réserve de pin pignons des différentes populations méditerranéennes
Afin de déterminer les teneurs des protéines de réserve du pin pignon, des graines préalablement délipidées sont utilisées. Les résultats des dosages ont permis de donner des estimations des protéines totales solubilisées ainsi que les différentes classes de protéines de réserve (Tableau 1).
Teneurs en protéines et compositions en classes protéiques de réserve des graines des populations méditerranéennes de pin pignon
| Solvants | Classes protéiques | Teneurs en protéines des populations méditerranéennes mg/g MS⁎ | ||||||||
| Populations | BE | E1 | F1 | G1 | IT | M1 | T1 | moyenne mg/g MS | % en protéines totales | |
| H2O | Albumines | 39,89 | 34,71 | 28,69 | 34,85 | 27,98 | 43,87 | 36,46 | 35,21 | 14,42% |
| Tris HCl, 100mM, NaCl 0,5 M | Globulines | 192,01 | 181,82 | 177,25 | 182,17 | 172,55 | 189,52 | 181,68 | 182,43 | 74,74% |
| Isopropanol 55% | Prolamines | 4,90 | 3,53 | 3,28 | 3,57 | 3,92 | 3,14 | 3,12 | 3,64 | 1,48% |
| Acide acétique 0,2 N | Glutélines | 12,37 | 41,71 | 14,40 | 17,47 | 41,00 | 15,76 | 16,83 | 22,79 | 9,33% |
| Somme | 249,17 | 261,77 | 223,62 | 238,06 | 245,45 | 252,29 | 238,09 | 244,06 mg/g MS soit 24,4% |
⁎ : chaque valeur est la moyenne de trois répétitions.
L'examen des données du Tableau 1 permet de remarquer que les graines de pin pignon sont riches en protéines, avec environ 244,06 mg/g MS, soit environ 25% du PS. Les globulines sont les protéines majeures : elles forment 74,74% des protéines totales, suivi par les albumines et les glutélines, qui forment respectivement 14,42% et 9,33%. La fraction prolamine est très peu présente, avec seulement 1,48%. De plus, l'analyse de la variance des teneurs dans les différentes classes des protéines de toutes les populations méditerranéennes étudiées montre que tous les tests ne sont pas significatifs (Tableau 2). Quelle que soit la classe considérée, le pin pignon montre une faible variabilité de composition. De même, la comparaison multiple des moyennes des teneurs dans les différentes classes protéiques ne montre pas de différence significative (Tableau 3).
Résultats de l'analyse de la variance à un facteur, portant sur les teneurs des différentes classes de protéines de réserve de pin pignon des populations méditerranéennes
| Classes | Source de variation | C.M. a | ddl b | c |
| Albumines | Population | 581,27 | 6 | 1,60 |
| Résiduelle | 96,87 | 14 | ||
| Globulines | Population | 802,46 | 6 | 0,45 |
| Résiduelle | 133,74 | 14 | ||
| Prolamines | Population | 7,03 | 6 | 0,65 |
| Résiduelle | 1,17 | 14 | ||
| Glutélines | Population | 2945,18 | 6 | 0,78 |
| Résiduelle | 490,86 | 14 |
a : Carrés moyens ;
b : degré de liberté ;
c : facteur Snedecor–Fisher.
Résultats de l'analyse de la comparaison multiple des moyennes des teneurs des différentes classes de protéines de réserve des populations méditerranéennes
| Descripteur | Moyenne | Groupement SNK a | Populations b |
| Albumines | 27,98 | A | I |
| 28,69 | A | F2 | |
| 34,71 | A | E2 | |
| 34,85 | A | G2 | |
| 36,46 | A | T2 | |
| 39,89 | A | BE | |
| 43,87 | A | M1 | |
| Globulines | 172,55 | A | I |
| 177,25 | A | F2 | |
| 181,68 | A | T2 | |
| 181,82 | A | E2 | |
| 182,17 | A | G2 | |
| 189,52 | A | M1 | |
| 192,01 | A | BE | |
| Prolamines | 3,12 | A | T2 |
| 3,14 | A | M1 | |
| 3,28 | A | F2 | |
| 3,53 | A | E2 | |
| 3,57 | A | G2 | |
| 3,92 | A | I | |
| 4,90 | A | BE | |
| Glutélines | 12,37 | A | BE |
| 14,40 | A | F2 | |
| 15,76 | A | M1 | |
| 16,83 | A | T2 | |
| 17,47 | A | G2 | |
| 41,00 | A | I | |
| 41,71 | A | E2 |
a : Groupement SNK : groupement Student–Newman et Keuls.
b : Les populations qui sont reliées par les mêmes lettres ne sont pas significativement différentes les unes des autres pour le seuil de probabilité fixé à 0,05.
3.2 Fractionnement des classes des protéines de réserve de pin pignon
La solubilisation des différentes classes protéiques des graines et leur fractionnement par électrophorèse nous ont permis de caractériser les PM des sous unités de chaque classe (Figs. 3–5). La population de Bechateur (Tunisie) a servi à cette analyse.

Électrophorégramme des globulines (1), des albumines (2) et des glutélines (3) de graines de pin pignon de la population tunisienne de Bechateur (BE), sur gel SDS-PAGE (PM : marqueur de taille de protéines standards).
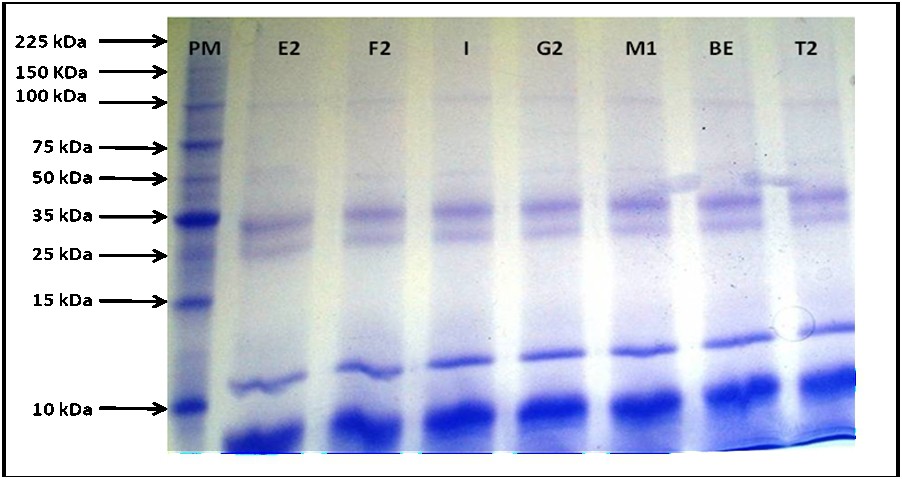
Electrophoregramme des globulines des populations méditerranéennes (PM : marqueur de taille) ; Espagne (E2), France (F2), Italie (I), Grèce (G2), Maroc (M2), Tunisie (BE) et Turquie (T2).

Représentation schématique des électrophoregrammes des globulines.
Les résultats indiquent que les globulines sont formées d'une quantité importante de sous unités de PM inférieurs à 10 kDa (G6) et d'autres d'environ 12 kDa (G5). Des chaînes moins abondantes de PM élevés ont des valeurs de 40–50 kDa (G3 et G4). Enfin, de très faibles bandes sont révélées au niveau des PM 75 et 150 kDa (G2 et G1). Les albumines de pin pignon présentent trois sous-unités d'environ 14 (A3), 24 (A2) et 46 (A3) kDa. Les albumines, en général faiblement représentées dans les graines, sont des protéines solubles de faible PM douées d'activités enzymatiques.
Quant aux glutélines, quatre sous-unités ont pu être révélées : ce sont Gt4, Gt3, Gt2 aux environs de 8, 20 et 43 kDa, respectivement, parmi lesquelles Gt2 est la plus abondante. Une dernière bande Gt1, très faible, est estimée à 64 kDa.
Les graines de pin pignon semblent avoir une composition en protéines de réserve particulière où les globulines dominent. Cependant, Allona et al. [6,7,11] trouvent que les glutélines sont les principales protéines de réserve des graines de l'espèce Pinus pinaster. La fraction des globulines représente également un pourcentage élevé (26%). Les structures des glutélines sont dimériques, avec deux sous-unités de 21 et 34 kDa, liées par des ponts disulfure. Les globulines présentent deux sous-unités de PM 175–190 kDa, composées de monomères de 22, 27 et 47 kDa, reliées par des interactions faibles, et une autre sous-unité de 14 kDa, composée de dimères dont les chaînes sont reliées par des ponts disulfure.
En résumé, les graines de pin pignon semblent donc avoir une composition en protéines de réserve particulière, au sein de laquelle les globulines (caractéristiques des légumineuses) dominent, avec des sous-unités de faibles PM (5–10 kDa) et d'autres ayant des PM plus élevés (50 kDa). Les prolamines (caractéristiques des céréales) n'existent que sous forme de traces.
Quant aux glutélines, les moins solubles, elles sont présentes, bien qu'en faible proportion (10% des protéines totales). Les sous-unités constitutives ont des PM fréquents de 43 kDa.
3.3 Analyse du polymorphisme des globulines des populations méditerranéennes
Dans cette analyse, la fraction des globulines – classe majeure des protéines des graines de pin pignon – a été employée, afin d'évaluer une éventuelle diversité parmi les sept populations prospectées.
La séparation par électrophorèse sur gel de polyacrylamide, en conditions dénaturantes (SDS-PAGE), ne nous a pas permis de visualiser des différences au niveau des différents profils. Nous constatons que ceux-ci sont homologues pour toutes les populations. Ainsi, on ne peut distinguer aucune variabilité parmi ces populations. D'autres analyses complémentaires seraient nécessaires : ainsi, une éléctrophorèse bidimensionnelle permettrait de visualiser les différentes protéines dans leur état natif et fournirait peut-être des résultats, plus informatifs.
3.4 Analyse en composantes principales
Ayant remarqué des variations sensibles dans les teneurs en albumines et en glutélines selon l'origine géographique (Tableau 1), une analyse en composante principale a été entreprise pour différencier les populations méditerranéennes en utilisant les teneurs des albumines, des globulines et des glutélines. De cette analyse, les deux axes d'inertie axe 1 et axe 2, qui expriment 97,851% de la variation totale, ont été retenus (Tableau 4).
Axes de l'ACP définis par la composition en albumines, globulines et glutélines des populations méditerranéennes de pin pignon
| Composantes | PC 1 | PC 2 | |
| % Inertie | 77,608 | 20,243 | |
| % Cumulative | 77,608 | 97,851 | |
| Caractères définissants les axes | Albumines | 0,608 | 0,427 |
| Globulines | 0,631 | 0,253 | |
| Glutélines | −0,482 | 0,868 |
Les deux axes d'analyse d'ACP, qui expriment 97,851% de la variation totale, sont représentés dans le Tableau 4. L'axe 1 explique 77,608% de la variation totale, et associe positivement les albumines et les globulines. Le long de l'axe 2, qui explique 20,243% de la variation, la variable la plus discriminante est la composition en glutélines.
La projection des données sur les plans définis par les axes d'inertie d'ACP (Fig. 6) montre que, malgré les variations sensibles de composition en protéines entre les différentes populations, une certaine structuration géographique peut être envisageable. En effet, les populations de Turquie (T2) et de Grèce (G2) forment un groupe de « populations de l'Est ». Les populations de Tunisie (BE) et du Maroc (M1) forment un groupe de « populations de d'Afrique du Nord ». Le reste des populations, individualisées, forme un troisième groupe « Europe de l'Ouest », qui comprend les populations d'Espagne (E2), de France (F2) et d'Italie (I).
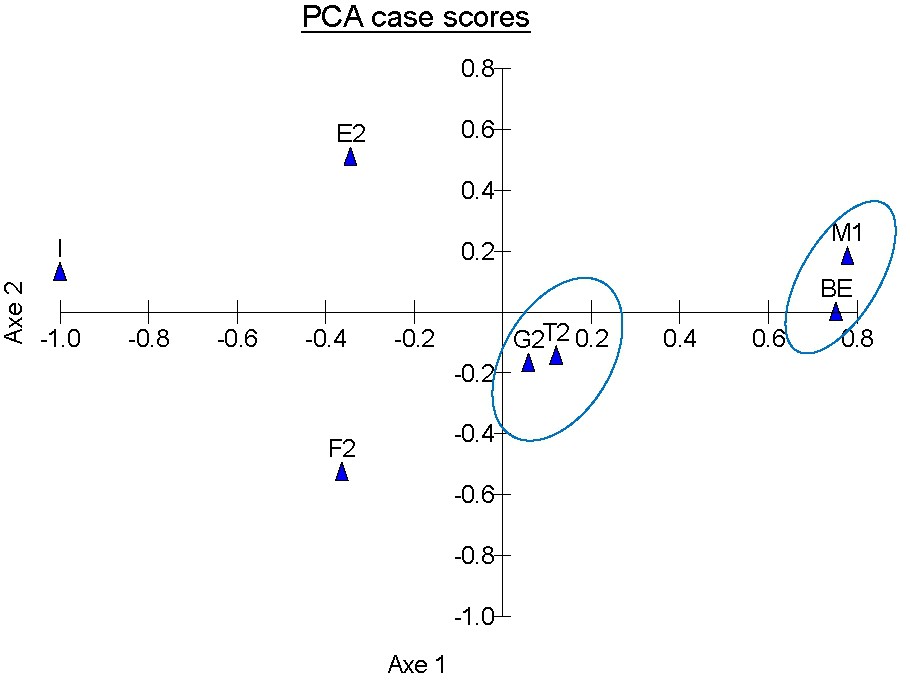
Variabilité de composition en proréines de réserve des populations méditerranéennes, exprimée par l'analyse en composante principale. Dispersion des populations dans les plans formés par les axes 1 et 2 de l'ACP.
4 Conclusion
Les graines de pin pignon contiennent une quantité importante de protéines de réserve, soit environ 25% du PS.
Les globulines sont les protéines majeures, qui forment environ 75% des protéines totales. Les albumines et les glutélines forment respectivement 15% et 10%. La fraction prolamine est très peu représentée, avec seulement 1,48%. Ainsi, les graines de pin pignon semblent avoir une composition en protéines de réserve différente de celle d'un autre conifère, Pinus pinaster [6,7,11], au sein de laquelle les globulines dominent. Elles sont formées de nombreuses sous unités (5–10 kDa) et d'autres moins abondantes, de PM plus élevé (50 kDa). Les prolamines, quant à elles, n'existent que sous forme de traces. Quant aux glutélines, elles sont présentes, bien qu'en faible proportion (10% des protéines totales) ; leurs sous-unités constitutives ont des PM aux environs de 43 kDa.
Bien que les électrophorégrammes des globulines des différentes populations méditerranéennes prospectées n'aient pas permis de distinguer une diversité quelconque parmi les populations méditerranéennes, une certaine structuration géographique semble exister. D'autres travaux seraient nécessaires afin de mieux cerner la qualité des protéines des graines de pin pignon et de la comparer à celles des autres représentants de la famille.


