Abridged English version
Few studies on postcopulatory sexual selection have focussed on simultaneous hermaphrodites, although these organisms harbour morphological and behavioural traits making them ideal models for the study of such a selection. For instance, some land snails mate multiply and have the ability to store sperm from successive mates in a spermatheca subdivided into tubules. Cryptic female choice could occur if a recipient was able to choose which mate fertilizes its eggs. This may be achieved by a separate storage of sperm from several mates in different tubules. However, the direct link between spermathecal morphology and a choice of the recipients has not been established so far. Such a choice may be modulated by the number of tubules, because this number seems positively correlated with the volume of sperm stored. This suggests that individuals with many tubules can store more sperm and potentially better separate sperm from successive mates.
In the snail Cantareus aspersus (formerly Helix aspersa), postcopulatory sexual selection has been intensively studied through the interests of the donor, but rarely in a recipient perspective. In the recipient, chemicals covering the donor's dart could temporarily affect the conformation of genitalia so that the transferred spermatophore would not be directly digested in the bursa copulatrix, which would result in more sperm reaching the spermatheca. However, the recipient may play an active role in postcopulatory sexual selection, as most of the received sperm is digested and the spermatheca of C. aspersus is also subdivided into tubules. As a result, cryptic female choice may occur, but the variation in spermathecal morphology remains to be explored. Here we investigate this variation in a population of C. aspersus snails previously mated with two partners. We also tested the effect of the number of tubules in spermathecae of recipients on sperm precedence of the second partner (P2) using a Generalized Linear Model. This analysis included four other independent variables presented elsewhere.
Twenty-seven recipients were dissected in order to study the structure of their spermatheca. Snails were killed by lethal injection of succinylcholine chloride and hexahydrate magnesium. Fertilization pouches, which include the spermatheca and the fertilization chamber, were isolated using a binocular glass under ×10 magnification. After fixation in 70% ethanol, samples were dehydrated by successive 95° alcohol and butanol baths. Once embedded in paraffin, spermathecae were serially cut and slices were coloured using the ‘picro–indigo–carmine’ technique. Finally, tubules were counted by visual observation under ×20–40 magnification of all slices obtained for each individual.
Spermathecae from 27 individuals were successfully dissected and the mean ± s.d. number of tubules was (from 3 to 13, median = 7). Given what is known from previous studies, the variance in spermathecal morphology we found within a single C. aspersus population is striking. In A. arbustorum, extensive studies of spermathecal morphology revealed a range of two to nine tubules in different populations. While we did not detect any significant effect of the number of tubules on sperm precedence using the subset of individuals considered here, the high variability of spermathecal morphology remains intriguing. Postcopulatory sexual selection in C. aspersus has been intensively studied from the donor perspective through dart shooting behaviour, but this factor explains only a small fraction of the variance observed in sperm precedence. We showed that other variables like time before mating and origin of mates can influence siring success, but the amount of unexplained variance in this analysis was also important. Additionally, it is worth considering that most sperm transferred (>99.5%) is eventually digested in the bursa copulatrix of the recipient, even when the donor successfully shoots a dart into its mating partner. As a result and given the anatomical features of the female reproductive tract of land snails, one can still expect that cryptic female choice may play a role in the patterns of paternity observed. For instance, an unexplored mechanism would be the selective storage of sperm in different tubules, a phenomenon possible to investigate by discriminant labelling of sperm from successive mates.
1 Introduction
La sélection sexuelle agit sur les traits morphologiques et comportementaux qui influencent le succès reproducteur des individus. Parmi ces traits, les caractères sexuels secondaires ont été très étudiés pour leur rôle dans le choix du partenaire sexuel [1]. En outre, la sélection sexuelle se poursuit durant et après l'accouplement, l'appareil reproducteur étant alors l'objet d'une forte sélection chez les espèces pratiquant les accouplements avec de multiples partenaires [2]. Dans ce contexte, les mollusques stylommatophores, chez lesquels de nombreuses espèces produisent un (ou plusieurs) dard(s) qui percera (ont) le partenaire lors de l'accouplement, fournissent des modèles de choix pour l'étude des phénomènes de sélection sexuelle post-copulatoire [3,4]. Le rôle du dard a fait l'objet de nombreuses recherches axées sur des développements plutôt théoriques dans les années 1980–1990 [5,6]. Plus récemment, l'intérêt évolutif d'une telle structure a été mis en évidence de manière indirecte grâce à des travaux fondés sur une approche physiologique engageant d'autres éléments de l'appareil reproducteur [7–9], puis des recherches analytiques nécessitant une reconstruction phylogénétique des taxons d'intérêt [10–12]. Au final, le (ou les) dard(s) permettrai(en)t de manipuler indirectement le partenaire en évitant la destruction du spermatophore dans une glande gamétolytique, la bourse copulatrice. Le bénéfice évolutif des accouplements multiples résiderait, quant à lui, dans un gain de fitness pour la fonction mâle, comme chez les organismes gonochoriques, mais la digestion du sperme dans la bourse copulatrice pourrait équilibrer les bénéfices avec ceux de la fonction femelle.
Nos travaux se situent dans le cadre de cette sélection post-copulatoire conflictuelle et portent sur le rôle potentiel de la fonction « femelle » chez l'escargot hermaphrodite Cantareus aspersus (= Helix aspersa). Plus précisément, nous avons recherché l'influence éventuelle des caractères impliqués dans la qualité de deux « donneurs » de sperme (origine géographique, taille corporelle) sur la paternité de la progéniture d'un « receveur », dans la mesure où ce dernier peut intervenir dans l'établissement de la paternité [13]. Nous avons ainsi démontré que la répartition de la progéniture entre les deux donneurs n'est pas aléatoire et ne dépend pas seulement du rang de l'accouplement [14]. Un choix « cryptique » du sperme par la femelle serait anatomiquement réalisable du fait d'une spermathèque compartimentée [15,16]. La présente étude est destinée à compléter les résultats précédents en précisant la nature et le degré de variabilité morphologique de la spermathèque et en testant la relation entre variabilité de cette structure et proportions de paternité observées.
2 Matériel et méthodes
2.1 Biologie sexuelle de l'espèce et protocole de croisements
Cantareus aspersus, l'escargot « petit-gris », est une espèce hermaphrodite simultanée d'origine méditerranéenne, se caractérisant par une exceptionnelle capacité de colonisation des habitats anthropisés [17]. Vers l'âge de 18 mois, les individus sont sexuellement matures, et s'accouplent de deux à sept fois au cours de la saison de reproduction [18]. Les accouplements, réciproques chez cet escargot, sont précédés de la projection bilatérale d'un dard et durent environ huit heures [4]. Le sperme, échangé au moyen d'un spermatophore, peut être conservé par le receveur pendant plusieurs mois, voire plus d'un an. Il est alors stocké dans une spermathèque subdivisée en tubules, qui rend possible une séparation physique des spermatozoïdes des différents partenaires (Fig. 1).
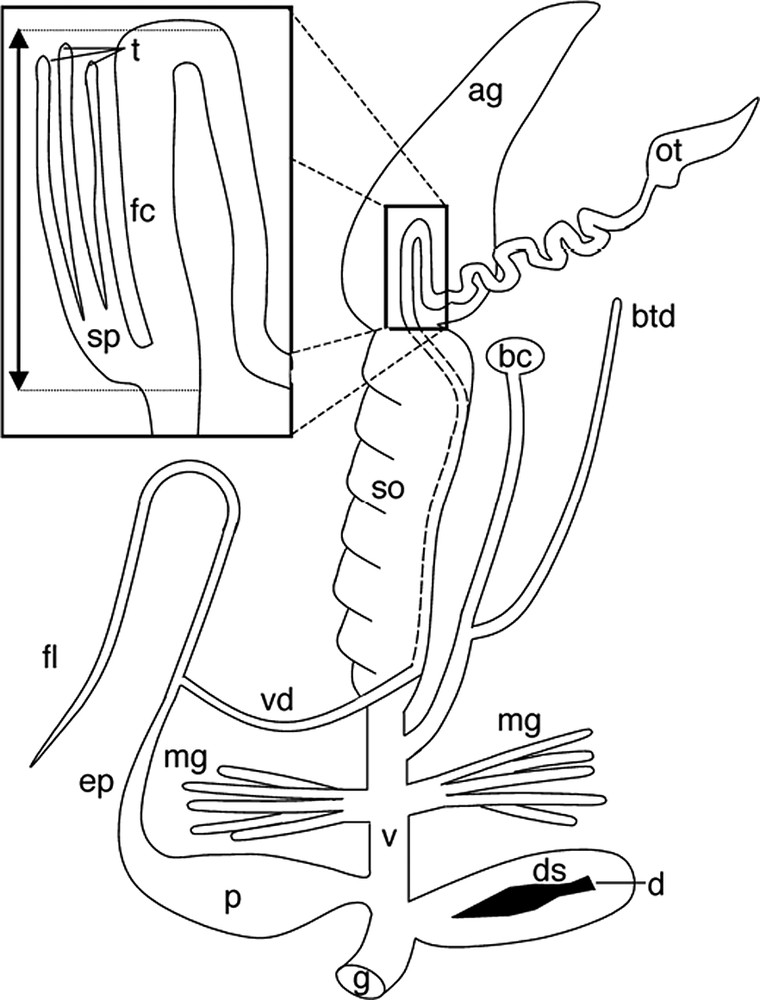
Représentation schématique des genitalia de Cantareus aspersus. Le cadre situé au niveau de la spermathèque (sp) indique la localisation des coupes sériées. Ag : glande à albumine ; bc : bourse copulatrice ; btd : diverticulum de la bourse copulatrice ; d : dard ; ds : sac du dard ; ep : épiphallus ; fc : chambre de fertilisation ; fl : flagellum ; g : pore génital ; mg : glandes multifides ; ot : ovotestis ; p : pénis ; so : spermoviducte (canal godronné) ; t : tubule ; v : vagin ; vd : canal déférent.
Notre expérience, qui se déroule en conditions artificielles, est fondée sur trois groupes, l'un constitué d'individus « receveurs » (s'accouplant deux fois) dont les descendants sont l'objet d'une analyse de paternité au moyen de trois marqueurs microsatellites hautement polymorphes (voir [14]), les deux autres étant composés d'escargots « donneurs » (s'accouplant une fois). Les receveurs proviennent d'un élevage localisé près de Rennes (Ille-et-Vilaine), pour nous garantir l'obtention d'animaux vierges en nombre suffisant. Les individus « donneurs » ont été prélevés immatures (absence de bordure réfléchie du péristome) dans la nature à proximité de Rennes et de Lille (Nord) en février 2001. Le protocole des croisements est le suivant : un escargot vierge mature (péristome rebordé) désigné comme receveur de sperme s'accouple successivement avec deux individus également vierges, qui jouent le rôle de mâle. Il s'agit soit d'un congénère de la même population (A), soit d'un escargot de Lille (L), soit d'un escargot de Rennes (R). Sept combinaisons d'accouplements ont été testées selon le modèle de la Fig. 2 : A|LR, A|RL, A|AL, A|AR, A|LA, A|RA et A|AA. Les conditions d'élevage, observations et mesures sur les reproducteurs ainsi que les analyses de paternité sont décrites en détail dans la référence [14].

Exemple d'une combinaison d'accouplements « A|LR » (sept combinaisons au total ; dix répétitions par combinaison). A : individu issu de la population d'élevage (receveur) ; L : premier donneur (origine géographique : Lille) ; R : second donneur (origine géographique : Rennes).
L'effet du nombre de tubules, ainsi que celui de quatre autres variables indépendantes (rapport de taille et origine des donneurs, temps de latence avant premier et second accouplements), sur la proportion de descendants issus du second donneur (P2) sont testés au moyen d'un modèle linéaire généralisé. Le test du modèle initial (famille d'erreur : binomiale ; fonction de lien : logit) montrait un effet hautement significatif de certains prédicteurs, mais également une déviance résiduelle bien plus élevée que les degrés de liberté correspondants. Le modèle final est fondé sur une famille quasi binomiale et conduit à un test plus conservatif (voir Tableau 1). Le traitement a été effectué au moyen du logiciel R [19].
Résultats du modèle d'ajustement (GLM) de P2 (proportion de descendants issus du second donneur) au moyen des cinq prédicteurs (orig1 × orig2 désigne l'interaction entre populations d'origine des premier et second donneurs de sperme)
| Origine déviance | d.d.l. | % déviance totale | P |
| rapport tailles | 1 | 0,003 | 0,797 |
| latence 1 | 1 | 0,043 | 0,364 |
| latence 2 | 1 | 11,532 | 0,138 |
| origine 1 | 2 | 1,576 | 0,860 |
| origine 2 | 2 | 0,005 | 0,952 |
| nb tubules | 1 | 7,400 | 0,235 |
| orig1 × orig2 | 2 | 10,942 | 0,353 |
2.2 Préparation histologique des spermathèques
Les individus dont la paternité de la ponte a été établie sont disséqués, afin d'observer la structure de leur spermathèque, en particulier le nombre de tubules. Nous avons adopté le protocole suivant.
Les escargots sont anesthésiés avant dissection avec une solution de chlorure de succinylcholine et de magnésium hexahydrate. Les spermathèques sont prélevées sous loupe binoculaire (grossissement ×10) à partir de l'appareil génital isolé, puis fixées à l'éthanol à 70° pendant 24 h. Après une déshydratation progressive dans des bains d'alcool à 95° puis de butanol (automate d'inclusion Citadel 1000, Firme LSI), les échantillons sont imprégnés puis inclus dans la paraffine (station d'enrobage TBS 88, firme Microm). Des coupes sériées (7 μm) des spermathèques sont ensuite réalisées avec un microtome motorisé HM 355 (Microm).
Trois colorations ont été testées sur les échantillons et nous avons retenu celle au « picro–indigo–carmin », pour sa plus grande capacité de mise en évidence des tubules [20]. Le dénombrement des tubules a été effectué en microscopie optique (grossissement ×20, ×40).
3 Résultats et discussion
3.1 Analyse des spermathèques
Les spermathèques de 27 escargots ont été disséquées avec succès et ont fait l'objet de coupes sériées. Le nombre de tubules varie de 3 à 13 par individu, avec une moyenne (± écart-type) de (Fig. 3) nettement supérieure à celle reportée dans la littérature pour l'espèce [21] et parmi les plus élevées chez les hélicidés déjà étudiés, à savoir Arianta arbustorum (de 2 à 9 [22]), Helix pomatia (de 3 à 5 [23]), Cepaea vindobonensis (de 1 à 8 [24]) et Helix lucorum (de 5 à 16 [24]). Environ 240 coupes ont été effectuées par échantillon, ce qui a permis de noter l'existence de ramifications secondaires sur les tubules, lesquelles ne sont pas décrites dans la littérature. Trois spermathèques ont été analysées sur toute leur longueur (environ 560 coupes) pour déterminer leur morphologie générale. Nous avons ainsi constaté que les tubules d'un même individu n'étaient pas tous de même longueur et que leur diamètre pouvait varier considérablement. Des spermatozoïdes ont été observés dans la chambre de fertilisation de deux individus (Fig. 3) et dans les tubules d'un seul escargot (deux tubules remplis sur six). Cette observation est inattendue dans la mesure où les escargots terrestres sont capables de stocker le sperme d'un partenaire pendant plusieurs mois et de féconder plusieurs pontes après un seul accouplement [25]. Elle suggère que les spermatozoïdes présents après la ponte auraient été digérés dans la bourse copulatrice [26], les escargots receveurs n'ayant pas été disséqués immédiatement après la ponte.
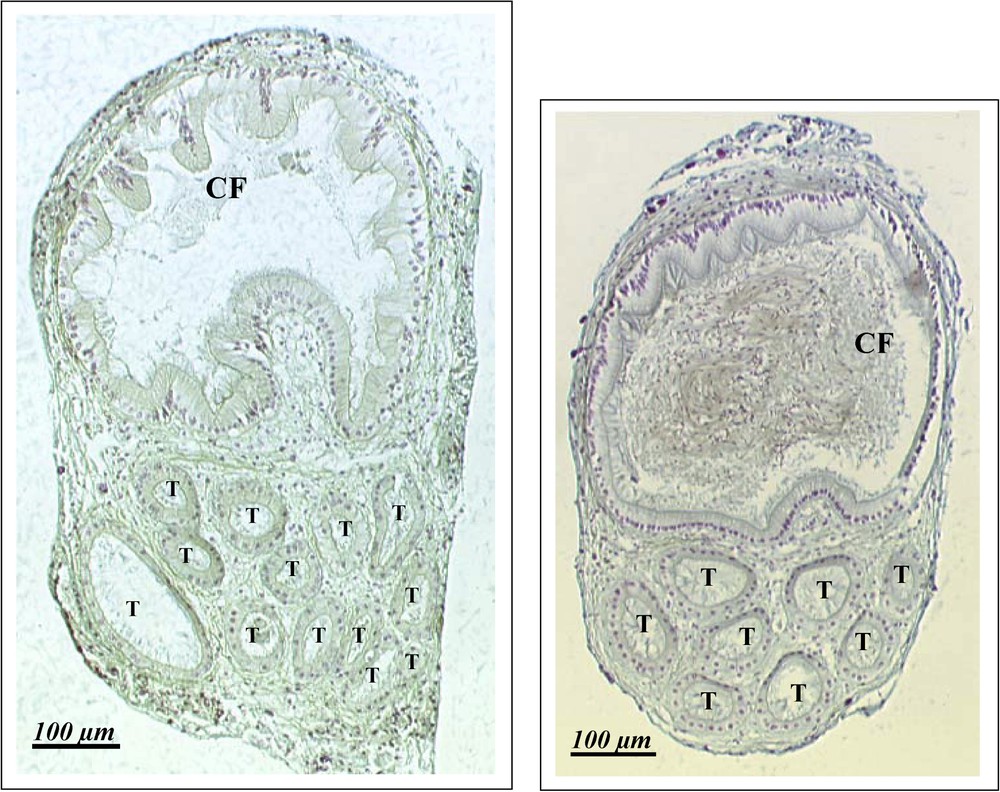
Coupes de spermathèques de C. aspersus (grossissement ×20). L'individu de droite présente une chambre de fertilisation remplie de spermatozoïdes dont on peut identifier les noyaux. CF : chambre de fertilisation ; T : tubule.
Les statistiques utilisées pour tester la signification des relations entre variables reposent sur des échantillons de faible effectif et ne doivent être considérées que comme des indications. Nous notons toutefois que (i) le nombre de tubules de la spermathèque et la taille des individus ne sont pas corrélés (, ), et que (ii), même s'il explique 7,4% de la déviance totale, l'effet du nombre de tubules sur P2 n'est pas significatif ( ; Tableau 1). En outre, le nombre moyen de tubules des individus dont les œufs ont été fécondés par un seul partenaire est identique à celui des escargots ayant produit une descendance à paternité multiple (respectivement et ).
3.2 Un choix cryptique de la fonction femelle ?
Plusieurs études menées sur Arianta arbustorum ont montré que la spermathèque est subdivisée en un nombre variable de tubules [22,26]. Ces auteurs ont observé une distribution hétérogène des spermatozoïdes dans les tubules, certains étant vides et d'autres remplis simultanément après plusieurs accouplements. Cette observation a conduit à l'hypothèse d'un choix cryptique de la fonction femelle, avec l'idée que celle-ci pourrait intervenir directement dans la paternité de sa progéniture en stockant les spermatozoïdes de ses partenaires dans des tubules différents. Toutefois, un autre mécanisme ferait intervenir l'effet de la variabilité individuelle du nombre de tubules sur la proportion de mélange des spermatozoïdes et donc, indirectement, sur le niveau de multipaternité. La longueur cumulée des tubules d'une spermathèque est, en outre, positivement corrélée avec leur nombre, ce qui indique que la capacité de stockage serait plus grande chez les individus ayant un nombre élevé de tubules [27].
Chez Cantareus aspersus, le nombre maximal est, dans notre étude, de treize tubules, mais ce facteur ne semble pas influencer les valeurs de P2 chez des individus receveurs vierges. Toutefois, le rôle potentiel du nombre de tubules dans les valeurs de P2 est difficile à mettre en évidence. Dans le cas d'un choix actif du receveur, on s'attend à des valeurs de P2 hétérogènes, mais pas nécessairement liées au nombre de tubules, la femelle pouvant a priori séparer les spermatozoïdes de deux partenaires avec seulement deux tubules. Le choix cryptique de la fonction femelle est lui-même très difficile à identifier de par la multitude des formes qu'il peut prendre et du fait de son interaction probable, dans de nombreux cas, avec la compétition spermatique [16,28,29]. Une façon de tester son existence avec certitude serait le marquage des spermatozoïdes d'un mâle en compétition avec un autre donneur, puis l'observation de l'arrangement, aléatoire ou non, des spermatozoïdes dans les tubules [30]. Une autre approche pourrait être la sélection de lignées ayant un nombre fixé de tubules (si ce caractère est héritable), selon l'exemple des souches du diptère Scatophaga stercoraria sélectionnées sur leur nombre de spermathèques [31].
Remerciements
Les auteurs remercient C. Cauty, INRA Scribe, pour son aide précieuse en histologie.


