Abridged English version
The Algerian steppe stretches over 20 million hectares on the edge of the northern desert. It is distributed over vast flat spaces slightly hilly, across which wadi beds run. It is divided by depressions and sometimes by high massifs. Within the framework of the fight against desertification, the development of the lands damaged by erosion and the recovery of marginal lands bordering the natural forests, large-scale reforestations (‘green barrier’), principally composed of Aleppo pines, have been undertaken within this zone from 1969 onward, extending the area of natural forests and linking together various forested massifs. A total area of 3 × 106 ha has thus been reforested in Algeria. The consequences to the region biodiversity are unknown. We are presenting here the first results of a study aiming at evaluating the effect of Aleppo pine reforestations of the green barrier on the structure of the Coleopteran and spider populations.
The study was conducted in the Djelfa region, located right in the heart of the steppe zone, 300 km south of Algiers. It is the last town before the Saharan Atlas and the desert. The reforestations occupy 60 182 ha. The Moudjbara reforestation, with an area of 20 000 ha, was started in 1969 and completed in 1993.
The Moudjbara zone is an originally steppic high plain, which is situated 3 km southeast of Djelfa, and stretching over 20 000 ha reforested with Aleppo pine, which is associated sometimes with Artemesia herba alba subjects. Unlawful pasture does exist though. Three stations were chosen in this region. The Oued-Sdar area, which is 25 km south of Djelfa, has a not very accentuated relief and is characterized by a steppic vegetation dominated by Stipa tenacissima and Artemisia herba alba. Two out of the three stations (Oued-Sdar 1 and 2) of this zone are plots fenced to avoid the pasture action. The third is not fenced and presents a few planted Opuntia ficus indica heads.
The catches were carried out with interception traps on the ground (Barber traps), unbaited so as to capture the Arthropoda at random without having an effect on their behaviour.
The collections in the six stations gave a total of 2557 subjects split into 95 species of Coleoptera and Spiders. Thirty-nine out of them were considered to be abundant, i.e. represented by a total number of collected subjects higher than the total number of the sampled stations. The selected four Coleoptera families represent 58 species and 2402 subjects, the Tenebriobidae largely dominating among them, with 43.1% of the species and 84.1% of the Coleoptera subjects, followed by the Carabidae (29.3% of the species and 10.6% of the subjects), and the Curculionidae (17.2% of the species and 4% of the subjects), the Scarabeidae representing only 10.4 of the species and 1.3 of the Coleoptera subjects. Among insects, 37 species, including 155 specimens and split into 15 families, were collected.
Whatever the station may be, the number of collected subjects in each species is low. Eleven species are even represented by only one specimen. The Gnaphosidae family is the best represented, with 12 species and 62 subjects.
Throughout the study, the Tenebrionidae turned out to be the best-represented group of insects, in species' number as well as in subjects' number, which is usual in pre-Saharan zone. Their predominance concerning the number of subjects in all environments is, to a large extent, due to the great abundance of P. mauritanica in the reforested area, where this species represents 49.8% of the catches (10.8% in steppic area), including spiders. All the same, the other species represent together 35.8% of the catches in the reforested area and 57% in the steppic area, which place them well ahead of the other groups, particularly the Carabidae and the spiders, which come second with regard to the subjects' number. These three groups move mainly or only by walking and are thus very easily captured with the type of trap used. This explains certainly, if partially, their number, which is higher than that of Scarabeidae and Curculionidae. With a comparable way of moving, the total numerical predominance of the Tenebionidae over the Carabids and spiders could be explained by the role of primary consumers or decomposers, while the two other groups are mainly predators. However, a number of spider species clearly higher than the Tenebionidae was captured throughout the study. More generally, the number of primary consumers or decomposers, phytophagous, detritivores (Tenebionidae + Curculionidae + Scarabeidae) subjects is widely higher than that of predators (Carabidae + Araneae), while their species number is lower or equal.
With respect to the groups dominated by predators, reforestation resulted in a general diminution of diversity and of the number of Carabids, compensated by an increase of the same parameters among the spiders. Almost all the these groups' species have the same tendency, except the T. bistriatus Carabidae and the Drassodes lutescens and Oxyptila blitea Araneae, which show a tendency clearly opposed to that of the other species of their group. This responsibility inversion between the Carabidae and Araneae, for a similar function (predation), can be explained by the unlikely and likely possibilities of hunting for a hide in a forest environment. If the function remains the same, execution conditions however differ greatly because, from Carabidae to Araneae, and for the same total number of subjects, they go up from a relatively limited number of species with abundant numbers to a high number of species with reduced number of subjects (3.3 subjects on average among spiders).
Consequently, it is possible to characterize both the environments with species' complexes, such as those resulting from the multi-varied analyses. The steppe stations are characterized globally by the abundance of Tenebrionidae, Curculionidae and Carabidae, while the reforested stations are characterized by the abundance of spiders. The Oued-Sdar station 3 differs from the two other steppic stations, especially Oued-Sdar station 1, by the abundance of Tenebrionidae to which Carabidae and Gnaphosidae spiders are added, Oued-Sdar 1 being rather represented by Carabidae. Moudjbara 2 tends to differ from the other stations by the presence of certain Tenebrionidae species.
It appears clearly that, despite the total specific abundance, the diversity total subject number indications do not always differ much between the two types of environment (excluding the modifications resulting from the abundance of P. mauritanica). Reforestation resulted in deep changes on the territories where it took place.
In addition to the significant development of the P. mauritanica populations, it has led to a change in the organization and functioning of the arthropoda populations, favouring or putting at disadvantage certain species and even some entire groups, the species and groups they belong to being able to vary in opposed directions. The specific abundance and biologic diversity of the Djelfa pre-Saharan region as a whole have been increased. The reasons for these changes are hard to explain, as the biology of most of the species included in the census taken and the environment factors determining their distribution are unknown, for the studies concerning them were most often about taxonomy.
1 Introduction
La steppe algérienne s'étend sur une superficie de 20 millions d'hectares, à la limite du Sahara septentrional. Elle se distribue sur de vastes espaces plats légèrement vallonnés, parcourus par les lits des oueds, entrecoupés de dépressions et, parfois, de massifs élevés. Dans le cadre de la lutte contre la désertification, de la mise en valeur des terres dégradées par l'érosion et de la récupération des terres marginales limitrophes aux forêts naturelles, des reboisements de grande envergure ( « barrage vert »), essentiellement de pin d'Alep, ont été entrepris dans cette zone à partir de 1969, étendant la superficie des forêts naturelles et liant entre eux divers massifs forestiers. Une superficie totale de 3 × 106 ha a ainsi été reboisée en Algérie. Les conséquences sur la biodiversité de la région sont inconnues. Nous présentons ici les premiers résultats d'une étude visant à apprécier l'effet des reboisements en pin d'Alep du barrage vert sur la structure des peuplements de Coléoptères et d'Araignées.
Le peuplement entomologique des steppes à alfa (Stipa tenacissima) de l'Ouest algérien a fait l'objet d'une seule étude [1] présentant un inventaire de 31 espèces de Coléoptères. Les autres inventaires d'arthropodes en Algérie ont concerné les Coléoptères de la Cédraie, avec 497 espèces capturées au piège de Barber [2], et les Araignées du Djurjura, avec 86 espèces [3]. Pour les steppes, divers travaux ont complété l'inventaire de [1] par la description de nouvelles espèces d'Araignées [4–8]. Notre objectif était donc aussi de compléter l'inventaire des Coléoptères et Araignées des steppes algériennes à Alfa.
2 Matériels et méthodes
2.1 Caractéristiques des milieux d'étude
L'étude a été menée dans la région de Djelfa, située en pleine zone de steppe, à 300 km au sud d'Alger, et dernière ville avant l'Atlas saharien et le désert. Les reboisements y occupent 60 182 ha. Le reboisement de Moudjbara, d'une superficie de 20 000 ha, fut entamé en 1969 et terminé en 1993.
D'après les données fournies par l'Office national de météorologie de Djelfa, le climat est semi-aride, fortement marqué par la continentalité, l'insuffisance des précipitations et leur irrégularité. Les précipitations annuelles moyennes oscillent entre 200 et 400 mm, les pluies tombant le plus souvent sous forme d'averses orageuses et torrentielles, quelquefois mêlées à la grêle. Le nombre de jours de pluie varie entre 37 et 80 par an. Les températures maximales du mois le plus froid sont comprises entre −1,8 °C et 1,9 °C, tandis que les températures maximales du mois le plus chaud dépassent 37 °C. Le nombre de jours de gelée peut atteindre 40. L'amplitude thermique annuelle est généralement supérieure à 20 °C.
La répartition des sols steppiques correspond à une mosaïque compliquée, où se mêlent sols anciens, récents, dégradés et évolués [9]. Ces sols sont en général peu profonds, pauvres en éléments nutritifs et en matière organique, avec prédominance des sols minces de couleur grise à cause de la rareté de l'humus. Certains sols, situés en général au niveau des dépressions, sont en revanche relativement profonds et riches. Les formations végétales qui les couvrent sont basses et ouvertes, inféodées à l'étage bioclimatique semi-aride et aride dont elles sont l'expression naturelle [10]. Comme le souligne [11], la végétation paraît souvent monotone à base de graminées (Stipa tenacissima, Stipa parviflora, Lygeum spartum...) ou de Chamaephytes vivaces (Artemisia herba alba, Artemesia campestris, Helianthemum hurtum...), auxquelles s'ajoute un cortège varié et souvent important d'espèces annuelles.
D'après [12,13], la pineraie s'adapte sur tout type de sol ; en Algérie, elle peut croître aussi bien sur des sols épais que sur sols superficiels. Le pin peut coloniser du sol très jeune en voie de formation à partir de la roche mère tendre (marnes, marnes et calcaires) ou dur (grès, calcaire, schistes...) [14]. Cependant, on retrouve, dans les stations de Moudjbara, le pin d'Alep, présentant un aspect totalement différent de celui des forêts naturelles : les arbustes sont de petite taille, avec une faible densité de feuillage, à cause des attaques de la chenille processionnaire, qui fait des dégâts considérables, par endroits, dans le barrage vert. La strate herbacée est représentée également par Stipa tenacissima, S. parviflora et S. barbata, avec des degrés d'abondance différents.
2.2 Choix des stations
Deux zones, distantes l'une de l'autre d'une vingtaine de kilomètres, Moudjbara et Oued-Sdar, ont été choisies, à des altitudes dépassant 1200 m et, dans chacune d'elles, trois stations d'environ 2 ha chacune et distantes l'une de l'autre d'environ 3 km ont été délimitées (Fig. 1). Le Tableau 1 récapitule les principales caractéristiques topographiques, chimiques et botaniques des stations.
Situation géographique des stations d'étude ; (Moud 1 = Moudjbara 1, Moud 2 = Moudjbara 2, Moud 3 = Moudjbara 3, Ou-Sd1 = Oued-Sdar 1, Ou-Sd2 = Oued-Sdar 2, Ou-Sd3 = Oued-Sdar 3).
Caractéristiques topographiques, chimiques et botaniques des stations
| Stations/Caractéristiques | Moudjbara 1 | Moudjbara 2 | Moudjbara 3 | Oued-Sdar 1 | Oued-Sdar 2 | Oued-Sdar 3 |
| Altitude (m) | 1209 | 1222 | 1223 | 1237 | 1232 | 1240 |
| Coordonées G.P.S. | Nord 34° |
Nord 34° |
Nord 34° |
Nord 34° |
Nord 34° |
Nord 34° |
| Est 03° |
Est 03° |
Est 03° |
Est 03° |
Est 03° |
Est 03° |
|
| Substrat | Roche calcaire | Roche calcaire | Roche calcaire | Roche calcaire | Roche calcaire | Roche calcaire |
| pH du sol | 7,12 | 7,25 | 7,15 | 8,01 | 8,12 | 7,99 |
| Matière organique% | 2,17 | 1,87 | 2,3 | 3,02 | 3,45 | 3,29 |
| Espèce végétale dominante | Pinus halepensis | Pinus halepensis | Artemesia herba alba | Stipa tenacissima | Artemesia herba alba | Opuntia ficus indica |
La zone de Moudjbara est une haute plaine originellement steppique, située à 3 km au sud-est de Djelfa et s'étendant sur 20 000 ha reboisés en pin d'Alep, lequel s'y trouve associé parfois à des sujets d'Artemesia herba alba. Le pâturage illicite existe quand même. Le pH y est légèrement supérieur à 7, et la teneur en matière organique autour de 2% La zone d'Oued-Sdar, située à 25 km au sud de Djelfa, possède un relief peu accentué et est caractérisée par une végétation steppique à dominance de Stipa tenacissima et d'Artemisia herba alba. Le pH y est voisin de 8, et la teneur en matière organique égale ou supérieure à 3%. Deux des trois stations (Oued-Sdar 1 et 2) de cette zone sont des parcelles clôturées pour éviter l'action du pâturage. La troisième n'est pas clôturée et présente quelques pieds d'Opuntia ficus indica plantés.
2.3 Piégeage et identification de la faune
Les captures ont été réalisées par des pièges d'interception au sol (pièges de Barber), non appâtés, de façon à capturer les Arthropodes au hasard de leurs déplacements, sans agir sur leur comportement. Dans chaque station, cinq pièges, espacés de 10 à 15 m les uns des autres, ont été disposés sur une ligne droite orientée nord–sud ou est–ouest, selon les stations. Les pièges contenaient du formol dilué à 4%, mélangé à un produit mouillant. Le contenu des pièges a été récolté chaque mois pendant une année, de septembre 2001 à août 2002, puis trié au laboratoire.
Les familles d'Araignées ont toutes été triées. En revanche, pour des raisons pratiques, seules les quatre familles de Coléoptères les plus abondantes (Ténébrionidés, Carabidés, Curculionidés et Scarabéidés) ont été considérées. Dans un premier temps, les Araignées ont été identifiées en utilisant des descriptions de la faune de France [15–22] et l'ouvrage de Locket et Millidge [23]. Pour les Coléoptères, on a eu recours à la description de la faune de France de [24,25], de la faune des Coléoptères du Nord de l'Afrique de [26,27] et l'ouvrage de Jeannel [28]. Les identifications ont ensuite été vérifiées au laboratoire d'entomologie et au laboratoire des Arachnides du Muséum national d'histoire naturelle de Paris, en utilisant les collections de références.
2.4 Analyse numérique
La diversité des peuplements a été appréciée en calculant trois types d'indice :
- – l'indice de diversité de Shannon
où - – l'équitabilité
- – l'indice de diversité de Simpson, qui mesure la probabilité que deux individus sélectionnés au hasard appartiennent à la même espèce :
3 Résultats
3.1 Richesse spécifique, effectifs, composition spécifique générale et diversité
La liste complète des espèces avec les nombres d'individus récoltés pour chacune d'elles dans chaque station est fournie en Annexe A. La richesse spécifique totale et les effectifs totaux, ainsi que ceux des Araignées et des principales familles de Coléoptères, sont présentés dans le Tableau 2 pour les diverses stations. La Fig. 2 présente l'abondance relative de ces groupes d'espèces dans les deux types de milieux (reboisement et steppe non reboisée). Le Tableau 3 fournit les valeurs de l'équitabilité et des indices de diversité totaux dans les diverses stations. Le Tableau 4 détaille les valeurs de ces paramètres pour les familles de Coléoptères et les Araignées dans chaque type de milieu.
Richesse spécifique (nombres d'espèces) et effectifs (nombre d'individus capturés) dans les diverses stations, au total et pour les principales familles de Coléoptères et les Araignées
| Variables /Stations | Moud 1 | Moud 2 | Moud 3 | Total Moud | Ou-Sd 1 | Ou-Sd 2 | Ou-Sd 3 | Total Ou-Sd | Total récolte |
| Richesse spécifique totale | 47 | 41 | 45 | 69 | 43 | 35 | 56 | 67 | 95 |
| (Effectifs totaux) | (502) | (525) | (576) | (1613) | (357) | (181) | (406) | (944) | (2557) |
| Nombre d'espèces abondantes | 38 | 34 | 38 | ||||||
| Ténébrionidés | 17 | 16 | 15 | 22 | 17 | 15 | 21 | 22 | 25 |
| (416) | (457) | (506) | (1379) | (224) | (127) | (289) | (640) | (2019) | |
| Carabidés | 8 | 3 | 7 | 9 | 11 | 9 | 14 | 16 | 17 |
| (58) | (19) | (20) | (97) | (77) | (28) | (52) | (157) | (254) | |
| Curculionidés | 3 | 2 | 1 | 3 | 5 | 5 | 7 | 9 | 10 |
| (3) | (6) | (3) | (12) | (38) | (13) | (34) | (85) | (97) | |
| Scarabéidés | 3 | 2 | 3 | 4 | 3 | 1 | 1 | 4 | 6 |
| (7) | (8) | (5) | (20) | (6) | (5) | (1) | (12) | (32) | |
| Araignées | 16 | 18 | 19 | 31 | 7 | 5 | 13 | 16 | 37 |
| (28) | (35) | (42) | (105) | (12) | (8) | (30) | (50) | (155) |
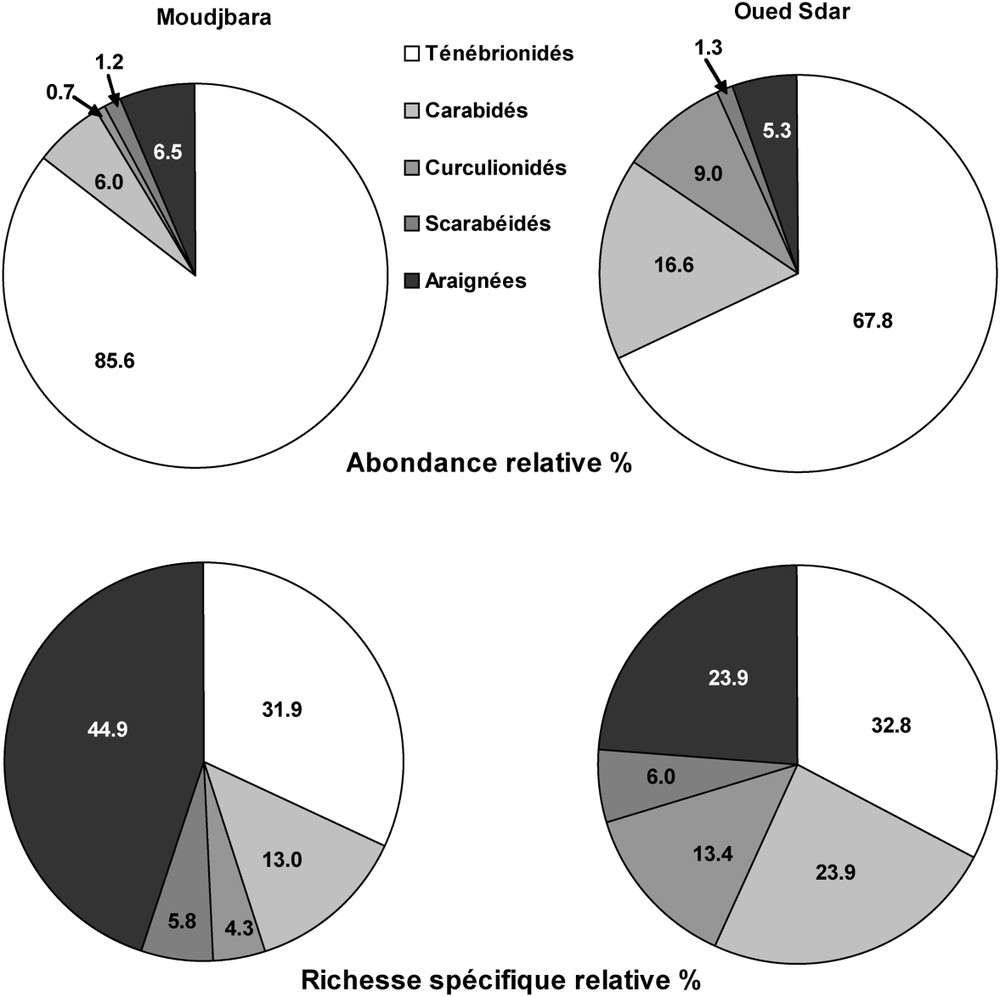
Abondance numérique relative et richesse spécifique relative des principales familles de Coléoptères et des Araignées dans les deux types de milieux : Moudjbara (reboisement) et Oued Sdar (steppe non reboisée).
Equitabilité et indices de diversité totaux dans les diverses stations
| Variables | Stations | Total Moudjbara (reboisement) | Stations | Total Oued-Sdar (steppe) | ||||
| Moudjbara 1 | Moudjbara 2 | Moudjbara 3 | Oued-Sdar 1 | Oued-Sdar 2 | Oued-Sdar 3 | |||
| E | 0,656 | 0,613 | 0,459 | 0,545 | 0,821 | 0,831 | 0,786 | 0,791 |
|
|
2,524 | 2,276 | 1,746 | 2,314 | 3,088 | 2,956 | 3,162 | 3,327 |
| D | 0,8082 | 0,7761 | 0,5780 | 0,713 | 0,9371 | 0,9213 | 0,9222 | 0,941 |
Equitabilité et indices de diversité dans les deux types de milieux, pour les principales familles de Coléoptères et les Araignées
| Total Moudjbara (reboisement) | Total Oued-Sdar (steppe) | |||||||||
| Ténéb. | Carab. | Curcul. | Scarab. | Araig. | Ténéb. | Carab. | Curcul. | Scarab. | Araig. | |
| E | 0,537 | 0,695 | 0,836 | 0,840 | 0,917 | 0,801 | 0,814 | 0,721 | 0,865 | 0,859 |
|
|
1,665 | 1,695 | 0,918 | 1,165 | 3,149 | 2,475 | 2,258 | 1,585 | 1,199 | 2,381 |
| D | 0,634 | 0,711 | 0,569 | 0,640 | 0,945 | 0,887 | 0,845 | 0,715 | 0,653 | 0,872 |
Les récoltes dans les six stations ont fourni un total de 2557 individus, répartis en 95 espèces de Coléoptères et d'Araignées (Tableau 2), 38 d'entre elles étant considérées comme abondantes, c'est-à-dire représentées par un nombre total d'individus récoltés supérieur au nombre total de stations échantillonnées [30]. Les quatre familles de Coléoptères retenues représentent 58 espèces et 2402 individus, les Ténébrionidés dominant largement parmi elles avec 43,1% des espèces et 84,1% des individus de Coléoptères, suivis des Carabidés (29,3% des espèces et 10,6% des individus) et des Curculionidés (17,2% des espèces et 4% des individus), les Scarabéidés ne comprenant que 10,4% des espèces et 1,3% des individus de Coléoptères (Tableau 2). Chez les Araignées, 37 espèces, comprenant 155 exemplaires et réparties en 15 familles, ont été récoltées. Quelle que soit la station, le nombre d'individus récolté dans chaque espèce est très faible ; onze espèces ne sont même représentées que par un seul exemplaire. La famille des Gnaphosidae est la mieux représentée, avec 12 espèces et 62 individus.
Alors que la richesse spécifique et les effectifs totaux sont voisins dans les trois stations reboisées, des différences nettes existent pour chacun de ces paramètres entre les trois stations steppiques (Tableau 2). En outre, bien que la richesse spécifique totale des deux milieux soit comparable (Tableau 2), les indices de diversité et l'équitabilité des stations de milieu steppique (Oued Sdar) sont tous élevés, et nettement supérieurs à ceux de la zone reboisée (Moudjbara) (Tableau 3).
La station d'Oued Sdar 3, non clôturée, autorise le pâturage, mais l'absence de répétition d'une telle situation ne permet pas de tirer de conclusion. On peut donc simplement signaler, lorsqu'elles apparaissent marquées, certaines différences avec les deux autres parcelles de steppe, comme une richesse spécifique plus élevée et des effectifs plus importants. Toutefois, les indices de diversité sont tout à fait comparables à ceux des deux autres stations. Certaines espèces apparaissent nettement plus abondantes à Oued Sdar 3, surtout des Ténébrionidés, tels que Adesmia metallica, Blaps gigas, Erodius zophoides, Micipsa mulsanti et Sepidium miltispinosum, mais aussi l'Araignée Minosia santchi (Annexe A). Certaines espèces, très peu abondantes, n'ont été capturées que dans cette parcelle. C'est le cas des Carabidés Eucarabus famini, Laemostenus algerinus et Licinus punctulatus, des Curculionidés Gonocleonus cristulatus et Trachyphloeus spinomanus, du Scarabéidé Ochodaeus gigas, ainsi que des Araignées Hoplodrassus dalmatensis, H. signifer, Xysticus acerbus, Palpimanus gibbulus et Selamia reticulata (Annexe A).
Malgré une richesse spécifique comparable dans toutes les stations (Tableau 2), et bien que des différences existent selon les espèces, les Ténébrionidés dans leur ensemble ont clairement une abondance relative et des effectifs plus élevés (Fig. 2 et Tableau 2) en zone reboisée qu'en zone restée steppique, mais leurs indices de diversité et leur équitabilité sont plus élevés en milieu steppique (Tableau 4). Ils représentent environ un tiers du total des espèces dans les deux types de milieu, mais ne sont majoritaires qu'en milieu steppique (Fig. 1). Dans les deux milieux, ils sont principalement représentés par des espèces de grande taille, avec Pimelia mauritanica, Tentyria thunbergi, et Erodius zophoides en zone reboisée, Blaps gigas et Gonocephalum perplexum en zone steppique (Annexe A). En zone reboisée, l'espèce P. mauritanica est très largement dominante, puisqu'elle correspond à 58,2% des captures de Ténébrionidés et à 49,8% du total des captures (toutes familles d'insectes et d'Araignées confondues), contre respectivement 15,9% et 10,8% en zone steppique.
Les Carabidés et les Curculionidés dans leur ensemble sont nettement mieux représentés en zone steppique qu'en zone reboisée, tant pour leur richesse spécifique (absolue et relative) que pour leurs effectifs totaux et leur abondance relative (Tableau 1 et Fig. 2). Leurs paramètres de diversité sont aussi plus élevés en zone de steppe, sauf l'équitabilité des Curculionides, qui est légèrement plus élevée en zone boisée (Tableau 4), conséquence d'effectifs réduits chez toutes les espèces. Les premiers sont représentés surtout par Orthomus berytensis en milieu steppique et Cymindis setifensis en milieu reboisé, tandis que les seconds sont surtout représentés par Brachycerus barbarus et Arammichnus cribricollis en zone steppique (Annexe A).
À l'inverse, les espèces d'Araignées sont nettement plus nombreuses, tant en valeur absolue que relative (Tableau 2 et Fig. 2) et les effectifs de la plupart d'entre elles, de même que leurs paramètres de diversité, nettement plus élevés en milieu reboisé que steppique (Tableaux 2 et 4), sauf Drassodes lutescens et Oxyptila blitea, pour lesquelles l'inverse a été observé (Annexe A). Leur abondance relative est cependant la même dans les deux milieux (Fig. 2).
Les paramètres spécifiques, numériques et de diversité des Scarabéidés dans leur ensemble sont sensiblement égaux dans les deux types de milieux (Tableaux 2 et 4 et Fig. 2), bien que des préférences existent au niveau spécifique, avec P. algerinum et Rhizotrogus pallidipensis pour le milieu reboisé et Scarabaeus sacer pour la zone steppique (Annexe A).
Huit espèces de Tenebrionidés (dont P. mauritanica, T. thunbergi, B. gigas et G. perplexum) et deux espèces de Carabidés (C. setifensis et O. berytensis), ont été récoltées dans toutes les stations, tandis qu'aucune de Curculionidés ni de Scarabéidés ne s'est montrée ubiquiste (Annexe A). Chez les Araignées, seule Minosia santschii a été récoltée dans toutes les stations. Cette ubiquité correspond cependant souvent à des effectifs différents dans les deux milieux. Ainsi chez les Ténébrionidés, non seulement P. mauritanica, mais aussi, bien qu'à un degré nettement moindre, Pimelia simplex, Scaurus tristis et Tentyria thunbergi, quoique ubiquistes, sont nettement plus abondantes en zone reboisée qu'en steppe, tandis que l'inverse s'observe pour G. perplexum et B. gigas (Annexe A). Chez les Carabidés, C. setifensis est plus abondant en reboisement et O. berytensis en zone steppique. En revanche, l'Araignée Minosia santschii semble parfaitement ubiquiste.
À l'opposé, un grand nombre d'espèces, même parmi les celles qualifiées d'abondantes sur l'ensemble des stations (plus de six individus au total), n'ont été capturées que dans un seul type de milieu. Ainsi, Pachychila sp. (Ténébrionidé), Tachys (Paratachys) bistriatus, Eotachys elongatulus (Carabidé), Alopecosa gracilis et Trochosa hispanica (Araignées) n'ont été capturées qu'en zone reboisée, tandis qu'Acinopus sabulosus (Carabidé), Brachycerus barbarus, Rhytidoderes plicatus et Arammichnus cribricollis (Curculionidés) n'ont été récoltées qu'en zone restée steppique (Annexe A). De même, si l'on considère les espèces qualifiées de peu abondantes sur l'ensemble des stations (six individus au maximum au total), mais représentées par au moins trois individus, Alphasida sp. (Ténébrionidé), Baris algirica (Curculionidé), Pentodon algerinum (Scarabéidé) et huit espèces d'Araignées n'ont été rencontrées qu'en milieu reboisé, alors que Pimelia interstitialis, Sepidium uncinatum (Ténébrionidés), Cyrtolepus oblitus (Curculionidé), S. sacer (Scarabéidé) et quatre espèces de Carabidés n'ont été rencontrées qu'en milieu resté steppique (Annexe A).
3.2 Les analyses multivariées
Les axes 1, 2, 3, 4 et 5 de l'AFC expliquent respectivement 45,8%, 22,4%, 12,8%, 9,9% et 9,1% de la variabilité. L'axe 1 oppose clairement les stations de steppe, associées largement aux Carabidés, aux Curculionidés, aux Ténébrionidés et à quelques espèces d'Araignées, aux stations de forêt, corrélées essentiellement avec la présence d'Araignées (Fig. 3). Seuls le carabe Tachys bistriatus, le charançon Baris algirica et les Ténébrionidés Akis goryi et Pachychila sp. sont associés aux stations forestières. L'axe 2 oppose entre elles les stations de steppe Oued-Sdar 1 et Oued Sdar 3, essentiellement par la présence, dans cette dernière, de la plupart des espèces d'Araignées trouvées en steppe (Fig. 3). L'axe 5 tend à séparer la station forestière Moudjbara 2 des deux autres, en concordance avec la séparation des Araignées en deux groupes (Fig. 4).
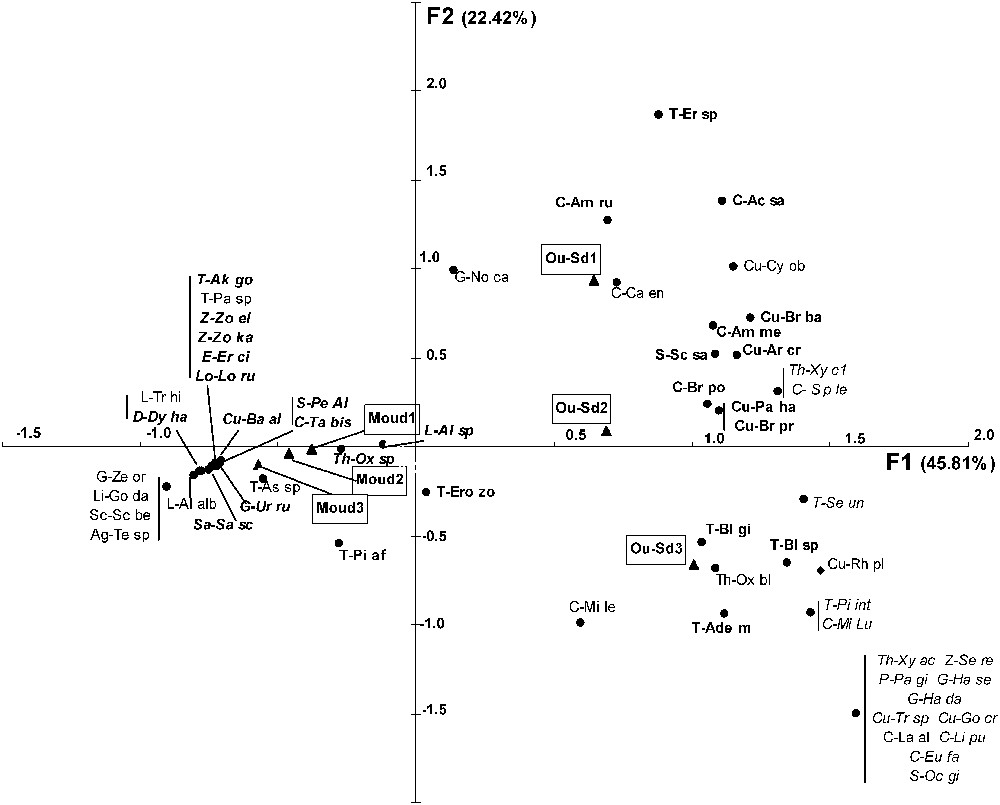
Ordination des espèces et des stations le long des axes F1 et F2 de l'AFC. Seules les espèces bien séparées de zéro sur au moins un des trois axes F1, F2 ou F5 ont été représentées. La signification des abréviations est indiquée dans l'annexe 1. Caractères gras droits = groupe I du dendrogramme des espèces (cf. Fig. 6) ; caractères droits simples = groupe II du dendrogramme des espèces ; caractères gras italiques = groupe III du dendrogramme des espèces ; caractères italiques simples = groupe IV du dendrogramme des espèces. Masquer
Ordination des espèces et des stations le long des axes F1 et F2 de l'AFC. Seules les espèces bien séparées de zéro sur au moins un des trois axes F1, F2 ou F5 ont été représentées. La signification des abréviations ... Lire la suite
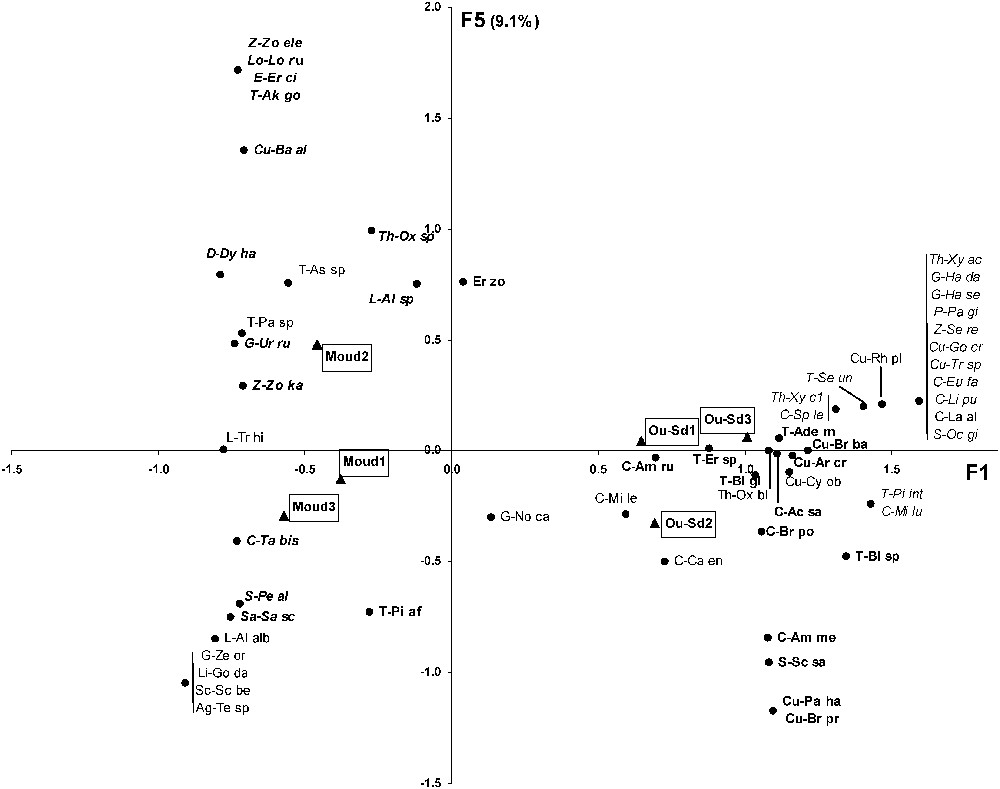
Ordination des espèces et des stations le long des axes F1 et F5 de l'AFC. Seules les espèces bien séparées de zéro sur au moins un des trois axes F1, F2 ou F5 ont été représentées. La signification des abréviations est indiquée dans l'annexe 1. Caractères gras droits = groupe I du dendrogramme des espèces (cf. Fig. 6) ; caractères droits simples = groupe II du dendrogramme des espèces ; caractères gras italiques = groupe III du dendrogramme des espèces ; caractères italiques simples = groupe IV du dendrogramme des espèces. Masquer
Ordination des espèces et des stations le long des axes F1 et F5 de l'AFC. Seules les espèces bien séparées de zéro sur au moins un des trois axes F1, F2 ou F5 ont été représentées. La signification des abréviations ... Lire la suite
Le dendrogramme de la Fig. 5 sépare nettement les stations de forêt de celles de steppe, parmi lesquelles Oued-Sdar 3 semble légèrement différer des deux autres. Le dendrogramme de la Fig. 6 confirme et précise les résultats de l'AFC. Il différencie nettement quatre grands groupes d'espèces.
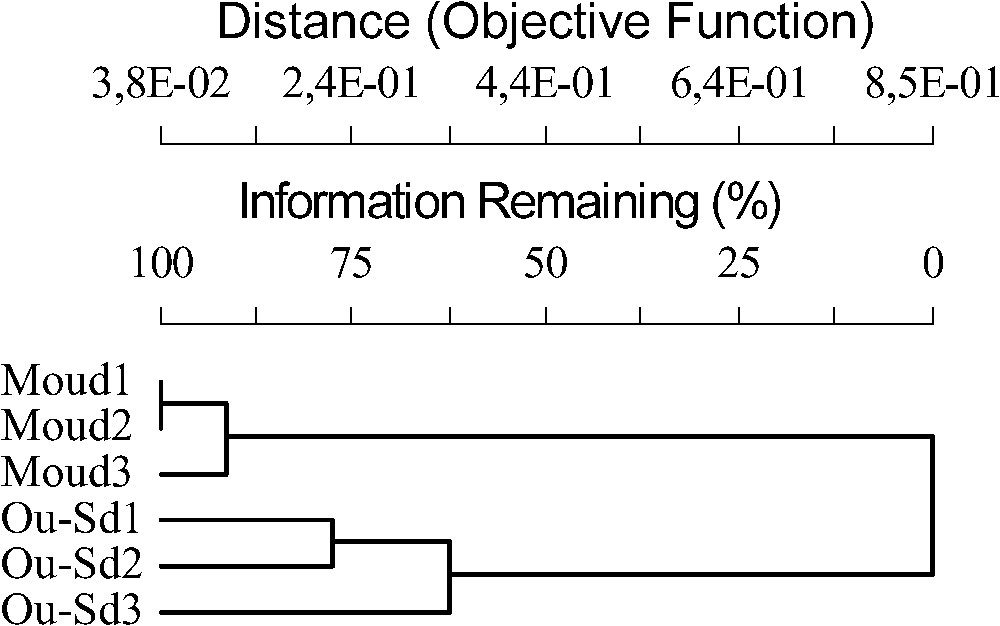
Dendrogramme des stations résultant de l'analyse de l'indice de Sorensen, pour l'ensemble des espèces capturées.
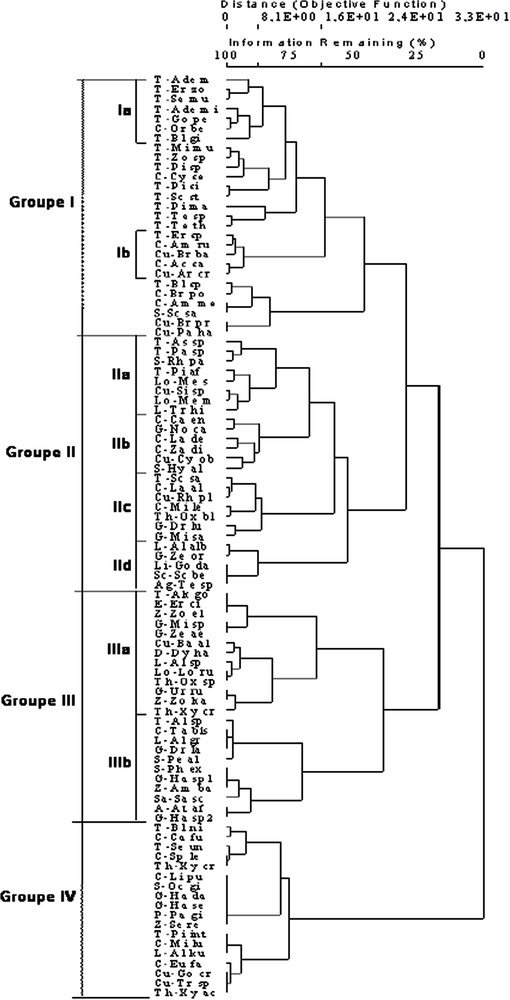
Dendrogramme des espèces dans les six stations, d'après l'analyse de Sorensen. La signification des abréviations est indiquée dans l'Annexe A.
Le groupe I contient 27 espèces, essentiellement des Ténébrionidés (16 espèces) représentant les 2/3 des espèces recensées dans cette famille. Les Curculionidés et les Carabidés (respectivement 40% et 35% des espèces recensées) y sont aussi bien représentés. Aucune araignée n'y figure. Quasiment toutes les espèces de ce groupe se retrouvent sur la partie positive de l'axe F1 de l'AFC (Fig. 3). Divers sous-groupes peuvent être reconnus sur le dendrogramme, dont deux se distinguent par leur position sur l'axe F2 (Fig. 3), le sous-groupe Ia (formé presque uniquement de Ténébrionidés) se situant dans la partie négative, le sous-groupe Ib (Carabidés et Curculionidés) dans la partie positive.
Le groupe II (26 espèces, Fig. 6) est constitué à parts égales d'insectes et d'Araignées. Aucune famille ne domine nettement. Les Carabidés, les Curculionidés, les Scarabéidés et les Araignées Gnaphosidés y représentent respectivement 30%, 29%, 33% et 33% du nombre total d'espèces recensées dans ces familles. Le groupe II peut se subdiviser en quatre sous-groupes, chacun localisé dans une partie bien définie des axes F1, F2 ou F5 de l'AFC (Figs. 3 et 4). Les sous-groupes IIb (dominé par les Carabidés) et IIc (Carabidés et Gnaphosidés dominants) se situent tous deux dans la partie positive de F1, le premier dans la partie positive de F2, le second dans la partie négative. Les sous-groupes IIa (Ténébrionidés dominants) et IId (uniquement Araignées) se trouvent tous deux dans la partie négative de F1, le premier du côté positif de F5, le second du côté négatif.
Le groupe III (24 espèces, Fig. 6) est largement dominé par les Araignées (18 espèces), qui y représentent près de la moitié du nombre total des espèces d'Araignées recensées. Les Gnaphosidés (six espèces) et les Zodariidés (trois espèces) y sont bien représentées (respectivement 50% et 75% du nombre total des espèces recensées dans ces familles). Ce groupe est entièrement localisé dans la partie négative de l'axe F1 de l'AFC (Fig. 3). Deux sous-groupes s'y distinguent clairement (Fig. 6), le sous-groupe IIIa, qui contient presque exclusivement des Araignées et qui se situe dans la partie positive de l'axe F5 de l'AFC (Fig. 4), et le sous-groupe IIIb, dont près de la moitié des espèces sont des insectes et qui se situe dans la partie négative de l'axe F5 de l'AFC.
Le groupe IV (18 espèces, Fig. 6) renferme une majorité d'insectes dont les espèces les plus représentées sont les Carabidés (29 sur le nombre total d'espèces recensées dans cette famille). Il est situé dans la partie la plus positive de l'axe F1 de l'AFC (Fig. 3).
4 Discussion
4.1 Importance des divers groupes taxonomiques
Sur l'ensemble de l'étude, les Ténébrionidés se sont révélés le groupe d'insectes le mieux représenté, tant en nombre d'espèces qu'en nombre d'individus, ce qui est habituel en zone présaharienne, résultats confirmés également par les travaux des références [31–33].
La prédominance de leurs effectifs, tous milieux confondus, est pour beaucoup liée à la très grande abondance de P. mauritanica en zone reboisée, où cette espèce représente 49,8% des captures (10,8% en zone steppique), Araignées comprises, mais les autres espèces représentent quand même ensemble 35,8% des captures en zone reboisée et 57% en zone de steppe, ce qui les place toujours loin devant les autres groupes, en particulier les Carabidés et les Araignées, qui viennent ensuite en nombre d'individus. Ces trois groupes se déplacent essentiellement ou uniquement à la marche et sont donc très facilement capturés par le type de piège utilisé, ce qui explique très certainement, au moins en partie, leurs effectifs plus élevés que ceux des Scarabéidés et des Curculionidés. À mode de déplacement comparable, la prépondérance numérique totale des Ténébrionides sur les Carabidés et les Araignées pourrait s'expliquer par leur rôle de consommateurs primaires ou de décomposeurs, alors que les deux autres groupes sont essentiellement des prédateurs. Un nombre cependant nettement plus grand d'espèces d'Araignées que de Ténébrionides a été capturé sur l'ensemble de l'étude (Tableau 2). Plus généralement, le nombre des individus consommateurs primaires ou décomposeurs, phytophages et détritivores [34], (Ténébrionidés + Curculionidés + Scarabéidés) est largement plus élevé que celui des prédateurs (Carabidés + Araignées) alors que leur nombre d'espèces est inférieur ou égal (Tableau 2 et Fig. 2).
4.2 Effets du pâturage
Le pâturage ne semble pas avoir conduit à de grandes différences entre la station d'Oued Sdar 3 et les deux autres stations steppiques. Les effectifs totaux plus élevés d'Oued Sdar 3 sont dus à une plus grande abondance d'espèces de Ténébrionidés, également présents dans les autres stations, tandis que sa plus grande richesse spécifique tient à la capture, uniquement dans ce lieu, de plusieurs espèces très peu abondantes. Toutefois, la faible fréquence de ces dernières ne permet précisément pas d'affirmer leur spécificité, surtout en l'absence de répétition. Parallèlement, on peut s'étonner qu'aucun Scarabéidé n'y soit abondant.
4.3 Distribution des groupes et des espèces entre la zone steppique et les zones reboisées ; effets du reboisement
Dans chaque groupe taxonomique et en conséquence pour l'ensemble des Arthropodes, il existe une variabilité plus grande (d'une station à l'autre) de la richesse spécifique et des effectifs en milieu steppique qu'en milieu reboisé. Cette observation est sans doute à relier à l'hétérogénéité du milieu steppique en termes de couvert végétal, alors que le milieu reboisé est dominé essentiellement par le pin d'Alep. La zone reboisée présente aussi, sans doute, des variations thermiques climatiques atténuées au niveau du sol. L'absence de pâturage à Oued Sdar 1 et Oued Sdar 2 et sa présence à Oued Sdar 3 est aussi une cause possible de variation entre stations de steppe.
La richesse spécifique totale est la même en zone steppique et en zone reboisée, mais les effectifs totaux sont beaucoup plus élevés dans cette dernière (1613 captures contre 944). Si l'on exclut P. mauritanica, les effectifs totaux deviennent cependant 811 en milieu reboisé et 842 en milieu steppique. L'abondance de P. mauritanica en zone reboisée a pour conséquence une abondance relative des Ténébrionidés beaucoup plus élevée en zone reboisée (85,6%) qu'en zone restée steppique (67,8%), et un calcul excluant cette espèce fournit des valeurs de 71,1% en zone reboisée contre 63,9% en milieu steppique. La richesse spécifique de ce groupe est en revanche la même dans les deux milieux. En conséquence, le fait que les indices de diversité et d'équitabilité des Ténébrionidés soient supérieurs en milieu steppique qu'en zone reboisée est aussi lié directement à l'abondance considérable de P. mauritanica en zone reboisée. Le calcul de ces indices en excluant cette espèce donne
Equitabilité et indices de diversité totaux dans les diverses stations, en excluant Pimelia mauritanica
| Variables | Stations | Total Moudjbara (reboisement) | Stations | Total Oued-Sdar (steppe) | ||||
| Moudjbara 1 | Moudjbara 2 | Moudjbara 3 | Oued-Sdar 1 | Oued-Sdar 2 | Oued-Sdar 3 | |||
| E | 0,811 | 0,758 | 0,803 | 0,761 | 0,822 | 0,845 | 0,785 | 0,799 |
|
|
3,105 | 2,797 | 3,040 | 3,223 | 3,074 | 2,979 | 3,146 | 3,346 |
| D | 0,920 | 0,881 | 0,910 | 0,915 | 0,935 | 0,922 | 0,916 | 0,941 |
La plus grande abondance, tant numérique que spécifique, des Curculionidés en zone de steppe peut sans doute s'expliquer par le régime alimentaire phytophage de cette famille [35], la steppe offrant une plus grande diversité d'espèces végétales que la forêt. Toutes les espèces de ce groupe suivent cette tendance, à l'exception de Baris algirica, totalement absente des stations de steppe, et qui semble au contraire favorisée par le reboisement et de Sitona callosus, qui semble indifférente. Les Scarabéidés, qui sont essentiellement détritivores au stade larvaire, ont en revanche des effectifs totaux également répartis dans les deux milieux, bien que la matière organique soit plus abondante en zone de steppe. Toutefois, certaines de leurs espèces apparaissent inféodées à la steppe, telle Scarabaeus sacer, et d'autres aux boisements, telles Pentodon algerinum et Rhizotrogus pallidipennis. Cette dernière a déjà été rapportée comme affectionnant les peuplements de pins d'Afrique du Nord [36].
Au niveau des groupes à dominance prédatrice, le reboisement a eu pour conséquence générale une diminution de la diversité et des effectifs de Carabidés, compensée par une augmentation des mêmes paramètres chez les Araignées. La quasi-totalité des espèces de ces groupes suivent cette tendance, sauf le Carabidé T. bistriatus et les Araignées Drassodes lutescens et Oxyptila blitea, qui montrent une tendance nettement opposée à celle des autres espèces de leur groupe. Cette inversion des responsabilités entre Carabidés et Araignées, pour une fonction (prédation) analogue peut s'expliquer par de plus faibles possibilités de chasse à la course et de plus grandes possibilités de chasse à l'affût en forêt. Si la fonction reste la même, ses modalités d'exécution diffèrent cependant grandement, puisque, des Carabes aux Araignées et pour un même effectif total, l'on passe d'un nombre relativement limité d'espèces à effectifs abondants (10 individus par espèces en moyenne chez les carabes) à un grand nombre d'espèces chacune d'effectif réduit (3,3 individus par espèce en moyenne chez les Araignées).
En conséquence, il est possible de caractériser chacun des deux milieux par des complexes d'espèces, tels que ceux qui ressortent des analyses multivariées. Les stations de steppe se caractérisent globalement par l'abondance des Ténébrionidés, des Curculionidés et des Carabidés (groupes I et IV), tandis que les stations reboisées se caractérisent par l'abondance des Araignées (groupe III). Les sous-groupes peuvent permettre de séparer certaines stations appartenant à un même milieu. La station Oued Sdar 3 se distingue des deux autres stations de steppe, et surtout d'Oued Sdar 1, par l'abondance des Ténébrionidés (sous-groupe Ia), auxquels s'ajoutent des Carabidés et des Araignées Gnaphosidés (groupe IIc), Oued Sdar 1 étant plutôt représentée par des Carabidés (sous-groupe IIb). Moudjbara 2 tend à se distinguer des autres stations reboisées par la présence de certaines espèces de Ténébrionidés (sous-groupe IIa).
5 Conclusions
Il apparaît clairement que, même si la richesse spécifique totale, les indices de diversité et le nombre total d'individus ne diffèrent souvent que peu entre les deux types de milieu (abstraction faite des modifications résultant de l'abondance de P. mauritanica), le reboisement a conduit à des modifications profondes des territoires où il a été effectué. Outre un développement considérable des populations de P. mauritanica, il y a induit un bouleversement de l'organisation et du fonctionnement des peuplements d'arthropodes, favorisant ou défavorisant certaines espèces et même certains groupes entiers, les espèces et les groupes auxquelles elles appartiennent pouvant varier parfois en directions opposées. La richesse spécifique et la diversité biologique de la région présaharienne de Djelfa dans son ensemble en ont été augmentées. Les raisons de ces bouleversements sont très difficiles à apprécier, parce que la biologie de la plupart des espèces recensées et les facteurs environnementaux qui déterminent leur distribution ne sont pas connus, les études les concernant n'ayant porté le plus souvent que sur la taxonomie.
Remerciements
Les auteurs remercient l'Institut national de la recherche forestière d'Algérie où s'est déroulé le travail sur le terrain et au laboratoire. Ils remercient aussi vivement tous les chercheurs ayant apporté leur aide aux déterminations d'espèces : Hélène Perrin, Claude Girard, Philippe Bruneau de Mire et Olivier Montreuil, du laboratoire d'entomologie, et Christine Rollard, du laboratoire des Arachnides, au Muséum national d'histoire naturelle de Paris, ainsi que Robert Bosmans, du laboratoire d'écologie terrestre de l'université de Gand (Belgique), pour les Arachnides.
Annexe A Nombre d'individus récoltés pour les diverses espèces de Coléoptères et d'Araignées, dans les six stations
| Familles | Genres et especes | Abréviations | Moud 1 | Moud 2 | Moud 3 | Ou-Sd 1 | Ou-Sd 2 | Ou-Sd 3 | Tot. |
| Tenebrionidae | Adesmia metallica Klug, 1830 | T-Ade m | 9 | 0 | 0 | 3 | 1 | 33 | 46 |
| Adesmia microcephala Solier, 1835 | T-Ade mi | 4 | 6 | 4 | 9 | 7 | 11 | 41 | |
| Akis goryi Solier, 1836 | T-Ak go | 0 | 1 | 0 | 0 | 0 | 0 | 1 | |
| Alphasida sp. | T-Al sp | 4 | 0 | 0 | 0 | 0 | 0 | 4 | |
| Asida sp. | T-As sp | 0 | 12 | 5 | 0 | 1 | 1 | 19 | |
| Blaps gigas Linne, 1767 | T-Bl gi | 11 | 6 | 11 | 19 | 29 | 87 | 163 | |
| Blaps nitens Castelnau, 1840 | T-Bl ni | 0 | 1 | 1 | 1 | 0 | 1 | 4 | |
| Blaps sp. | T-Bl sp | 0 | 0 | 0 | 0 | 3 | 3 | 6 | |
| Erodius sp. | T-Er sp | 0 | 0 | 2 | 23 | 1 | 0 | 26 | |
| Erodius zophoides Allard,1864, | T-Er zo | 9 | 27 | 2 | 5 | 0 | 15 | 58 | |
| Gonocephalum perplexum Lucas, 1849 | T-Go pe | 6 | 11 | 3 | 41 | 12 | 21 | 94 | |
| Micipsa mulsanti Levrat, 1853 | T-Mi mu | 20 | 7 | 9 | 1 | 6 | 16 | 59 | |
| Pachychila sp. | T-Pa sp | 6 | 9 | 3 | 0 | 0 | 0 | 18 | |
| Pimelia affi. grandis Klug, 1830 | T-Pi af | 0 | 0 | 3 | 0 | 0 | 1 | 4 | |
| Pimelia interstitialis Solier, 1836 | T-Pi int | 0 | 0 | 0 | 0 | 1 | 2 | 3 | |
| Pimelia mauritanica Solier, 1836 | T-Pi ma | 207 | 226 | 369 | 37 | 27 | 38 | 904 | |
| Pimelia simplex Solier, 1836 | T-Pi si | 11 | 2 | 0 | 2 | 2 | 1 | 18 | |
| Pimelia sp. | T-Pi sp | 18 | 3 | 0 | 0 | 0 | 6 | 27 | |
| Scaurus sanctiamandi Solier, 1838 | T-Sca sa | 2 | 0 | 0 | 2 | 0 | 5 | 9 | |
| Scaurus tristis Olivier, 1795 | T-Sca st | 10 | 0 | 3 | 2 | 0 | 1 | 16 | |
| Sepidium multispinosum Solier, 1843 | T-Se mul | 5 | 15 | 0 | 2 | 3 | 15 | 40 | |
| Sepidium uncinatum Erichson, 1841 | T-Se un | 0 | 0 | 0 | 1 | 0 | 2 | 3 | |
| Tentyria sp. | T-Te sp | 11 | 38 | 37 | 32 | 18 | 10 | 146 | |
| Tentyria thunbergi Stevens, 1829 | T-Te th | 67 | 86 | 42 | 34 | 12 | 15 | 256 | |
| Zophosis sp. | T-Zo sp | 16 | 7 | 12 | 10 | 4 | 5 | 54 | |
| Carabidae | Tachys (Paratachys) bistriatus | ||||||||
| (Dufstchmid, 1812) | C-Ta bis | 4 | 1 | 3 | 0 | 0 | 0 | 8 | |
| Acinopus sabulosus Fabricius, 1792 | C-Ac sa | 0 | 0 | 0 | 11 | 2 | 2 | 15 | |
| Amara (Amathitis) rufescens | |||||||||
| Dejean, 1829 | C-Am ruf | 6 | 0 | 0 | 17 | 1 | 2 | 26 | |
| Carabidae | Amara mesatlantica Antoine, 1935 | C-Am mes | 0 | 0 | 0 | 1 | 3 | 0 | 4 |
| Broscus politus Dejean (1828) | C-Br po | 1 | 0 | 0 | 3 | 4 | 3 | 11 | |
| Calathus encaustus Fairmaire, 1868 | C-Ca en | 1 | 0 | 0 | 2 | 2 | 0 | 5 | |
| Calathus fuscipes algiricus | |||||||||
| Gautier des Cottes, 1866 | C-Ca fu | 0 | 0 | 1 | 1 | 1 | 1 | 4 | |
| Cymindis setifensis Lucas, 1842 | C-Cy se | 31 | 11 | 3 | 21 | 2 | 1 | 69 | |
| Eucarabus famini maillei Solier, 1835 | C-Eu fa | 0 | 0 | 0 | 0 | 0 | 3 | 3 | |
| Laemostenus (Pristonychus) algerinus | |||||||||
| (Gory, 1833) | C-La al | 0 | 0 | 0 | 0 | 0 | 6 | 6 | |
| Laemostenus (Rhysosphodrus) deneveui | |||||||||
| (Fairmaire, 1859) | C-La de | 2 | 0 | 2 | 5 | 0 | 3 | 12 | |
| Licinus punctatulus Fabricius, 1792 | C-Li pu | 0 | 0 | 0 | 0 | 0 | 1 | 1 | |
| Microlestes levipennis Lucas, 1846 | C-Mi le | 0 | 0 | 2 | 0 | 0 | 3 | 5 | |
| Microlestes luctuosus Holdhaus, 1912 | C-Mi lu | 0 | 0 | 0 | 0 | 1 | 2 | 3 | |
| Orthomus berytensis Reiche & Soulcy, 1854 | C-Or be | 8 | 7 | 8 | 12 | 12 | 23 | 70 | |
| Sphodrus leucophtalmus Linné, 1758 | C-Sp leu | 0 | 0 | 0 | 1 | 0 | 1 | 2 | |
| Zabrus (Aulacozabrus) distinctus | |||||||||
| Lucas, 1842 | C-Za ds | 5 | 0 | 1 | 3 | 0 | 1 | 10 | |
| Curculionidae | Brachycerus barbarus Linné, 1758 | Cu-Br ba | 0 | 0 | 0 | 21 | 5 | 12 | 38 |
| Arammichnus cribricollis Gyllenhal, 1834 | Cu-Ar cri | 1 | 0 | 0 | 11 | 3 | 8 | 23 | |
| Baris algirica Desbrochers Des Loges, 1892 | Cu-Ba al | 1 | 5 | 0 | 0 | 0 | 0 | 6 | |
| Brachycerus pradieri Fairmaire, 1856 | Cu-Br pr | 0 | 0 | 0 | 0 | 2 | 0 | 2 | |
| Cyrtolepus oblitus Desbrochers 1896 | Cu-Cy ob | 0 | 0 | 0 | 3 | 1 | 1 | 5 | |
| Gonocleonus cristulatus Fairmaire, 1859 | Cu-Go cr | 0 | 0 | 0 | 0 | 0 | 2 | 2 | |
| Pachytychius haematocephalus | |||||||||
| Gyllenhal, 1836 | Cu-Pa ha | 0 | 0 | 0 | 0 | 2 | 0 | 2 | |
| Rhytidoderes plicatus Olivier, 1790 | Cu-Rh pl | 0 | 0 | 0 | 2 | 0 | 7 | 9 | |
| Sitona callosus Gyllenhal, 1834 | Cu-Si sp | 1 | 1 | 3 | 1 | 0 | 2 | 8 | |
| Trachyphloeus spinimanus Germar, 1824 | Cu-Tr sp | 0 | 0 | 0 | 0 | 0 | 2 | 2 | |
| Scarabaeidae | Ochodaeus gigas Marseul, 1913 | S-Oc gi | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Hymenoplia algirica Reitter, 1890 | S-Hy al | 0 | 3 | 1 | 3 | 0 | 0 | 7 | |
| Pentodon algerinum Fairmaire, 1893 | S-Pe al | 3 | 0 | 2 | 0 | 0 | 0 | 5 | |
| Phyllognatus excavatus Forster, 1771 | S-Ph ex | 1 | 0 | 0 | 0 | 0 | 0 | 1 | |
| Rhizotrogus pallidipensis Blanchard, 1850 | S-Rh pa | 3 | 5 | 2 | 2 | 0 | 0 | 12 | |
| Scarabaeus sacer Linné, 1938 | S-Sc sa | 0 | 0 | 0 | 1 | 5 | 0 | 6 | |
| Lycosidae | Alopecosa sp. | L-Al sp | 0 | 4 | 0 | 0 | 2 | 0 | 6 |
| Alopecosa albofasciata (Brullé, 1832) | L-Al alb | 1 | 0 | 2 | 0 | 0 | 0 | 3 | |
| Alopecosa gracilis (Bosenberg, 1895) | L-Al gr | 5 | 1 | 1 | 0 | 0 | 0 | 7 | |
| Alopecosa kuntzi Denis, 1953 | L-Al ku | 0 | 1 | 0 | 0 | 1 | 2 | 4 | |
| Trochosa hispanica Simon, 1870 | L-Tr hi | 2 | 3 | 4 | 0 | 0 | 0 | 9 | |
| Atypidae | Atypus affinis Thoell, 1873 | A-At af | 2 | 0 | 0 | 0 | 0 | 0 | 2 |
| Gnaphosidae | Drassodes lapidosus Walckenaer, 1802 | G-Dr la | 4 | 1 | 1 | 0 | 0 | 0 | 6 |
| Drassodes lutescens C.L. Koch, 1839 | G-Dr lu | 0 | 1 | 3 | 2 | 3 | 6 | 15 | |
| Haplodrassus dalmatensis | |||||||||
| (C.L. Koch, 1866) | G-Ha da | 0 | 0 | 0 | 0 | 0 | 1 | 1 | |
| Haplodrassus signifer (C.L. Koch, 1839) | G-Ha se | 0 | 0 | 0 | 0 | 0 | 1 | 1 | |
| Haplodrassus sp,1 | G-Ha sp1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | |
| Haplodrassus sp,2 | G-Ha sp2 | 2 | 0 | 0 | 0 | 0 | 0 | 2 | |
| Minosia santschii Dalmas, 1921 | G-Mi sa | 1 | 3 | 9 | 2 | 1 | 8 | 24 | |
| Minosia spinosissima Simon, 1878 | G-Mi sp | 1 | 1 | 0 | 0 | 0 | 0 | 2 | |
| Nomisia castanea Dalmas, 1921 | G-No ca | 1 | 0 | 1 | 2 | 0 | 0 | 4 | |
| Urozelotes rusticus (L. Koch, 1872) | G-Ur ru | 1 | 2 | 1 | 0 | 0 | 0 | 4 | |
| Zelotes aeneus (Simon, 1878) | G-Ze ae | 1 | 1 | 0 | 0 | 0 | 0 | 2 | |
| Zelotes oryx (Simon, 1879) | G-Ze or | 0 | 0 | 2 | 0 | 0 | 0 | 2 | |
| Ereseidae | Eresus latifasciatus Simon, 1910 | E-Er ci | 0 | 1 | 0 | 0 | 0 | 0 | 1 |
| Linyphiidae | Gonatium dayense Simon, 1886 | Li-Go da | 0 | 0 | 1 | 0 | 0 | 0 | 1 |
| Loxoscelidae | Loxcoceles rufescens (Simon, 1868) | Lo-Lo ru | 0 | 3 | 0 | 0 | 0 | 0 | 3 |
| Liocranidae | Mesiothelus mauritanicus Simon, 1909 | Lo-Me m | 2 | 1 | 5 | 1 | 0 | 1 | 10 |
| Mesiotelus sp. | Lo-Me s | 0 | 0 | 4 | 3 | 0 | 1 | 8 | |
| Thomisidae | Oxyptila blitea Simon, 1875 | Th-Ox bl | 0 | 0 | 1 | 1 | 0 | 4 | 6 |
| Oxyptila sp. | Th-Ox sp | 0 | 3 | 0 | 0 | 1 | 0 | 4 | |
| Xysticus acerbus Thorell, 1872 | Th-Xy ac | 0 | 0 | 0 | 0 | 0 | 2 | 2 | |
| Xysticus cribratus Simon, 1885 | Th-Xy c1 | 0 | 0 | 0 | 1 | 0 | 1 | 2 | |
| Xysticus cristatus (Clerck, 1757) | Th-Xy c2 | 0 | 2 | 1 | 0 | 0 | 1 | 4 | |
| Palpimanidae | Palpimanus gibbulus Dufour, 1829 | P-Pa gi | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Salticidae | Salticus scenicus (Clerck,1757) | Sa-Sa sc | 1 | 0 | 1 | 0 | 0 | 0 | 2 |
| Scytodidae | Scytodes bertheloti Lucas, 1838 | Sc-Sc be | 0 | 0 | 1 | 0 | 0 | 0 | 1 |
| Agelenidae | Tegenaria sp. | Ag-Te sp | 0 | 0 | 1 | 0 | 0 | 0 | 1 |
| Dysderidae | Dysdera hamifera Simon, 1910 | D-Dy ha | 0 | 4 | 2 | 0 | 0 | 0 | 6 |
| Zodaridae | Amphiledorus balnearius | ||||||||
| Jocqué & Bosmans, 2001 | Z-Am ba | 1 | 0 | 0 | 0 | 0 | 0 | 1 | |
| Selamia reticulata (Simon, 1870) | Z-Se re | 0 | 0 | 0 | 0 | 0 | 1 | 1 | |
| Zodarion elegans (Simon, 1873) | Z-Zo el | 0 | 1 | 0 | 0 | 0 | 0 | 1 | |
| Zodarion kabylianum Denis, 1937 | Z-Zo ka | 2 | 2 | 1 | 0 | 0 | 0 | 5 | |
| Total | 512 | 525 | 576 | 357 | 181 | 406 | 2557 |


