1 Introduction
Depuis les travaux de Herbst (1892) [1] qui ont mis en évidence l'influence du lithium sur le développement précoce des oursins, Waterman, Wilson, Lallier, Bougis [2–8] notamment, ont démontré l'intérêt des échinodermes en écotoxicologie. Ainsi, l'oursin (adultes, larves, gamètes) est utilisé pour tester la toxicité des agents chimiques (métaux, polluants industriels, substances cancérigènes, médicaments, etc.) ainsi que des agents physiques (rayon X, UV, gamma, etc.) [9]. Certains auteurs l'utilisent également pour tester la toxicité d'eau douce (après ajout de saumure), de rejets urbains et de sédiments [10,11]. Ainsi, dans de nombreux pays, le test biologique utilisant les larves d'oursins est aujourd'hui parmi les mieux standardisés en écotoxicologie [9,12–16].
Toutefois, peu de travaux démontrent la possibilité d'utiliser les larves d'oursins comme biomarqueurs de l'environnement marin. Wilson montre que certaines eaux de mer sont meilleures que d'autres pour le développement des larves d'oursins [3]. Kobayashi envisage l'utilisation de la fertilité des œufs d'oursin comme matériel biologique pour tester la qualité d'une eau de mer au Japon [17]. Pendant les années 1970–1985, la technique a été affiné et d'autres méthodologies ont été développées [9,17,18].
Les tests utilisant les oursins sont nombreux et peuvent être basés sur différents stades de développement : gamètes, embryons ou adultes.
Les tests d'expositions des gamètes sont les plus nombreux car ils sont rapides, faciles à mettre en place et permettent une multiplication des bio-essais. L'activation, la mobilité et le taux de mortalité des spermatozoïdes sont les plus faciles à utiliser mais la sensibilité du test est faible [19–22]. Dinnel et Stober proposent une standardisation d'un bio-essai en se servant du pouvoir fertilisant des spermatozoïdes pour la surveillance des effluents par l'agence de la protection de l'environnement américaine [23,24]. Ce test est très rapide (1 heure d'exposition) et assez performant lorsque les espèces locales sont utilisées.
Les tests utilisant l'exposition des embryons sont basés sur le taux de survie, le taux d'anormalité et les retards de croissance pour caractériser l'effet toxique. Les bio-essais durant la phase de développement larvaire endotrophe permettent de s'affranchir de la qualité de l'alimentation [7]. Les tests de Bougis et al. [25,26] démontrent une excellente sensibilité aux métaux mais leurs effets sont variables en fonction de la composition biochimique des ovocytes, de la qualité génétique des géniteurs ou de la température de l'eau [27]. L'utilisation de géniteurs prélevés dans le milieu naturel engendre une forte hétérogénéité voire même l'impossibilité de réaliser les tests à certaines périodes de l'année (notamment en été).
Toutefois, les avancées réalisées en échiniculture permettent de résoudre les problèmes rencontrés [28–30]. L'obtention de familles génétiquement homogènes et conditionnées de façon optimale en écloserie permet de standardiser l'approvisionnement [29,31]. L'utilisation d'une eau de mer reconstituée permet de limiter les variations de la qualité de l'eau. Cette étude vise à proposer la standardisation d'un bio-essai basée sur l'utilisation de géniteurs issus de l'aquaculture pour le suivi environnemental de la qualité de l'eau dans le cadre de réseau de surveillance mais également utilisable en éco toxicologie.
2 Matériel et méthodes
2.1 Obtention des géniteurs
Les oursins, Paracentrotus lividus, sont issus de l'élevage du centre expérimental du SMEL (Syndicat mixte pour l'équipement du littoral) à Blainville-sur-mer (France). Ils sont élevés en circuit semi-fermé jusqu'à atteindre une taille suffisante (40 mm minimum en deux ans) dans des structures d'élevage thermorégulées à 18 °C. Ils sont alimentés avec Laminaria digitata durant tous la phase de croissance.
Un cycle de maturation permet d'obtenir des animaux matures [32]. Une phase de jeûne à 18 °C en jour court (8:16) permet de vider par amaigrissement et d'homogénéiser le lot de géniteurs ; les oursins sont ensuite alimentés avec du maïs en grain durant 1 mois augmentant ainsi la glycémie et favorisant le développement de réserves, parallèlement la température de l'eau est progressivement réduite à 8 °C. Les animaux sont maintenus à cette température basse durant 1 mois, ils sont alimentés avec Laminaria digitata et la photopériode évolue progressivement vers 16:8 (jour long), la température est ensuite remontée à 18 °C (1 °C/48 h) pour accélérer le développement des gamètes. Ils sont élevés à cette température durant un mois. Chaque jour, les fèces sont retirées et un renouvellement de 50% de l'eau est effectué. Les larves pourront alors être testées dans les deux mois suivant cette période de conditionnement.
2.2 Eau de mer reconstituée
Une eau de mer reconstituée permet de servir de référence (ou contrôle négatif). Elle est réalisée à partir d'eau d'Evian® dans laquelle sont dissous 39,2 g de sel SERA® Premium par litre pour obtenir une salinité finale de 33‰. Cette eau est réalisée au moins 24 heures à l'avance et elle est aérée grâce à un diffuseur pendant 2 heures avant son utilisation.
2.3 Obtention de gamètes
Les oursins matures sont stimulés en injectant 1 ml de KCl (0,5 M) dans le péristome. Les oursins sont positionnés (face aborale vers le bas) individuellement sur des béchers en polypropylène de 100 ml contenant de l'eau de mer reconstituée à 18 °C. L'émission des spermatozoïdes et des ovocytes a lieu quelques minutes après l'injection. Les ovocytes sont observés et comptés au microscope (×40), une dilution avec de l'eau de mer reconstituée permettant d'obtenir une concentration de 500 ovocytes par millilitre. La fécondation est réalisée par ajout de sperme. Une observation microscopique permet de vérifier que le taux de fécondation (décollement de la membrane) est supérieur à 95%.
2.4 Le bio-test
Les ovocytes fécondés sont placés dans des piluliers en polypropylène de 125 ml contenant 100 ml d'eau à tester à raison de 5 œufs/ml. La durée d'incubation est de 96 heures. A l'issue de cette période, les larves sont fixées au formaldéhyde (2%). La mesure des spicules est réalisée au microscope (×100) associé à un logiciel de mesure et comptage (Image Motic 2000). Le taux de malformation ou de non développement est calculé. Un minimum de 15 larves est mesuré pour chaque répliquat. La moyenne et l'intervalle de confiance (95%) sont ensuite calculés. Une ANOVA permet de réaliser l'analyse statistique (Stat View).
2.5 Evaluation de la température optimale
Dix températures comprises entre 5,2 et 21,5 °C sont testées (températures moyennes mesurées sur quatre jours : 5,2 ; 6 ; 7,7 ; 9,7 ; 12,2 ; 14,1 ; 16,3 ; 18,1 ; 20,3 ; 21,5 – Ecart type maximum de 0,2 °C). Les échantillons sont placés dans des doubles bains-marie afin de limiter les variations de température (±0,2 °C). L'eau de mer reconstituée est utilisée pour cette expérimentation ; la salinité est de 33 ppt et le pH d'environ 8.4. Les échanges air/eau en surface du pilulier sont suffisants pour conserver l'oxygène dissous proche de 100% de la concentration maximale. Après 96 heures, les larves sont observées après fixation au formaldéhyde (2%) et celles atteignant le stade plutéus sont mesurées.
2.6 Evaluation du pH admissible
Une série de 11 solutions d'eau de mer reconstituée avec un pH compris entre 7,0 et 9,0 est testée (pH moyens mesurés entre t0 et t96 : 7,0 ; 7,2 ; 7,3 ; 7,6 ; 7,8 ; 8,1 ; 8,3 ; 8,4 ; 8,6 ; 8,8 ; 9,0). Le pH de l'eau de mer reconstituée est voisin de 8,4. Les autres pH sont ajustés par ajout d'acide chlorhydrique (1 mol/l pour titration CHEM-LAB) ou d'hydroxyde de sodium (32% Normapur pour analyse PROLABO). La température de l'eau est maintenu entre 18 et 20 °C, la salinité est d'environ 33 ppt.
2.7 Evaluation de la salinité admissible
Une gamme de salinité comprise entre 19,9 et 41,9 ppt est testée (salinités moyennes mesurées entre t0 et t96 : 19,9 ; 21,4 ; 23,5 ; 25,6 ; 27,1 ; 28,8 ; 31,1 ; 32,7 ; 34,7 ; 36,6 ; 38,6 ; 40,5 ; 41,9). Elle est obtenue à partir d'une eau d'Evian® Sel SERA Premium® à 41,9 ppt plus ou moins diluée. La température de l'eau est maintenue entre 18 et 20 °C, le pH est d'environ 8,4.
2.8 Toxicité du cuivre – contrôle positif
Une gamme de 0 à 100 μg/l de cuivre est testée (0 ; 10 ; 20 ; 30 ; 40 ; 50 ; 60 ; 70 ; 80 ; 90 ; 100). Le sulfate de cuivre (CuSO4, 5H2O pour Analyse, Labosi) est ajouté à l'eau de mer reconstituée à une salinité de 33 ppt. La température de l'eau est maintenue entre 18 et 20 °C, le pH est d'environ 8,4. Les échinoodermes sont sensibles au cuivre et ce métal est souvent utilisé dans les tests écotoxicologique. Ce test permettra de comparer nos résultats à ceux obtenus par d'autres auteurs. D'autre part, il peut permettre d'obtenir un contrôle positif. L'utilisation de ce contrôle positif associé au contrôle négatif de l'eau de mer reconstitué permet d'encadrer strictement l'utilisation de ce test, de rejeter ou d'accepter les résultats d'une série en fonction de des résultats de ces deux niveaux de contrôles.
2.9 Suivi environnemental
Sept eaux naturelles sont prélevées chaque mois, durant une année, sur les côtes du département de la Manche (Table 1, Fig. 1). Le pH et la salinité sont mesurés. La salinité est réajustée à l'aide du sel SERA PREMIUM® ou de l'eau d'Evian® pour qu'elle soit comprise entre 30 et 34 ppt. L'eau « sortie de Havre » est une eau saumâtre (havre de Geffosse) et l'eau « rivière » est une eau douce (La Sienne au niveau du Pont de la Roque).
Positionnement des points de prélèvements de l'eau.
| Site | Latitude | Longitude | |
| 1 | Côte côte ouest | 49°01.176 N | 1°37.070 W |
| 2 | Large côte ouest | 49°03.433 N | 1°41.858 W |
| 3 | Sortie de Havre (Geffosse) | 49°08.079 N | 1°35.481 W |
| 4 | Estuaire (Sienne) | 49°01.176 N | 1°30.327 W |
| 5 | Port St Vaast | 49°35.188 N | 1°15.171 W |
| 6 | Côte côte est | 49°32.544 N | 1°17.311 W |
| 7 | Large côte est | 49°29.595 N | 1°12.212 W |

Carte positionnant les points de prélèvement de l'eau : 1 – Blainville-sur-mer, 2 – Les Nattes, 3 – Havre de Geffosse, 4 – Estuaire de la Sienne, 5 – Port de Saint Vaast la hougue, 6 – Lestre, 7 – Large de la côte est.
Un contrôle négatif est effectué parallèlement lors de chaque série avec de l'eau de mer reconstituée. La moyenne et l'intervalle de confiance de la longueur des spicules sont calculés pour chacune des eaux. L'indice de croissance moyen (IC) est la moyenne des indices de croissance calculés pour chacune des larves mesurées par rapport à la longueur moyenne obtenue avec l'eau de reconstituée :
Cet indice peut-être de 0 en cas de non développement des larves dans l'eau à tester. En cas de développement des larves, la longueur des larves varie de 250 μm à près de 600 μm (environ 500 μm en moyenne pour l'eau de mer reconstituée). Ainsi, l'indice peut varier entre environ 50 pour les larves les plus petites jusqu'à une valeur légèrement supérieure à 100, lorsque la qualité de l'eau testée est meilleure que l'eau de mer reconstituée. Dans nos expérimentations, cet indice n'a pas dépassé 105.
Chaque bio-essai est réalisé en tripliquat.
3 Résultats
3.1 Évaluation de la température optimale
La température a un effet significatif sur le développement des larves d'oursins (, ) (Fig. 2). Une température de l'eau de mer inférieure ou égale à 10 °C ne permet pas l'obtention de larves au stade plutéus en 4 jours. Entre 12 et 16 °C, le pourcentage de larves malformées est important (30% à 16 °C). Pour une température comprise entre 18 et 21,5 °C, aucune larve malformée n'est observée. Les larves ont une taille similaire d'environ 500 μm.
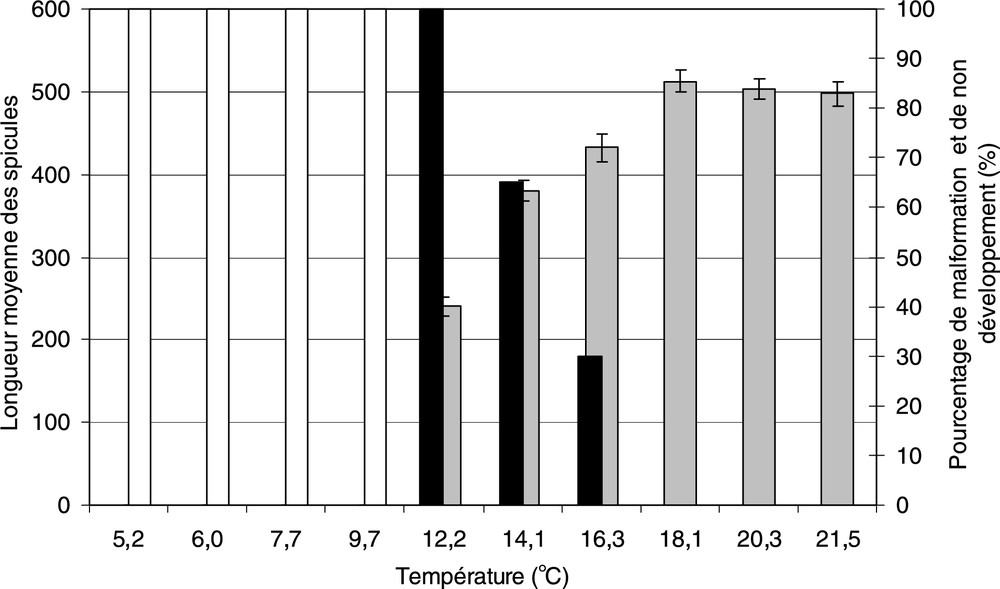
Influence de la température sur la longueur moyenne (±IC95) des spicules (en gris), pourcentage de malformation (en noir) et pourcentage de non développement (en blanc) des larves d'oursins P. lividus durant les 4 premiers jours.
3.2 Évaluation du pH admissible
Le pH de l'eau de mer testée a une influence significative sur le développement des larves à 4 jours (, ) (Fig. 3). Dans la gamme de pH testés (7,0 à 9,0) les larves se développent pour une température de 19 °C et une salinité de 34 ppt. Quelques larves malformées sont observées pour un pH inférieur ou égal à 7,8 et supérieur ou égal à 8,6. Aucune larve malformée n'est observée entre 8,1 et 8,4.
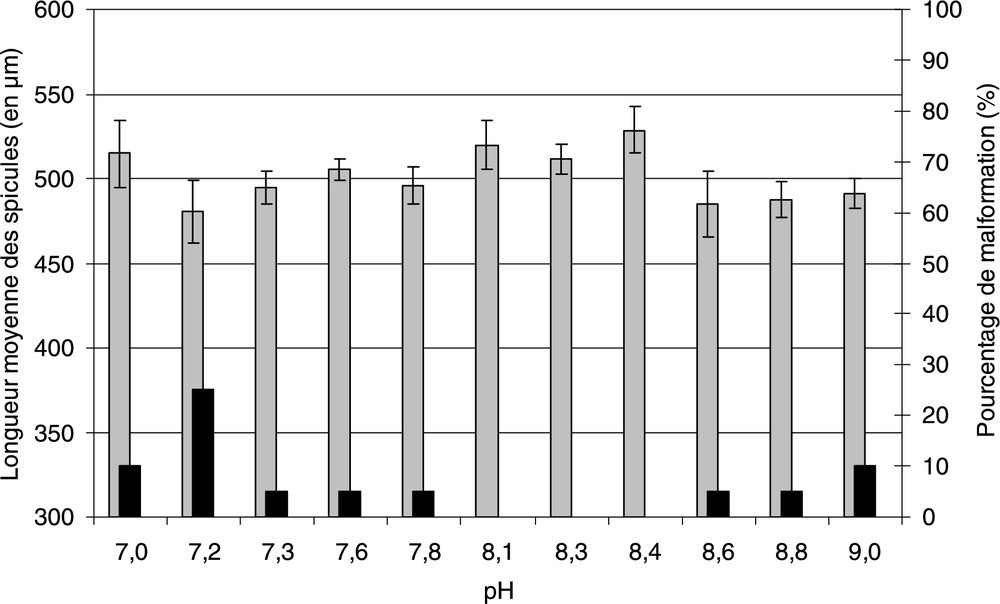
Influence du pH sur la longueur moyenne (±IC95) des spicules (en gris), pourcentage de malformation (en noir) des larves d'oursins P. lividus durant les 4 premiers jours.
3.3 Évaluation de la salinité admissible
La salinité a un effet significatif sur le développement des larves à 4 jours (, ) (Fig. 4). Aucun développement n'est observé en dessous de 21,4 ppt ni au dessus de 41,9 ppt. Le taux de malformation est important en dessous de 27,1 ppt et au dessus de 34,7 ppt. Les larves développées dans une salinité comprise entre 28,8 et 32,7 ppt sont les plus grandes obtenues avec une taille similaire de l'ordre de 450 μm.

Influence de la salinité sur la longueur moyenne (±IC95) des spicules (en gris), pourcentage de malformation (en noir) et pourcentage de non développement (en blanc) des larves d'oursins P. lividus durant les 4 premiers jours.
3.4 Évaluation de la toxicité du cuivre
Les larves se développent jusqu'à une concentration en cuivre de 90 μg/l mais des malformations apparaissent dès 50 μg/l (Fig. 5). Le cuivre entraîne une diminution de la croissance significative à partir de 30 μg/l (, ) avec des larves dont les spicules atteignent par rapport à avec l'eau de mer reconstituée sans ajout de cuivre. Pour une concentration de 60 μg Cu/l le taux de malformation atteint 43% et 70% pour une concentration de 70 μg Cu/l. A partir de 80 μm certaine larves ne se développent plus.
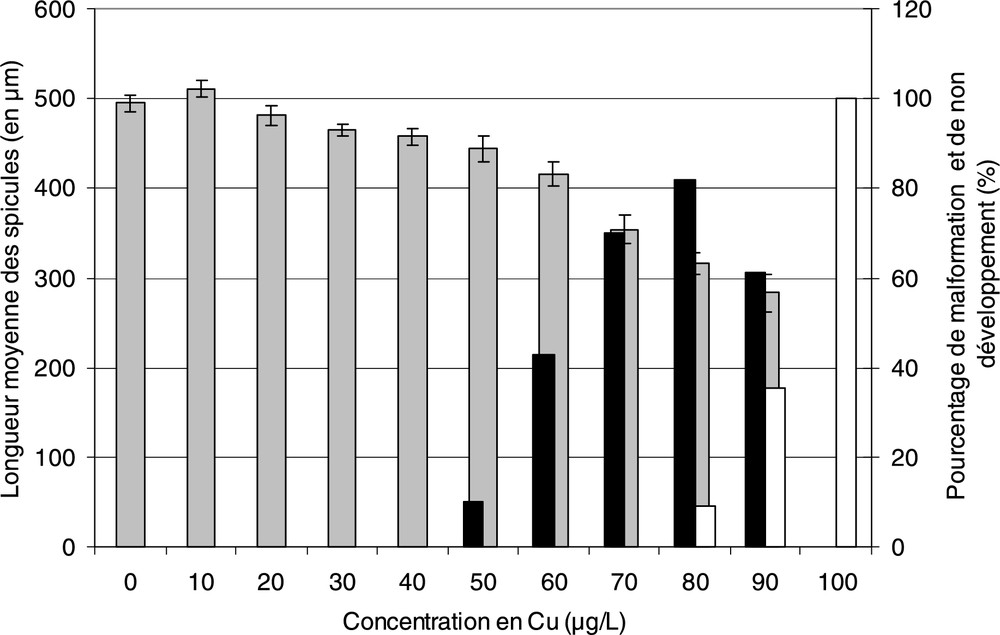
Influence du cuivre sur la longueur moyenne (±IC95) des spicules (en gris), pourcentage de malformation (en noir) et pourcentage de non développement (en blanc) des larves d'oursins P. lividus durant les 4 premiers jours.
3.5 Suivi environnemental
L'eau de mer reconstituée permet d'obtenir des larves à 4 jours d'une taille moyenne comprise entre 487 μm en février et 536 μm août (Fig. 6). Ces variations sont significatives (, ) mais les différences restent assez faibles.

Longueur moyenne des spicules (μm) de P. lividus élevé dans l'eau de mer reconstituée durant une année.
Les variations obtenues dans les eaux naturelles sont beaucoup plus importantes. La Fig. 7 montre l'évolution de l'eau de la côte ouest du Cotentin avec des eaux prélevées à proximité de la côte et des eaux prélevées à plusieurs kilomètres. Il est constaté que les eaux du large permettent généralement d'obtenir des larves de plus grande taille par rapport aux eaux côtières, mais que l'indice IC est de 83% au minimum. Pendant les périodes de février et août, l'eau de mer engendre des larves plus petites.
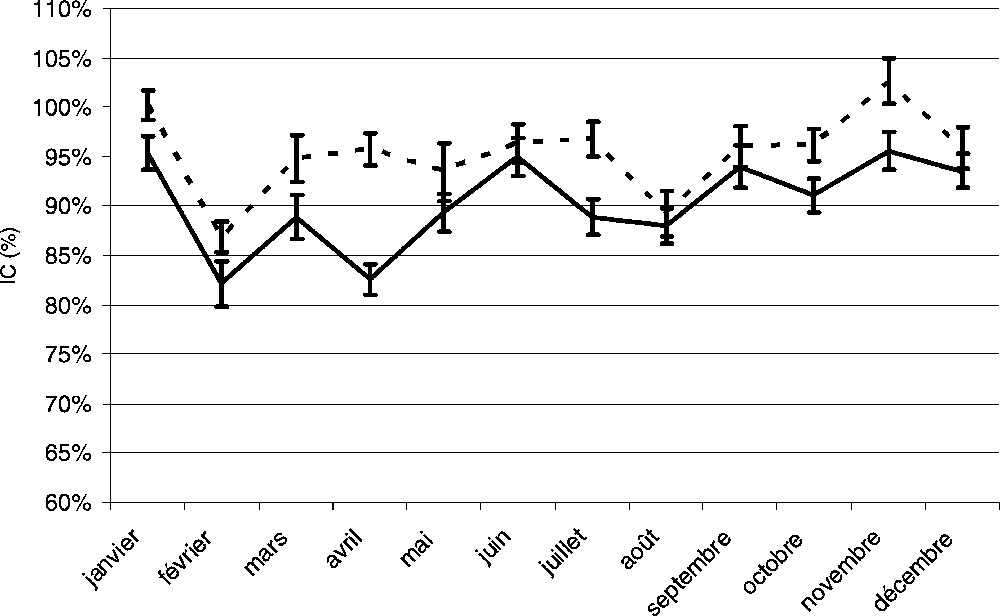
Evolution annuelle de l'indice de croissance des larves d'oursins (en pourcentage par rapport à l'EDR) élevé dans de l'eau de la côte ouest du Cotentin [côte (trait plein) et large (pointillés)].
Les variations obtenues sur la côte est du cotentin sont plus importantes avec un IC minimum de 65% (Fig. 8). Les deux périodes de moindre qualité (février et août) sont également observées mais avec une ampleur plus importante. L'eau prélevée dans le port permet généralement d'obtenir des larves plus petites mais les variations annuelles sont similaires avec l'eau du large ou l'eau de la côte.

Evolution annuelle de l'indice de croissance des larves d'oursins (en pourcentage par rapport à l'EDR) élevé dans de l'eau de la côte est du Cotentin [côte (trait plein) et large (pointillés) et port (gris)].
Ces évolutions annuelles ne sont pas observées en eau douce de rivière ainsi qu'en eau saumâtre de sortie de havre (Fig. 9). Ces eaux permettent donc d'obtenir des larves toute l'année mais avec un IC proche de 75% pour l'eau de sortie de havre avec une amélioration en décembre et janvier, contre 85% pour l'eau de l'estuaire de qualité moins variable.
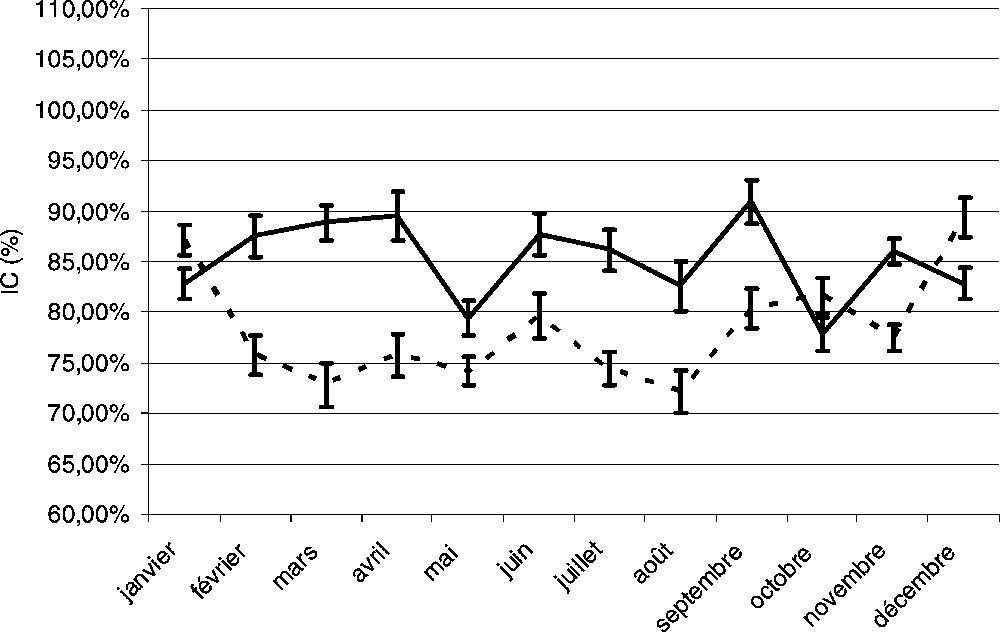
Evolution annuelle de l'indice de croissance des larves d'oursins (en pourcentage par rapport à l'EDR) élevé dans de l'eau d'une rivière (eau douce resalée) (trait plein) et de l'eau de sortie de havre (eau saumâtre réajustée) (pointillés).
4 Discussion
Les expérimentations permettent de montrer que la température optimale pour la réalisation des tests est comprise entre 18 et 22 °C, 22 °C étant la température la plus élevée testée. Au-delà, des développements bactériens importants peuvent avoir lieu compromettant ainsi la réussite du test. D'autre part, la quantité d'oxygène dissous diminuant fortement avec une température élevée (le système ne disposant pas d'aération mécanique), le risque d'anoxie entraînant une mortalité des larves augmente fortement. En dessous de 18 °C, les larves se développent normalement mais leur taille est plus petite pour une même durée d'élevage. Ces résultats sont conformes avec les techniques utilisées par d'autres auteurs mais ils dépendent généralement de l'espèce utilisée. Losso et al. [16] effectuent leurs tests à 18 °C avec la même espèce alors que Fernandez et al. utilisent 20 °C [33]. Hall et Golding [14] recommande 20 °C pour l'oursin des sables (Fellaster zealandiae) alors que l'ASTM [15] stipule des températures différentes en fonction de l'espèce allant de 12 °C pour Strongylocentrotus droebachiensis à 20 °C pour Arbacia punctulata. Ainsi, une température comprise entre 18 et 20 °C est utilisée pour cette technique.
La salinité optimale obtenue dans les expérimentations est comprise entre 30 et 34 ppt. His et al. [34] montrent que 33 ppt est meilleure que 20 et 35 ppt, alors que Losso et al. [16] utilisent une eau de mer à une salinité de . Selon Dinnel et Stober [23] le développement des gamètes serait très sensible aux basses salinités même si les adultes ont été acclimatés. Warnau et al. [35] indiquent que P. lividus peut se développer dans des eaux à 38 ppt. Lors de cette expérimentation des larves de 4 jours sont obtenues jusqu'à 41,5 ppt malgré une proportion de malformées qui augmente. Le sel Sera Premium® et l'eau d'Evian® utilisés dans les expérimentations pour la réalisation de l'eau de mer reconstituée permet de faire évoluer la salinité très simplement en obtenant de très bon résultats sur la croissance des larves. D'autres auteurs utilisent des formulations différentes [36,37] mais tous les sels commerciaux ne permettent pas l'obtention de larves de qualité suffisante (non publié). De ce fait, certains auteurs utilisent une saumure ou de l'eau déionisée pour ajuster la salinité [12] mais l'obtention d'eau de mer non-contaminée et son évaporation peuvent être des difficultés majeures et une source de contamination. D'autre part, l'augmentation de la salinité implique une dilution de l'échantillon qui peut être importante (33% pour une eau douce) entraînant une moins bonne sensibilité du test. La salinité d'une eau pourra être ajustée entre 30 et 34 ppt par dilution ou par ajout de sel. Une eau douce ou saumâtre pourra alors être testée avec cette méthode.
Le pH compris entre 8 et 8,4 permet l'obtention de belles larves avec un minimum de malformation. Ces valeurs sont celles généralement rencontrées dans les eaux de mer, Aminot [38] indiquant un pH moyen de 8,2, mais cette valeur peut être altérée dans les eaux côtières où les rejets industriels ou ceux des eaux continentales entraînent un déséquilibre ionique suite, par exemple à des complexations métalliques susceptibles de modifier le pH ; ce paramètre apparaît alors comme un indice de pollution. Toutefois, l'évolution de la biomasse phytoplanctonique peut également influencer la concentration en CO2 dissous et agir sur le tampon carbonate. Les valeurs rencontrées en zone côtière peuvent alors varier entre 7,5 et 8,5 [12]. La mesure du pH est généralement réalisée dans les tests toxicologiques mais peu d'auteurs l'ajustent. Souvent une variation de la valeur de pH est le résultat d'une pollution. Il est apparu que le pH n'a effectivement pas besoin d'être ajusté lorsqu'il est compris entre 7 et 9 car cette étude a montré qu'il n'y avait pas de variations significatives de la croissance des spicules ni de malformation chez les larves (Fig. 3) dans cette gamme. Les résultats obtenus par Bellas et al. [11] sur le taux de malformation de Ciona intestinalis (ascidie) vont également dans ce sens. Les valeurs extrêmes de pH ( et ), conduisent à une augmentation du pourcentage de malformation (Fig. 3). La valeur du pH doit donc être considérée avec prudence en fonction des objectifs de chaque étude. Aucune étude de l'influence du pH sur la croissance des larves n'avait été réalisée auparavant.
L'une des difficultés majeures de l'utilisation des larves est l'obtention de géniteurs de bonne qualité. Généralement cette qualité est très saisonnière pour des animaux prélevés dans la nature [39] rendant impossible l'utilisation de cet indicateur toute l'année. Luis et al. [40] montrent que la maturation d'oursins prélevés dans le milieu naturel est délicate pour l'obtention de larve à chaque saison. Volpi Ghirardini et al. [41] mesurent l'indice gonadique (IG = poids humide de gonade/poids humide total × 100) pour établir la qualité de leur géniteur, cet indice devant être compris entre 5 et 9. Toutefois, la quantité de gonade ne peut pas être assimilée à la qualité pour la reproduction. En effet, le développement gonadique passe par une phase de mise en réserve avec un indice gonadique élevé mais ne permettant pas l'obtention de gamètes [32]. D'autre part, les Figs. 7 et 8 montrent que l'origine des oursins peut influencer la qualité des géniteurs puisque la qualité de l'eau côtière a une influence sur le taux de croissance des larves. Les résultats obtenus dans cette étude montrent que le système de conditionnement mis au point permet d'obtenir des larves de très bonne qualité quelle que soit la saison.
L'ajout d'un métal à l'eau de mer reconstituée permet d'obtenir un contrôle positif ; Hall et Golding [14] utilisent le zinc mais de nombreux auteurs utilisent le cuivre. Une faible concentration de 30 μg/l de cuivre permet d'observer un effet significatif sur la croissance alors qu'il faut une concentration de 50 μg de Cu/l pour observer les premières malformations de larves. Ces résultats sont conformes à ceux qu'obtiennent His et al. [34] qui montrent des malformations pour 60 μg de Cu/l de cuivre. Volpi Ghirardini et al. [41] montrent une toxicité à 40 μg de Cu/l pour les larves de P. lividus (EC50-72h : 60 μg/l) proche de celle de Manzo et al. [42] avec un EC50-72h de 46 μg de Cu/l. Bougis et Corre [26] suggèrent que l'effet du cuivre est variable en fonction de la qualité des géniteurs. Cela expliquerait les différences parfois assez importantes obtenues entre différents auteurs. Il est probable que des gamètes de moindre qualité soient plus sensibles à un agent toxique. La standardisation d'une méthode passe donc impérativement par la standardisation du conditionnement des géniteurs. D'autre part, la relative augmentation de taille des larves avec une concentration de 10 μg de Cu/l peut être la résultante de l'effet Arndt-Schulz décrit par Pagano et Romana [9] sous l'appellation d' « hormèse » par lequel de faibles concentrations en agent toxique provoquent une augmentation de la croissance. Ainsi, la réponse biologique à un stress organique ou inorganique ne conduit pas nécessairement à un effet négatif sur la croissance à court terme. Et donc, toutes variations, positives ou négatives, par rapport au témoin devront être interprétées avec prudence.
Cette étude a pour objectif de valider une technique proposant l'utilisation tout au long de l'année de larves d'oursins d'élevage conditionnés dans le cadre d'études écotoxicologiques ou de réseau de surveillance de la qualité du milieu. Les causes des variations de croissance observées lors du suivi environnemental (Figs. 7 et 8) feront l'objet d'un article ultérieur (Basuyaux et al., in prep.). Il est apparu que la technique utilisée convient parfaitement dans le cadre d'un réseau de surveillance. L'eau de mer reconstituée qui permet d'obtenir des larves proche de 500 μm quelle que soit la saison peut être considérée comme une eau de référence permettant de comparer les résultats obtenus avec des eaux naturelles. Les faibles variations observées peuvent être la résultante de la méthode de conditionnement des géniteurs. En effet, les lots de géniteurs, une fois conditionnés, sont utilisés durant deux mois, soit trois tests. Or, durant cette période, la qualité des gonades évolue pouvant alors influencer la qualité des larves. Un conditionnement spécifique à chaque test permettrait sans doute de diminuer cette variabilité. Toutefois, les oursins étant alimentés, pour partie en algues fraîches dont la qualité évolue sur l'année [30], une part de la variabilité pourrait être imputée à l'alimentation. La cryopréservation des gamètes ou des ovocytes fécondés pourrait simplifier la technique et la rendre utilisable dans l'ensemble des laboratoires. Actuellement peu de travaux ont abouti sur les oursins. Adams et al. [43,44] ont décrit une méthode de cryopréservation des spermatozoïdes mais les travaux sur les ovocytes d'oursins ne permettent pas de les conserver dans de bonnes conditions.
L'eau de mer reconstituée peut être un contrôle négatif permettant de valider le test biologique.
Notre suivi démontre que toutes les eaux littorales peuvent être testées, y compris des eaux douces ou saumâtres. La rapidité de l'analyse (quelques jours), sa sensibilité et son coût permettent de l'utiliser à grande échelle. Pour autant, la maturation des géniteurs reste un élément contraignant. Ce problème de disponibilité des géniteurs est également observé chez la plupart des espèces utilisées comme biomarqueur de l'environnement [11,33]. Ces études basées sur la comparaison de la qualité du biomarqueur montrent que ces outils doivent être utilisés en batterie afin d'obtenir une réponse biologique adaptée. Hagger [45] développe un index intégrant différents effets biologiques sur Mytilus edulis pour la classification des eaux (directive européenne), mais d'autres espèces, comme Paracentrotus lividus, pourraient être intégrées.
Remerciements
Ce travail a été financé par le Syndicat Mixte pour l'Equipement du Littoral ainsi que des fonds Européens. Nous remercions ML Mahaut, C Caplat et JM Panoff pour leurs précieux conseils dans la rédaction. Nous remercions également toutes les personnes qui ont participé aux prélèvements d'eau, à l'élevage des oursins et à leur conditionnement et particulièrement Stéphane Pacary qui nous a dramatiquement quitté en début d'année et a qui nous dédions ce papier.


