1 Introduction
La conservation de la biodiversité se pose comme l’un des enjeux majeurs du XXIe siècle [1–4]. Dès les années 1980, les forêts dites « sacrées » ont attiré l’attention d’instances internationales, telles l’Unesco, notamment sur le potentiel lié à la conservation de la biodiversité [5,6]. En Afrique, dans de nombreux pays comme le Togo, le Bénin, la Côte d’Ivoire et le Burkina, les recherches sur les rôles écologiques/écosystémiques de ces systèmes forestiers se multiplient depuis de nombreuses années [7–12]. L’ensemble de ces travaux témoigne d’une prise de conscience généralisée sur la nécessité de conserver ces écosystèmes potentiellement pluriséculaires face à l’accentuation des pressions anthropiques.
La détermination des facteurs régissant l’organisation spatiale de la diversité végétale actuelle est primordiale dans un plan de conservation de la biodiversité et aura de profondes implications dans la définition de stratégies d’inventaire des ressources naturelles et de gestion durable de ces forêts tropicales [13]. En Afrique, l’examen des groupements végétaux s’effectue généralement à deux échelles complémentaires, régionale et locale. À l’échelle régionale (phytogéographique) de l’Afrique tropicale, les groupements végétaux sont traditionnellement définis par les facteurs géologiques, historiques et climatiques couvrant de vastes territoires, correspondant aux grandes subdivisions climato-phytogéographiques [14,15]. À l’échelle locale, l’identification des groupements repose tout particulièrement sur l’analyse floristique, en lien avec les conditions stationnelles, notamment la topographie, le sol, le climat, la faune et l’action de l’homme [16].
En Guinée, l’étude des écosystèmes forestiers est surtout concentrée sur les zones forestières et/ou sur les aires protégées d’États [17–20]. Les rares travaux disponibles sur les forêts sacrées de Guinée traitent principalement des aspects socioculturels [21–24], les aspects écologiques demeurant secondaires, voire inconnus. Afin de palier cette quasi-absence de données, ce travail porte sur la caractérisation phytoécologique de quatre forêts sacrées et des végétations environnantes afin d’évaluer le niveau d’anthropisation des différents systèmes connectés à ces forêts. Les connaissances écologiques concernant ces groupements sont actuellement très limitées en Guinée, et ne permettent pas d’appréhender efficacement la structuration floristique des forêts sacrées ainsi que des systèmes plus ou moins anthropisés qui les entourent. Il est donc nécessaire, dans ce fort contexte de pressions anthropiques, d’estimer (i) quels types de groupements végétaux dominent ces environnements, (ii) quels sont les facteurs majeurs responsables de la répartition spatiale des groupements végétaux et (iii) quels sont les types biologiques et phytogéographiques qui caractérisent les différents groupements.
L’objectif de cette étude est donc d’analyser les caractéristiques floristiques des îlots forestiers à caractère sacré en lien avec les facteurs écologiques dans les savanes soudano-guinéennes. Il s’agit d’identifier les groupements végétaux dans un but de conservation de la biodiversité mais, surtout, de déterminer les types biologiques et chorologiques qui dominent ces différents groupements, ainsi que les facteurs écologiques responsables de leur distribution spatiale. Cette étude permettra, in fine, d’estimer le rôle des forêts sacrées dans la conservation locale de la biodiversité en haute Guinée.
2 Matériels et méthodes
2.1 Sites d’étude
Les forêts sacrées étudiées sont localisées dans les villages de Diankana, de Tintioulenkoro et de Dossori (Fig. 1), situés au niveau de la préfecture de Kankan, en haute Guinée, localisée entre 9°40’ et 10°45’N et 8°18’ et 9°45’W, dans la région naturelle de la Haute Guinée. Son climat est défini par deux saisons très marquées : une saison sèche, d’octobre à avril, et une saison pluvieuse, de mai à septembre. Les précipitations annuelles sont comprises entre 1200 mm dans le Nord de la préfecture et 1800 mm dans le Sud. La température moyenne annuelle atteint 28 °C. Selon la classification de Troupin [25], la préfecture appartient à la zone soudano-guinéenne. Les sols sont majoritairement de types ferrallitiques gravillonnaires, à l’exception des zones alluviales, qui forment des sols hydromorphes. Le réseau hydrographique est essentiellement constitué par la rivière Milo et ses affluents. La végétation est dominée par les savanes parcourues de galeries forestières. La population compte 473 359 habitants (recensement 2014), soit 17 habitants/km2, d’ethnie Malinké en majorité, tous dépendant de l’agriculture et de l’élevage pour leur subsistance.

Localisation géographique des zones d’étude en République de Guinée. Les sites de Dossori, Diankana, et Tintioulenkoro sont indiqués par une étoile verte sur la carte de haute Guinée.
2.2 Méthodes d’étude
Les inventaires phytosociologiques ont été réalisés dans les forêts sacrées (espaces protégés) et leurs environs (espaces non protégés). Les principales zones prédéfinies (Fig. 2) du centre de ces forêts vers les zones environnantes sont : (i) la zone centrale interne de la forêt (Cif), (ii) la zone centrale externe de la forêt (Cef), (iii) la zone lisière forestière (Lf) et (iv) la zone environnante (Ze). Au niveau de chacune de ces zones, les relevés ont été réalisés sur huit placettes de 400 m2 chacune, soit 32 relevés par sites et 128 dans l’ensemble. Il s’agit d’un échantillonnage stratifié, puis aléatoire. Dix variables environnementales ont été relevées : les données géomorphologiques [topographie (ou topo-séquence) et inclinaison de la pente], la texture, l’humidité, la température, le pH, le rapport carbone-azote (C/N) du sol, la lumière atteignant la surface du sol, le recouvrement ligneux et les activités humaines. Les variables non mesurées sur place sont issues d’analyses effectuées en laboratoire à partir d’échantillons de sols prélevés.
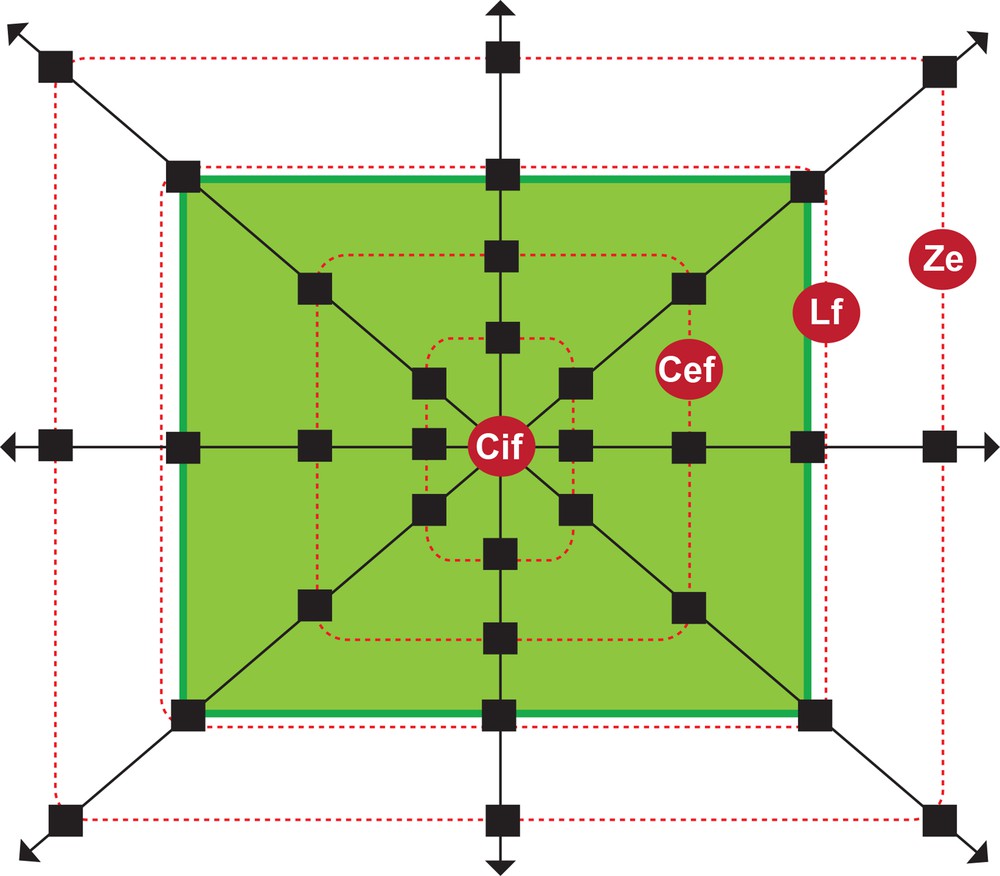
Modèle d’échantillonnage appliqué dans chaque site d’observation afin de maintenir une cohérence par rapport aux résultats obtenus (Cif : zone centrale interne de la forêt ; Cef : zone centrale externe de la forêt ; Lf : lisière forestière ; Ze : zone environnante).
Les relevés floristiques ont consisté à dresser la liste de toutes les espèces (spermaphytes et fougères) présentes dans chaque placette. Le recouvrement moyen de chaque espèce a été noté en utilisant l’échelle d’abondance-dominance de Braun-Blanquet. Les plantes non identifiées sur le terrain ont été photographiées et récoltées. Leur identification a été effectuée à l’université de Kankan, à l’herbier national de Guinée et à l’université de Lomé. Pour les problèmes de classification et de nomenclature, le système APG (APG IV, 2016) a été utilisé.
2.3 Analyse des données
La détermination de la texture du sol s’est basée initialement sur une granulométrie grossière : séparation des grosses particules (˃ 2 mm) des particules fines (˂ 2 mm) par tamisage. Le procédé de tamisage a été utilisé et la « charge gravillonnaire » (grosses particules) a été exprimée en pourcentage par rapport au poids total de l’échantillon mesuré. La fraction fine (fraction passante) a été étudiée par granulométrie laser afin d’en établir une répartition. Les différentes données ont été regroupées en trois fractions, d’après Feller et al. [26] : 20–2000 μm (sables), 2–20 μm (limons) et 0–2 μm (argiles). Le carbone organique et l’azote total ont été mesurés par « analyse élémentaire » à l’aide du Flash 2000 Thermo Fischer.
La discrimination des groupements végétaux à partir des relevés floristiques s’est basée sur les méthodes de classification ascendante hiérarchique (CAH) à partir du logiciel PAST2. La détermination des principaux facteurs de discrimination a été réalisée sur base d’analyses en composantes principales (ACP) portant sur les valeurs moyennes des variables environnementales des groupements végétaux.
L’analyse du spectre biologique des groupements s’est basée sur les types biologiques définis : mégaphanérophytes (˃ 30 m de hauteur), mésophanérophytes (8–30 m de hauteur), microphanérophytes (2–8 m de hauteur), nanophanérophytes (0,25–2 m de hauteur), chaméphytes, hémicryptophytes, géophytes et thérophytes.
L’analyse du spectre phytogéographique a été effectuée sur la base des grandes subdivisons chorologiques établies pour l’Afrique [15]. Il s’agit d’espèces cosmopolites, pantropicales, paléotropicales, afro-américaines, soudano-zambéziennes, afro-tropicales, afro-malgaches, plurirégionales africaines, guinéo-congolaises et soudaniennes.
3 Résultats
3.1 Richesse floristique
La richesse floristique a été évaluée via le nombre d’espèces identifiées. Au total, 431 espèces de plantes (herbacées comme ligneux), appartenant à 312 genres et 87 familles, ont été recensées, dont 242 espèces, 187 genres et 64 familles botaniques dans les forêts sacrées de haute Guinée. Les familles les plus représentées (en nombre d’espèces) dans ces îlots forestiers sont les Fabaceae (36 espèces), les Rubiaceae (28 espèces), les Apocynaceae (10 espèces), les Phyllanthaceae (10 espèces) et les Malvaceae (9 espèces). Dans les végétations situées aux alentours de ces forêts sacrées, les Fabaceae (55 espèces), les Poaceae (43 espèces), les Rubiaceae (21 espèces), les Malvaceae (19 espèces) et les Asteraceae (13 espèces) sont les familles dominantes.
3.2 Groupements végétaux
L’analyse de similarité met en évidence douze groupements végétaux (Fig. 3), dont cinq caractérisant les îlots forestiers (G2, G3, G4, G8 et G12) et sept se rapportant aux végétations environnant les îlots forestiers (G1, G5, G6, G7, G9, G10 et G11).
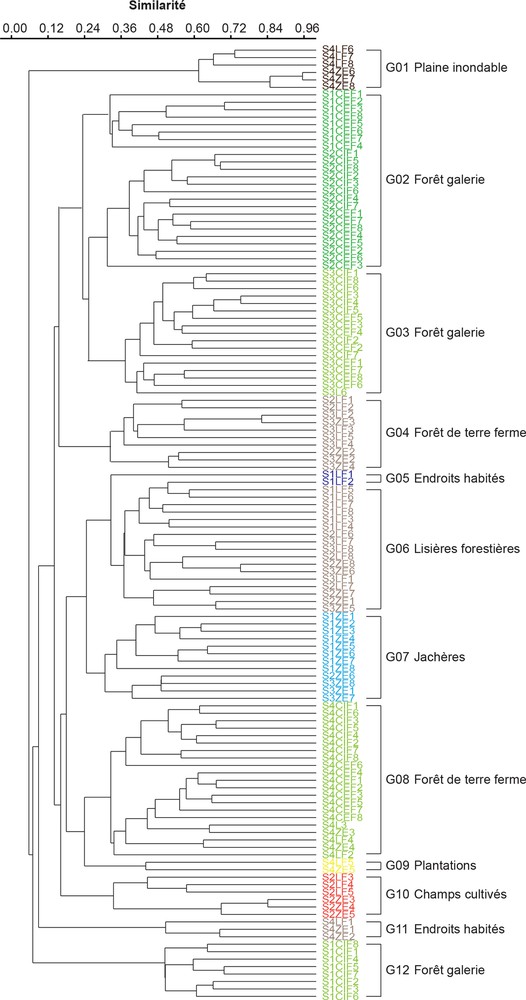
Classification ascendante hiérarchique des relevés floristiques effectués. L’origine stationnelle des groupements végétaux est indiquée sur la partie droite du document. Légende : S1CIF1-S1CIF8 : relevés de la centrale interne de la forêt du site 1 ; S1CEF1-S1CEF8 : relevés de la centrale externe de la forêt du site 1 ; S1LF1-S1LF8 : relevés des lisières forestières du site 1 ; S1ZE1-S1ZE8 : relevés des zones environnant la forêt du site 1. S2CIF1-S2CIF8 : zone centrale interne de la forêt du site 2 ; S2CEF1-S2CEF8 : zone centrale externe de la forêt du site 2 ; S2LF1-S2LF8 : lisières forestières du site 2 ; S2ZE1-S2ZE8 : zones environnant la forêt du site 2 ; S3CIF1-S3CIF8 : zone centrale interne de la forêt du site 3 ; S3CEF1-S3CEF8 : zone centrale externe de la forêt du site 3 ; S3LF1-S3LF8 : lisières forestières du site 3 ; S3ZE1-S3ZE8 : zones environnant la forêt du site 3 ; S4CIF1-S4CIF8 : zone centrale interne de la forêt du site 4 ; S4CEF1-S4CEF8 : zone centrale externe de la forêt du site 4 ; S4LF1-S4LF8 : lisières forestières du site 4 ; S4ZE1-S4ZE8 : zones environnant la forêt du site 4. Masquer
Classification ascendante hiérarchique des relevés floristiques effectués. L’origine stationnelle des groupements végétaux est indiquée sur la partie droite du document. Légende : S1CIF1-S1CIF8 : relevés de la centrale interne de la forêt du site 1 ; S1CEF1-S1CEF8 : relevés de la centrale externe de ... Lire la suite
G1 (groupement à Ambrosia maritima et Oryza sativa) est identifié dans six relevés effectués dans une plaine rizicole au voisinage d’une forêt sacrée. Les quelques espèces constantes de ce groupement sont Cynodon dachtylon, Acmella uliginosa et Centella asiatica. Les arbres représentent 15 %, les arbustes 25 %, les arbrisseaux 1 %, les lianes 8 % et les herbes 52 %.
G2 (groupement à Cola cordifolia et Dialium guineense) se développe sur les abords externe d’une forêt galerie. Il a pour espèces constantes Combretum racemosum, Saba senegalensis, Alchornea hirtella et Olyra latifolia. Les arbres représentent 27 %, les arbustes 34 %, les lianes 15 % et les herbes 24 %.
G3 (groupement à Erythrophleum suaveolens et Canarium schweinfurthii) est uniquement identifié dans les relevés effectués dans une forêt galerie. Ses espèces constantes sont Detarium senegalense, Dialium guineense, Antiaris africana et Lecaniodiscus cupanioides. Il est constitué de 29 % d’espèces d’arbres, de 38 % d’espèces d’arbustes, de 11 % de lianes et de 22 % d’herbacées.
G4 (groupement à Anthonotha crassifolia et Erythrophleum suaveolens) est également constitué par des relevés réalisés dans une forêt. Il renferme des espèces constantes comme Cola cordifolia, Detarium senegalense, Tabernaemonthana longiflora, Afzelia africana, Ochna schweinfurthiana, Clerodendron capitatum, Geophila obvallata et Cissus aralioides. Les espèces d’arbres représentent 26 %, d’arbustes 35 %, d’arbrisseaux 1 %, de lianes 11 % et d’herbes 27 %.
G5 (groupement à Mangifera indica et Sida rombifolia) correspond à une végétation rudérale à la marge des endroits habités et d’une forêt sacrée. Parmi ses espèces constantes figurent Euphorbia hirta, Triumfetta pentandra et Synedrella nodiflora. Les arbres en constituent 20 % des espèces, les arbustes 22 %, les lianes 5 % et les herbes 53 %.
G6 (à Anthonotha crassifolia et Nephrolepis bisserata). Les espèces constantes de ce groupement sont Asystasia gangetica, Aframomum sulcatum et Dioscorea preussii. Il est constitué par les relevés provenant des zones de lisières de plusieurs îlots forestiers. Les arbres représentent 24 % d’espèces, les arbustes 29 %, les arbrisseaux 2 %, les lianes 8 % et les herbes 44 %.
G7 (à Gmelina arborea et Andropogon africanus) a comme espèces constantes Detarium microcarpum, Daniellia oliveri, Hymenocardia acida, Vitellaria paradoxa et Parkia biglobosa. Il correspond aux relevés effectués dans plusieurs jachères, dont certaines sont reboisées avec les espèces introduites (Gmelina arborea et Tectona grandis). Il est composé de 20 % d’espèces d’arbres, 28 % d’arbustes, 3 % d’arbrisseaux, 5 % de lianes et 44 % d’herbes.
G8 (à Isoberlinia doka et Cola cordifolia) est essentiellement composé des relevés effectués dans une forêt sur terre ferme, à charge gravillonnaire élevée et à texture limono-argileuse. Les espèces constantes de G8 sont Combretum glutinosum, Albizia zygia, Khaya senegalensis, Ochna schweinfurthiana et Clerodendron capitatum. Les arbres sont représentés par 31 % des espèces, les arbustes 38 %, les lianes 9 % et les herbes 22 %.
G9 (à Mangifera indica et Daniellia oliveri) caractérise les plantations sur sols gravillonnaires limoneux au voisinage d’une forêt sacrée. Les espèces constantes sont Elionurus pobeguinii, Isoberlinia doka, Vitellaria paradoxa et Lantana camara. Les arbres sont constitués par 24 % des espèces, les arbustes 28 %, les arbrisseaux 1 %, les lianes 9 % et les herbes 38 %.
G10 (à Sesamum indicum et Arachis hypogea) est caractéristique des champs cultivés sur les plateaux aux sols gravillonnaires limono-sableux. Les espèces constantes du groupement sont Hymenocardia acida, Pericopsis laxiflora, Vitellaria paradoxa, Daniellia oliveri et Anacardium occidentale (espèce dont la présence dans ce groupement indique la création d’une plantation). Les arbres sont représentés par 22 % des espèces, les arbustes 18 %, les arbrisseaux 1 % et les herbes 57 % des espèces.
G11 (à Sida rhombifolia et Urena procumbens) correspond à une végétation rudérale des endroits habités, au voisinage des forêts. Les espèces constantes de ce groupement sont Hyptis suaveolens, Euphorbia hirta et Elionurus pobeguinii. Les arbres représentent 20 % des espèces, les arbustes 13 %, les lianes 8 % et les herbes 60 %.
G12 (à Carapa procera et Garcinia ovalifoli) est lié aux sols limono-argileux hydromorphes (station temporairement marécageuse) et uniquement constitué par les relevés dans l’aire centrale de la forêt galerie de Diankana. Les espèces constantes de ce groupement sont Ixora longiflora, Raphia sudanica, Napoleonaea leonensis et Cercestis afzelii. Les arbres représentent 32 % des espèces, les espèces d’arbustes 40 %, les lianes 22 % et les espèces d’herbes 5 %.
L’analyse de similarité (ANOSIM) indique une forte dissimilarité entre ces différents groupements (Rvalue = 0,89 ; Pvalue < 0,001).
3.3 Facteurs écologiques majeurs de distribution des groupements
Les axes (1 & 2) du plan discriminant (ACP, Fig. 4) expliquent 68,55 % de l’inertie totale. L’axe 1 de l’ACP isole à droite du plan les groupements G1, G5, G6, G7, G9, G10 et G11. Il s’agit des groupements constitués par des relevés effectués dans les biotopes plus ouverts ou plus anthropisés (plaine rizicole, champ cultivé des coteaux, endroits habités, plantation, jachères), situés autour des îlots forestiers. Ces groupements sont bien corrélés à la lumière, la température, la topographie (plateau), ainsi qu’aux activités humaines. Au niveau des valeurs négatives de cet axe se retrouvent les groupements forestiers G2, G3 G4, G8 et G12. Ces groupements sont corrélés avec le recouvrement ligneux et l’humidité du sol. L’axe 1 de l’ACP traduit une répartition des groupements en fonction du microclimat et l’hydromorphie du sol, liée à l’évolution géomorphologique du terrain, qui conditionne la texture et le régime hydrique du sol.

Analyse en composantes principales type biplot démontrant la relation entre les groupements végétaux et les variables environnementales.
L’axe 2 de l’ACP classe dans les valeurs positives les groupements constitués par les relevés réalisés dans les milieux à forte proportion des éléments plus fins (limon et argile). Dans les valeurs négatives figurent les groupements correspondant aux sols plus sableux. Cet axe exprime une distribution des groupements en fonction de la texture du sol. Le rapport C/N est également corrélé en bas du plan aux groupements caractéristiques des forêts, où il est relativement élevé. Cette analyse ne montre pas de corrélations significatives des groupements avec le pH du sol.
3.4 Analyse du spectre biologique des groupements végétaux
Cette analyse révèle la présence de huit types biologiques dans les différents types de végétation étudiés, avec une prédominance des microphanérophytes (19 à 58 %) selon les groupements végétaux (Fig. 5A), soit 37 % en moyenne (Fig. 6A). Les mésophanérophytes correspondent à une valeur de 15–32 % (avec une moyenne de 22 %) et les thérophytes à 1–36 % (moyenne de 17 %). Les groupements identifiés dans les formations environnantes, plus ouvertes et plus perturbées, sont, en revanche, dominés par les thérophytes, suivies des microphanérophytes et mésophanérophytes. La forte prédominance des Phanérophytes, tous types confondus, montre que même les parcelles anthropisées des savanes soudano-guinéennes présentent des conditions édaphiques favorables aux formations forestières ou boisées.
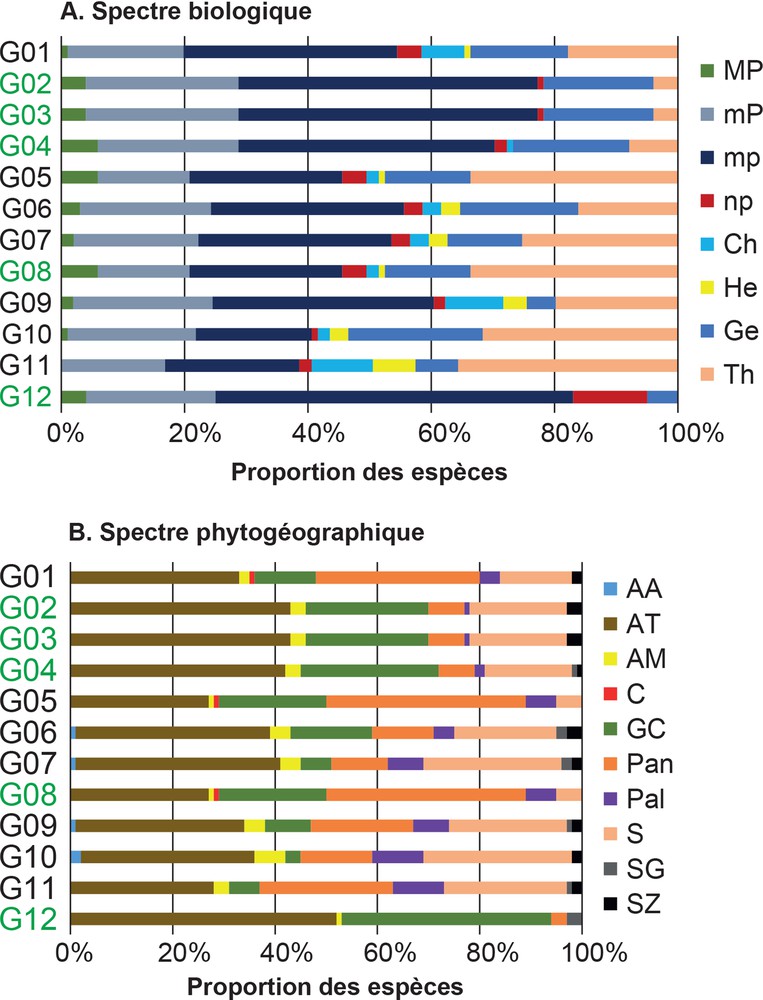
Spectres biologiques et phytogéographiques des groupements végétaux. Les G2, G3, G4, G8 et G12 sont des groupements forestiers. Le reste est constitué par les groupements identifiés dans les végétations environnantes des forêts. A : MP : mégaphanérophyte ; mP : mésophanérophyte ; mp : microphanérophyte ; np : nanophanérophyte ; Ch : chaméphyte ; He : hémicryptophyte ; Ge : géophyte ; Th : thérophyte. B : AA : afro-américaine ; AT : afro-tropicale ; AM : afro-malgache ; C : cosmopolite ; GC : guinéo-congolaise ; Pal : paléotropicale ; Pan : pantropicale ; S : soudanienne ; SG : soudano-guinéenne ; SZ : soudano-zambézienne.

Représentation graphique des proportions moyennes (%) des types biologiques (A) et phytogéographiques (B) dans la végétation de la zone soudano-guinéenne. A : MP mégaphanérophyte ; mP : mésophanérophyte ; mp : microphanérophyte ; np : nanophanérophyte ; Ch : chaméphyte ; He : hémicryptophyte ; Ge : géophyte ; Th : thérophyte. B : AA : afro-américaine ; AT : afro-tropicale ; AM : afro-malgache ; C : cosmopolite ; GC : guinéo-congolaise ; Pal : paléotropicale ; Pan : pantropicale ; S : soudanienne ; SG : soudano-guinéenne ; SZ : soudano-zambézienne.
3.5 Analyse du spectre phytogéographique des groupements végétaux
Les flores de dix domaines phytogéographiques ont été recensées dans la zone. L’analyse révèle une forte représentation des espèces afro-tropicales, qui varient entre 27 et 52 % selon les groupements végétaux (Fig. 5B), soit 37 % en moyenne pour la zone d’étude (Fig. 6B). Elles sont suivies par la flore guinéo-congolaise (3 à 41 %, soit 19 % en moyenne), plus représentée dans les îlots forestiers, principalement dans les forêts galeries (Fig. 5B). Ensuite viennent la flore soudanienne (6 à 29 %, soit 18 % en moyenne) et la flore pantropicale (3 à 39 %, soit 16 % en moyenne). Les fortes proportions de ces deux derniers types sont observées dans les écosystèmes les plus ouverts ou les plus anthropisés (secteurs habités, agricoles, jachères). Ces résultats montrent qu’en zone soudano-guinéenne, les conditions stationnelles édaphiques des forêts, notamment au niveau des forêts galeries, sont favorables à l’émergence de la flore guinéo-congolaise et constituent les derniers remparts de cette flore dans ces environnements. En revanche, l’anthropisation de cette végétation semble favoriser les espèces soudaniennes et pantropicales. Cette analyse met également en évidence la complexité de la flore située en zones de transition écologique, principalement à l’échelle régionale.
4 Discussion
4.1 Groupements végétaux des forêts galeries
Les groupements G2, G3 et G12 sont ici caractéristiques des milieux humides. Ils ont été identifiés dans les forêts couvrant les sources des petits cours d’eau à régime temporel ou saisonnier. Le site de Diankana, dont la dépression est un peu plus profonde et large, a favorisé le développement de deux groupements bien distincts, dont l’un occupe la bordure de la dépression (G2) et l’autre le noyau ou thalweg (G12). Le premier est moins hygrophile et se développe dans les parties non inondables, sur un substrat rocailleux, gravillonnaires à texture limono-sableuse. Le second, plus hygrophile, semble supporter la présence d’un marécage temporaire, sur un substrat boueux en surface, à texture limono-argileuse. La dépression de la galerie de « Kolonbatou » n’est pas assez large et profonde pour créer deux biotopes significativement différents. Cette galerie, dont les caractéristiques écologiques et floristiques sont assez homogènes sur toute son étendue, correspond à un seul groupement.
L’ensemble de ces groupements semblent définis par les conditions édaphiques (texture et hydromorphie) et la géomorphologie locale. Le type de galerie semble aussi expliquer l’individualisation plus ou moins nette des groupements. Les espèces qui les caractérisent sont en majorité forestières et plus ou moins hygrophiles. Elles sont aussi présentes dans les formations similaires dans d’autres régions de la Guinée [27]. En domaines soudano-guinéen et soudanien de la Côte d’Ivoire [28–30], au Sénégal [31], au Burkina Faso [32] et au Benin [33], certaines de ces espèces sont également considérées comme caractéristiques des galeries forestières ou forêts ripicoles. Toutefois, la plupart de ces études ne précisent pas la distribution spatiale de ces espèces selon leur exigence écologique au sein de ces formations édaphiques.
4.2 Groupements végétaux des forêts sur « terre ferme »
Les groupements G4 et G8 correspondent aux forêts sacrées de plateau supportées par des sols profonds et gravillonnaires en surface. Parmi les principales espèces de ces groupements se retrouvent Anthonotha crassifolia (G4) et Isoberlinia doka (G8). Ces espèces font partie de la flore commune des forêts claires de la Haute Guinée [27]. Elles sont répandues sur l’ensemble des savanes guinéennes et soudaniennes. Au Togo, Dourma et al. [34] ont identifié neuf groupements à Isoberlinia dans les forêts claires sur sols ferrugineux plus ou moins profonds.
À la faveur d’une protection relativement longue contre les défrichements, les feux et l’exploitation des arbres, l’évolution des conditions microclimatiques forestières a entraîné la disparition des herbacées héliophiles et a favorisé l’installation d’un sous-bois. Ce dernier comprend certaines espèces fréquentes, telles que Sorindeia juglandifolia, Anchomanes difformis, Ochna schweinfurthiana et Clerodendron capitatum. Cette flore révèle des affinités avec certains îlots de forêts denses sèches ou semi-décidues de plateau décrits dans la même zone phytogéographique en Côte d’Ivoire [29,30,35].
4.3 Groupements des végétations environnantes des forêts sacrées
Ces groupements correspondent aux milieux plus anthropisés (les secteurs habités et agricoles). Les défrichements-brûlis, les feux, le pâturage, le reboisement des zones dégradées par les espèces introduites ou le choix d’espèces à conserver pour une utilité quelconque ont façonné la végétation et la flore de ces zones d’exploitation autour des forêts sacrées. En effet, le caractère répétitif et durable de ces activités, longtemps remarquées dans la région, impacte significativement les couvertures végétales et pédologiques naturelles [17,36,37]. Encore aujourd’hui, le phénomène se poursuit et les zones proches des habitations humaines sont toujours les plus affectées. Baldé [38] a remarqué dans les alentours des villages de Kankan, dont Tintioulenkoro, une fréquence de plantations d’arbres fruitiers et des cultures saisonnières de plateau moins exigeantes sur des sols qu’il a qualifiés « d’épuisés », avec une pression importante des petits ruminants. Sesamum indicum et Archis hypogea, deux cultures connues pour ce caractère en zone de savanes [39], dominent les champs cultivés en périphérie de la forêt « Kolonbatou » de Tintioulenkoro.
Les espèces caractéristiques de ces groupements sont, en général, cultivées, rudérales, ubiquistes ou conservées par les paysans pour leur utilité. Parmi ces dernières figurent Vitellaria paradoxa et Parkia biglobosa. Leur conservation dans les agrosystèmes ou dans les jachères en haute Guinée a été observée par Diallo [19] et Baldé [38]. Il en est de même dans toutes les savanes guinéennes et soudaniennes ouest-africaines [40–42]. Les espèces rudérales caractéristiques sont pantropicales et sont parmi les plus communes des villes et villages de Guinée [27]. L’analyse de similarité entre ces groupements révèle que l’anthropisation a créé une différence significative entre les parcelles protégées (îlots forestiers) et les parcelles perturbées (espaces périphériques).
4.4 Spectres biologique et phytogéographique des groupements
L’analyse du spectre biologique des groupements végétaux révèle, dans l’ensemble, une forte prédominance des Phanérophytes au sens large et plus particulièrement des microphanérophytes et mésophanérophytes. Ces résultats sont semblables à ceux obtenus par Rakotozafy et al. [43] dans une formation forestière à l’ouest de Madagascar, et à ceux d’Ali et al. [42] et d’Ahouandjinou et al. [44] en zone soudano-guinéenne au Bénin. Pour les îlots forestiers étudiés dans le Sud du Togo par Kokou et Caballé [10], les microphanérophytes, sont suivies des nanophanérophytes. La forte proportion des thérophytes est observée dans les systèmes plus ouverts. Ces formations sont les plus ouvertes et les plus dégradées par l’anthropisation.
Les résultats de l’analyse phytogéographique de la flore des différents groupements végétaux révèlent une forte proportion d’espèces afro-tropicales, guinéo-congolaises, soudaniennes et pantropicales. Les fortes proportions d’espèces guinéo-congolaises sont observées dans les forêts galeries (35 % en moyenne). Elles sont relativement moins représentées dans les forêts de terre ferme (24 % en moyenne) et très peu retrouvées dans les milieux plus ouverts ou plus anthropisés, où leur proportion en moyenne est de 10 %. Les espèces pantropicales et les espèces soudaniennes ont, en revanche, des fortes proportions dans ces milieux plus ouverts. Ces résultats sont comparables à ceux de Kokou et al. [8] et d’Ali et al. [42], qui ont été respectivement obtenus dans le Sud du Togo et au Benin. Les plus fortes proportions des espèces à affinité guinéo-congolaise sont situées dans les groupements forestiers, contrairement aux formations périphériques dégradées. Par ailleurs, ces résultats sont différents de ceux d’Ali et al. [45], obtenus dans les végétations naturelles en zone de Sahel au Niger où les espèces paléotropicales, pantropicales et soudano-zambéziennes dominent. En zone de savanes soudano-guinéennes, la présence d’espèces à affinité guinéenne pourrait s’expliquer par l’humidité édaphique relativement forte [28,30,46]. Ces espèces profitent de l’humidité édaphique locale qui mime les effets liés à la forte pluviométrie de la région guinéo-congolaise, où ces espèces atteignent leur distribution maximale [33].
L’importante proportion des espèces soudaniennes et guinéo-congolaises, après les espèces afro-tropicales, témoigne du fait que les végétations étudiées se situent dans la zone de transition soudano-guinéenne.
5 Conclusions
À l’échelle de la zone couvrant les sites d’observation, les variations climatiques ne pourraient pas être considérées comme étant le facteur principal de discrimination des groupements végétaux. Les résultats de cette étude montrent principalement que les conditions édaphiques (la texture et le régime hydrique du sol), la géomorphologie locale et l’intervention humaine influencent la distribution spatiale des groupements végétaux. L’étude met également en évidence la forte diversité écologique et floristique de ces îlots forestiers, témoins de la biodiversité guinéenne. Une forte proportion d’espèces guinéo-congolaises a été observée dans ces groupements forestiers, alors que la flore soudanienne et les espèces pantropicales émergent dans les milieux plus ouverts, soulignant que le fait que l’anthropisation joue un rôle de plus en plus prépondérant dans la dynamique des écosystèmes situés en périphérie de ces forêts. Une protection accrue ferait de ces îlots forestiers des niches écologiques pour de nombreuses espèces végétales et animales à affinité forestière, la richesse floristique de ces forêts faisant état, a priori, de 242 espèces, 187 genres et 64 familles.
Remerciements
Les auteurs tiennent à remercier l’ambassade de France en Guinée ainsi que Campus France. Cette étude a été financée en partie par l’Institut universitaire de France ainsi que par l’université Paul-Sabatier–Toulouse-3. Les auteurs tiennent également à vivement remercier les populations des villages de haute Guinée qui ont accepté que soit menée cette étude de leurs forêts sacrées.


