1 Introduction
Les végétaux se démarquent de la plupart des êtres vivants par leur capacité à synthétiser un très large assortiment d’éléments organiques diversifiés, dont une vaste majorité ne semble pas participer directement à leur croissance ou à leur développement. Tandis que les molécules produites par l’ensemble des espèces végétales et directement impliquées dans la nutrition et les processus physiologiques fondamentaux intrinsèques à un organisme donné sont qualifiés de métabolites primaires (e.g., glucides, lipides, acides aminés, acides nucléiques), plusieurs dizaines de milliers de composés organiques n’interviennent pas dans les mécanismes vitaux du développement végétal, mais jouent un rôle majeur, notamment en ce qui concerne les interactions entre les plantes et leur environnement, qu’elles soient de nature biotique ou abiotique [1–3]. Ces molécules organiques, dont les fonctions restent encore à préciser dans de nombreux cas, forment l’ensemble hétérogène des métabolites secondaires et appartiennent à des groupes chimiques variés inégalement présents et abondants, tant à l’échelle des différents taxons qui constituent le monde végétal qu’à celle des tissus qui composent chaque individu [3–5]. Les composés phénoliques, les terpénoïdes et les composés azotés forment les trois classes de métabolites secondaires prépondérantes [6].
La plupart des composés azotés appartiennent au vaste ensemble des alcaloïdes avec plus de 21 000 molécules identifiées [3], mais il existe d’autres groupes de métabolites secondaires azotés, qui se distinguent par leur structure moléculaire et leur mode d’action, car ce sont les produits de leur hydrolyse qui vont intervenir directement dans les mécanismes d’interaction entre les végétaux et leur environnement [6]. Parmi ceux-ci, les glucosinolates forment un groupe relativement restreint de molécules thiosaccharidiques soufrées et jouent un rôle essentiel dans les stratégies de défense contre les ravageurs des plantes de l’ordre des Brassicales, qui comprennent une partie notable des légumes dédiés à la consommation humaine [7].
2 Les glucosinolates
Ces métabolites secondaires sont dérivés de huit acides aminés différents et invariablement constitués de trois entités structurelles distinctes : un résidu β-d-glucopyranosyle, un groupement thiohydroximate-O-sulfate en position anomérique et une chaîne latérale aglycone relativement hydrophobe dénommée groupement R (Fig. 1). Ce dernier constitue le principal variant structural des glucosinolates, qui sont divisés en trois catégories selon la nature des acides aminés précurseurs du groupement R : les glucosinolates aliphatiques, dérivés en grande partie de la méthionine (Met), mais aussi de l’alanine (Ala), l’isoleucine (Ile), la leucine (Leu) et la valine (Val), les glucosinolates benzéniques dérivés de la phénylalanine (Phe) et de la tyrosine (Tyr) et les glucosinolates indoliques dérivés du tryptophane (Trp) [8–10]. De très rares variations ont aussi été observées au niveau des deux autres entités constitutives des glucosinolates, et ce sont ainsi plus de 130 différentes structures moléculaires qui ont été identifiées au total [11]. Néanmoins, seule une partie d’entre elles est présente chez une espèce donnée, la plupart des taxons en synthétisant un nombre limité [11–14].
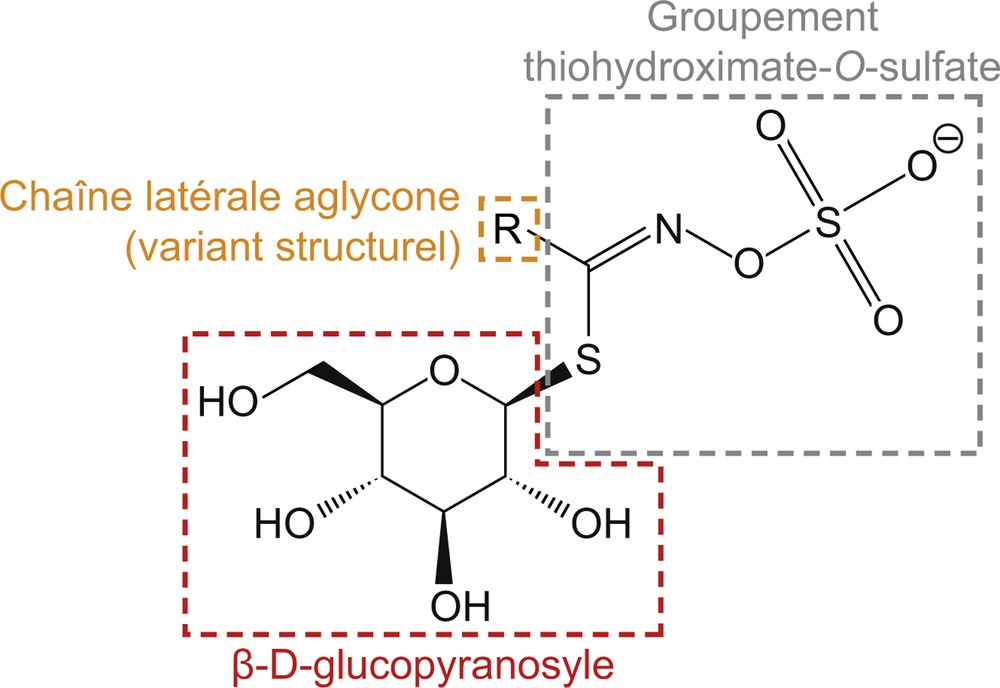
Structure générale des glucosinolates. Ces molécules sont invariablement composées des trois entités structurelles représentées et le principal variant structural de ces molécules est constitué par la chaîne latérale aglycone R, qui dérive d’un acide aminé.
2.1 Importance écologique et économique
Depuis qu’Hippocrate (460–356 av. J.-C.) a décrit les effets favorables du cresson (Nasturtium officinale W.T. Aiton) sur la santé humaine, les propriétés bénéfiques des glucosinolates contenus dans les Brassicaceae ont de tous temps été reconnues [7]. Ces composés soufrés, appelés autrefois glycosides d’huile de moutarde, sont à l’origine des arômes et saveurs caractéristiques plus ou moins âcres des choux, radis, raifort et nombreux autres légumes et condiments de cette famille qui entrent dans notre alimentation [8]. La sinalbine, premier composé identifié de ce groupe de métabolites secondaires, n’a toutefois été isolée et caractérisée à partir de semences de moutarde (Sinapis alba L.) qu’au début du XIXe siècle, dans le but de comprendre l’origine chimique de la saveur piquante caractéristique de ces graines [7,15]. Mais avant d’être utile à l’homme, ces molécules constituent une part essentielle d’un arsenal de défense que les Brassicales ont développé au cours de leur histoire évolutive dans le cadre d’une course aux armements que se livrent ces végétaux et les facteurs biotiques de leur environnement. Le rôle écologique majeur des glucosinolates est ainsi de défendre ces plantes contre les herbivores et les agents pathogènes à travers leurs produits de dégradation. Ceux-ci peuvent en effet non seulement jouer un rôle de défense en cas d’attaques de champignons pathogènes [16,17] ou d’infection bactérienne [18], mais ils ont aussi un effet toxique ou dissuasif pour une vaste gamme d’herbivores qui inclut non seulement des insectes, des oiseaux et des mammifères, mais aussi des mollusques, des invertébrés aquatiques ou des nématodes [19]. Comme c’est le cas avec d’autres classes de molécules de défense, les glucosinolates ne sont pas efficaces contre tous les herbivores et peuvent même jouer un rôle d’attraction pour certains insectes spécialisés dans la consommation des Brassicales [17,20–22]. Ceux-ci, tout comme quelques insectes généralistes, ont développé au cours de l’évolution différentes stratégies pour bloquer la formation des produits de dégradation toxiques des glucosinolates synthétisés par les plantes ou induire la formation de molécules moins toxiques [19,23–25]. C’est le cas, par exemple, de nombreux lépidoptères appartenant notamment aux sous-familles des Pierinae et des Plutellinae et dont l’alimentation est basée sur des espèces de Brassicales qui synthétisent des glucosinolates indoliques utilisés aussi par ces insectes dans la reconnaissance de leur hôte et la détermination des lieux de ponte [6,22,25]. La compréhension des mécanismes complexes de défense basés sur la synthèse et la modification des glucosinolates et développés par les Brassicales au cours de leur histoire évolutive contre les pathogènes et ravageurs, mais aussi des adaptations qui ont pu se mettre en place chez ces derniers pour contourner ces obstacles, revêt une importance toute particulière d’un point de vue économique. La famille des Brassicaceae constitue en effet un vivier de ressources alimentaires, industrielles et médicales qui la place au deuxième rang des familles végétales sur le plan agronomique et économique, juste derrière les Poaceae [26]. La découverte des propriétés thérapeutiques de certains produits de dégradation des glucosinolates dans le cadre de la prévention contre le cancer et les maladies cardiovasculaires [25,27], ainsi que la présence de ces molécules chez la plante modèle Arabidospsis thaliana (L.) Heynh., viennent enrichir les enjeux médicaux et scientifiques qui sont liés à la compréhension des mécanismes de synthèse et de modification de ces molécules parmi les plantes de cette famille.
2.2 Origine évolutive et distribution taxonomique
La synthèse de glucosinolates constitue probablement une synapomorphie pour les Brassicales [28–30]. Cet ordre, avec plus de 5000 espèces réparties dans 18 familles, représente environ 2,2 % de la diversité des Eudicotylédones, la famille des Brassicaceae regroupant à elle seule environ 80 % de cette richesse spécifique [29,31]. En dépit d’une diversité spécifique et morphologique impressionnante, la présence de glucosinolates a été détectée chez quasiment toutes les familles de Brassicales qui regroupent la plupart des espèces végétales où se rencontrent ces molécules [30,32]. En effet, la présence en dehors de cet ordre de glycosides soufrés n’est attestée que pour le genre Drypetes Vahl (env. 200 spp.) qui inclut la majeure partie des espèces de Putranjivaceae (Malpighiales) [29] et plusieurs études ont montré que les glucosinolates auraient évolué dans cette famille phylogénétiquement éloignée des Brassicales de manière indépendante [25,33]. En outre, la diversification des glucosinolates au sein de l’ordre des Brassicales présente des caractéristiques essentielles propres à ce groupe taxonomique, car plusieurs modifications majeures se sont produites au cours de l’évolution (Fig. 2). Les analyses phylogénétiques menées au cours des dernières années ont ainsi montré qu’à l’origine, les glucosinolates auraient été synthétisés exclusivement à partir de la phénylalanine et des acides aminés aliphatiques à chaîne latérale ramifiée (Leu, Ile, Val), une caractéristique que l’on semble retrouver actuellement chez les membres des familles basales de Brassicales [30]. Les glucosinolates indoliques et les glucosinolates dérivés de la méthionine, tous deux spécifiques de certaines familles de Brassicales, seraient apparus plus tardivement, et ces innovations auraient conduit les Brassicaceae à abriter la plus importante diversité de glucosinolates observée chez les végétaux [32]. Plusieurs auteurs ont suggéré que des événements de polyploïdisation accompagnés de duplication de gènes en tandem et suivis de processus de néofonctionalisation des gènes dupliqués auraient pu jouer un rôle fondamental dans l’apparition et la diversification exceptionnelle de ces nouvelles molécules chez les Brassicales [30,34,35]. Trois étapes-clés auraient ainsi été identifiées au cours de l’histoire évolutive de ce groupe de végétaux (Fig. 2). Un premier événement de duplication complète du génome (At-β) se serait produit entre 85 et 92,2 millions d’années (Crétacé supérieur), avant l’apparition des Limnanthaceae, et aurait conduit, notamment, à l’émergence et à la diversification de nouvelles voies de synthèse de glucosinolates à partir du tryptophane après que cette famille a divergé [30]. Aucun changement significatif du taux net de diversification n’a cependant été mis en évidence à l’origine de ces glucosinolates indoliques, mais il est plausible que cela soit dû à l’ancienneté de cet événement, qui se situe avant la phase d’extinction de masse du Crétacé [35]. Il faut toutefois noter que la synthèse de glucosinolates indoliques a aussi été détectée parmi des membres de trois familles basales des Brassicales (i.e. Akaniaceae, Tropaeolaceae, Caricaceae) et que ces observations pourraient remettre en cause le scénario évolutif de l’apparition des glucosinolates indoliques tel qu’il a été récemment proposé au sein des Brassicales [36–39]. Les glucosinolates dérivés de la méthionine seraient apparus plus tardivement (Paléocène ou Éocène inférieur) à la base du clade formé par les trois familles qui abritent la plupart des espèces de Brassicales (i.e. Brassicaceae, Capparaceae, Cleomaceae), et le développement de ces nouvelles voies métaboliques se serait assorti de duplications de gènes en tandem et se serait produit de manière concomitante à une augmentation significative du taux net de diversification au sein des lignées résultantes [35,40]. Un second événement majeur de polyploïdisation (At-α), suivi lui aussi de duplications de gènes en tandem, a eu lieu beaucoup plus récemment (Éocène supérieur ou Oligocène) au sein des Brassicaceae et aurait conduit à l’apparition de nouvelles voies de synthèse et à l’élaboration de nouvelles structures de glucosinolates [30,34,40]. De surcroît, une augmentation significative du taux net de diversification aurait été observée lors de cette dernière étape clef [40].
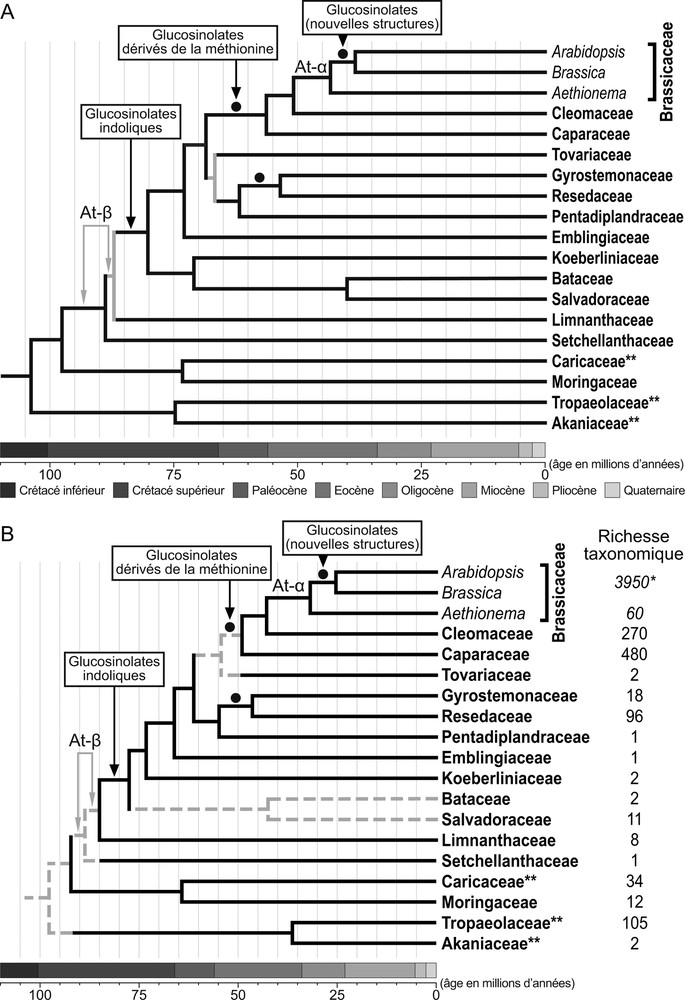
Évolution des glucosinolates au sein des Brassicales. Les chronogrammes A et B représentant les relations phylogénétiques entre les 17 familles de Brassicales ainsi que les échelles temporelles indiquées au bas de chaque topologie ont été établis à partir de [40] et [30], respectivement. Le chronogramme A est basé sur une matrice combinée [40] de trois régions chloroplastiques (ndhF, matK, rbcL) et deux séquences mitochondriales (matR, rps3), tandis que B a été estimé à partir des séquences de 72 gènes appartenant au génome chloroplastique [30]. Les positions respectives de l’apparition des différents types de glucosinolates représentés, des événements de duplication de l’ensemble du génome At-α et At-β, avec deux positions possibles pour ce dernier, ainsi que des trois principaux changements du taux net de diversification observés au cours de l’évolution des Brassicales (cercle noir), ont été établis à partir de [30,34,35,40] et sont indiquées sur chacune des topologies. Dans le chronogramme A, les relations phylogénétiques non supportées selon [40] sont représentées de couleur grise. Les relations représentées par des pointillés de couleur grise dans le chronogramme B représentent les nœuds dont la calibration temporelle n’a pas été réalisée par [30]. La richesse taxonomique en nombre d’espèce des différentes familles de Brassicales suivant [29] est indiquée à droite du chronogramme B. * : nombre d’espèces pour la famille des Brassicaceae sans le genre Aethionema. ** : familles basales de Brassicales pour lesquelles la présence de glucosinolates indoliques a été détectée [36–39]. Masquer
Évolution des glucosinolates au sein des Brassicales. Les chronogrammes A et B représentant les relations phylogénétiques entre les 17 familles de Brassicales ainsi que les échelles temporelles indiquées au bas de chaque topologie ont été établis à partir de [40] ... Lire la suite
2.3 Biosynthèse
Chez les Brassicales, la biosynthèse des glucosinolates dérive probablement de celle des glucosides cyanogéniques, qui forment une classe de métabolites secondaires mobilisés dans différents mécanismes de défense et très répandue chez les végétaux [14,41]. Les voies métaboliques qui conduisent à la synthèse des structures de base de ces deux groupes de molécules partagent en effet les mêmes acides aminés précurseurs et les enzymes à cytochrome P450 impliqués dans les toutes premières étapes de formation de la structure de base des molécules issues de chacune de ces voies métaboliques proviennent des mêmes familles de gènes [25]. La biosynthèse des glucosinolates a été tout particulièrement étudiée chez Arabidopsis thaliana, modèle choisi dans les années 1990 pour mieux comprendre la génétique et le fonctionnement biologique des Angiospermes. La quarantaine de glucosinolates (GLs) identifiés chez A. thaliana sont synthétisés à partir de trois acides aminés précurseurs [42–44]. La méthionine (GLs aliphatiques) et le tryptophane (GLs indoliques) sont à la base de la grande majorité des glucosinolates rencontrés chez cette espèce, alors que la phénylalanine (GLs benzéniques) n’est à l’origine que de quelques-unes de ces molécules [14]. L’étude de leurs voies de synthèse a permis de déterminer l’existence de trois étapes principales communes à la plupart des GLs connues chez les Brassicales (Fig. 3), la première étape étant spécifique des GLs issus de la méthionine ou de la phénylalanine [8,9,25,45,46]. Cette phase initiale, constituée de cinq modifications enzymatiques, commence dans le cytosol par une désamination réalisée par une aminotransférase (branched-chain aminotransférase [BCAT]) et conduisant à la formation d’un α-cétoacide qui pénètre ensuite dans le chloroplaste via une protéine de transport (bile acid transporter [BAT]) pour entrer dans un cycle de trois transformations successives : condensation avec un acétyl-CoA par l’intermédiaire d’une synthase méthyle thioalkylmalate (MAM), isomérisation par une isomérase isopropylmalate (IPMI) suivie d’une décarboxylation oxydative grâce à une déshydrogénase isopropylmalate (IPMDH) aboutissant à la synthèse d’un α-cétoacide prolongé d’un seul groupe méthylène. Cet homocétoacide peut alors être à nouveau transféré dans le cytosol par la même protéine de transport et subir une transamination par le biais de BCAT avant d’entrer dans la seconde étape de synthèse commune à tous les GLs ou, dans le cas particulier de la méthionine, suivre un à cinq nouveaux cycles d’élongation dans le chloroplaste avant d’être transporté dans le cytosol [46,47]. La seconde phase de biosynthèse des GLs (Fig. 3) se déroule de manière identique quel que soit l’acide aminé précurseur et se subdivise selon sept modifications enzymatiques successives qui aboutissent à la formation de la structure de base des glucosinolates [9,46]. Les deux premières transformations se déroulent au niveau de la membrane du réticulum endoplasmique et font intervenir des enzymes à cytochrome P450 codés par les gènes de deux familles différentes, CYP79 et CYP83 [25,48]. Deux N-hydroxylations des précurseurs, suivies de réactions de décarboxylation et de déshydratation conduisant à la formation d’aldoximes, sont catalysées par des enzymes de la famille des CYP79s [49–51]. Les aldoximes sont ensuite transformés par des enzymes de la famille des CYP83s en composés actifs (oxydes de nitrile ou acides nitroniques) [25,52]. Les modifications ultérieures de ces composés actifs prennent place dans le cytosol, où ils sont tout d’abord conjugués avec du glutathion, un donneur de soufre tripeptidique contenant une cystéine [46]. Les produits de cette réaction, qui pourrait être catalysée par des glutathion S-transférases (GSTs), sont ensuite clivés par des γ-glutamate peptidases (GGPs) pour former des S-alkyl-thiohydroximates, ceux-ci étant ensuite convertis en thiohydroximates sous l’action d’enzymes de clivage (C-S lyases). L’intégration du glucose constitue la dernière partie de l’étape de biosynthèse de la structure de base des glucosinolates. La S-glycosylation des thiohydroximates est catalysée par des glucosyltransférases (UGTs) et aboutit à la formation de désulfoglucosinolates, qui sont finalement sulfatés par des sulfotransférases (SOTs), conduisant à l’obtention de la structure de base des glucosinolates [9,13,46,48]. La troisième et dernière étape de biosynthèse de ces composés peut alors commencée et est constituée d’une large gamme de modifications secondaires de la chaîne latérale R, ces différents types de transformations étant à l’origine de la majeure partie de la diversité des structures observées au sein des glucosinolates [9,13,43]. Tandis que les chaînes latérales des glucosinolates aliphatiques peuvent faire l’objet de modifications secondaires variées (i.e. oxygénations, hydroxylations, alcénylations, benzoylations), les transformations qui affectent les glucosinolates indoliques sont en nombre plus réduits (hydroxylations et méthoxylations), et seules des réactions d’hydroxylation ont été observées lors de cette étape parmi les glucosinolates benzéniques [9,43,53,54].
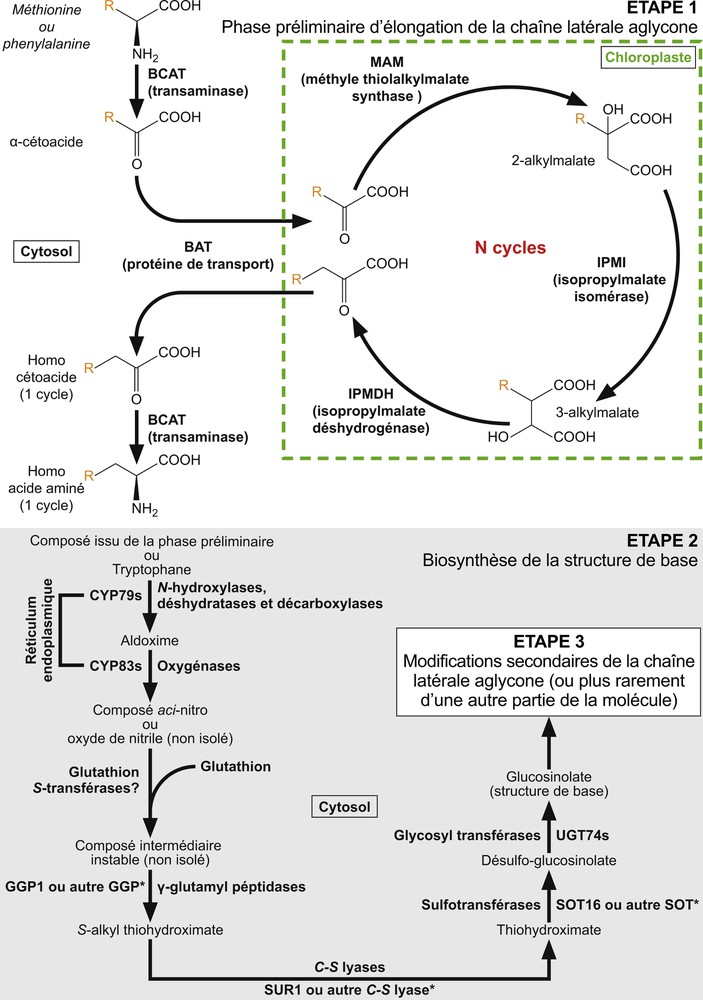
Biosynthèse des glucosinolates chez Arabidopsis thaliana. Étape 1: phase préliminaire d’élongation de la chaîne latérale aglycone (voie de biosynthèse des glucosinolates aliphatiques et benzéniques) qui se déroule principalement dans le chloroplaste, à l’exception des réactions de transamination catalysées par l’enzyme cytosolique BCAT ; un seul cycle d’élongation a été observé pour la phénylalanine, le nombre de cycles N varie de 1 à 6 pour la méthionine. Étape 2: biosynthèse de la structure de base des glucosinolates, commune à l’ensemble des composés aliphatiques et benzéniques issus de l’étape 1 et au tryptophane. R : chaîne latérale aglycone. * : enzyme spécifique non identifiée dans le cas de la biosynthèse des glucosinolates aliphatiques. Figure réalisée suivant [8,9,25,45,46]. Masquer
Biosynthèse des glucosinolates chez Arabidopsis thaliana. Étape 1: phase préliminaire d’élongation de la chaîne latérale aglycone (voie de biosynthèse des glucosinolates aliphatiques et benzéniques) qui se déroule principalement dans le chloroplaste, à l’exception des réactions de transamination catalysées par ... Lire la suite
2.4 Répartition spatio-temporelle et mode d’action
Les glucosinolates constituent des barrières chimiques constitutives rencontrées chez la plupart des Brassicales. Ces métabolites secondaires sont synthétisés continuellement, même en l’absence d’agents pathogènes, et font ainsi partie d’un ensemble de molécules de défense préformées appelées phytoanticipines [54,55]. Néanmoins, certains groupes de GLs, comme ceux dérivés du tryptophane, peuvent en outre se comporter comme des phytoalexines, la synthèse de ces composés étant aussi stimulée lorsque les tissus végétaux sont endommagés [54,56,57]. Il s’agit donc essentiellement de précurseurs qui montrent par eux-mêmes une activité biologique très limitée mais qui, à la suite de l’intervention de facteurs biotiques, sont modifiés pour être activés dans le cadre d’une stratégie de défense induite [44]. Cette stratégie s’appuie sur deux composantes indispensables : des précurseurs inactifs accumulés préalablement et des mécaniques enzymatiques qui peuvent être différentes suivant le type d’organisme pathogène et qui vont déclencher la transformation de ces précurseurs en composés bioactifs du système de défense [55,58]. Pour que cette combinaison soit efficace, il est indispensable que la synthèse, le transport et le stockage des deux ensembles de molécules soient étroitement régulés dans l’espace et le temps avec un haut degré de spécificité afin que les défenses chimiques puissent être mobilisées à l’endroit et au moment opportuns [59]. Les nombreuses expérimentations menées principalement chez Arabidospsis thaliana, mais aussi chez d’autres espèces de Brassicaceae [60], montrent en effet que l’accumulation de GLs dans les différents organes est soumise à une étroite régulation spatiotemporelle [13,59,60] et que la synthèse de ces molécules est spatialement distincte de leur stockage, ce phénomène faisant intervenir non seulement des transports intra- et intercellulaires à courte distance, mais aussi à longue distance à travers le xylème et le phloème [61,62]. Chez les plantes d’Arabidopsis non affectées par des agents pathogènes, les glucosinolates sont stockés à l’intérieur des vacuoles de cellules spécialisées qui ne synthétisent pas ces molécules et sont appelées cellules S en raison de leur contenu élevé en soufre [63,64]. Celles-ci sont localisées entre le phloème et l’endoderme, en périphérie des vaisseaux, ainsi que le long de la bordure foliaire [44,65]. En dehors de la rosette et de l’inflorescence, d’autres sites de stockage ont été détectés, notamment au sein des semences où il n’y a pas de biosynthèse de glucosinolates [66]. Tandis que la concentration en GLs contenus dans la rosette diminue drastiquement au cours de la maturation des plantes, les plus hauts niveaux de concentration sont observés dans les graines chez les individus matures, suivies des inflorescences et des siliques. Ces constatations suggèrent, en outre, que les principales sources de GLs accumulés dans les graines pourraient être la rosette de feuilles et les siliques [59,60]. La biosynthèse de glucosinolates aliphatiques et indoliques peut aussi avoir lieu dans le système racinaire, celui-ci présentant les plus hauts niveaux de GLs dérivés du tryptophane [61]. Tandis que la rosette foliaire constitue l’organe source et le site de stockage majeurs des GLs aliphatiques à courte chaîne latérale (3 à 5 groupes méthylène), ceux qui possèdent une longue chaîne latérale (6 à 8 groupes méthylène) sont synthétisés à la fois dans la rosette et le système racinaire, celui-ci constituant le site de stockage majeur de ce groupe de glucosinolates [61,67,68].
La transformation par hydrolyse des glucosinolates accumulés en molécules bioactives se produit dans un organe donné lorsque celui-ci est endommagé par l’intervention d’un facteur biotique de l’environnement (e.g., organismes pathogènes ou insectes ravageurs). Cette réaction, communément appelée « bombe de l’huile de moutarde » [69], est catalysée par des enzymes de la famille des β-thioglucoside glucohydrolases appelées myrosinases et nécessite typiquement une rupture, non seulement des tissus, mais aussi de la compartimentalisation cellulaire pour que substrats et enzymes entrent en contact [70,71]. Les myrosinases, protéines homodimériques composées de deux sous-unités dont la chaîne protéique est glycosylée, sont classiquement stockées dans les vacuoles d’idioblastes spécifiques appelés cellules à myrosine, celles-ci étant distribuées à proximité des faisceaux vasculaires dans les parties aériennes, mais aussi au niveau du cortex dans les racines et de l’embryon dans les graines [72–75]. En dehors de ces cellules spécialisées, leur accumulation a aussi été détectée dans les cellules de garde des stomates [71,75,76], mais à côté de ce modèle classique où le stockage des deux composantes du système a lieu dans des cellules différentes, des travaux récents ont mis en évidence l’existence de deux systèmes myrosinase/glucosinolate atypiques chez A. thaliana [58,77]. Chacun de ces systèmes reposerait sur un type de myrosinases particulières (PEN2 et PYK10, respectivement), qui ne contiennent pas la glutamine caractéristique des myrosinases classiques, celle-ci étant remplacée par un acide glutamique, mais qui conservent la capacité de rompre la liaison soufre–glucose de glucosinolates dérivés du tryptophane [78]. Les enzymes de type PEN2, accumulées dans les peroxysomes de cellules de l’épiderme foliaire, interviendraient dans le cadre d’une stratégie de défense contre certains agents fongiques, et l’activation de ce système enzymatique aurait lieu dans des cellules intactes, impliquant le transport de ces molécules jusqu’au site de l’infection [58,79]. Les myrosinases de type PYK10 seraient, quant à elles, stockées au niveau des corps du réticulum endoplasmique de cellules du système racinaire, ces petites structures dérivées du réticulum endoplasmique étant apparemment spécifiques d’une lignée monophylétique de Brassicales composée des trois familles les plus diversifiées de cet ordre (Brassicaceae, Caparaceae, Cleomaceae) [77,80]. Il a été en outre montré que, dans le cas d’Arabidopsis, les cellules où ces myrosinases atypiques ont été détectées ont aussi la capacité de stocker des GLs indoliques dans un compartiment cellulaire différent, préservant ainsi la disjonction dans l’espace des deux composantes du système en l’absence de l’intervention d’organismes pathogènes [80,81]. Tout comme pour les glucosinolates, les nombreuses études menées à ce jour indiquent donc que de nombreuses formes différentes de myrosinases coexistent au sein de la même plante [73,80], mais aussi que la répartition et le mode d’action de ces myrosinases au sein d’une plante donnée dépend de l’espèce, du tissu et du stade de développement considérés [70,75]. La rupture de la compartimentalisation, qu’elle soit d’ordre tissulaire ou cellulaire, est nécessaire dans la plupart des cas pour activer le système myrosinase/glucosinolate et conduit à la modification des glucosinolates en composés de défense bioactifs, l’activation de ce système pouvant néanmoins se produire dans des tissus non endommagés dans le cadre de stratégies de défense atypiques [79]. La myrosinase catalyse l’hydrolyse de la liaison thioglucosidique des GLs, pour libérer un d-glucose et un intermédiaire instable, le thiohydroximate-O-sulfate (Fig. 4). Cet aglycone est ensuite spontanément réarrangé pour former différents produits dérivés présentant potentiellement différentes activités biologiques en fonction de la structure de la chaîne latérale du glucosinolate impliqué, des conditions du milieu ainsi que de la présence de cofacteurs ou de protéines spécifiques [44,70,71]. Alors que les isothiocyanates constituent le groupe de produits d’hydrolyse le plus courant et que leur toxicité a été démontrée pour un large spectre d’organismes [79], les autres groupes de produits dérivés incluent principalement les nitriles, les épithionitriles et les thiocyanates [25,71,79,82,83]. La formation de ces produits secondaires d’hydrolyse dépend de facteurs tels que le pH, la concentration en ions ferriques et la présence ou non de différents types de protéines spécifiques. Bien que les mécanismes d’action de ces protéines restent encore assez mal connus, il est probable qu’elles agissent directement sur l’aglycone avant sa modification spontanée en isothiocyanate pour conduire à la formation de l’un ou l’autre de ces composés en fonction du type de protéine spécifique impliqué et de la structure chimique de la chaîne latérale de l’aglycone [79,83,84]. L’activité biologique de ces différentes molécules demeure encore largement ignorée, mais plusieurs études expérimentales indiquent qu’elles joueraient un rôle dans les stratégies de défense directes ou indirectes des végétaux chez qui elles sont synthétisées [85–88]. Les différents produits d’hydrolyse des GLs ne se rencontrent par ailleurs pas de manière uniforme, tant du point de vue taxonomique que spatio-temporel et, tout comme il existe de multiples variations des profils de glucosinolates, le nombre et la composition des molécules engendrées par le système glucosinolate/myrosinase varient considérablement en fonction, non seulement de l’espèce, de l’accession ou de l’organe végétal considérés, mais aussi du stade de développement et des conditions environnementales, créant ainsi potentiellement un mécanisme de défense particulièrement dynamique et adaptatif [11,44,71].
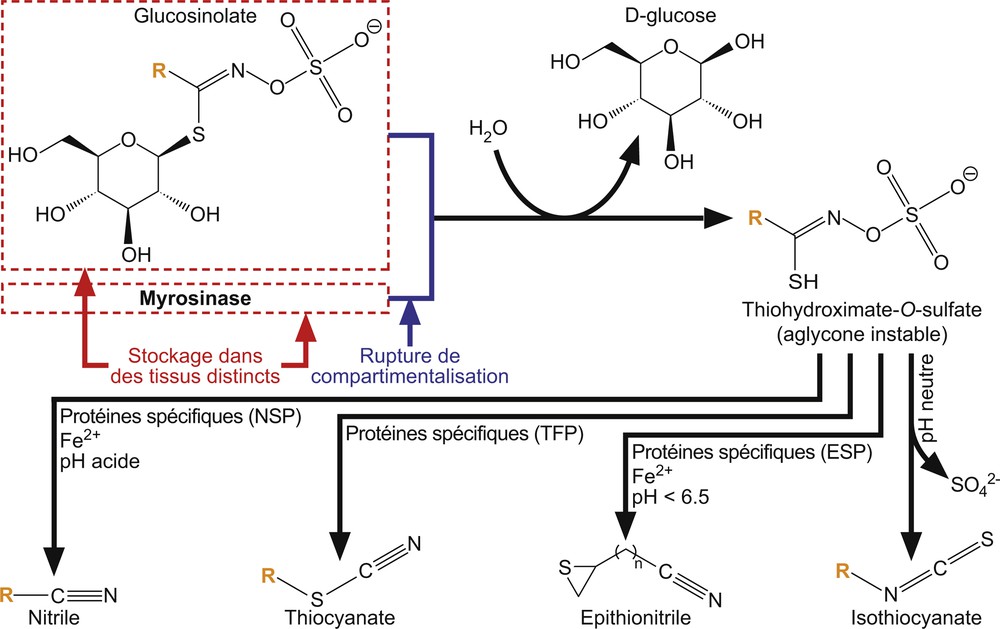
Système myrosinase/glucosinolate typique. Dans les tissus végétaux intacts, les glucosinolates et les myrosinases sont stockées dans des compartiments distincts. Une rupture de ces compartiments est nécessaire pour que les myrosinases catalysent l’hydrolyse de la liaison thioglucosidique et produisent un glucose et un aglycone instable. À pH neutre, l’aglycone forme spontanément un isothiocyanate. En fonction de la nature de la chaîne latérale aglycone R, du pH et de la présence d’ions ferriques, d’autres molécules peuvent se former sous l’action de différentes protéines spécifiques. ESP : epithiospecifier protein. NSP : nitril specifier protein. TFP : thio-forming protein. Seuls les principaux produits finaux sont indiqués. Figure réalisée suivant [14,25,71,82,83]. Masquer
Système myrosinase/glucosinolate typique. Dans les tissus végétaux intacts, les glucosinolates et les myrosinases sont stockées dans des compartiments distincts. Une rupture de ces compartiments est nécessaire pour que les myrosinases catalysent l’hydrolyse de la liaison thioglucosidique et produisent un glucose ... Lire la suite
2.5 Importance des glucosinolates indoliques
Le catabolisme du tryptophane (Trp) constitue une des branches métaboliques majeures du système immunitaire des végétaux [89] et, parmi les trois grandes classes de glucosinolates, les GLs indoliques (GIs) dérivés du Trp forment non seulement une des catégories les plus abondantes dans la nature [90], mais se démarquent aussi des autres catégories de glucosinolates par de nombreux aspects. La phase initiale de la biosynthèse de la structure de base des GIs aboutit à la formation de l’indole-3-acétaldoxime (IAOx), une molécule intermédiaire qui constitue également un précurseur essentiel de l’auxine [91–93], hormone issue du métabolisme primaire, dont les effets sur le développement et la croissance des végétaux sont capitaux, mais aussi de la camalexine, un alcaloïde indolique considéré comme la plus importante phytoalexine impliquée dans des mécanismes de défense chez A. thaliana, et dont la présence est aussi attestée parmi d’autres Brassicaceae [94,95]. Les GIs, seuls ou en combinaison avec les glucosinolates aliphatiques, jouent par ailleurs un rôle crucial dans de multiples mécanismes de défense contre une vaste gamme d’organismes pathogènes et de ravageurs [22,53,85,90,96–98] et ont une influence significative sur le choix des sites d’oviposition des herbivores spécialistes des crucifères [85,96,97]. Ils constituent, en outre, les seuls glucosinolates impliqués dans les systèmes glucosinolate/myrosinase atypiques (myrosinases PEN2 et PYK10), jouant dans le cas de PEN2 un rôle central dans les mécanismes de réponse immunitaire innée de protection contre la pénétration de champignons pathogènes [58,81,99]. Du point de vue de la santé humaine, de nombreuses études épidémiologiques ont apporté des éléments qui suggèrent que plusieurs produits de dégradation des glucosinolates indoliques, dont notamment l’indole-3-carbinol (I3C), pourraient exercer dans certaines conditions un effet protecteur contre plusieurs types de cancers [100–104]. Dans les cellules humaines, l’I3C serait ainsi impliqué dans l’inhibition du cycle cellulaire, l’induction de l’apoptose et l’inhibition de la prolifération tumorale et métastasique [105,106]. Les mécanismes par lesquels l’I3C interviendrait dans ces processus restent néanmoins mal connus [104,105,107].
3 Les glucosinolates dérivés du tryptophane chez A. thaliana
Dans ce contexte, l’identification et la caractérisation précise des modes de fonctionnement et de régulation des gènes impliqués dans les différentes étapes de biosynthèse des glucosinolates indoliques, mais aussi de leurs produits de dégradation issus des différents systèmes glucosinolate/myrosinase où ils sont impliqués, revêt une importance fondamentale. Un effort de recherche considérable a ainsi été fourni au cours des 20 dernières années pour effectuer ce travail chez l’espèce modèle A. thaliana. Alors que la formation de la structure de base des glucosinolates indoliques a été clarifiée dans les premières années du XXIe siècle [8,108], de très récents progrès ont permis notamment d’identifier les gènes codant pour les protéines responsables des modifications secondaires de GIs [43,53,109], de mieux comprendre le fonctionnement des facteurs de transcriptions qui régulent la synthèse de leur structure de base [110–112] et de préciser le rôle et la manière dont les glucosinolates indoliques sont susceptibles d’intervenir dans différents mécanismes de défense [80,108,113–116]. Les gènes qui encodent pour les enzymes impliqués dans la biosynthèse de la structure de base et les modifications secondaires de la chaîne latérale des GIs sont listés dans le matériel supplémentaire (Tableau A.1).
3.1 Biosynthèse de la structure de base
Comme cela a été vu précédemment, la biosynthèse des glucosinolates dérivés du tryptophane ne comporte pas d’étape préalable d’élongation de l’acide aminé précurseur et se subdivise en deux phases, avec la formation d’une structure de base suivie de modifications secondaires de la chaîne latérale R. Les différentes modifications qui aboutissent à la formation de la structure de base des glucosinolates indoliques, l’indole-3-yl-méthyle (I3M), ainsi que les enzymes qui catalysent chacune des transformations intermédiaires et les gènes qui codent pour ces protéines sont pour la plupart identifiés (Fig. 5, Tableau A.1). L’utilisation chez Arabidopsis du double mutant cyp79b2cyp79b3 [91] et de lignées mutantes de surexpression de CYP79B2 [91,113,114] ainsi que l’étude de l’expression hétérologue de CYP79B2 et CYP79B3 chez Escherichia coli [117,118] ont permis de montrer que la première réaction de conversion du tryptophane en IAOx est probablement catalysée par les deux enzymes à cytochrome P450 encodées respectivement par chacun de ces deux gènes. Comme les voies de biosynthèse des GIs, de la camalexine et de l’auxine sont métaboliquement connectées par l’IAOx, on comprend que cette étape revêt une importance fondamentale. Le degré d’implication de chacun de ces deux gènes dans ces différentes voies métaboliques demeure incertain, même si la banque de données d’expression de gènes ATTED-II [119] indique clairement qu’ils présentent des profils d’expression hautement similaires. L’étape suivante va conduire à la formation d’un oxyde de nitrile ou d’un composé aci-nitro. Il reste en effet une ambiguïté concernant l’identification de cette molécule intermédiaire, car elle n’a pas pu être correctement isolée à cause de son instabilité [120,121]. Différentes approches ont permis de caractériser l’enzyme responsable de cette transformation et ont montré que l’IAOx peut être métabolisé par CYP83B1, mais aussi par CYP83A1, son homologue dans la voie de synthèse des glucosinolates aliphatiques dérivés de la méthionine [120,122–124]. CYP83B1 présente néanmoins une affinité beaucoup plus élevée pour l’aldoxime issu du tryptophane [124], et les différents travaux menés à ce jour montrent que les deux protéines n’agissent probablement pas de manière redondante en conditions physiologiques normales [8,124]. L’aldoxime actif ainsi produit subirait ensuite une réaction de conjugaison avec un tripeptide, le glutathion (γ-Glu-Cys-Gly), pour former un intermédiaire biosynthétique instable [125–127]. L’intervention du glutathion dans cette étape de la voie métabolique a conduit à s’interroger sur la nécessité d’une activité glutathion S-transférase (GST) pour catalyser cette réaction et la contribution de GSTF9 et GSTF10 a été proposée [128]. Le gène codant pour l’enzyme GSTF9 présente en effet un profil d’expression extrêmement proche de CYP79B2 et CYP79B3. Chez A. thaliana, il est localisé sur le second chromosome et forme un tandem avec GSTF10 [129], les deux protéines étant identiques à 80 % suivant TAIR [130]. Enfin, des analyses d’expression de gènes d’A. thaliana chez la levure ont indiqué que la glutathion S-transférase GSTF9 pourrait participer à la synthèse de ce conjugué intermédiaire [131]. Cependant, il n’a pas encore été possible de confirmer catégoriquement que la formation de ce composé requiert spécifiquement ces deux GSTs chez A. thaliana, ou même qu’une activité glutathione S-transférase soit réellement nécessaire [127,131–133]. En conséquence de cette conjugaison avec le glutathion, une hydrolyse de la liaison entre le γ-glutamyl et la cystéine, tous deux issus du glutathion, est nécessaire pour permettre l’action de l’enzyme qui va éliminer le groupement alkyle [134,135]. Des analyses de co-expression ont permis de montrer que, parmi les γ-glutamyl peptidases présentes chez A. thaliana, seul GGP1 était significativement co-régulée avec deux autres gènes (i.e. CYP83B1, SUR1) impliqués dans la biosynthèse de la structure de base des glucosinolates indoliques et l’expression de GGP1 chez Nicotiana benthamiana a indiqué que l’enzyme encodée par ce gène catalyse la réaction d’hydrolyse mentionnée ci-dessus dans le cas de la synthèse des glucosinolates benzéniques [48]. Néanmoins, l’utilisation de simples mutants ggp1-1 et ggp3-1 ainsi que du double mutant ggp1-1ggp3-1 chez Arabidopsis ont permis de mettre en évidence que les deux enzymes GGP1 et GGP3 interviennent dans cette réaction lorsque la biosynthèse des glucosinolates indoliques se déroule en conditions naturelles [127]. L’intervention d’une carboxypeptidase additionnelle pour hydrolyser la liaison entre la glycine et la cystéine demeure indéterminée et pourrait être inutile pour que la réaction suivante puisse se dérouler [127,136]. L’absence totale de glucosinolates aliphatiques et indoliques à des niveaux détectables chez le mutant sur1 a conduit à l’identification de la C-S lyase responsable de cette étape chez Arabidopsis et a révélé que l’enzyme SUR1 (SUPPERROOT1) fonctionne de manière non redondante dans chacune des deux voies de biosynthèse [137]. La conversion du thiohydroximate ainsi obtenu en désulfoglucosinolate serait ensuite catalysée par une ou plusieurs glycosyltransférases [138]. La combinaison d’analyses de co-expression des gènes impliqués dans différentes voies de biosynthèse des glucosinolates, d’étude d’expression hétérologue du gène qui encode UGT74B1 (UDP-glucose : thiohydroximate glycosyltransférase) ainsi que d’analyses comparée des profils de glucosinolates chez le type sauvage Col-0 (Columbia-0) et le mutant ugt74b1 ont suggéré de manière robuste que cette enzyme joue un rôle prépondérant dans la glycosylation du thiohydroximate, mais aussi que d’autres glycosyltransférases pourraient intervenir dans cette réaction [138,139]. La dernière réaction conduisant à la production de la structure de base des glucosinolates indoliques (I3M) fait intervenir une sulfatation et, parmi les 21 sulfotransférases (SOTs) identifiées chez Arabidopsis [140,141], trois SOTs ayant la capacité de catalyser cette réaction ont été identifiées [142]. Les études d’expression des gènes responsables de la synthèse de ces trois enzymes ont permis de montrer une préférence significative de SOT16 (sulfotransférase 16), aussi identifiée comme AtST5a (A. thaliana sulfotransférase 5a), pour les désulfoglucosinolates dérivés du tryptophane et de la phénylalanine, tandis que SOT17 (= AtST5c) et SOT18 (= AtST5b) semblent agir de manière prépondérante sur des substrats à longue chaîne aliphatique issus de la méthionine [141–143].
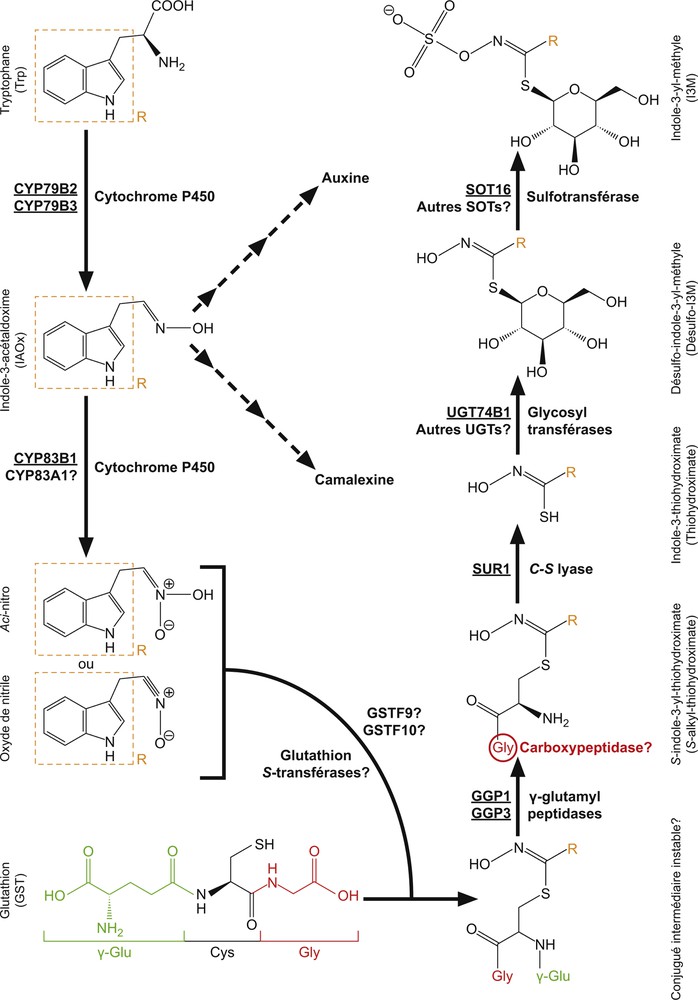
Voie de biosynthèse de la structure de base des glucosinolates indoliques. Tous les gènes ainsi que les enzymes correspondantes ont été identifiés et caractérisés chez Arabidopsis thaliana, à l’exception des glutathion S-transférases dont le rôle éventuel a été proposé uniquement sur la base d’analyses de co-expression [131]. Les enzymes dont le nom est souligné indique que leur rôle dans cette voie de biosynthèse a été démontré. L’intervention d’une carboxypeptidase pour hydrolyser la liaison entre la glycine et la cystéine du S-alkyl-thiohydroximate demeure hypothétique. Les deux flèches en pointillés représentent les connections entre l’IAOx et, respectivement, la voie de biosynthèse de la camalexine d’une part et une des voies métaboliques de l’auxine d’autre part. R : chaîne latérale aglycone. Figure réalisée suivant [9,108,122,124,127,128,131,136,141,143]. Masquer
Voie de biosynthèse de la structure de base des glucosinolates indoliques. Tous les gènes ainsi que les enzymes correspondantes ont été identifiés et caractérisés chez Arabidopsis thaliana, à l’exception des glutathion S-transférases dont le rôle éventuel a été ... Lire la suite
3.2 Modifications secondaires de la chaîne latérale
La diversité structurale des glucosinolates indoliques est uniquement liée aux modifications secondaires de la chaîne latérale aglycone de l’I3M. Ces modifications par hydroxylation sont généralement suivies d’une méthoxylation ultérieure du noyau indolique et interviennent plus particulièrement en position 1 (modifications 1-IG) ou 4 (modifications 4-IG) de ce dernier [43,53,109]. Jusqu’en 2009, les différents modèles proposés postulaient l’existence de quatre molécules différentes de glucosinolates indoliques [53] communément présentes chez A. thaliana [42,144] tout comme notamment chez de nombreuses espèces de Brassica [145–150,90] : outre l’I3M, il s’agit du 1-méthoxy-indole-3-yl-méthyle (1MO-I3M), du 4-hydroxy-indole-3-yl-méthyle (4OH-I3M) et du 4-méthoxy-indole-3-yl-méthyle (4MO-I3M) dont les structures moléculaires sont présentées (Fig. 6). Chez Arabidopsis, l’I3M constitue le glucosinolate indolique le plus abondant au niveau des feuilles tandis que l’1MO-I3M est prépondérant au niveau du système racinaire [42,66,144]. L’existence d’une cinquième molécule a été proposée en combinant analyses de QTL visant à mettre en évidence les locus déterminant la résistance contre deux espèces d’insectes herbivores chez A. thaliana [151] et analyses des profils d’expression de gènes potentiellement impliqués dans les réactions de modification de l’I3M au sein de lignées sauvages et mutantes [53,58,99]. Ces différentes études ont en effet permis d’établir le rôle de l’enzyme à cytochrome P450 CYP81F2 dans la réaction d’hydroxylation qui conduit à la formation du 4OH-I3M à partir de l’I3M. Cependant, la comparaison des profils de glucosinolates entre le type sauvage Col-0 et le mutant cyp81f2 a révélé que, bien que la production de 4OH-I3M et 4MO-I3M soit significativement réduite chez le mutant, ces deux molécules sont encore détectables [53]. Cette observation pourrait suggérer que d’autres enzymes interviennent dans cette réaction [43,53]. Par ailleurs, ces mêmes comparaisons ont indiqué que CYP81F2 n’interviendrait pas dans la formation de l’1MO-I3M ; la voie métabolique conduisant à la formation de cette molécule serait ainsi distincte de celle qui permet de produire le 4OH-I3M et le 4MO-I3M [53,58,99], une hypothèse corroborée par le fait que différents QTLs contrôleraient les variations naturelles de l’1MO-I3M, d’une part, et des composés dont le noyau indolique a été modifié en position 4, d’autre part [53,151]. Dans cette configuration, l’hypothèse de l’existence d’une molécule intermédiaire analogue au 4OH-I3M entre l’I3M et l’1MO-I3M a été formulée [53]. Cet 1-hydroxy-indole-3-yl-méthyle (1OH-I3M) serait néanmoins hautement instable à cause de la position du groupement hydroxyle à l’intérieur du noyau indolique, ce qui expliquerait que ce composé n’ait pas été détecté au cours des nombreuses analyses de profils de glucosinolates réalisées à la date de cette étude [43]. Ces premiers éléments ont permis de développer de nouvelles stratégies d’approche. En effet, l’enzyme CYP81F2 est rattachée à une petite sous-famille de quatre monoxygénases à cytochrome P450, CYP81F1, CYP81F3 et CYP91F4, dont les gènes forment un cluster sur le chromosome 4, tandis que CYP81F2 est localisé sur le chromosome 5 [109,152]. Par ailleurs, l’analyse du réseau de co-expression des différents gènes CYP81Fs a indiqué une corrélation significative de leurs expressions respectives avec celle de plusieurs gènes codant pour des O-méthyle transférases, celles-ci pouvant être impliquées dans les réactions de méthylation du 1OH-I3M et du 4OH-I3M [43,96,153,154]. À partir de ces observations et en utilisant de manière combinée un système d’expression hétérologue chez N. benthamiana et l’analyse de mutants d’Arabidopsis pour différent CYP81Fs, il a été possible de montrer qu’en conditions naturelles les enzymes CYP81F1 à F3 ne pouvaient réaliser l’hydroxylation du noyau indolique qu’en position 4 et que CYP81F4 ne catalysait cette réaction qu’en position 1 [43]. Parallèlement, une analyse des profils métaboliques de différentes lignées mutantes cyp81f4 menée indépendamment est venue renforcer ces conclusions [152]. L’étude d’expression hétérologue des gènes de plusieurs O-méthyle transférases dans un système qui incluait non seulement les principaux gènes qui participent à la biosynthèse de la structure de base des GIs mais aussi les gènes CYP81Fs a permis de révéler que dans ces conditions au moins deux O-méthyle transférases nommées IGMT (indole glucosinolate O-methyltransférase) 1 et 2, étaient capable de convertir le 1OH-I3M en 1MO-I3M et le 4OH-I3M en 4MO-I3M [43]. Cette étude n’est toutefois pas parvenue à apporter une confirmation à l’existence du 1OH-I3M. Il existe cinq gènes IGMTs connus chez A. thaliana, tous localisés sur le chromosome 1, mais tandis que IGMT1 à IGMT4 sont disposés en tandem et ont un degré d’identité supérieur à 94 %, IGMT5 en est spatialement éloigné et ne présente qu’environ 70 % d’identité avec les quatre autres gènes encodant ce groupe de méthyle transférases [109]. Ces cinq gènes produisent en outre des profils de co-expression distincts : une corrélation significative a en effet été détectée entre CYP81F2 et IGMT1 à IGMT4, d’une part, et entre CYP81F4 et IGMT5, d’autre part [154]. Récemment, l’analyse comparée des profils de glucosinolates indoliques entre la lignée sauvage Col-0 et des lignées mutantes igmt5 ainsi que des profils d’expression d’IGMT5 et de CYP81F4 au sein de ces différentes lignées a permis de confirmer l’existence du 1OH-I3M et de montrer que IGMT5 encode la méthyle transférase responsable de sa conversion en 1MO-I3M. Cette étude a aussi révélé que, lorsque IGMT5 était inactivé deux autres GIs, dénommés N-Hex-indole-3-yl-méthyle (N-Hex-I3M) et N-X-indole-3-yl-méthyle (N-X-I3M), était formés à partir du 1OH-I3M [109]. La représentation actuelle des différentes voies de transformations secondaires de l’I3M et des gènes impliqués dans ces modifications résulte de l’ensemble de ces observations (Fig. 6).
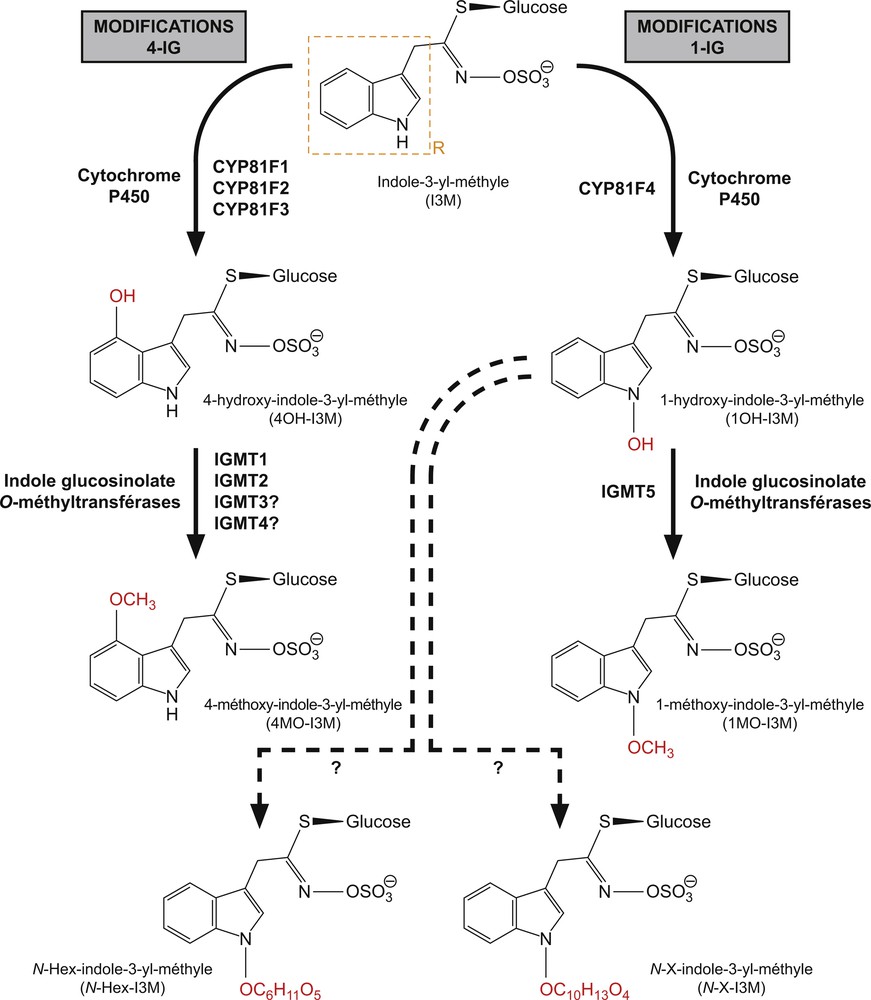
Modifications secondaires 1-IG et 4-IG du noyau indolique de l’I3M chez Arabidopsis thaliana. Les noms des enzymes impliquées dans chacune des étapes de ces voies métaboliques sont désignés à proximité des flèches et un point d’interrogation à la suite du nom signale une fonction proposée mais non démontrée biochimiquement. Les flèches en pointillés représentent des voies de biosynthèse de conjugués récemment découverts [109] et les astérisques indiquent que les enzymes correspondants sont inconnus. Les modifications successives sont colorées en rouge sur la représentation de chacune des molécules. R : chaîne latérale aglycone. Figure réalisée suivant [43,53,109]. Masquer
Modifications secondaires 1-IG et 4-IG du noyau indolique de l’I3M chez Arabidopsis thaliana. Les noms des enzymes impliquées dans chacune des étapes de ces voies métaboliques sont désignés à proximité des flèches et un point d’interrogation à la suite ... Lire la suite
3.3 Régulation génétique et hormonale
De manière générale, les glucosinolates sont accumulés constitutivement suivant des modalités différentes en fonction des organes et des stades de développement, mais sont aussi synthétisés ou dégradés en réponse à une très large gamme de stimuli [16,18,66,144,155–157]. Le fonctionnement de l’ensemble de ces mécanismes est lié à une régulation stricte des voies métaboliques conduisant à l’accumulation, la synthèse et la dégradation des différents glucosinolates et de leurs dérivés. Parmi les éléments qui interviennent dans cette régulation, plusieurs protéines appartenant aux deux principales familles de facteurs de transcription (MYB et bHLH/MYC) identifiés chez A. thaliana jouent un rôle central dans la régulation de la biosynthèse des glucosinolates indoliques [110,111,158–160]. L’utilisation de lignées mutantes d’inactivation et de surexpression d’un ou plusieurs gènes cibles, combinée avec des analyses de transcriptomique et métabolomique, ont ainsi permis de montrer qu’en conditions naturelles l’expression de gènes impliqués dans la biosynthèse des GIs est positivement régulée par trois facteurs de transcription (FTs) étroitement homologues appartenant au sous-groupe 12 de la sous-famille R2R3-MYB : MYB34, MYB51 et MYB122 [110,158,161–163]. Ces travaux ont aussi révélé que ces protéines ne semblent pas intervenir de manière redondante sur la régulation de cette voie métabolique, même si elles ne présentent pas toutes la même importance en termes de régulation [110]. Elles seraient ainsi indispensables à la synthèse de l’IAOx et, par voie de conséquence, l’altération de leur fonctionnement aurait un impact indirect et conditionnel sur la biosynthèse de la camalexine et le métabolisme de l’auxine [93,157,158,161,163]. Sachant que l’expression de CYP79B2 et CYP79B3 est régulée par ces trois FTs, il est en effet possible que la production d’autres dérivés de l’IAOx tels que la camalexine, l’acide indole-3-acétique et l’acide indole-3-carboxylique soit aussi régulée par MYB34, MYB51 et MYB122 [157,158,161,163]. Certaines de ces études ont aussi mis en évidence une expression tissulaire différenciée des gènes encodant pour ces trois facteurs de transcription [111]. La protéine MYB34 semblerait constituer le principal régulateur de la synthèse des GIs dans les racines et ce FT serait crucial pour l’accumulation du 1MO-I3M ; MYB51 aurait un rôle prépondérant au niveau de l’appareil végétatif aérien et favoriserait la production du 4MO-I3M, tandis que la participation de MYB122 serait accessoire, cette molécule semblant avoir un impact plus réduit sur la biosynthèse des glucosinolates indoliques [110]. Il a été, en outre, établi récemment que bHLH04/MYC4, bHLH05/MYC3 et bHLH06/MYC2, trois facteurs de transcription appartenant au sous-groupe IIIe de la famille de gènes bHLH/MYC, joueraient aussi un rôle dans la régulation de la biosynthèse des GIs, conjointement avec MYB34, MYB51 et MYB122, mais la manière dont ils y participent et interagissent avec les MYBs reste obscure, même si leur rôle est probablement critique [111,160,164]. Il a été tout d’abord montré, à travers l’analyse des profils de glucosinolates indoliques du mutant bHLH06/myc2, que la protéine MYC2 régulerait négativement leur production [165], mais des études ultérieures ont indiqué à travers les analyses de transcriptome réalisées chez le triple mutant myc2 myc3 myc4 une régulation positive de cette voie métabolique par les trois MYCs [160,164]. Les interactions MYB-MYC pourraient en outre jouer un rôle fondamental dans le contrôle de la biosynthèse des GIs, car il a été non seulement constaté que la réduction des niveaux de glucosinolates indoliques était plus prononcée chez le double mutant myb51 myc3 que chez le simple mutant myc3, mais aussi que l’augmentation de la production de GIs était significativement plus prononcée chez le double mutant de surexpression myb34-1D myc3-D94 que chez les simples mutants correspondants ou chez le type sauvage [164]. L’existence de telles interactions a déjà été observée pour la régulation d’autres voies métaboliques [166] et il est donc possible qu’elles jouent un rôle central dans la régulation de la biosynthèse des glucosinolates indoliques. Par ailleurs, plusieurs études ont suggéré qu’il existerait à travers l’action de ces facteurs de transmission un mécanisme de régulation réciproque des voies métaboliques conduisant à la synthèse des glucosinolates indoliques et aliphatiques [158,162,167,168]. Néanmoins, les modes de fonctionnement de ces interactions restent à ce jour indéterminés [111].
La biosynthèse des glucosinolates, et notamment des glucosinolates indoliques, est aussi régulée par différentes phytohormones, dont l’acide jasmonique (AJ), l’éthylène, l’acide salicylique (AS) et les brassinostéroïdes (BRs) [169–174]. L’acide jasmonique ainsi que ses précurseurs et dérivés, notamment le jasmonate de méthyle (MeJA) et le conjugué jasmonoyl-isoleucine (JA-Ile), sont connus collectivement sous le nom de jasmonates (JAs). Ces molécules jouent non seulement un rôle majeur dans la régulation de nombreux processus du développement végétal, mais aussi dans les mécanismes de défense contre les organismes pathogènes et les insectes ravageurs [93,172,175]. Un nombre considérable d’études menées avec différentes espèces de Brassicales ont montré que l’application exogène de certains jasmonates augmente considérablement le niveau de glucosinolates indoliques accumulés et que l’activité de nombreux gènes impliqués dans la biosynthèse de ces glucosinolates peut être fortement stimulée dans ce contexte [19,175,90]. Il existe néanmoins des variations naturelles significatives des profils de glucosinolates induit par l’application de jasmonates non seulement aux niveaux inter- et intraspécifiques, mais aussi au niveau tissulaire [90]. Les expérimentations menées à ce jour suggèrent en outre que la biosynthèse des glucosinolates indoliques est plus fréquemment et plus intensément induite par les jasmonates que celle des glucosinolates aliphatiques et benzéniques [19,175]. Chez A. thaliana, le rôle des jasmonates dans l’induction de la biosynthèse des glucosinolates a été mis en évidence à travers l’étude comparée de l’évolution des profils de glucosinolates chez une lignée mutante coi1 insensible aux jasmonates et le type sauvage correspondant Col-0. Ce mutant, caractérisé par l’absence d’une protéine de la classe des F-box appelée COI1 (CORONATINE INSENSITIVE1), ne montre en effet aucune variation perceptible des glucosinolates indoliques en présence de différents insectes ravageurs [170,172,176,177]. Il a été montré que les jasmonates, et plus particulièrement le JA-Ile, agissent suite à un stress ou à un signal interne comme un ligand pour assembler un corécepteur constitué essentiellement de COI1 et d’une classe de répresseurs appelés JAZ (Jasmonate ZIM domain) [178,179]. Ces répresseurs interagissent et inactivent un grand nombre de facteurs de transcription, dont notamment les FTs du sous-groupe IIIe de la famille de gènes bHLH/MYC [178]. Les jasmonates interviendraient donc dans le cadre des mécanismes de défense basés sur les glucosinolates indoliques en affectant les interactions entre les protéines bHLH/MYC et JAZ, permettant ainsi l’action des facteurs de transcription impliqués dans la régulation de leur biosynthèse [93,164,175]. L’analyse des profils de glucosinolates indoliques obtenus à partir de différents mutants d’Arabidopsis pour les trois gènes MYBs impliqués dans la biosynthèse de ces glucosinolates a en outre révélé une régulation différentielle de ces FTs en présence de MeJA (MYB34, MYB122), d’acide salicylique (MYB51) et/ou d’éthylène (MYB51, MYB122) [110]. La voie de signalisation dépendante du salicylate est connue pour son implication dans les mécanismes de défense et il a été montré que l’application d’acide salicylique conduisait à l’induction de différents types de glucosinolates chez des espèces diverses de Brassicales, mais pouvait aussi réduire le taux de certains d’entre eux [38,169,177,180]. L’utilisation de mutants insensibles ainsi que de mutants accumulant des niveaux plus élevés d’acide salicylique chez A. thaliana a permis d’établir qu’en ce qui concerne les glucosinolates indoliques, la synthèse du 4MO-I3M pourrait être induite par l’acide salicylique alors que celles de l’I3M et du 1MO-I3 M seraient réduites [172,181]. Les résultats de ces travaux ont aussi suggéré qu’il existerait un antagonisme entre la voie de signalisation des jasmonates et celle de l’acide salicylique. Plusieurs études ont également rapporté l’existence probable de liens entre la voie de signalisation de l’éthylène et la biosynthèse des glucosinolates, mais la nature de ces interactions demeure difficile à interpréter [110,172,176,177,182] et les mécanismes de défense sont certainement modelés par des interconnexions complexes entre les différentes voies de signalisation phytohormonale, qui impliquent notamment les jasmonates, l’acide salicylique et l’éthylène [93,183], mais aussi les brassinostéroïdes [171]. Ces molécules constituent en effet un groupe de phytohormones essentiels dans le cadre d’un large spectre de processus tant physiologiques que développementaux [184]. Parmi les nombreuses fonctions qui ont été identifiées à ce jour, leur rôle dans différents mécanismes de réponse aux stress environnementaux a été particulièrement examiné [185–187] et plusieurs études ont permis d’apporter de nouveaux éléments en relation avec la synthèse des glucosinolates indoliques. L’analyse comparée des données de puces à ADN de lignées mutantes (BR-déficiente et BR-insensible) ainsi que du type sauvage correspondant chez Arabidopsis a tout d’abord permis de révéler que l’expression de CYP79B2 serait régulée négativement en présence de brassinostéroïdes [171]. L’étude des profils de glucosinolates après l’application de différentes concentrations d’un composé de type brassinostéroïde, le 24-epibrassinolide, sur des individus Col-0 a par ailleurs montré une réduction de l’accumulation des glucosinolates indoliques I3M et 1MO-I3M, mais aussi de plusieurs glucosinolates aliphatiques, ces résultats étant corroborés par les niveaux mesurés de ces différents glucosinolates chez deux lignées mutantes (BR-déficiente et BR-surexpression) [174]. Plus récemment, une analyse des gènes ciblés par BZR1, un facteur de transcription synthétisé à partir de la voie de signalisation des brassinostéroïdes, a mené à l’identification de sites de liaison pour ce FT au niveau des promoteurs de MYB34 et MYB51 [173]. À la suite à ces observations, des analyses de métabolomique et transcriptomique ont été menées au sein de lignées mutantes accumulant respectivement BZR1 et BES1, un second facteur de transcription dépendant de la voie de signalisation des brassinostéroïdes. Ces travaux ont permis de montrer que l’accumulation de l’un ou l’autre de ces FTs entraînait une diminution significative du niveau d’expression des gènes encodant pour de nombreux enzymes à cytochrome P450 impliquées dans la biosynthèse des glucosinolates indoliques et aliphatiques, mais aussi des gènes de la famille des MYBs intervenant dans la régulation de ces voies métaboliques, dont notamment MYB34, MYB51 et MYB122 [174]. Ces résultats suggèrent que la production de glucosinolates serait régulée par les brassinostéroïdes à travers l’expression de BZR1 et BES1, deux facteurs de transcription qui pourraient interagir directement avec les gènes de biosynthèse des GLs ou les gènes de régulation de la famille des MYBs [93].
3.4 Rôles écologiques des glucosinolates indoliques
La diversité structurale des glucosinolates et de leurs produits d’hydrolyse affecte une très large gamme d’organismes pathogènes et d’insectes ravageurs. Néanmoins, les rôles écologiques spécifiques des différentes molécules issues de la biosynthèse des glucosinolates indoliques demeurent encore mal connus, même si de récents progrès ont été faits dans ce domaine. Plusieurs études récentes ont en effet montré clairement que les différentes molécules issues de la biosynthèse des glucosinolates indoliques ainsi que leurs produits de dégradation respectifs jouent probablement des rôles distincts suivant la nature des interactions écologiques dans lesquelles ils interviennent. Parmi celles-ci, les mécanismes de résistance contre les aphides, et notamment Myzus persicae (puceron vert du pêcher) [53,96,97,153,188], l’induction des systèmes glucosinolate/myrosinase atypiques PEN2 [58,99,189] et PYK10 [80,81], les effets antiparasites contre les nématodes des racines noueuses du genre Meloidogyne [109,115] et l’influence sur le choix des sites d’oviposition de plusieurs lépidoptères spécialistes des crucifères [20–22,85,98] ont été plus particulièrement étudiés au cours de ces dernières années.
Les pucerons ont la capacité de prélever la sève élaborée en insérant directement leurs stylets dans le phloème, ce qui, conjointement à des sécrétions salivaires particulières, leur permettrait de réduire drastiquement les dégâts qu’ils pourraient causer aux tissus environnants et d’inhiber l’activation de certains mécanismes de défense [190–192]. Bien que la sève élaborée contienne des glucosinolates, les aphides pourraient ainsi éviter d’activer le système typique de défense glucosinolate/myrosinase, cette enzyme étant présente dans les tissus adjacents au phloème [73,193,194]. Diverses études ont indiqué que les glucosinolates indoliques pourraient néanmoins jouer un rôle important dans les stratégies de défense d’A. thaliana contre M. persicae. Un effet inhibiteur de ces composés, potentiellement par l’intermédiaire de leurs produits de dégradation post-ingestion, a en effet été constaté sur la prolifération de ce puceron sans l’intervention apparente de myrosinases et il a été observé de manière concomitante que les modifications des profils de glucosinolates induites par cet aphide étaient largement négligeables, hormis une augmentation très significative des niveaux de 4MO-I3M [96,97]. L’impact de cette molécule sur M. persicae a aussi été mesuré in vivo, en comparant chez Arabidospsis les performances de ce puceron sur une lignée mutante cyp81f2 et le type sauvage correspondant, et ces analyses ont suggéré que CYP81F2, l’un des gènes responsables de la transformation du I3M en 4OH-I3M, pourrait jouer un rôle essentiel dans les processus de défense contre les aphides [53,153]. L’importance du rôle joué par l’induction de la synthèse de certains glucosinolates indoliques dans cette stratégie demeure néanmoins controversée, et il semble fort probable qu’une grande part des mécanismes visant à réduire les niveaux d’infestation et de prolifération de M. persicae chez les Brassicaceae restent encore à découvrir [188,195,196].
Le 4MO-I3M est aussi un acteur majeur des réponses immunitaires innées chez Arabidopsis, qui font intervenir l’hydrolyse de ce composé par la myrosinase atypique PEN2 [58]. Ce système, qui semble pouvoir être stimulé par un large spectre de champignons, d’oomycètes et de bactéries pathogènes non spécifiques [99,189,197–200] représenterait un mécanisme induit de défense cellulaire autonome qui nécessiterait une séquence complexe et finement régulée de phénomènes subcellulaires débutant par l’augmentation ciblée de la synthèse d’un substrat non toxique (4MO-I3M) suivi de son activation par PEN2. Cette enzyme catalyserait en effet la production d’un ou plusieurs composés toxiques encore non identifiés, mais capables de cibler un vaste ensemble d’organismes pathogènes [17,201]. Les différentes études menées à ce jour ont permis de mettre en évidence le rôle majeur de CYP81F2 dans ce mécanisme. Cette enzyme à cytochrome P450 serait ainsi un maillon essentiel de ce système de défense, et il a été montré récemment que, dans le cadre d’une tentative de pénétration des tissus foliaires d’A. thaliana par l’oïdium des céréales, ce dernier pouvait non seulement déclencher l’accumulation de CYP81F2 au niveau du réticulum endoplasmique (RE) des cellules situées à proximité du site d’interaction avec le champignon, mais aussi la formation de PEN2, et que cette enzyme serait localisée à la fois au niveau de peroxysomes et à celui d’un sous-ensemble de mitochondries étroitement associées au RE [202]. Ce système de défense, nommé CYP81F2/PEN2, est actif dans les tissus foliaires, mais pourrait aussi contribuer à la lutte contre les pathogènes racinaires [203,204]. Des analyses de co-expression menées à partir de la banque de données ATTED-II [119] ont en outre révélé l’existence d’une corrélation hautement significative entre l’expression de PEN2, CYP81F2 et IGMT1 à 4, corroborant l’existence probable d’un lien entre cette myrosinase atypique et la voie métabolique de modifications secondaires 4-IG [81]. Un réseau de co-expression similaire a été découvert entre les gènes CYP81F4 et IGMT5, qui encodent les enzymes impliqués dans les modifications 1-IG [109], et PYK10, gène responsable de la synthèse d’une protéine appartenant à une sous-famille différente de celle de PEN2, mais dont la séquence est particulièrement proche, ce qui suggère que PYK10 pourrait aussi posséder une activité myrosinase atypique [80,81]. Cette protéine est particulièrement présente chez A. thaliana au niveau des corps du réticulum endoplasmique, ces organelles dérivées du RE mais continues avec celui-ci étant strictement limitées aux racines chez les plantes adultes [77,81]. Néanmoins, même si la capacité de PYK10 à hydrolyser l’I3M a été démontrée in vitro, le ou les substrats spécifiques, mais aussi le rôle exact et le fonctionnement de cette myrosinase restent à élucider in vivo [205–207]. L’existence d’un système de défense intracellulaire à deux composantes a été avancé, suggérant que les glucosinolates indoliques et PYK10 seraient accumulés au niveau des corps du RE et que l’activité myrosinase serait régulée par un contrôle du pH à l’intérieur de ces organelles, leur rupture entraînant l’activation du système [81]. PYK10 a été initialement considéré chez A. thaliana comme un gène exprimé spécifiquement au niveau du système racinaire et dont le niveau d’expression était particulièrement élevé dans les tissus infectés par des nématodes à kyste de l’espèce Heterodera schachtii [208]. Une étude récente a par ailleurs montré que des nématodes à galle de l’espèce Meloidogyne incognita pouvaient entraîner au niveau du système racinaire l’induction de gènes impliqués notamment dans la biosynthèse des glucosinolates indoliques et de la camalexine, et que ceux-ci pourraient jouer un rôle important dans la défense d’Arabidopsis contre ce type de parasite [115]. Parallèlement, et en se basant sur le fait que le 1MO-I3M représente le glucosinolate indolique dominant à l’intérieur des racines d’Arabidopsis [43,66,144], l’analyse comparée des niveaux d’infection par une autre espèce de nématode à galle (Meloidogyne javanica) des lignées mutantes cyp81f4 et igmt5 et de la lignée sauvage correspondante Col-0 a permis de révéler un effet nématicide non pas du 4MO-I3M ou du 1MO-I3M mais du 1OH-I3M et/ou des deux conjugués N-Hex-I3M et N-X-I3M découverts au cours de cette même étude [109]. Même si ces résultats ont clairement mis en évidence que la voie de modifications 1-IG pouvait potentiellement générer des composés bioactifs, la manière dont ils pourraient être mobilisés par la plante dans sa lutte contre les nématodes demeure spéculative, les nématodes n’ayant semble-t-il pas rencontrés d’obstacles majeurs pour infecter la lignée sauvage. L’ensemble de ces constatations suggère néanmoins que le système de myrosinase atypique PYK10 pourrait être impliqué.
La piéride de la rave (Pieris rapae) et la teigne des crucifères (Plutella xylostella) représentent au niveau mondial les deux plus importants lépidoptères ravageurs rencontrés parmi les Brassicaceae [209–211]. Ces deux insectes spécialistes ont développé au cours de l’évolution des mécanismes de contre-adaptation pour contourner les systèmes de défense de ce groupe de végétaux et utiliser les glucosinolates et leurs produits de dégradation pour choisir les sites d’oviposition et permettre à leurs chenilles de s’alimenter à partir de ces plantes [23,24]. Plusieurs travaux menés notamment chez Brassica oleracea et Arabidospsis thaliana ont montré que, dans le cas de P. rapae, les glucosinolates indoliques jouaient probablement un rôle majeur en stimulant l’oviposition de cette espèce [20,85,212] ainsi que d’autres Pieris [21], mais également que les glucosinolates aliphatiques pourraient avoir un rôle complémentaire dans ce processus [98]. Ils ont aussi permis de suggérer l’existence d’un système de régulation basé sur la présence d’un composé issu du mécanisme de détoxification des glucosinolates utilisé par les chenilles des piérides pour consommer les crucifères. Pour pouvoir s’alimenter à partir de ces végétaux, les chenilles de P. rapae sont en effet capables de rediriger l’hydrolyse des glucosinolates vers la formation de nitriles généralement moins toxiques que les isothiocyanates produits typiquement par le système glucosinolate/myrosinase [24]. La présence de ces nitriles à la surface des végétaux aurait alors un effet répresseur sur l’oviposition, ce qui aurait pour conséquence de réguler les populations de chenilles présentent sur les plantes [98]. Le système de détoxification des glucosinolates mis en œuvre par les chenilles de P. xylostella est quant à lui totalement distinct de celui des piérides et se caractérise par la production d’une glucosinolate sulfatase qui transforme les glucosinolates en composés sur lesquels les myrosinases ne peuvent pas agir, empêchant ainsi la formation de composés toxiques [23]. La plupart des études portant sur les mécanismes de stimulation de l’oviposition chez la teigne des crucifères indiquent non seulement que glucosinolates et isothiocyanates auraient un effet positif [213–215] mais que les glucosinolates indoliques intacts, et notamment le 4MO-I3M, seraient particulièrement importants dans ce processus [22]. Les fonctions de signalisation respectives de ces composés et la manière dont ils interviennent pour déclencher l’oviposition des femelles de P. xylostella restent néanmoins à élucider.
4 Conclusions et perspectives
Malgré un long historique de caractérisation des voies de biosynthèse des glucosinolates indoliques et de leurs différents rôles écologiques, l’ensemble des travaux menés sur ces différents sujets jusqu’à aujourd’hui montrent que le fonctionnement et les interconnections des systèmes de défense dans lesquels ils interviennent nous sont encore largement inaccessibles. De nombreuses interrogations demeurent en ce qui concerne l’identification et le rôle respectif des gènes impliqués dans différentes étapes clés des différentes voies métaboliques, la manière dont ceux-ci sont activés et régulés, non seulement spatio-temporellement, mais aussi en fonction des interactions avec les facteurs biotiques et abiotiques de l’environnement. Parmi les multiples questions qui se posent encore, il reste par exemple à déterminer les rôles respectifs de CYP79B2 et CYP79B3 dans la transformation du tryptophane en IAOx, étape clé à l’origine de trois voies métaboliques essentielles, ou encore l’implication de GSTF9 et GSTF10 dans l’étape de conjugaison avec le glutathion. La caractérisation des conjugués récemment identifiés et des gènes encodant pour les protéines éventuellement responsables de leur synthèse à partir du 1OH-I3M lors de la phase de modifications secondaires des glucosinolates indoliques constitue aussi une des nombreuses zones d’ombre qui demeurent. Un autre important domaine de recherche concerne la caractérisation des fonctions alternatives que peuvent remplir ces différentes voies métaboliques dans le cadre des réponses immunitaires innées. Les études menées jusqu’à présent sur les glucosinolates indoliques suggèrent que différentes sous-classes de ces composés phytochimiques, même en étant dérivés du même précurseur, peuvent intervenir pour remplir des fonctions dont la spécificité peut être liée à la fois au type d’attaque, au tissu végétal concerné et au stade d’infection. Il est aussi apparu ces dernières années que notre connaissance de l’organisation spatiale et temporelle de ces processus atypiques au niveau intracellulaire comme au niveau tissulaire demeure insuffisante. Par exemple, la manière dont le système de myrosinase atypique PYK10 est activé, le type de substrats sur lesquels il fonctionne et la localisation de ce système dans les cellules sont des questions auxquelles des réponses doivent encore être apportées. Au-delà de ces différentes interrogations, et de manière plus globale, c’est la place et l’importance relative de l’ensemble de ces mécanismes au sein d’un réseau de défense extrêmement plus vaste et plus complexe qui doivent encore être élucidés.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Remerciements
Ce travail a été réalisé grâce à l’appui de l’Agence nationale de la recherche (subvention ANR-10-GENM-005 attribuée à J.K.) et du consulat général de France à Jérusalem (bourse attribuée à M.M.).


