Abridged English version
The factors that determine spatial patterning of soil macro-organisms can be divided into two categories: (i) biotic factors such as social behaviour, inter- and intraspecific competition, dispersal abilities or trophic resource availability, and (ii) abiotic factors such as climate or soil physical and chemical properties. Responses of soil macrofauna communities to trophic resource variations greatly vary, depending on whether resource quality, quantity, or spatial distribution is considered.
The aim of this paper is to investigate factors controlling soil macrofauna spatial pattern under a pure beech (Fagus sylvatica L.) and a mixed beech-hornbeam (Carpinus betulus L.) stand. According to the hierarchical model of factors controlling organic matter decomposition processes in terrestrial ecosystems [1], we hypothesize that under mixed stand, macrofauna spatial patterns are controlled by the composition of litterfall, i.e. distal control (external to humic epipedon) and under pure stand, they are controlled by microbial activity, i.e. proximal control (internal to humic epipedon) estimated through macro-morphological and chemical humic epipedon properties.
In each stand, soil macro-invertebrates were sampled in spring 2001 by hand sorting 121 () soil monoliths regularly distributed on a 10-m mesh () squared grid within each stand. Environmental variables such as humic epipedon morphological (organic horizon total thickness, OH and A thickness) and chemical properties (pH of A and E horizons, C–N ratio of A horizon), relative irradiance, soil bulk density, and the plant species composition of OLn in MS were also investigated. Detritivores were identified at the species level, while other macro-invertebrates were identified at the family level. Environmental variables – soil macrofauna relationships were analysed by co-inertia analysis. LOWESS regressions (LOcally WEighted regression Scatter plot Smoothing) were used to assess variation patterns of detritivorous density, species richness, Shannon index, and evenness along the main axes of PCA performed on environmental variables. Geostatistics were also used to search for spatial autocorrelation between macro-invertebrate communities and environmental variables strongly correlated with co-inertia axes.
- 1) The total taxonomic diversity was nearly similar on both sites: 34 taxa were recorded under pure stand (PS) and 32 under mixed stand (MS). Nonetheless, the average diversity per sample was greater under PS. Average sample density was also greater under PS than under MS. Detritivorous communities exhibited similar trends.
- 2) Co-inertia analysis performed on PS data revealed that the main factor explaining soil macrofauna spatial distribution was humus form activity. Under MS, this factor was revealed as a second order determinant and the main explicative factor was the litter quality, i.e. the contrast between hornbeam litter and beech litter.
- 3)
LOWESS regressions performed between (i) sample scores on the main axes of the PCA on environmental variables and (ii) detritivorous species richness (SR), Shannon index (), Evenness () and density did not revealed strong statistical correlations. Nevertheless, some trends could be underlined:
- (a) under PS, SR and tended to increase when A thickness and IR increased. and detritivorous density did not exhibit significant variation patterns;
- (b) under MS, SR, and detritivorous density exhibited the highest values when 25 to 35% of hornbeam leaves were present in OLn. did not exhibit any significant variation pattern.
- 4) Geostatistical analyses revealed that, except plant species composition of OLn in MS, which showed an autocorrelation range of about 50 m of soil macrofauna, all other tested variables did not exhibit any spatial structure at the scale of the study.
Soil macro-invertebrate communities composition and density under the pure and the mixed stand are in accordance with those reported in the literature for the same type of forest. They indicate that humus forms within both stands belong to mull-moder type. The highest average density and taxonomic richness per sample under PS can be explained either by (i) moder humus forms dominance under PS, which can provide a more suitable habitat, or (ii) the impact of the last thinning operation, which occurred in 1998 for MS and 1995 for PS.
The rate of litter decomposition (accounting for microbial activity) is the main explicative factor of soil macrofauna spatial distribution under PS. This factor can act on macro-invertebrates communities by two effects: (i) a habitat effect (i.e. a high decomposition rate leads to a decreasing habitat integrity) and a resource effect (i.e. a high decomposition rate leads to more available nutrients). Under MS, the litter quality is the main explicative factor of soil macrofauna spatial distribution (i.e. a resource effect). Under MS, density and species richness of soil detritivorous species reach a maximum when OLn is composed of 25 to 35% hornbeam leaves. This could be explained either (i) by the best trade off between resource quality and habitat suitability (more than 35% of hornbeam leaves favours resource easily decomposable at the expense of habitat integrity, while less than 25% favours habitat suitability at the expense of resource quality) and/or (ii) by the fact that a highest detritivorous diversity is exhibited for a medium level of habitat integrity and resource quality, which can be understood in the light of the intermediate stress hypothesis.
Co-inertia analysis validated the hypothesis that under MS the spatial distribution of soil macrofauna communities is controlled by the composition of litterfall, i.e. distal control (external to humic epipedon), while under PS, it is controlled by microbial activity, i.e. proximal control (internal to humic epipedon).
1 Introduction
Les patrons de distribution des espèces (animales ou végétales) sont rarement uniformes et continus dans l'espace et le temps, et l'identification des facteurs influençant ces variations est devenue une préoccupation majeure en écologie [2]. Les facteurs conditionnant la distribution horizontale et/ou verticale des macro-invertébrés du sol sont divisés en deux catégories : (i) les facteurs biotiques, comme le comportement social [3], la capacité de dispersion [4], la compétition inter- et intra-spécifique et les relations proies-prédateurs [5] ou encore la ressource trophique [6] ; (ii) les facteurs abiotiques, comme le pH du sol [7], son humidité [8], sa texture [9] ou l'épaisseur et l'hétérogénéité verticale des horizons holorganiques [10,11].
La réponse des communautés de détritivores à une variation de la ressource trophique a été approfondie au cours de ces dernières années. Les résultats sont variables si l'on considère, soit la qualité de la ressource [12], soit sa quantité [13], soit sa variabilité spatiale [14], et leur interprétation, parfois soumise à controverse [12]. Lors d'expériences de manipulation de litière dans des écosystèmes forestiers [13,15,16], les réponses des communautés de détritivores ne sont pas forcément attribuables à la manipulation de la ressource elle-même, mais plutôt aux modifications de l'habitat consécutives à la perturbation [12]. Les interactions entre les différents facteurs biotiques et abiotiques rendent donc difficile l'étude des liens entre le compartiment végétal (producteur de ressources pour les détritivores) et le compartiment détritivore. En ce qui concerne les relations entre les diversités respectives des deux compartiments, Hooper et al. [17] rapportent que les corrélations peuvent être (i) positives sans nécessairement de lien causal direct entre les deux (les deux compartiments peuvent répondre de manière similaire aux variations d'un facteur environnemental), (ii) négatives (par exemple, les insectes rhizophages peuvent réduire la diversité de la végétation sus-jacente), ou (iii) neutres (les deux ne répondent pas aux mêmes contraintes abiotiques).
Dans une étude précédente [18], nous avions comparé la diversité et l'hétérogénéité des communautés de la macrofaune du sol dans une hêtraie pure (Fagus sylvatica L.) c'est-à-dire une litière de qualité médiocre, et une hêtraie–charmaie (Carpinus betulus L.), c'est-à-dire une litière améliorante, toutes deux développées sur limons des plateaux en Haute-Normandie. Nous avions montré qu'il n'existait pas de différences significatives en terme de diversité entre les deux peuplements et que l'hétérogénéité de la macrofaune était plus importante sous peuplement pur (quand la qualité des retombées de litière était spatialement homogène).
L'objectif de la présente étude est donc de rechercher les causes de la plus forte hétérogénéité spatiale observée sous peuplement pur de hêtre. On recherche les facteurs contrôlant la répartition spatiale de la macrofaune (essentiellement épigée [18]) du sol à l'échelle des deux peuplements forestiers précédemment étudiés. D'après le modèle hiérarchique des facteurs contrôlant les processus de décomposition dans les écosystèmes terrestres [1], à l'échelle de la station forestière (climat et propriétés physiques du sol identiques), les niveaux hiérarchiques immédiatement supérieurs et inférieurs au compartiment macrofaune (respectivement la qualité de la ressource et les microorganismes) doivent conditionner la structure et la répartition spatiale des communautés de la macrofaune du sol. Nous pensons que la présence d'une litière facilement dégradable (source de carbone et d'azote facilement assimilable) dans le peuplement mélangé hêtre–charme conduit à un contrôle de la variabilité spatiale de la macrofaune par les retombées de litière, c'est-à-dire à un contrôle distal (externe à l'épisolum humifère). Sous peuplement pur de hêtre, la qualité de la ressource est uniforme. Par conséquent, l'activité des microorganismes (sur laquelle s'appuient les macro-invertébrés pour digérer une vaste gamme de substance [6,19]) doit conditionner la répartition de la macrofaune, c'est-à-dire assurer un contrôle proximal (interne à l'épisolum humifère). Pour cela, nous avons échantillonné (de manière spatialement explicite) la macrofaune du sol et différentes variables susceptibles d'expliquer sa répartition spatiale : composition de la litière sous peuplement mixte, épaisseur et caractéristiques macro-morphologiques de l'épisolum humifère (rendant compte de l'activité des microorganismes), densité apparente et éclairement au sol sous les deux peuplements.
2 Matériel et méthodes
2.1 Sites d'étude
Deux parcelles forestières, faisant partie de deux forêts domaniales de Haute-Normandie, ont été retenues pour cette étude : une traitée en futaie régulière pure de hêtre située dans le massif d'Eawy (01°18′E, 49°44′ N ; 205 m d'altitude) et une traitée en futaie régulière mélangée 70 % hêtre–30 % charme, située dans le massif de Lyons (01°37′E, 49°26′N ; 200 m d'altitude). Les hauteurs annuelles moyennes des précipitations sont de 800 mm et les températures annuelles moyennes sont de 10 °C [20]. Les caractéristiques structurales des deux peuplements sont sensiblement équivalentes. Le peuplement pur est âgé de 116 ans, a une densité de 178 arbres ha−1, avec un diamètre moyen de 41,7 cm et une surface terrière de 28,7 m2 ha−1. La dernière coupe d'éclaircie a eu lieu en 1995. Le peuplement mélangé est âgé de 114 ans, compte 179 arbres ha−1, avec un diamètre moyen de 40,9 cm et une surface terrière égale à 26,1 m2 ha−1. La dernière éclaircie fut pratiquée en 1998.
Les deux peuplements sont en situation topographique plane et croissent sur des LUVISOLS très acides, oligosaturés [21]. Les formes d'humus varient du dysmull à l'eumoder selon la classification française [22] et sont en moyenne plus actives sous peuplement mélangé que sous peuplement pur [23]. La végétation s'y développant appartient à l'association phytosociologique de l'Endymio-Fagetum [24,25].
2.2 Échantillonnage
2.2.1 Variables mésologiques
Dans chaque peuplement, une grille carrée de 1 ha, avec une maille régulière de 10 m, a été matérialisée. À chaque nœud de la grille, une description macro-morphologique de l'épisolum humifère a été réalisée durant l'hiver 2000–2001. Les variables suivantes ont été relevées : l'épaisseur totale des horizons organiques, l'épaisseur de l'horizon humifère OHr sensu AFES [21], l'épaisseur de l'horizon organo-minéral A. Le carbone organique et l'azote total de l'horizon A ont été dosés par chromatographie gazeuse avec un micro-analyseur de type CHN, afin de calculer le rapport C/N. Le pHeau de l'horizon A et des cinq premiers centimètres de l'horizon E sous-jacent ont été mesurés selon la méthode Baize [26] (mélange sol–eau dans un rapport ). Deux variables relatives à l'organisation de la canopée ont également été échantillonnées : (i) la lumière sous la canopée a été estimée au début de juillet 2001 par la mesure de l'irradiance relative (rapport lumière sous couvert forestier : hors couvert) et (ii) l'appartenance spécifique des feuilles de l'horizon OLn sensu AFES [21] sous le peuplement mixte. L'impact des pratiques d'exploitation sur le tassement du sol a été évalué au moyen de la densité apparente. À chaque nœud, trois carottes de sols de 100 cm3 ont été prélevées, puis séchées à 105 °C pendant 3 j, et pesées. La moyenne de ces trois prélèvements a été utilisée pour les analyses statistiques.
2.2.2 Macrofaune du sol
La macrofaune du sol a été échantillonnée au printemps 2001. À chaque point de la grille, un bloc de sol () a été prélevé et trié manuellement dans une bassine en plastique. Les macro-invertébrés détritivores ont été identifiés jusqu'à l'espèce, les autres jusqu'à la famille à l'aide des ouvrages de Bouché [27], Demange [28], Sims and Gerard [29], Dindal [30], Hopkin [31] et Wheater and Read [32].
2.3 Analyses statistiques
2.3.1 Densité et structures des communautés de la macrofaune
L'effet de la composition de la canopée (hêtre pur versus hêtre–charme) sur chaque groupe taxonomique a été testé à l'aide de comparaisons de moyennes deux à deux en utilisant des tests Tukey HSD au seuil significatif de . La normalité des données a été préalablement vérifiée au moyen du test de Wilk–Shapiro au seuil significatif de . Une transformation logarithmique a été pratiquée, si nécessaire. Ces analyses ont été réalisées avec le logiciel Statistix [33].
2.3.2 Facteurs de variabilité spatiale de la macrofaune
Pour chaque peuplement, une analyse en composantes principales (ACP) a été réalisée sur la matrice de variables mésologiques et la matrice faunistique. Préalablement aux ACP-faune, les taxons présents dans un seul relevé ont été retirés de la matrice. Par conséquent, en ce qui concerne le peuplement pur, la matrice de variables mésologiques possède 121 lignes (relevés) et 8 colonnes (variables) et la matrice faunistique 121 lignes et 26 colonnes (taxons). Concernant le peuplement mélangé, la matrice de variables mésologiques compte 121 lignes et 10 colonnes, tandis que la matrice faunistique possède 121 lignes et 23 colonnes. Pour chaque peuplement, une analyse de co-inertie ACP–ACP [34,35] a été utilisée, afin d'analyser la structure commune aux ACP faune et variables mésologiques. Un test de 1000 permutations aléatoires (Monte-Carlo) a été appliqué pour tester la significativité de la co-inertie observée entre les deux ACP. La significativité des analyses de co-inertie est testée au seuil de 10 %. L'analyse de co-inertie permet de dégager les principaux facteurs explicatifs de la répartition spatiale de la macrofaune du sol à l'échelle du peuplement forestier.
2.3.3 Attributs structurels des communautés de détritivores
Pour chaque point, la densité, la richesse spécifique, l'indice de Shannon et l'équitabilité [36] ont été calculés pour les communautés de détritivores. Des régressions par la méthode LOWESS (LOcally WEighted regression Scatter plot Smoothing) [37] ont ensuite été réalisées entre ces différentes caractéristiques des communautés de détritivores et les coordonnées des relevés sur les principaux axes des ACP réalisées sur les variables mésologiques, afin de rendre compte de l'influence des principaux facteurs explicatifs sur la structure des communautés. À la différence des méthodes de régression classiques, la méthode LOWESS ne prend pas la totalité des points de données pour ajuster un polynôme, mais estime la variable à prédire pour chaque point de données par le résultat d'une régression simple utilisant les plus proches voisins du point [38]. On pondère ensuite ces voisins par un poids fonction de leur distance au point estimé (fonction tricube). Cette opération est renouvelée aux points suivants (Chessel et Thioulouse, fiche thématique 31-ADE-4, 1997). La question principale est donc de choisir un nombre de voisins convenables. Pour cela, l'erreur de prédiction en fonction du nombre de voisins est calculée et exprimée en pourcentage de la variance initiale. Le choix de minimiser l'erreur en prenant un nombre de voisins le plus petit possible est retenu.
Ce type d'analyse est un outil d'exploration des données par régression locale [38,39] et non un moyen d'obtenir des équations de prédiction. Il permet d'identifier, en première instance, les tendances de variation sous-jacentes d'un jeu de données sans qu'il soit besoin de spécifier un modèle statistique linéaire ou polynomial [40]. Dans un second temps, si des relations linéaires ou curvilignes sont mises en évidence par les régressions LOWESS, des régressions classiques (linéaires ou polynomiales) peuvent être réalisées afin de modéliser statistiquement ces relations [40].
Les analyses de co-inertie et les régressions LOWESS ont été réalisées avec le logiciel ADE-4 [41].
2.3.4 Patrons spatiaux des communautés et des variables mésologiques
Des analyses géostatistiques ont été utilisées pour caractériser les patrons spatiaux des communautés de la macrofaune du sol ainsi que des principales variables mésologiques contrôlant la variabilité spatiale de la macrofaune (mises en évidence par les analyses de co-inertie). Ces analyses ont été pratiquées sur les coordonnées des points d'échantillonnage sur les premiers axes des ACP faune (patrons de composition des communautés) et les données brutes des principales variables mésologiques explicatives (d'après l'analyse de coinertie). En pratique, la structure spatiale d'une variable donnée est estimée à l'aide de l'analyse de la semi-variance (γ), qui est une mesure de la variance entre couples de points séparés par une distance donnée [42]. La semi-variance pour une distance spécifique (h) est la suivante :
Lorsque les patrons de composition de la macrofaune et les variables contrôlant la répartition de la macrofaune présentaient une structure spatiale à notre échelle d'échantillonnage, une analyse de la cross semi-variance fut pratiquée afin d'estimer leur interdépendance spatiale. La cross semi-variance entre deux variables u et v est calculée d'après la formule suivante :
Les analyses géostatistiques ont été réalisées avec le logiciel GSTAT [48]. La normalité des données a été préalablement vérifiée au moyen du test de Wilk–Shapiro au seuil significatif de à l'aide du logiciel Statistix [33] et une transformation logarithmique a été pratiquée, si nécessaire.
3 Résultats
3.1 Densité et structure des communautés de la macrofaune
Sur l'ensemble des deux sites, 38 taxons (Tableau 1) ont été récoltés : 34 sous peuplement pur (PP) et 32 sous peuplement mélangé (PM). La densité moyenne par point (Tableau 2) est plus élevée sous PP. Dendrobaena rubida, Lumbricus rubellus, Trichoniscus pusillus, Glomeris marginata, Chordeuma sylvestre, Tachypodoiulus albipes, Aegopinella pura, Discus rotundatus, les dermaptères, coléoptères phytophages et chilopodes présentent des densités plus importantes sous PP (Tableau 1). Les limacidés non identifiés, les formicidés et les opilionidés montrent des densités plus importantes sous PM. Parmi les détritivores, si la richesse taxonomique et l'indice de Shannon moyen par point sont plus élevés sous PP (Tableau 2), le cortège global par site reste sensiblement équivalent (Tableau 1) : 23 taxons sous PP et 22 sous PM.
Densités moyennes (ind m−2) des détritivores et autres macro-invertébrés sous peuplement pur et sous peuplement mélangé. Les valeurs entre parenthèses représentent les déviations standards. Les lettres indiquent les différences significatives pour α<0,05 (Tukey HSD test)
| Peuplement pur | Peuplement mélangé | Peuplement pur | Peuplement mélangé | ||
| Dendrodrilus rubidus, (Savigny) | Oxychilus cellarius, (O.F. Muller) | 0,13 (1,45) | 0,00 (0,00) | ||
| Lumbricus eiseni, (Levinsen) | 0,40 (2,50) | 0,13 (1,45) | Vitrina pellucida, (O.F. Muller) | 0,00 (0,00) | 0,13 (1,45) |
| Lumbricus rubellus, Hoffmeister | Limacidés non identifiés | ||||
| Trichoniscus pusillus, Brandt | Gastéropodes non identifiés | 0,13 (1,45) | 0,00 (0,00) | ||
| Oniscus asellus, Linné | 12,96 (16,69) | 21,16 (34,27) | Larve de diptères | 11,50 (16,03) | 13,75 (22,75) |
| Philocia muscorum, (Scopoli) | 3,17 (8,42) | 1,72 (6,47) | Dermaptères | ||
| Porcelio scaber, Latreille | 0,00 (0,00) | 0,26 (2,05) | Coléoptères detritivores | 2,25 (5,58) | 2,64 (6,96) |
| Glomeris marginata, (Villers) | Diptera adultes | 12,69 (17,52) | 15,74 (23,46) | ||
| Chordeuma sylvestre, Koch | Chilopodes | ||||
| Polydesmidés | 1,45 (4,62) | 2,91 (6,85) | Coléoptères prédateurs | 9,26 (12,35) | 11,24 (13,01) |
| Leptoiulus kervillei, (Brölemann) | 1,06 (3,99) | 2,64 (7,55) | Coléoptères phytophages | ||
| Cylindroiulus latestriatus, (Curtis) | 1,06 (3,99) | 1,19 (5,13) | Coléoptères autres | 18,38 (29,33) | 18,78 (26,18) |
| Cylindroiulus londinensis, (Leach) | 1,32 (5,30) | 0,40 (2,50) | Hétéroptères | 0,53 (2,87) | 0,66 (3,20) |
| Cylindroiulus nitidus, Verhoeff | 0,00 (0,00) | 0,13 (1,45) | Formicidés | ||
| Tachypodoiulus albipes, (Koch) | Hyménoptères | 0,26 (2,05) | 0,40 (3,24) | ||
| Diplopodes non identifiés | 0,00 (0,00) | 0,13 (1,45) | Arachnides | 16,00 (15,46) | 15,87 (20,08) |
| Aegopinella nitidula, (Draparnaud) | Opilionidés | ||||
| Aegopinella pura, (Alder) | Névroptères | 0,13 (1,45) | 0,00 (0,00) | ||
| Discus rotundatus, (O.F. Muller) | Lépidoptères | 2,51 (5,85) | 2,25 (6,30) |
Caractéristiques structurelles moyenne des communautés de détritivores sous peuplement pur (n=121) et sous peuplement mélangé (n=121). Les valeurs entre parenthèses représentent les déviations standards. Les lettres indiquent les différences significatives pour α<0,05 (Tukey HSD test)
| Peuplement pur | Peuplement mélangé | |
| Densité (ind m−2) | ||
| Richesse taxonomique | ||
| Equitabilité | 0,9273 (0,06) | 0,9392 (0,07) |
| Indice de Shannon |
3.2 Facteurs de variabilité spatiale
Les deux premiers axes de l'analyse de co-inertie réalisée entre les ACP faune et variables mésologiques relatives au PP (Fig. 1b) absorbent 52,22 % de l'inertie totale (respectivement 28,81 % et 23,41 % pour le premier et le second axe). Au regard de la très rapide décroissance des valeurs propres des axes de l'analyse (Fig. 1a), seuls les deux premiers furent conservés pour interprétation. Les coefficients de corrélation entre les deux premiers axes des ACP et entre les deux seconds sont respectivement de 0,52 et 0,54. Le test de Monte-Carlo (1000 permutations) valide la co-structure pour .
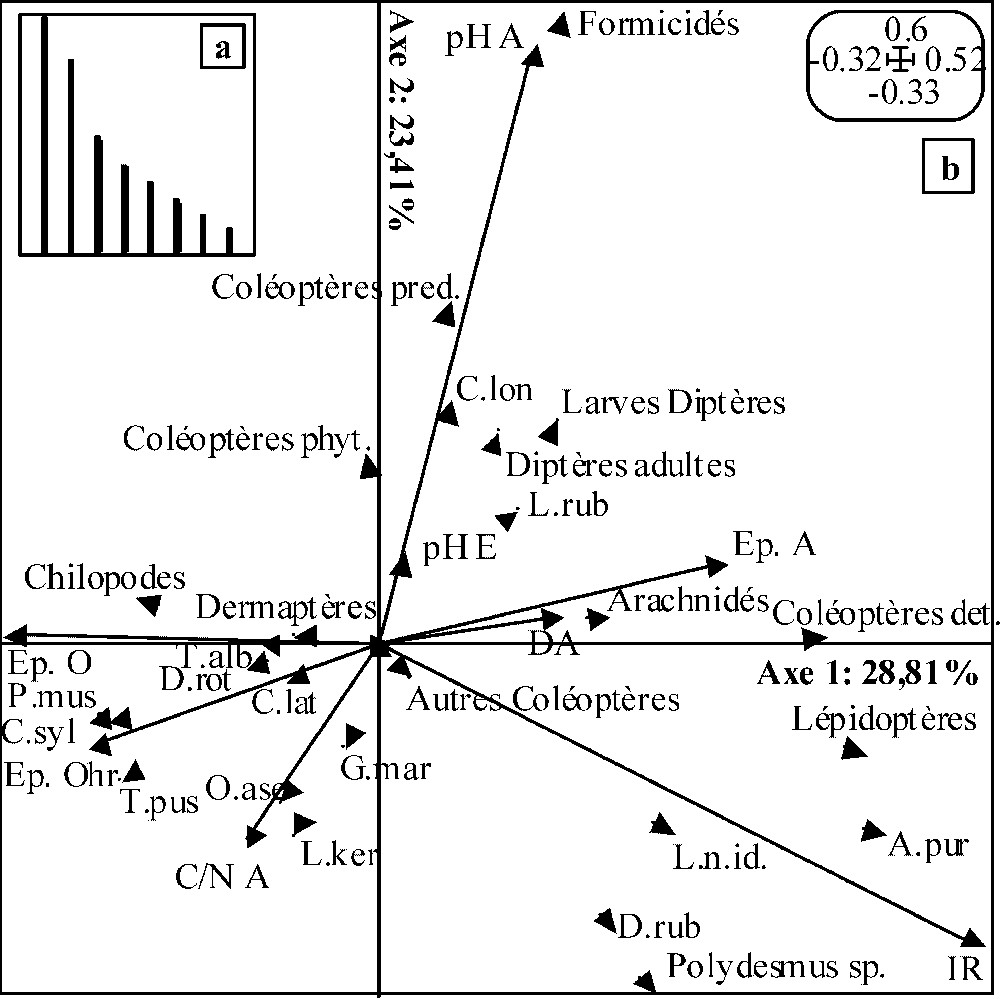
Résultats de l'analyse de co-inertie décrivant la co-structure entre les ACP faune et les ACP variables mésologiques pour le peuplement pur : (a) valeurs propres des axes de co-inertie ; (b) plan de co-inertie défini par les axes 1 et 2 de l'analyse. Voir le Tableau 3 pour les coefficients de corrélation entre les taxons et les deux axes de co-inertie ainsi que la signification des codes utilisés pour les taxons, et le Tableau 4 pour les coefficients de corrélation entre les variables mésologiques et les deux premiers axes de co-inertie ainsi que la signification des codes utilisés pour les variables. Pour plus de lisibilité, seules les extrémités des vecteurs relatifs aux différents taxons ont été représentées.
Les coefficients de corrélation associés aux taxons sur l'axe 1 (Tableau 3) traduisent une opposition entre (a) les coléoptères détritivores, les lépidoptères et Aegopinella pura, d'une part, et (b) Philocia muscorum, Chordeuma sylvestre et Trichoniscus pusillus d'autre part. Les coefficients de corrélation associés aux variables mésologiques (Tableau 4) indiquent une opposition entre (i) de fortes épaisseurs de l'horizon organo-minéral A associées à de fortes valeurs d'irradiance relative et (ii) de fortes épaisseurs totales d'horizons organiques associés à des horizons OHr très épais. Il peut être interprété comme un gradient de vitesse de décomposition de la litière. L'axe 2 est défini par une opposition entre (a) les formicidés et coléoptères prédateurs associés à de fortes valeurs du pH de l'horizon A et (b) Dendrobaena rubida et Polydesmus sp., associés à de faibles valeurs du pHA, de fortes valeurs du rapport C/N de cet horizon et un fort pourcentage de lumière sous couvert forestier.
Coefficients de corrélation entre les taxons et les deux premiers axes des analyses de co-inertie : Les codes correspondent aux abréviations utilisées dans les Figs. 1 et 2
| Codes | Peuplement pur | Peuplement mélangé | |||
| axe 1 | axe 2 | axe 1 | axe 2 | ||
| Dendrodrilus rubidus | D.rub | 0,20 | −0,27 | 0,17 | 0,02 |
| Lumbricus rubellus | L.rub | 0,12 | 0,13 | −0,08 | 0,26 |
| Trichoniscus pusillus | T.pus | −0,22 | −0,13 | −0,08 | −0,48 |
| Oniscus asellus | O.ase | −0,09 | −0,15 | −0,02 | −0,11 |
| Philocia muscorum | P.mus | −0,24 | −0,07 | −0,34 | 0,24 |
| Glomeris marginata | G.mar | −0,03 | −0,09 | −0,44 | −0,16 |
| Chordeuma sylvestre | C.syl | −0,26 | −0,07 | ||
| Polydesmus sp. | 0,23 | −0,33 | −0,16 | −0,43 | |
| Leptoiulus kervillei | L.ker | −0,08 | −0,18 | 0,10 | −0,21 |
| Cylindroiulus latestriatus | C.lat | −0,08 | −0,03 | −0,25 | 0,29 |
| Cylindroiulus londinensis | C.lond | 0,06 | 0,23 | ||
| Tachypodoiulus albipes | T.alb | −0,10 | 0,00 | ||
| Aegopinella pura | A.pur | 0,44 | −0,18 | ||
| Discus rotundatus | D.rot | −0,12 | −0,02 | 0,20 | −0,06 |
| Limacidés non identifiés | L.n.id. | 0,25 | −0,18 | 0,12 | 0,33 |
| Larves diptères | 0,15 | 0,21 | −0,13 | 0,14 | |
| Dermaptères | −0,08 | 0,01 | −0,14 | −0,07 | |
| Coléoptères détritivores | Coléoptères det. | 0,38 | 0,01 | −0,03 | 0,00 |
| Diptères adultes | 0,10 | 0,20 | |||
| Chilopodes | −0,18 | 0,05 | 0,06 | −0,25 | |
| Coléoptères prédateurs | Coléoptères préd. | 0,06 | 0,32 | −0,28 | 0,24 |
| Coléoptères phytophages | Coléoptères phyt. | −0,01 | 0,18 | −0,05 | 0,01 |
| Autres Coléoptères | 0,02 | −0,03 | −0,34 | 0,02 | |
| Formicidés | 0,16 | 0,60 | −0,16 | 0,16 | |
| Arachnides | 0,19 | 0,03 | −0,28 | −0,17 | |
| Lépidoptères | 0,41 | −0,11 | −0,04 | −0,15 | |
| Hétéroptère | −0,39 | −0,12 | |||
| Opilionidés | −0,07 | 0,08 |
Coefficients de corrélation entre les variables mésologiques et les deux premiers axes des analyses de co-inertie : les codes correspondent aux abréviations utilisées dans les Figs. 1 et 2
| Codes | Peuplement pur | Peuplement mélangé | |||
| axe 1 | axe 2 | axe 1 | axe 2 | ||
| Épaisseur horizons organiques | Ep. O | −0,42 | 0,01 | 0,17 | −0,59 |
| Épaisseur OHr | Ep. OHr | −0,33 | −0,15 | −0,03 | −0,30 |
| Épaisseur A | Ep. A | 0,40 | 0,11 | 0,02 | 0,45 |
| pH A | 0,18 | 0,83 | −0,14 | −0,44 | |
| C/N A | −0,15 | −0,28 | 0,01 | 0,11 | |
| pH E | 0,03 | 0,12 | −0,01 | −0,14 | |
| Densité apparente | DA | 0,21 | 0,04 | 0,15 | 0,22 |
| Irradiance relative | IR | 0,68 | −0,42 | 0,12 | 0,29 |
| % feuilles de hêtre | % Hêtre | 0,64 | −0,01 | ||
| % feuilles de charme | % Charme | −0,71 | 0,06 |
Les inerties relatives des deux premiers axes de l'analyse de co-inertie réalisée sur les données du PM (Fig. 2b) sont respectivement de 43,13 % et 17,56 % (soit 60,69 % de l'inertie totale). La décroissance des valeurs propres étant très brutale (Fig. 2a), seuls les deux premiers ont été retenus pour l'interprétation. Le coefficient de corrélation entre les deux premiers axes des ACP est de 0,58. Celui relatif aux deux seconds axes est de 0,57. Le test de permutations aléatoires valide la co-structure dans les deux cas pour .
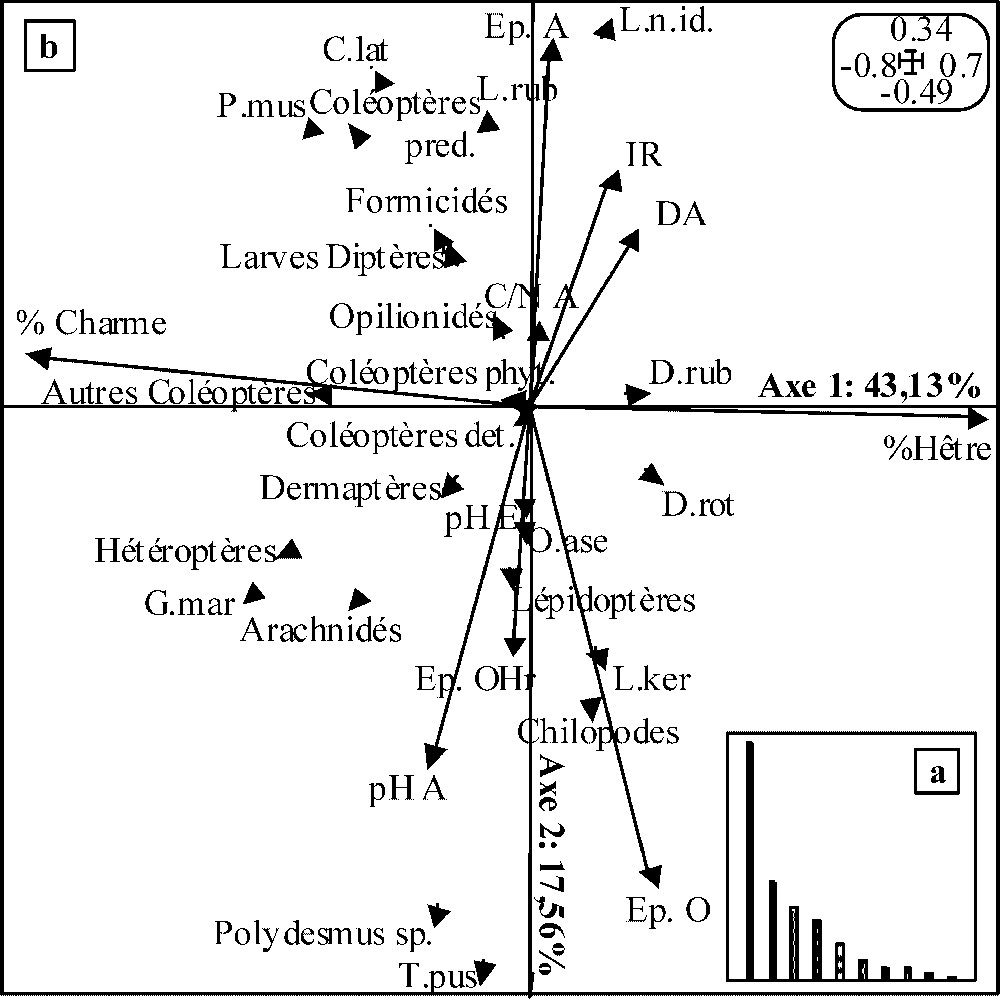
Résultats de l'analyse de co-inertie décrivant la co-structure entre les ACP faune et variables mésologiques pour le peuplement mélangé : (a) valeurs propres des axes de co-inertie ; (b) plan de co-inertie défini par les axes 1 et 2 de l'analyse. Voir le Tableau 3 pour les coefficients de corrélation entre les taxons et les deux axes de co-inertie ainsi que la signification des codes utilisés pour les taxons. Voir le Tableau 4 pour les coefficients de corrélation entre les variables mésologiques et les deux premiers axes de co-inertie, ainsi que la signification des codes utilisés pour les variables. Pour plus de lisibilité, seules les extrémités des vecteurs relatifs aux différents taxons ont été représentées.
Les coefficients de corrélation associés aux taxons (Tableau 3) et aux variables mésologiques (Tableau 4) sur l'axe 1 traduisent une opposition entre (a) Dendrobaena rubida et Discus rotundatus, associés à de forts pourcentages de litière de hêtre dans l'OLn et (b) Philocia muscorum, Glomeris marginata et les hétéroptères associés à de forts pourcentages de litière de charme dans l'OLn. Il peut être interprété comme un gradient de qualité de litière. L'axe 2 oppose (i) Lumbricus rubellus, Philocia muscorum, Cylindroiulus latestriatus et les coléoptères prédateurs, dans sa partie positive, et (ii) Trichoniscus pusillus et Polydesmus sp., dans sa partie négative. Concernant les variables mésologiques, cet axe sépare (i) de fortes épaisseurs de A et des valeurs d'irradiance relative élevées dans sa partie positive et (ii) de fortes épaisseurs d'horizons organiques associées à des épaisseurs d'OHr importantes et un pHA élevé dans sa partie négative. Il peut être interprété comme un gradient de vitesse de décomposition de la litière.
3.3 Attributs structurels des communautés de détritivores
Les régressions LOWESS permettent de caractériser les patrons de variations des indices relatifs à la structure des communautés de détritivores le long des principaux axes des ACP réalisées sur les matrices de variables mésologiques. Le premier constat qui s'impose au regard des fortes valeurs des erreurs de prédiction (Figs. 3–5) est qu'il n'existe pas de fortes corrélations statistiques entre les axes des ACP et les indices de diversité relatifs aux communautés de détritivores. Toutefois, quelques tendances peuvent être citées.
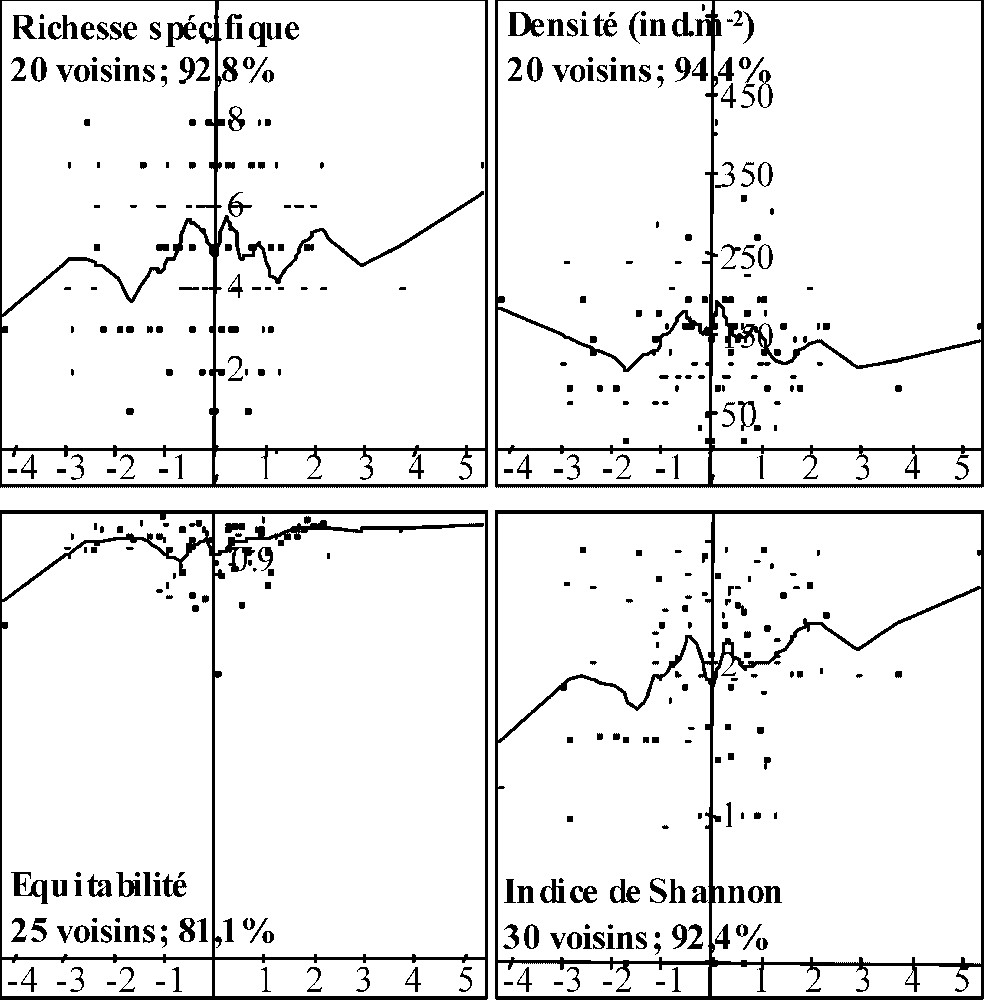
Régressions LOWESS entre les coordonnées sur le premier axe de l'ACP des variables mésologiques des points d'échantillonnage sous peuplement pur et les caractéristiques structurelles des communautés de détritivores. Le nombre de voisins utilisés pour les régressions locales ainsi que le pourcentage d'erreur par rapport à la variance initiale sont donnés pour chaque variable structurelle.
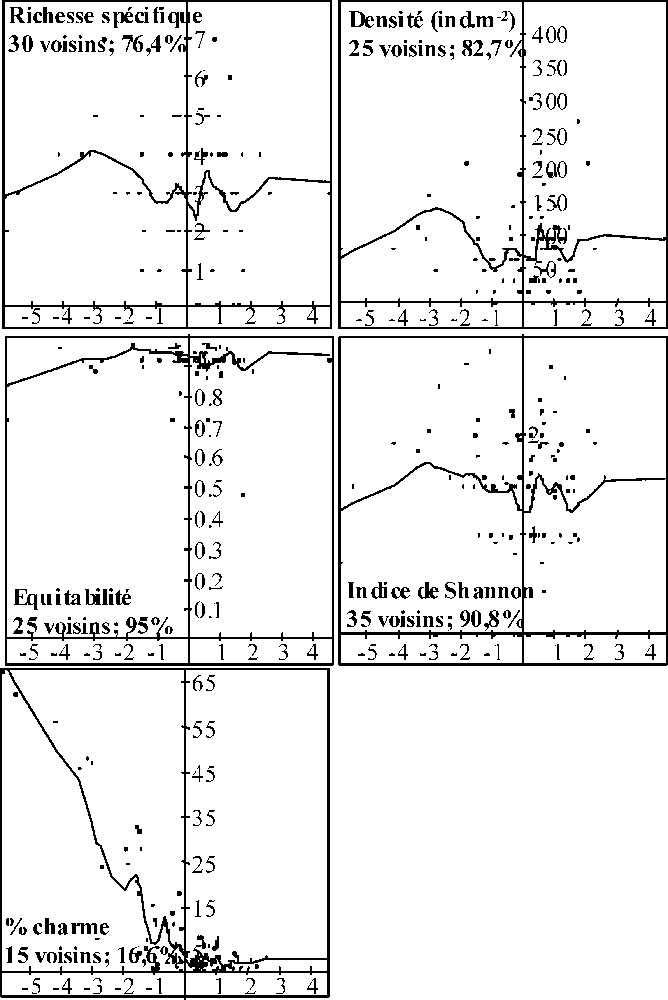
Régressions LOWESS entre les coordonnées sur le premier axe de l'ACP des variables mésologiques des points d'échantillonnage sous peuplement mélangé et les caractéristiques structurelles des communautés de détritivores. Le nombre de voisins utilisés pour les régressions locales ainsi que le pourcentage d'erreur par rapport à la variance initiale sont donnés pour chaque variable structurelle.
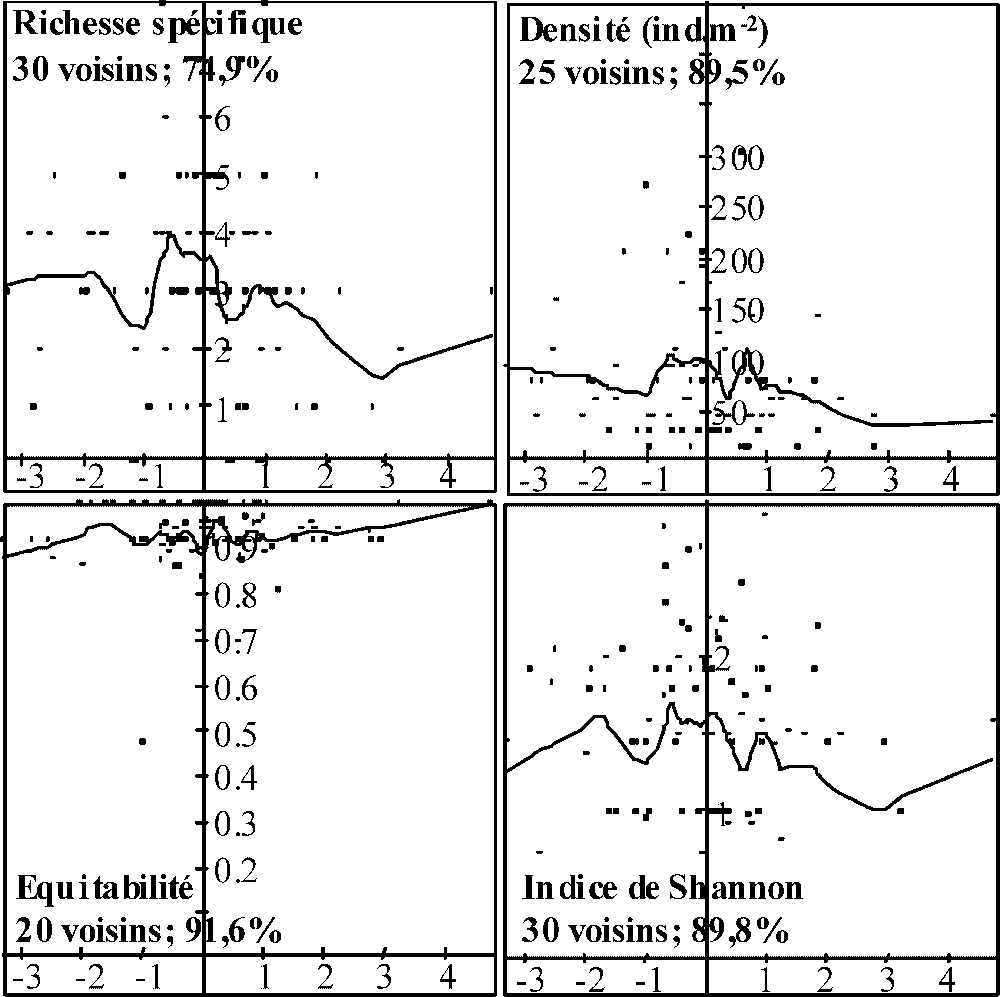
Régressions LOWESS entre les coordonnées sur le deuxième axe de l'ACP des variables mésologiques des points d'échantillonnage sous peuplement mélangé et les caractéristiques structurelles des communautés de détritivores. Le nombre de voisins utilisés pour les régressions locales ainsi que le pourcentage d'erreur par rapport à la variance initiale sont donnés pour chaque variable structurelle.
Concernant le PP (Fig. 3), les régressions montrent que la richesse spécifique des communautés de détritivores et les valeurs de l'indice de Shannon ont tendance à augmenter quand l'épaisseur du A et les valeurs d'irradiance relative augmentent. Les variations de l'équitabilité et de la densité le long de l'axe 1 de l'analyse ne montrent pas de patrons de variation nets. Concernant le PM, les régressions indiquent que les valeurs de la richesse spécifique, l'indice de Shannon et la densité ont tendance à être maximales pour des pourcentages de litière de charme dans l'OLn compris entre 25 et 35 % (Fig. 4). L'équitabilité ne montre pas de grandes variations le long de l'axe 1 de l'ACP « variables mésologiques ». Le long de l'axe 2 (Fig. 5), exception faite de l'indice d'équitabilité, les trois autres variables semblent décroître avec l'augmentation de l'activité au sein des formes d'humus.
3.4 Patrons spatiaux des communautés et des variables mésologiques
Les patrons spatiaux des communautés de la macrofaune du sol et des principaux facteurs de contrôle de leur variabilité spatiale ont été mis en évidence à l'aide d'analyses de semi-variance.
Concernant PP, les coordonnées des relevés sur l'axe 1 de l'ACP faune (CP1), l'irradiance relative (IR), l'épaisseur totale des horizons holorganiques (Ep.O) et l'épaisseur de l'horizon O humifère (Ep.OH) ont montré une structure spatiale pour des distances inférieures à 20–25 m (Fig. 6a, b, d et e). Excepté l'IR, pour laquelle 54,5 % de la variance totale est attribuable à l'autocorrélation spatiale, l'effet pépite important pour les autres variables indique la possible présence de structures spatiales à des échelles inférieures à notre maille d'échantillonnage (). Par ailleurs, l'épaisseur de l'horizon organo-minéral (Ep.A) n'est pas structurée spatialement (Fig. 6c). Les semi-variogrammes croisés n'ont pas montré de co-structure spatiale entre les patrons de composition des communautés de la macrofaune et IR, Ep.O et Ep.OH à l'échelle de la maille d'échantillonnage (Fig. 6f–h).
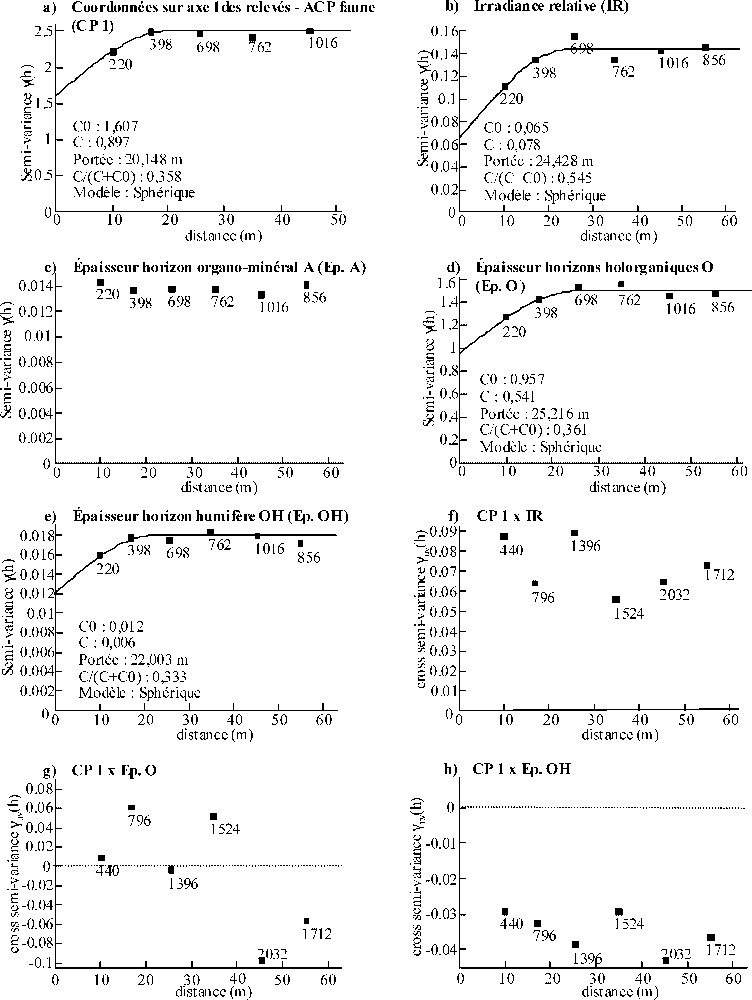
(a–e) Semi-variogrammes observés obtenus pour les coordonnées sur l'axe 1 de l'ACP « faune » des relevés sous peuplement pur et les principales variables mésologiques explicatives de la répartition spatiale de la macrofaune du sol à l'échelle du peuplement, d'après l'analyse de co-inertie (cf. Fig. 2). Des modèles théoriques (____) ont été ajustés lorsque les semi-variogrammes mettaient en évidence une structure spatiale. (f–h) Variogrammes croisés pour les coordonnées sur l'axe 1 et l'irradiance relative (f), les coordonnées sur l'axe 1 et l'épaisseur des horizons holorganiques (g), et les coordonnées sur l'axe 1 et l'épaisseur de l'horizon O humifère (h).
Concernant PM, les semi-variogrammes calculés pour les coordonnées des relevés sur les axes 1 et 2 de l'ACP faune, Ep.OH et Ep.A indiquent l'absence de structures spatiales à l'échelle de prospection (Fig. 7a, b, d, e). Le semi-variogramme calculé pour le pourcentage de charme dans l'Oln atteint un plateau pour des distances proches de 48 m (Fig. 7c) et indique une forte proportion de la variance totale attribuable à l'autocorrélation spatiale (96 %). L'IR, le pH du A et Ep.O présentent des semi-variogrammes atteignant des plateaux pour des distances variant de 16 à 24 m (Fig. 7f–h), mais avec de forts effets pépites () variant de 0,16 à 0,29). En l'absence de structure spatiale au sein des communautés de la macrofaune du sol, aucun semi-varigramme croisé n'a été calculé.
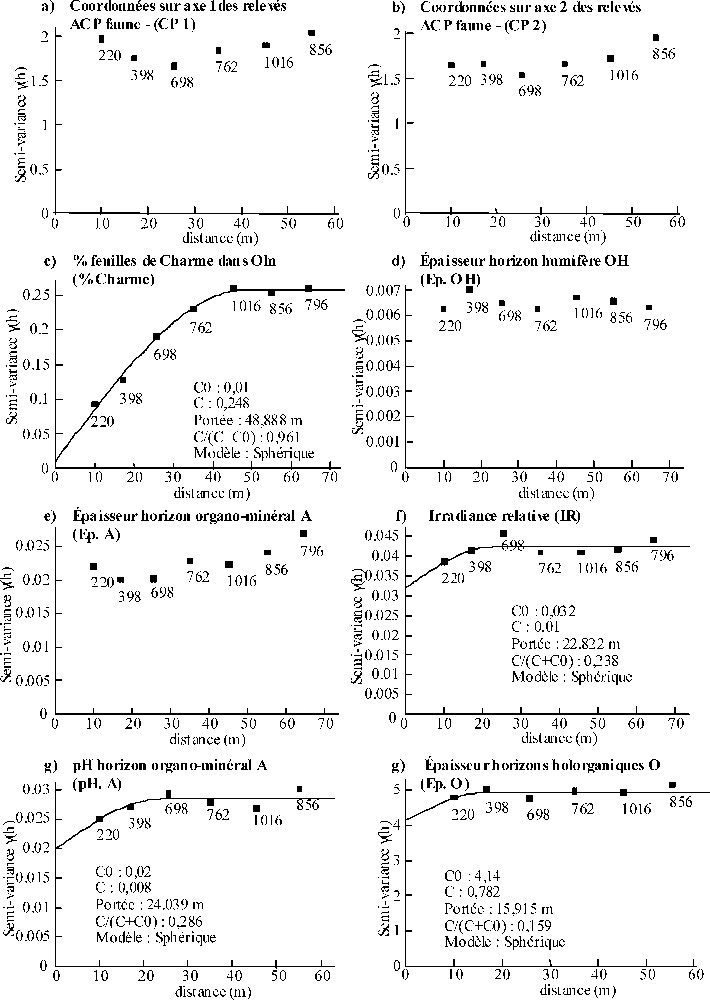
(a–g) Semi-variogrammes observés obtenus pour les coordonnées sur les axes 1 et 2 de l'ACP « faune » des relevés sous peuplement mélangé et les principales variables mésologiques explicatives de la répartition spatiale de la macrofaune du sol à l'échelle du peuplement, d'après l'analyse de co-inertie (cf. Fig. 3). Des modèles théoriques (____) ont été ajustés lorsque les semi-variogrammes mettaient en évidence une structure spatiale.
4 Discussion
4.1 Densité et structures des communautés de la macrofaune
La comparaison des densités des différents groupes taxonomiques rencontrés sur nos deux sites avec les données publiées dans littérature apparaît délicate au regard de la grande variabilité de ces dernières (voir [49,50]). Néanmoins, les densités de diplopodes et isopodes sous nos peuplements sont en accord avec celles rapportées par Geoffroy et al. [51] et David [52] dans des forêts feuillues tempérées, développées sur des sols acides, avec des formes d'humus similaires (mull-moder à dysmoder) : respectivement 40 et 20 ind m−2. Dans ce même type de milieu, la richesse spécifique et les densités de lombricidés sont faibles, avoisinant respectivement quatre espèces et 20 ind m−2 [53–55]. Selon les travaux de David et al. [56], les densités de ces trois groupes de détritivores dans les deux sites correspondraient à celle rencontrées dans des formes d'humus de type mull-moder. Cependant, les formes d'humus sous PP sont essentiellement du type hemimoder–eumoder selon la classification française [21] tandis qu'elles sont de type dysmull–hemimoder sous PM [23]. Des vitesses de décomposition équivalentes entre (i) des sites à très forte diversité de litière et faible densité d'isopodes et (ii) des sites à plus faible diversité de litières et plus forte densité d'isopodes ont déjà été observées [57]. Les différences macro-morphologiques de l'épisolum humifère entre nos deux sites n'apparaissent donc pas attribuables au compartiment fonctionnel de la macrofaune détritivore.
La majeure partie des taxons rencontrés présente des densités significativement inférieures sous PM. Concernant les détritivores, la richesse spécifique moyenne par point est même supérieure sous PP. Deux propositions peuvent être formulées pour expliquer ce résultat : (i) la prédominance des formes d'humus de type moder sous PP et (ii) la perturbation engendrée par la dernière coupe d'éclaircie plus récente sous PM. Les moders sont caractérisés par de fortes épaisseurs des horizons holorganiques et une hétérogénéité verticale importante due à la superposition des horizons OLn, OLv, OF et OH [22,58]. Geoffroy et al. [51] ont montré que ces différents horizons n'étaient pas colonisés par les mêmes taxons. Parmi les prédateurs, les araignées affectionnent les couches L et F tandis que les chilopodes se situent plutôt dans la couche H et l'horizon A. Chez les détritivores, les diplopodes ne s'installent pratiquement pas dans les couches L au contraire des Isopodes. Ceci expliquerait les plus faibles densités de Glomeris marginata, Chordeuma sylvestre, Trachypodoiulus albipes (diplopodes) et des chilopodes sous PM. Une autre explication pourrait être l'impact de la dernière coupe d'éclaircie (1998 pour PM et 1995 pour PP), c'est-à-dire réduction des apports de litière, déplacement de la litière et tassement du sol, apport de lumière au sol plus important. Peu de travaux se sont intéressés à l'impact des coupes d'éclaircie sur les communautés de macro-invertébrés du sol. Deconchat [59] rapporte une modification des communautés de la mésofaune deux ans après l'exploitation d'un peuplement, par disparition de certaines espèces. Ces modifications semblent se résorber dans une période de trois à dix ans après la coupe. Bengtsson et al. [60] ont montré que les effets d'une coupe à blanc sur les communautés d'arthropodes étaient plutôt d'ordre quantitatif (chute de l'abondance) que qualitatif (pertes d'espèces). David et al. [13], lors d'une expérimentation d'interception de litière, ont rapporté une chute de l'abondance des macro-arthropodes 1 à 2,5 ans selon les groupes, après le début de l'expérience. Par ailleurs, Geoffroy et al. [51] ont rapporté que certains groupes tels que les isopodes supportaient difficilement le piétinement. On peut donc émettre l'hypothèse que le laps de temps écoulé depuis la dernière éclaircie sous PM n'est pas assez important pour que les modifications structurales engendrées sur les communautés de macro-invertébrés du sol se soient résorbées. Une étude diachronique entre deux coupes successives permettrait de tester cette hypothèse.
4.2 Facteurs de variabilité spatiale
Il est souvent difficile de distinguer l'effet habitat de la litière (quantité) de son effet trophique (qualité de la ressource) [3,17]. Sous PP, le principal facteur de variabilité est la vitesse de décomposition de la litière. Les conclusions quant à son effet sur la répartition spatiale de la macrofaune sont ambiguës. Une décomposition rapide va influencer à la fois (i) la ressource spatiale, c'est-à-dire une réduction des épaisseurs des horizons holorganiques conduisant à une perte de l'intégrité physique de l'habitat et (ii) la ressource trophique, c'est-à-dire une minéralisation plus importante de la matière organique fraîche (MOF) conduisant à une libération de substrats aisément assimilables par les macro-invertébrés [58]. Dans les deux cas, la variabilité spatiale de la macrofaune (en particulier les détritivores) n'est pas conditionnée par les retombées de litière, mais par les processus de minéralisation au sein de l'épisolum. Dans ce système, la macrofaune détritivore étant composée d'organismes fragmenteurs de litière [61], les processus de décomposition sont essentiellement assurés par la microflore [6]. L'intensité de leur activité va alors contrôler la répartition spatiale de la macrofaune.
Sous PM, la présence d'une litière de meilleure qualité conduit à un rejet de l'activité des formes d'humus en facteur de second ordre par l'analyse de co-inertie. Ceci est en accord avec le modèle hiérarchique des facteurs contrôlant les processus de décomposition dans les écosystèmes terrestres, proposé par Lavelle et al. [1]. Le principal facteur explicatif de la répartition spatiale de la macrofaune se trouve donc être la ressource trophique : qualité de la MOF, conditionnée par les retombées de litière.
4.3 Attributs structurels des communautés de détritivores
Les régressions LOWESS n'ont pas permis la mise en évidence de fortes corrélations statistiques entre les variables de structure des communautés de détritivores et les variables mésologiques supposées explicatives de la répartition de la macrofaune après les analyses de co-inertie. Aucun modèle mathématique n'a donc été recherché. Cependant, les régressions ont révélé que la richesse spécifique et la densité des détritivores avaient tendance à être maximales pour un pourcentage de feuilles de charme dans la litière compris entre 25 et 35 %. Si ces tendances doivent être vérifiées par des expériences de manipulation de litière en conditions contrôlées, deux interprétations peuvent être avancées face à ce résultat. Chez les détritivores, un compromis peut exister entre le choix d'une ressource trophique facilement assimilable et le choix d'un habitat fonctionnel (protection contre la sécheresse, la chaleur, la lumière) [17]. De même, un compromis peut exister entre le coût énergétique de la recherche d'une ressource potentiellement plus profitable et les bénéfices de se nourrir à l'endroit où se trouve l'individu [4]. Un taux de feuilles de charme dans la litière compris entre 25 et 35 % apparaît comme étant le bon compromis. Un pourcentage supérieur accroît la quantité de ressource facilement assimilable ; cependant, sa décomposition plus rapide réduit l'intégrité physique de l'habitat. Un pourcentage inférieur conserve l'intégrité de l'habitat aux dépens de la qualité de la ressource. Une autre interprétation pourrait être apportée par l'application de l'hypothèse du stress intermédiaire [62,63] : la diversité est maximale pour un niveau moyen de stress environnemental. L'effet de la qualité–quantité de la ressource pouvant prévaloir sur l'hétérogénéité de sa répartition ; l'hypothèse du stress intermédiaire suggère alors un maximum de diversité des détritivores pour un niveau moyen de la qualité de la ressource et de l'habitat [17,64].
4.4 Patrons spatiaux des communautés et des variables mésologiques
La présente étude avait pour objectif d'appréhender les facteurs de contrôle de la variabilité spatiale de la macrofaune à l'échelle du peuplement forestier. L'utilisation de l'analyse de co-inertie a permis de mettre en évidence des corrélations statistiques entre les patrons de composition des communautés de la macrofaune et les patrons de variations des variables mésologiques échantillonnées dans les deux peuplements. Cependant, l'emploi de géostatistiques n'a pas permis de montrer une superposition des patrons spatiaux de ces communautés avec celle des variables mésologiques fortement corrélées aux principaux axes des analyses de co-inertie. Exception faite du pourcentage de feuilles de charme dans la litière du PM, les fortes variances pépites observées laissent supposer l'existence de structures spatiales à des échelles inférieures à celle de la maille utilisée pour l'échantillonnage dans cette étude. Saetre et al. ainsi que Mottonen et al. [65,66] ont montré que les patrons spatiaux des communautés bactériennes et fongiques sous peuplements résineux étaient respectivement de 11 et 4 m. Au regard de ces travaux et de nos résultats (analyses de co-inertie et géostatistique), la répartition spatiale des micro-organismes pourrait être une explication à la plus forte variabilité spatiale des communautés de la macrofaune sous PP [18]. Dans le cas de PM, l'analyse de co-inertie a montré une relation entre les patrons de variation des communautés de la macrofaune et le pourcentage de feuilles de charme dans la litière. Or, si les retombées de litière de charme montrent une auto-corrélation spatiale à l'échelle du peuplement (environs 50 m), les communautés de la macrofaune ne montrent aucune structure spatiale à cette même échelle. Deux hypothèses peuvent expliquer ces résultats : (i) la macrofaune présente une structure spatiale plus fine que celle détectable par le dispositif d'échantillonnage (), ou bien (ii) l'absence de structure spatiale à l'échelle étudiée est due à l'impact de la dernière coupe d'éclaircie (1998 pour PM et 1995 pour PP), c'est-à-dire qu'à l'instar de la diversité, les communautés de la macrofaune n'ont pas recouvré leur structure spatiale d'avant le passage en coupe.
5 Conclusion
Au sein de l'épisolum humifère, les retombées de litière et les processus de décomposition de la matière organique régulent ensemble et à la fois la ressource habitat et la ressource trophique pour les invertébrés du sol [6]. Dans le cas du peuplement mélangé, notre hypothèse de départ était la suivante : la répartition spatiale de la macrofaune est contrôlée par la qualité de litière de charme (contrôle distal, c'est-à-dire externe à l'épisolum humifère). Cette hypothèse est validée par l'analyse de co-inertie, mais pas par les géostatistiques. Sous peuplement pur, la litière est monospécifique et de médiocre qualité (possédant un fort taux de composés phénoliques [58] qui la rendent peu appétente pour les organismes fragmenteurs [67]). La ressource facilement assimilable va donc être le produit le l'activité des microorganismes capables de rendre plus accessibles le carbone et l'azote contenus dans ces composés [58,67,68]. L'hypothèse du contrôle proximal de la répartition spatiale de la macrofaune (c'est-à-dire interne à l'épisolum humifère) est acceptée.
Acknowledgments
Nous tenons à remercier le conseil régional de Haute-Normandie pour la bourse accordée à M. Aubert ainsi que l'Office national des forêts pour son aide dans le choix des sites d'étude. Merci également aux deux lecteurs spécialistes pour leurs commentaires, qui ont grandement participé à améliorer la qualité de l'article.


