Abridged English version
The Octopus vulgaris of Morocco is of regional significant economical importance. Its reproduction cycle is characterized by a noticeable seasonal periodicity and consequently by an irregularity in its spawning periods. With the main objective of studying the sexual cycle and spawning periods of Octopus vulgaris in the southern Moroccan Atlantic, the present study proposes to detail the process of maturity at the level of the oogenesis and follicular cells. Indeed, a sequence of maturation stages in the male and female gonads will be presented; this will enable us to locate the spawning periods and contribute then to specify the adequate periods of fishing breaks in the region. The samples used were collected during various stages of maturation from December 2001 to May 2003 in commercial catches of coastal trawlers operating between Tan Tan and Boujdour. The gonads collected are directly fixed and coloured by haematoxylin, eosin and green light. The biometric analysis reveals the presence of a spectrum of lengths between 30 and 300 mm. Sex-ratio analysis confirms a predominance of females during the spawning periods, for instance in spring and autumn. Sexual maturity is in advance for males than females; indeed, the length at first maturity is estimated to be 121 mm for the males, while it is 143 for the females. Spawning periods are made out by analyzing monthly the RGS: the spring spawning period extends between March and July, while the autumnal period, which is less intense, takes place between September and October. The peaks of these two periods shift about one month every year. The evolution of germinal cell in male is characterized by a classic and centripetal differentiation. The cytological study shows the existence of five stages of development: spermatogenesis (stage I), spermatocytes I (stage II), spermatocytes II (stage III), spermatides (stage IV), and spermatozoids (stage V). In addition, the histological study of the ovary reveals that the ovarian dynamic is characterized by two principal phenomena: the previtellogenesis and vitellogenesis. During the sexual cycle, follicular cells can be either in phase of intense multiplication (stages IIIb and IIIc), or of yolk synthesis (IVa, IVb, and IVc); moreover, the multiplication of follicular cells covers the totality of the sexual cycle. Intense cellular multiplication (spermatogenesis and spermatocytes) takes place during May, June, and July. Then, the spermiogenesis starts in October and becomes very active during the rest of the sexual cycle. In addition, the sexual cycle of females is characterized by the stages IIIb and IIIc in October–December. Afterwards, the ovary starts the synthesis of yolk in the period December–January and continues until the period of mating. According to those results, the ovogenesis starts really in autumn; therefore, the maturation of females occurs approximately seven months later than that of males.
1 Introduction
Le poulpe Octopus vulgaris est une espèce exclusivement côtière, qui vit dans les profondeurs de 35 à 150 m. C'est une espèce abondante en Méditerranée, en Atlantique et dans les eaux japonaises [1]. Au Maroc, il revêt une grande importance économique de par son poids débarqué et sa valeur commerciale, ce qui lui confère une place particulière parmi les espèces exploitées dans la région. La biologie d'Octopus vulgaris a fait l'objet de plusieurs travaux [2–6] ; toutefois, peu d'auteurs ont insisté sur la gamétogenèse. C'est une espèce gonochorique semelpare, à courte durée de vie ; son cycle de vie s'achève par la reproduction.
Les études de l'activité de reproduction des céphalopodes, et particulièrement du poulpe [7,8], ont montré une périodicité saisonnière très marquée et une irrégularité dans les périodes de ponte. D'autant plus, les mâles atteignent précocement leur maturité sexuelle par rapport aux femelles [2,7,8]. La gamétogenèse d'Octopus mimus a fait l'objet d'études récentes [9,10] ; ces travaux ont montré que l'ovogenèse comprend neuf stades de développement et que la maturité folliculaire s'effectue sur 13 stades intra-ovariens. En outre, Olivares et al. [10] ont mis en évidence trois étapes de développement sexuel pour les mâles de taille moyenne 122 mm. En Mauritanie, Khallahi [11,12] a révélé l'existence de cinq stades de maturité des gamètes pour les femelles et quatre pour les mâles d'Octopus vulgaris. D'autre part, Koueta [13] et Koueta et Boucaud-Camou [14] ont signalé chez Sepia officinalis que l'ovocyte I était bloqué en première division de méioses durant l'ovogenèse.
Afin d'élucider le cycle sexuel et les périodes de ponte du poulpe Octopus vulgaris de l'Atlantique Sud-marocain, nous avons jugé utile et nécessaire d'étudier les paramètres biologiques de l'espèce et de détailler le processus de maturation à l'échelle des gonies et des cellules folliculaires. Ceci permettra de proposer une séquence de stades de maturation des gonades mâles et femelles et de marquer les périodes de ponte. Ces résultats pourront en effet contribuer à préciser les périodes adéquates pour le repos biologique de l'Octopus vulgaris dans le Sud marocain.
2 Matériel et méthodes
L'étude a été réalisée sur 2411 spécimens d'Octopus vulgaris (1280 femelles et 1131 mâles), collectés mensuellement au niveau des débarquements des chalutiers côtiers opérant entre Tan Tan (N) et Boujdour (N) (Fig. 1), de décembre 2001 à mai 2003. Ces individus ont été pêché à des profondeurs allant de 25 à 100 m, sur des fonds sableux à rocheux. Les mesures morphométriques prélevées sont : longueur dorsale du manteau () en millimètres, poids entier (P) et poids éviscéré (), au gramme près. Après une dissection ventrale, les gonades () sont prélevées et pesées au centième de gramme près. Les relations biométriques utilisées sont : taille–poids (), sex ratio testé par le test , taille à la première maturité sexuelle (), stades de maturité sexuelle : I = immatures (gonade petite, pas de spermatophores, ovaire sphérique de petite taille blanchâtre, ovocytes non visibles) ; II = en maturation (testicule en développement, spermatophores en formation, ovaire et glande de l'oviducte en cours de maturation, ovocytes visibles) ; III = matures (ovaire volumineux de couleur jaune due à l'abondance des ovocytes, testicule développé avec un maximum de spermatophores) ; rapport gonado-somatique (RGS). Pour l'étude histologique, les fragments de gonades ont été directement fixés au Bouin alcoolique pendant une durée de quatre jours. Les coupes minces de 5 μm d'épaisseur ont été colorées par l'hématoxyline, l'éosine et le vert lumière [15]. Les observations microscopiques ont été réalisées sous un microscope photonique muni d'un appareil photo (Leica).
Délimitation de la zone d'étude d'Octopus vulgaris entre Tan Tan (N) et Boujdour (N).
3 Résultats
3.1 Relation taille–poids et distribution des fréquences de taille
La régression linéaire établie entre le poids entier (P) et le poids éviscéré () du poulpe a montré une parfaite corrélation entre les deux mesures pour le sexe combiné, avec un coefficient de corrélation (Fig. 2). Le facteur a et le coefficient d'allométrie b sont présentés dans le Tableau 1. Pour les deux sexes, le coefficient b a toujours été significativement inférieur à 3 ; l'allométrie de croissance est donc minorante. Le poids d'Octopus vulgaris du Sud marocain croît proportionnellement moins vite que sa taille.
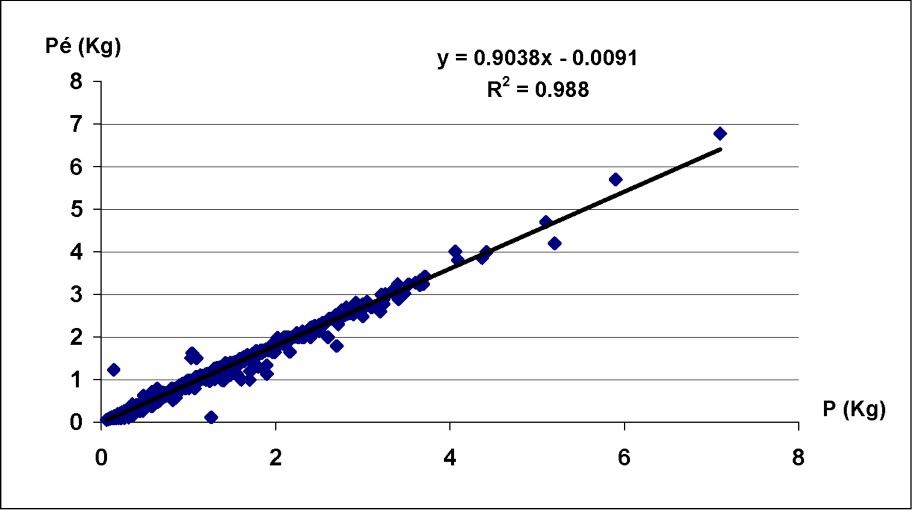
Paramètres de la relation () d'Octopus vulgaris dans le Sud marocain.
Paramètres de la relation taille–poids d'Octopus vulgaris du Sud marocain
| Sex | a | b | n | R |
| Mâles | 0,0088 | 2,792 | 1407 | 0,81 |
| Femelles | 0,0086 | 2,794 | 1665 | 0,84 |
| S. combinés | 0,0087 | 2,79 | 3072 | 0,92 |
Par ailleurs, sur un sous-échantillon de 653 poulpes, les individus de tailles de 30 à 40 mm n'avaient pas encore de bras hectocotyle. D'après les résultats du Tableau 2, la taille moyenne du poulpe à sexe discernable correspond à la classe 65 mm, avec 63% des individus étudiés. À la taille de 90 mm, 100% d'individus ont un sexe discernable.
Proportion en pourcentage et par classe de taille des individus d'Octopus vulgaris à sexe extérieurement discernable
| Classe de taille (mm) | Effectifs par classe | % d'individus à sexe discernable | ||
| Non discernable | Discernable | Total | % | |
| 30 | 2 | – | 2 | 0% |
| 40 | 14 | – | 14 | 0% |
| 50 | 43 | 4 | 47 | 9% |
| 60 | 45 | 31 | 76 | 41% |
| 65 | 15 | 25 | 40 | 63% |
| 70 | 5 | 64 | 69 | 93% |
| 80 | 2 | 125 | 127 | 98% |
| 90 | – | 128 | 128 | 100% |
La structure des fréquences de tailles, exprimé en pourcentages, est illustrée dans la Fig. 3. Le spectre des tailles est large, variant de 60 à 300 mm pour les mâles et de 60 à 240 mm pour les femelles. Trois modes ont été mis en évidence pour les deux sexes : un mode de jeunes individus, de 70 et 90 mm respectivement pour les mâles et les femelles, et deux modes de géniteurs : 120–220 mm pour les mâles et 150–200 mm pour les femelles.
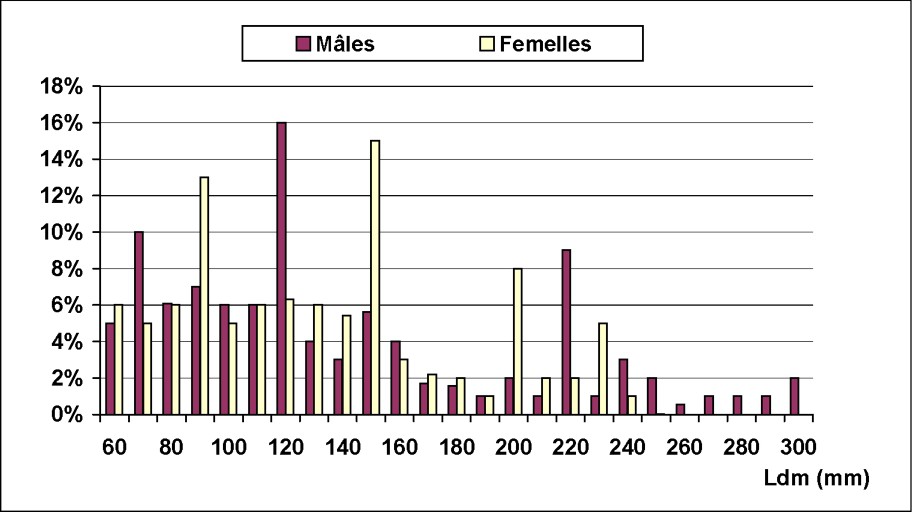
Distribution des fréquences de tailles des mâles et des femelles d'Octopus vulgaris dans le Sud marocain.
3.1.1 Indices de maturité sexuelle
Le sex ratio d'Octopus vulgaris a été estimé mensuellement. Le test a été ensuite utilisé pour tester l'égalité du sex ratio au cours des saisons. Le test a montré une différence significative entre les saisons, au seuil de 5%. Cette différence ne serait donc pas attribuable aux fluctuations d'échantillonnage. Le sex ratio a été en faveur des femelles durant le printemps, l'été et l'automne, tandis qu'il était en faveur des mâles en hiver. L'évolution mensuelle du sex ratio a aussi montré une irrégularité du taux de femelles dans les prises côtières ; le taux le plus élevé a été enregistré en juin 2003. Les femelles sont largement représentées par les individus de classes de taille allant de 60 à 200 mm (Fig. 4).
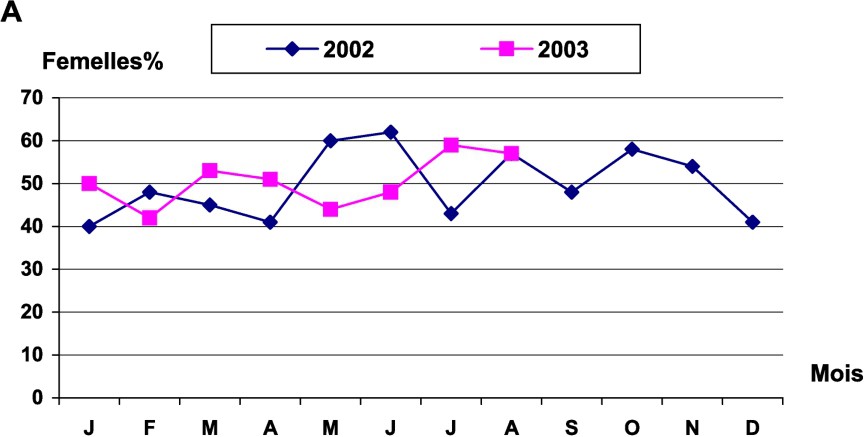
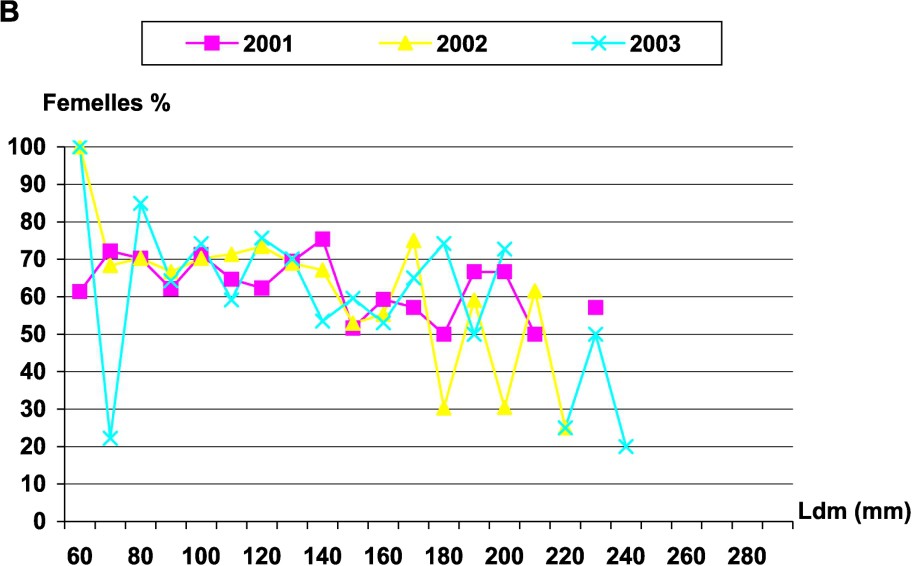
Évolution du sex ratio chez les femelles d'Octopus vulgaris : (A) en fonction des mois (B) par classes de tailles.
Les stades de maturité sexuelle ont été déterminés macroscopiquement chez tous les individus étudiés. L'échelle de maturité utilisée est celle décrite par [16]. L'évolution mensuelle, par pourcentages, des stades de maturité sur les 18 mois d'étude a montré que le nombre de males et de femelles mûres n'est jamais nul ; la ponte serait donc étalée sur plusieurs mois, mais avec des maximums pendant certaines périodes de l'année (Fig. 5). Un maximum de mâles mûrs se situe entre mars et juillet, tandis qu'il se déplace entre juin et juillet pour les femelles.
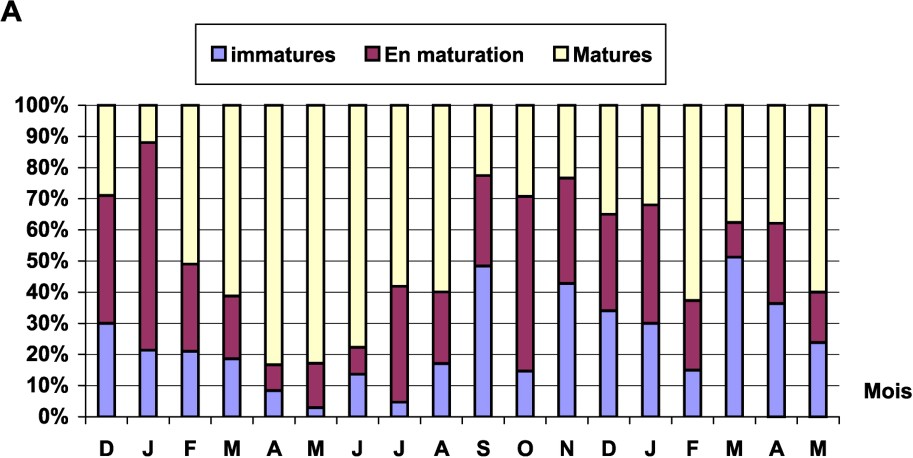
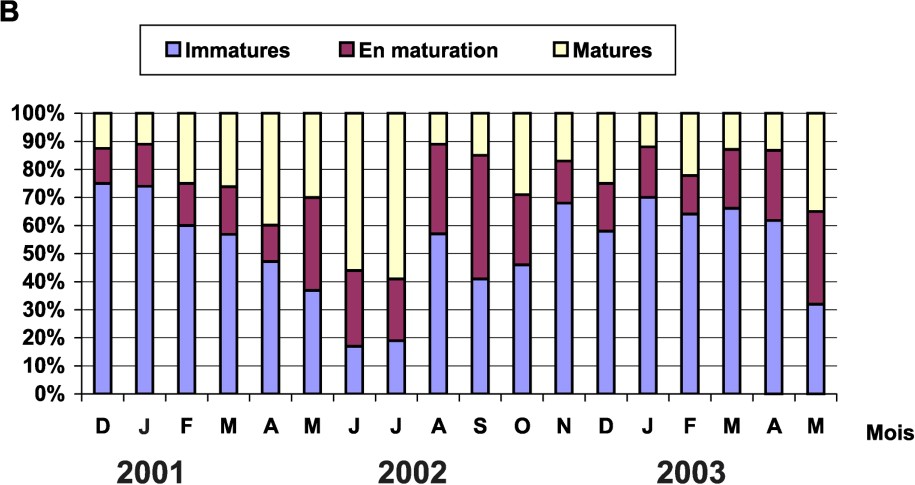
Évolution mensuelle du pourcentage de stades de maturités sexuelle : (A) chez les mâles et (B) chez les femelles.
La Fig. 6 montre la taille à la première maturité sexuelle. Cette taille a été de l'ordre de 121 mm pour les mâles et de 143 mm pour les femelles. Les mâles mûrissent donc plus tôt que les femelles. Les variations mensuelles du RGS chez Octopus vulgaris sont données dans la Fig. 7. Pour les femelles, la fourchette de variations du RGS est plus étendue ; la moyenne mensuelle variant entre 0,21 et 1,45. L'évolution du RGS montre un pic important en juin 2002, suivi d'un deuxième en septembre 2002, moins intense et plus étendu ; en 2003, le pic se manifeste en juin. Cependant, ces pics ne semblent pas avoir la même intensité d'une année à l'autre. Pour les mâles, l'évolution mensuelle du RGS a mis en évidence une période maximale d'activité sexuelle qui se situe entre mars et juin 2002, suivie d'une second période en novembre de la même année. En 2003, l'activité reproductrice débute en février et s'étend jusqu'à mai.
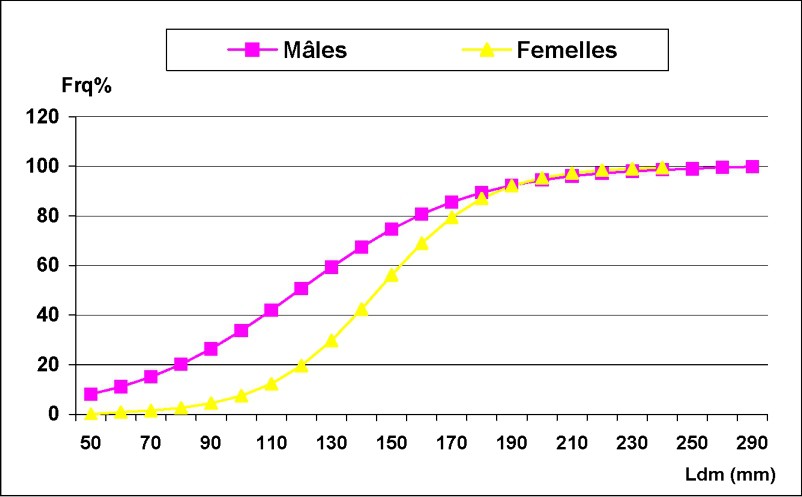
Taille à la première maturité sexuelle chez les mâles et les femelles d'Octopus vulgaris dans le Sud marocain.
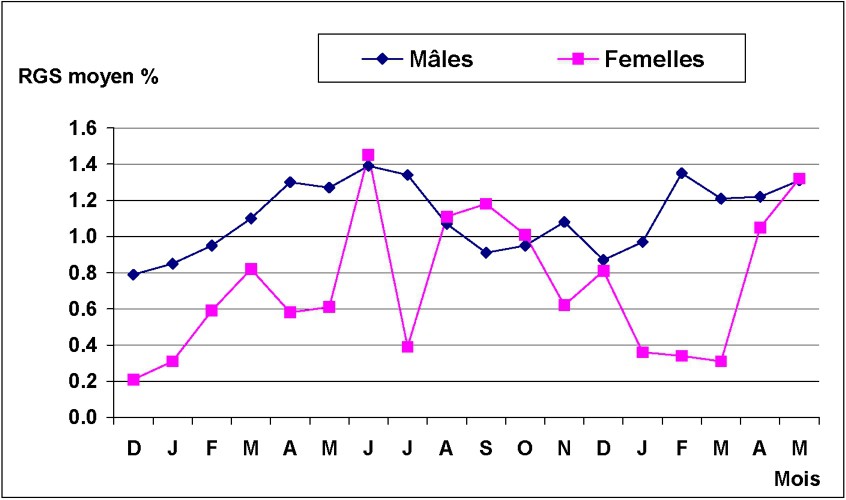
Évolution mensuelle du RGS moyen chez les mâles et les femelles d'Octopus vulgaris dans le Sud marocain.
On en conclut l'existence de deux périodes de ponte chez l'Octopus vulgaris du Sud marocain, accomplies par deux types de reproducteurs ayant deux modes différents. Ceci confirme d'avantage l'idée de l'existence de deux cycles, qui se chevauchent dans le temps et dans l'espace [8,17].
3.2 Histologie
3.2.1 Structure microscopique de la gonade mâle
La spermatogenèse est caractérisée par une différenciation classique et centripète. Le début de la maturation génitale est marqué par la mise en place des tubules séminifères. En effet, les cellules conjonctives et musculaires s'assemblent pour délimiter la périphérie des cystes. Sur la coupe, on trouve des spermatogonies moins différenciées, proches de la membrane limitante externe du tubule (Fig. 8a). Chez les individus sexuellement mûrs, la gonade est formée par des tubules séminifères très développés (Fig. 8b). On rencontre, de la périphérie du tubule séminifère vers la lumière centrale, les spermatogonies (stade I), les spermatocytes I (stade II), les spermatocytes II (stade III), les spermatides (stade IV) et la différenciation des spermatides en spermatozoïdes (stade V), qui se situe dans la lumière centrale du cyste (Fig. 8c–d). Dans chaque segment des tubules séminifères, le processus de la spermatogenèse se produit suivant une séquence centripète et régulière. Ainsi, à chaque instant, presque tous les spermatocytes II d'une partie du cyste sont en train de se diviser ; il en est de même dans le segment voisin. Les spermatocytes I possèdent un noyau de grande taille et présentent une condensation progressive des chromosomes (phénomène d'accroissement) ; ils sont suivis par les spermatocytes II, qui ont un noyau plus petit. Les spermatides sont, au début, sphériques, et s'allongent par la suite (spermiogenèse). Une fois l'élongation des spermatides achevée, les spermatozoïdes subissent un processus de maturation, qui leur confère la possibilité de féconder (Fig. 8e). En effet, le phénomène de transition des spermatides en spermatozoïdes mûrs est accompagné par des modifications de taille, de forme et des propriétés métaboliques (Fig. 8f). Après l'accouplement, le cyste testiculaire se rétrécit et la lumière centrale devient vide de spermatozoïdes (Fig. 8h).

Anatomie microscopique de la gonade mâle d'Octopus vulgaris. (a) Testicule immature à la fin mai ; (b) Testicule en maturation (juin–juillet) ; (c) développement et multiplication intense du testicule (août–septembre) ; (d) testicule mûr au mois de septembre ; (e) début de spermiogenèse active en octobre ; (f) spermatozoïdes entourés par des flagelles en formation (octobre) ; (g) cyste testiculaire mâle en post-accouplement (juin). Abréviations : tcm, tissu conjonctivo-musculaire ; sg, spermatogonies ; SpI, spermatocytes I ; SpII, spermatocytes II ; st, spermatides ; spz, spermatozoïdes ; d, divisions ; fl, flagelles ; lu, lumière.
3.2.2 Structure microscopique de l'ovaire
Le suivi de la dynamique ovarienne chez la femelle a montré que l'ovaire renferme des ovogonies disséminées entre les cellules folliculaires, des ovocytes en début de prévitellogenèse, des ovocytes en prévitellogenèse et des ovocytes en vitellogenèse (Fig. 9a et b). L'ovaire est formé d'un ensemble de follicules et d'un tissu conjonctif richement vascularisé. Chaque follicule est relié à la masse conjonctive centrale par un pédicelle constitué de vaisseaux sanguins et de tissu conjonctif.
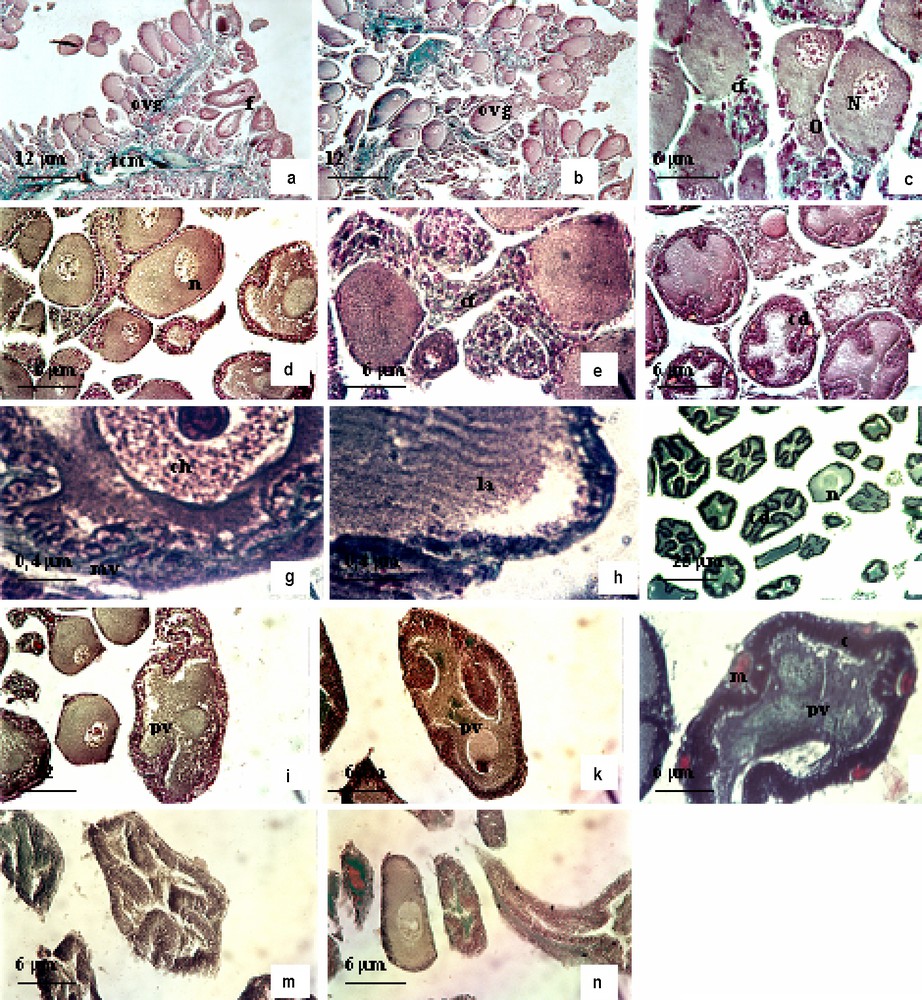
Anatomie microscopique de l'ovaire du poulpe Octopus vulgaris. (a) Ovaire en cours de maturation ; (b) ovocytes en stade IIIa, stade IIIb et stade IIIc ; (c)–(e) poulpe immature stade IIIa, en juillet–août ; (f) ovocyte au stade IIIb en août et septembre ; (g)–(h) ovocyte I au stade IIIb dans l'ovaire du poulpe en cours de maturation (octobre) ; (i) ovocyte I en stade IIIc en octobre et en novembre ; (j) ovocyte I en vitellogenèse, stade IVb en décembre ; (k) ovocyte I en vitellogenèse, stade (IVc) de décembre à janvier ; (l) ovocyte I mûre stade V, vitellogenèse en février ; (m)–(n) ovaire en post-ponte en mai. Abréviations : ovg, ovogonie ; tcm, tissu conjonctivo-musculaire ; , follicule mûr ; o, ooplasme ; n, noyau ; cf, cellules folliculaires ; mv, microvillosités ; la, lamelles annelées ; pv, plaquettes vitellines ; c, chorion.
3.2.2.1 Stade IIIa (prévitellogenèse).
L'ovocyte est de forme sphérique, avec un noyau central. Il est entouré par une seule couche de cellules folliculaires (Fig. 9c). Le cytoplasme contient de nombreuses mitochondries et des vésicules claires, abondantes à la périphérie de l'ovocyte (Fig. 9d et e).
3.2.2.2 Stade IIIb (prévitellogenèse).
L'ovocyte prend une forme ovoïde, son noyau est repoussé vers le pôle animal de la cellule. L'ooplasme présente de nombreux remaniements morphologiques. Les cellules folliculaires s'agencent sous forme de cordons qui pénètrent à l'intérieur, l'axe de chaque cordon étant occupé par un vaisseau sanguin et un peu de tissu conjonctif (Fig. 9f). Au niveau de l'enveloppe nucléaire de l'ovocyte se développent de nombreux pores (Fig. 9g et h). On note la présence des lamelles annelées dans le cytoplasme de l'ovocyte.
3.2.2.3 Stade IIIc (prévitellogenèse).
Les cordons folliculaires envahissent la totalité du cytoplasme de l'ovocyte. Les microvillosités sont plus développées que pendant le stade précédent. Au cours de ce stade, le cytoplasme contient des citernes de réticulum endoplasmique et un appareil de Golgi. Les figures de division sont de plus en plus nombreuses dans les cellules folliculaires : c'est la phase de multiplication intense (Fig. 9i).
3.2.2.4 Stade IVa (début de la vitellogenèse).
Ce stade est caractérisé par deux événements principaux : l'augmentation considérable de la taille des cellules folliculaires et le dépôt des premiers éléments constituant le vitellus secondaire dans l'ooplasme. Ces formations vitellines sont peu abondantes et de forme assez irrégulière à structure para cristalline (Fig. 9j).
3.2.2.5 Stade IVb (vitellogenèse).
Les cordons folliculaires sont toujours présents à l'intérieur de l'ovocyte. À la maturité, la taille du follicule ovarien augmente proportionnellement avec le poids de l'ovaire.
3.2.2.6 Stade IVc (vitellogenèse).
Au cours de la formation du vitellus, les cordons folliculaires sont repoussés vers l'extérieur, en l'absence d'inclusion lipidique. À la fin de ce stade, les cellules folliculaires régressent et se trouvent éliminées de la surface ovocytaire, et il y a la mise en place du chorion (Fig. 9k).
3.2.2.7 Stade V (fin de vitellogenèse).
L'œuf est allongé, les cordons des cellules folliculaires ont complètement disparu, l'ovocyte est entouré par un chorion. Les plaquettes vitellines sont encastrées les unes dans les autres. Au cours de l'élaboration du vitellus, l'ooplasme est refoulé vers l'extrémité de l'œuf. Il forme une mince couche s'étendant entre le chorion et le vitellus. Le vitellus, constitué par des lipo-glycoprotéines, est très abondant à la fin de ce stade de développement (œufs télolécithes) (Fig. 9l).
3.2.2.8 Stade VI (émission de l'ovocyte : post-ponte).
Au cours de la période de ponte (printemps), les follicules ovariens sont en dégénérescence, avec présence de résidus cellulaires (Fig. 9m et n).
Le cycle sexuel de la phase exploitée d'Octopus vulgaris du Sud marocain est récapitulé dans la Fig. 10. Pour les mâles, le cycle est dominé par la spermiogenèse active, qui débute en octobre et s'étend jusqu'à la saison d'accouplement (printemps). Pour les femelles, le processus est un peu plus long : la prévitellogenèse commence en août et s'étend jusqu'au mois de décembre ; la vitellogenèse se déclenche à partir de la mi-décembre et s'étend jusqu'à la période de ponte (printemps). La maturation est par conséquent plus tardive chez les femelles ; elle s'étend sur environ sept mois, alors qu'elle ne dure chez les mâles que trois mois.
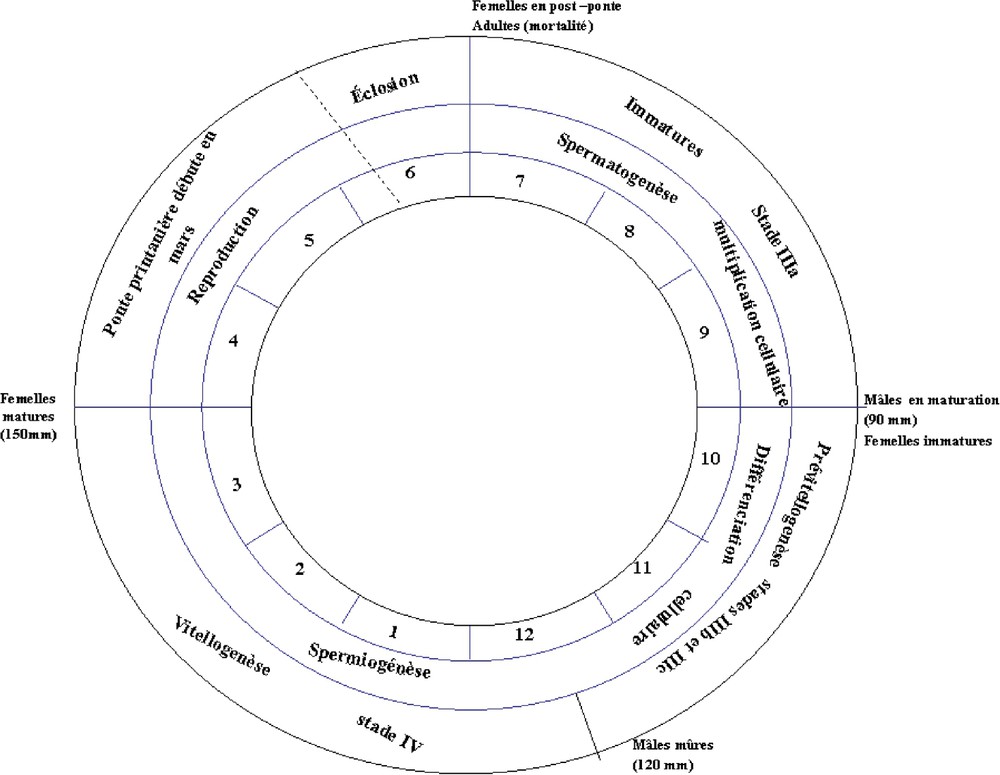
Cycle sexuel du poulpe Octopus vulgaris du Sud marocain.
4 Discussion et conclusions
Depuis une vingtaine d'années, les rendements et les débarquements du poulpe Octopus vulgaris au large des côtes marocaines présentent une baisse significative [18]. La bonne connaissance de cette ressource grâce à des études sur la biologie, sur l'écologie et sur la dynamique des populations apparaît indispensable. Dans ce contexte, le présent travail a pour objectif d'étudier les modalités du cycle sexuel de cette espèce dans le Sud marocain.
L'analyse des paramètres biologiques du poulpe Octopus vulgaris a révélé la présence d'un large spectre de tailles, qui varient de 30 à 300 mm. L'allométrie de croissance estimée par les auteurs [3–5] est minorante, aussi bien en Atlantique qu'en Méditerranée ; ceci est conforme à nos résultats. Le sex ratio a montré une prédominance des femelles durant la saison de ponte. À titre comparatif avec d'autres résultats, Mangold-Wirz [2] et Guerra [7] ont révélé que le sex ratio est dominé en Méditerranée par les mâles, ainsi qu'en Mauritanie [8] le sex ratio est légèrement en faveur des mâles et présente des fluctuations importantes interannuelles en fonction de la bathymétrie. Selon Mangold-Wirz [2], la déviation à la proportion pourrait être due à des raisons d'ordre écologique ou morphologique. La maturité sexuelle d'Octopus vulgaris au sud du Maroc est précoce chez les mâles par rapport aux femelles. Le même résultat a été rapporté dans différents régions et pour tous les céphalopodes [2–8,13,14,17,19–21]. La maturité sexuelle du poulpe en Méditerranée est généralement plus précoce que dans l'Atlantique ; cette différence pourrait être expliquée par l'influence de la température et de la disponibilité de la nourriture [2]. Par ailleurs, les géniteurs du poulpe ont été présents durant tout le cycle annuel : ceci est en concordance avec le résultat des auteurs précités et celui de Cortez et al. [22], qui ont en effet montré qu'au nord du Chili, l'activité reproductive d'Octopus minus est étalée sur tout le cycle annuel, avec une période maximale située entre le printemps et l'été. L'évolution mensuelle du RGS a révélé la présence de deux périodes de ponte : une ponte printanière, qui s'étend sur trois à quatre mois (de mars à juillet) et une ponte automnale, moins intense, entre septembre et octobre. Dans le Tableau 3 sont présentés les résultats d'autres auteurs. Ces deux périodes sont citées par les travaux réalisés dans l' Atlantique, tandis que la ponte en Méditerranée s'est globalement limitée à une seule période. Boyle et Knobloch [1] ont expliqué que les espèces de poulpe ont des périodes de ponte différentes, passant d'une saison déterminée à tout un cycle annuel. En outre, Mangold-Wirz [2] a souligné que les périodes de ponte peuvent différer pour la même espèce de poulpe selon la région, ou pour plusieurs espèces cohabitant dans une même zone.
Périodes de ponte du poulpe Octopus vulgaris selon différents auteurs
| Périodes de ponte | Zone d'étude | Auteurs |
| mai–juin//septembre–octobre | cap Blanc | [19] |
| mai –juillet//septembre–novembre | cap Blanc | [18] |
| mars–mai//septembre–octobre | Mauritanie | [8] |
| mars//septembre | mer Catalane | [2] |
| janvier–juillet | Espagne | [4] |
| avril–juillet | Méditerranée | [5] |
| mai–juin | Méditerranée | [7] |
La spermatogenèse d'Octopus vulgaris dans le Sud marocain commence par une multiplication intense et centripète des spermatogonies et des spermatocytes. Le même processus est observé chez Octopus vulgaris en Mauritanie [11] et chez Octopus mimus au Chili [10]. La multiplication cellulaire a lieu en mai, juin et juillet ; elle est suivie d'une différenciation cellulaire, qui débute en octobre et se prolonge jusqu'à la ponte suivante. Cinq stades de développement gonadique ont été mis en évidence. Khallahi [11] et Olivares et al. [10] ont identifié respectivement quatre et trois stades dans leurs zones d'étude, en se limitant à des individus sexuellement matures. La vitellogenèse chez l'Octopus vulgaris se traduit par une multiplication intense des cellules folliculaires. Au début, ces cellules forment des cordons folliculaires, qui envahissent par la suite la totalité de l'ooplasme ovocytaire. Les travaux effectués généralement sur les octopode [9,11] et les décapodes [13,14,19,23,24] ont effectivement montré que l'ovogenèse se caractérise par d'étroites relations entre l'ovocyte et les cellules folliculaires. Les auteurs ont mis l'accent sur le rôle vraisemblable joué par les cellules folliculaires dans la synthèse et le dépôt du vitellus : à l'approche de la maturité, l'ovaire du poulpe présente une prolifération des cellules folliculaires à l'intérieur de l'ovocyte. Ces cellules sont étroitement engrenées avec les replis de la membrane plasmique pour former les cordons folliculaires [22,23]. La vitellogenèse prend lieu par l'apparition des vitellus à structure para cristalline. Une zone pellucide est ensuite mise en place et différencie l'ovocyte et les cellules folliculaires [13,14,23,24].
Nous avons identifié à travers cette étude huit stades du développement du follicule ovarien chez l'Octopus vulgaris du Sud marocain. Les observations microscopiques montrent que l'ovaire des femelles en post-ponte garde une entité importante d'ovocytes à différents stades de développement (IIIb, IIIc et IV). Olivares et al. [9], Dia [17], Koueta [13] et Medhioub [20] ont en effet confirmé que le développement ovocytaire est non synchrone. Khallahi [11] a distingué cinq stades de développement : trois stades en prévitellogenèse, la vitellogenèse et la post-ponte. D'après Khallahi [11], la ponte est totale chez Octopus vulgaris, du fait qu'il y a un arrêt du développement des ovocytes les plus évolués, dans l'attente de l'évolution des autres. Cette hypothèse reste néanmoins à discuter, vu le faible effectif utilisé dans cette étude (30 individus). Dans le Pacifique, [9] a décrit neuf stades d'ovogenèse pour les individus matures : prolifération, folliculogenèse, formation glandulaire, début de la vitellogenèse, vitellogenèse, fin de la vitellogenèse, pré-ovulation, ovulation et post-ovulation. Le mode de ce développement gonadique est non synchronique.
Des recherches antérieures sur les céphalopodes ont démontré que le cycle sexuel était lié à des facteurs internes et externes, tels que la photopériode, la température et la salinité. En effet, Richard [25], Koueta et al. [26] et Henry [27] ont montré que les glandes optiques jouent un contrôle endocrine sur la maturation génitale et la vitellogenèse et la couvaison des œufs chez Octopus vulgaris. Koueta et Boucaud-Camou [14], Dhainaut et Richard [24], Henry et al. [28], Henry et Zatylny [29], ainsi que Palmegiano et D'Apote [30], ont montré que la glande optique contrôle la maturité génitale, la vitellogenèse la ponte et la dégénérescence post-reproductive chez la seiche. Les résultats obtenus dans le présent travail apportent des précisions quant à la gamétogenèse, l'apport des glandes annexes et la fécondation chez la variété Octopus vulgaris des côtes du Sud marocain et confirment, dans cette région, l'effet des variations saisonnières sur la maturation sexuelle et la ponte observé chez les céphalopodes. Toutes ces données permettront d'apporter des précisions dans la période de ponte, le développement et la survie larvaire, avec leur incidence sur le recrutement, en vue d'une bonne gestion des stocks d'Octopus vulgaris dans la région.


