1. Introduction
L’adressage ciblé de molécules thérapeutiques constitue un défi médical majeur. Les caractéristiques physico-chimiques de nombreux principes actifs rendent, en effet, souvent difficile leur passage à travers les barrières biologiques, et les barrières enzymatiques peuvent également entraîner leur métabolisation rapide, en particulier lorsqu’il s’agit de molécules fragiles issues des biotechnologies, comme les acides nucléiques, les protéines ou les peptides. Beaucoup de molécules diffusent mal à l’intérieur des cellules ou sont incapables d’atteindre les compartiments intracellulaires au niveau desquels sont localisées leurs cibles biologiques spécifiques. C’est dans ce contexte que le développement de nanomédicaments (nanovecteurs encapsulant un principe actif) a pris une importance considérable, offrant des systèmes d’administration submicroniques, d’une taille comprise entre quelques dizaines et quelques centaines de nanomètres, capables de contrôler la libération du médicament encapsulé au bon moment et au bon endroit de l’organisme. Ces avancées ouvrent la voie à la découverte de nouvelles approches thérapeutiques dans de nombreux domaines (oncologie, infectiologie, maladies métaboliques ou neurologiques, etc.), mais aussi diagnostiques (imagerie) et vaccinales. Les nanomédicaments étant généralement administrés par une voie systémique (intraveineuse), la palette des matériaux susceptibles d’être utilisés pour leur préparation est relativement limitée car ceux-ci doivent être biocompatibles, biodégradables et ne pas générer de métabolites toxiques. Mais la mise en œuvre de matériaux organiques qui répondent à ces contraintes permet de préparer des nano-vecteurs de taille, de forme et de morphologie très variées, comme les liposomes (vésicules phospholipidiques) [1], les nanoparticules polymères (à base de polymères biodégradables d’acide poly-lactique-co-glycolique ou de polyalkylcyanoacrylate) [2], les micelles (à base de polymères amphiphiles) [3], les nanoparticules lipidiques [4] ou les dendrimères (à base de polymères en étoile) [5]. Des nanomatériaux inorganiques (comme les nanoparticules ultrafines d’oxyde de fer USPIO) [6, 7] ou des hybrides organiques-inorganiques (comme les « metal oxyde frameworks » ou NanoMOFs) peuvent aussi être utilisés pour la construction de nanoparticules à condition d’en évaluer le métabolisme [8].
2. Nanovecteurs de première génération à tropisme hépatique
Administrés par voie intraveineuse, les nanomédicaments sont reconnus par l’organisme comme des particules exogènes. En raison de leur petite taille, ces nano-objets présentent une surface spécifique considérable ; celle-ci va permettre l’adsorption de nombreuses protéines sériques, parmi lesquelles des opsonines comme la fibronectine, les fragments Fc des immunoglobulines et le complément, qui va être activé à leur surface (Figure 1A). Ce marquage moléculaire du « non-soi » va entrainer la capture rapide et massive des nanoparticules ou des liposomes par les macrophages du système des phagocytes mononucléés (SPM) : les cellules de Kupffer du foie mais aussi les macrophages de la rate et, dans une moindre mesure, de la moëlle. Ces cellules possèdent, en effet, des récepteurs capables de reconnaitre les particules ainsi opsonisées qui seront alors internalisées par phagocytose (Figure 1B). En raison de cette importante capture hépato-splénique, les nanovecteurs de première génération se caractérisent tous par une clearance plasmatique très rapide.
(A) Après administration intraveineuse, les opsonines s’adsorbent à la surface des nanovecteurs. (B) Ceux-ci sont ensuite reconnus par les macrophages du foie (Cellules de Kupffer) et de la rate et sont internalisées (voir le schéma). Une photo en microscopie électronique réalisée après biopsie du foie d’un animal de laboratoire illustre la présence de nombreuses nanoparticules dans les lysosomes des cellules de Kupffer. (C) Autoradiographie d’une souris après administration intraveineuse de nanoparticules marquées au 14C. On observe une concentration importante au niveau du foie et de la rate.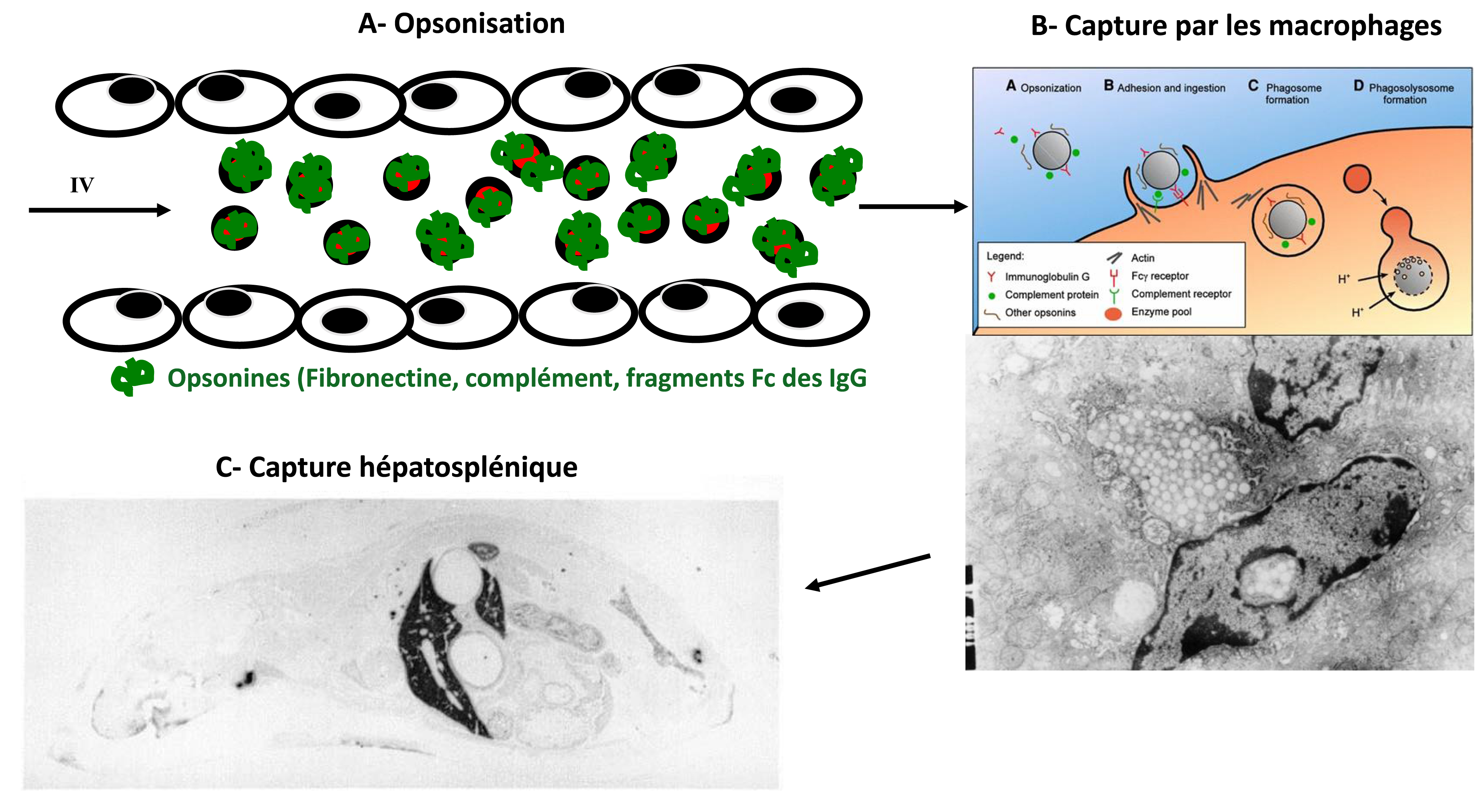
La distribution hépatique des nanoparticules a ainsi ouvert la voie à des applications dans de nombreux domaines.
Dans un article séminal, il a par exemple été montré que des liposomes de méglumine (un dérivé antimonié antiparasitaire) s’accumulaient à l’intérieur des cellules de Kupffer dans l’environnement immédiat de Leishmania donovani, un parasite responsable de la leishmanie viscérale, avec une activité antiparasitaire augmentée et à une dose 100 fois inférieure au traitement par la méglumine en solution [9].
Dans le domaine de l’oncologie, nous avons montré que des nanoparticules biodégradables de polyalkylcyanoacrylate chargées en doxorubicine, un cytostatique intercalant de l’ADN, permettaient, après administration intraveineuse, de délivrer la molécule anticancéreuse au niveau du foie avec une activité antitumorale augmentée et une toxicité cardiaque réduite, sur des modèles expérimentaux pré-cliniques de métastases hépatiques [10]. De manière remarquable, ces mêmes nanoparticules permettent aussi de contourner la résistance « multidrogues » (phénotype mdr) qui rend inopérant la plupart des traitements chimiothérapeutiques classiques. Cette résistance est attribuée à l’expression de glycoprotéines d’efflux (PgP, MRP, etc.) dont sont équipées les cellules tumorales, en particulier dans le cas du carcinome hépato-cellulaire [11]. Encapsulée dans ces nanoparticules biodégradables, la doxorubicine est rendue invisible, empêchant sa prise en charge par la PgP, trompant ainsi les mécanismes de détoxification dont sont équipées ces cellules tumorales. L’activité anticancéreuse de ce nanomédicament a été démontrée in vitro mais aussi in vivo sur un modèle d’hépatocarcinome multi-résistant chez la souris transgénique [12]. Ces travaux ont abouti à des essais cliniques jusqu’en fin de phase III pour le traitement du cancer primitif du foie [13].
3. Nanovecteurs « furtifs » de deuxième génération
Dans de nombreux cas, l’opsonisation conduisant au tropisme hépato-splénique des nanomédicaments peut constituer un handicap lorsqu’il est nécessaire de délivrer des principes actifs au niveau d’autres tissus. Ce verrou technologique a pu être contourné grâce à l’application du concept physico-chimique de la « répulsion stérique » : le recouvrement des nanovecteurs par des polymères hydrophiles et flexibles (comme les polyéthylèneglycols) va alors empêcher les opsonines de s’adsorber à leur surface, réduisant ainsi la reconnaissance par les macrophages du SPM et conduisant à une clearance plasmatique ralentie après administration intraveineuse [14, 15]. Dès 1999, nous avons visualisé, pour la première fois, par cryomicroscopie électronique à transmission (Cryo-TEM) et SDS-PAGE, l’inhibition de l’adsorption des protéines plasmatiques à la surface de nanoparticules recouvertes de PEG [16]. Ces nanovecteurs dits « PEGylés » ou « furtifs », moins reconnus par le SPM, confèrent ainsi une rémanence vasculaire accrue aux molécules qu’ils transportent. L’augmentation de leur temps de résidence dans la circulation sanguine permet de tirer profit de deux particularités anatomiques que l’on retrouve dans de nombreuses tumeurs : un endothélium vasculaire plus perméable, autorisant l’infiltration de nanoparticules, et un drainage lymphatique réduit, limitant l’élimination des nanoparticules captées par le tissu néoplasique. Cet effet de perméabilité accrue et de rétention tissulaire est bien connu sous le nom d’effet dit « EPR », pour « Enhanced Permeability and Retention » et il résulte des processus inflammatoires souvent associés aux lésions cancéreuses [17] (Figure 2). Cet effet a été mis à profit avec succès, en préclinique, pour le ciblage de tumeurs expérimentales à l’aide de nanomédicaments. Des liposomes PEGylés chargés en doxorubicine ont ainsi montré une efficacité accrue (par rapport à la doxorubicine) dans le traitement de diverses tumeurs expérimentales murines, et chez l’homme avec certaines indications cliniques. Ces observations ont conduit à la mise sur le marché du Doxil®, initialement prescrit dans le traitement du sarcome de Kaposi, mais ensuite étendu à d’autres cancers (ovaire, myélome multiple etc.) [18].
Schéma représentant l’extravasation vers les tissus inflammatoires de nanomédicaments recouverts de polyéthylèneglycol et illustrant l’effet EPR.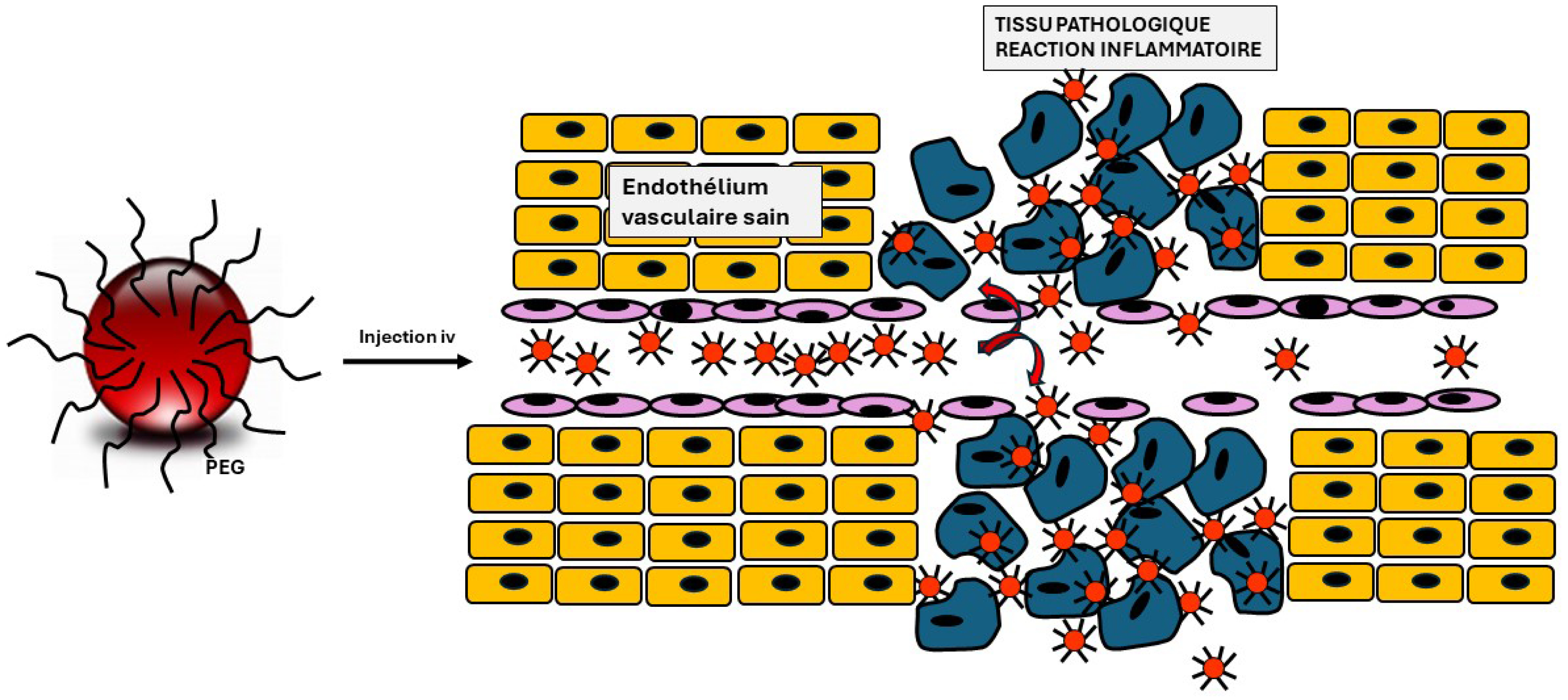
Si, comme discuté ci-dessus, les caractéristiques aberrantes de la néovascularisation tumorale et l’accumulation passive de nanomédicaments qui en résulte ont été largement démontrées dans de très nombreux modèles de tumeurs expérimentales chez le rongeur, en revanche, la réalité de l’effet EPR chez l’homme fait l’objet de nombreux débats : il est très variable d’une lésion tumorale à l’autre, fortement influencé par le microenvironnement tumoral ; il dépend du patient et du stade d’évolution de la tumeur. C’est la raison pour laquelle, il a été suggéré d’utiliser des nanoparticules ultrafines d’oxyde de fer (USPIO) qui, en diminuant le signal T2 en IRM (le signal T2 est un signal hydrique ; sa diminution témoigne d’un œdème, d’une nécrose tissulaire ou d’un processus inflammatoire), peuvent servir de biomarqueurs prédictifs pour réaliser une stratification des patients, en fonction de la perméabilité vasculaire de la lésion cancéreuse à traiter. Une telle médecine de précision s’appuie sur plusieurs observations cliniques qui ont démontré que des niveaux plus élevés d’USPIO au niveau des nodules tumoraux sont associés à une plus grande réduction de la taille des lésions après traitement par nanothérapies anticancéreuses [19].
A côté de l’oncologie, d’autres applications thérapeutiques ont été décrites, dès lors qu’il existe un processus inflammatoire sous-jacent. A titre d’exemple, nous avons montré que des nanoparticules biodégradables de polyalkylcyanoacrylate décorées avec du PEG pouvaient atteindre les structures cérébrales, en particulier la matière blanche, dans des situations pathologiques comme dans l’encéphalomyélite allergique expérimentale au cours de laquelle, la perméabilité de la barrière hémato-encéphalique est augmentée. La diffusion passive des nanoparticules et leur capture par les macrophages inflammatoires semblent être le mécanisme sous-jacent de la pénétration cérébrale [20].
4. Nanovecteurs de troisième génération pour l’adressage moléculaire
L’adressage de nanovecteurs de médicaments au niveau tissulaire, cellulaire ou même subcellulaire peut s’effectuer grâce à l’utilisation de ligands moléculaires tels que des anticorps, des morceaux d’anticorps, des peptides, des sucres ou des petites molécules (hormones, vitamines), capables de reconnaître de manière sélective des antigènes ou des récepteurs surexprimés à la surface des cellules malades. La conception de ces vecteurs de troisième génération nécessite la construction d’édifices supramoléculaires comprenant un cœur (de préférence biodégradable) pour l’encapsulation du principe actif, une couche de PEG pour éviter la reconnaissance hépato-splénique, et à l’extrémité de certaines chaînes de PEG, un ligand de reconnaissance membranaire (Figure 3).
Schéma représentant des nanovecteur de 3e génération, fonctionnalisés en surface à l’aide de ligands moléculaires, capables de reconnaitre des biomarqueurs spécifiques situés à la surface des cellules cibles.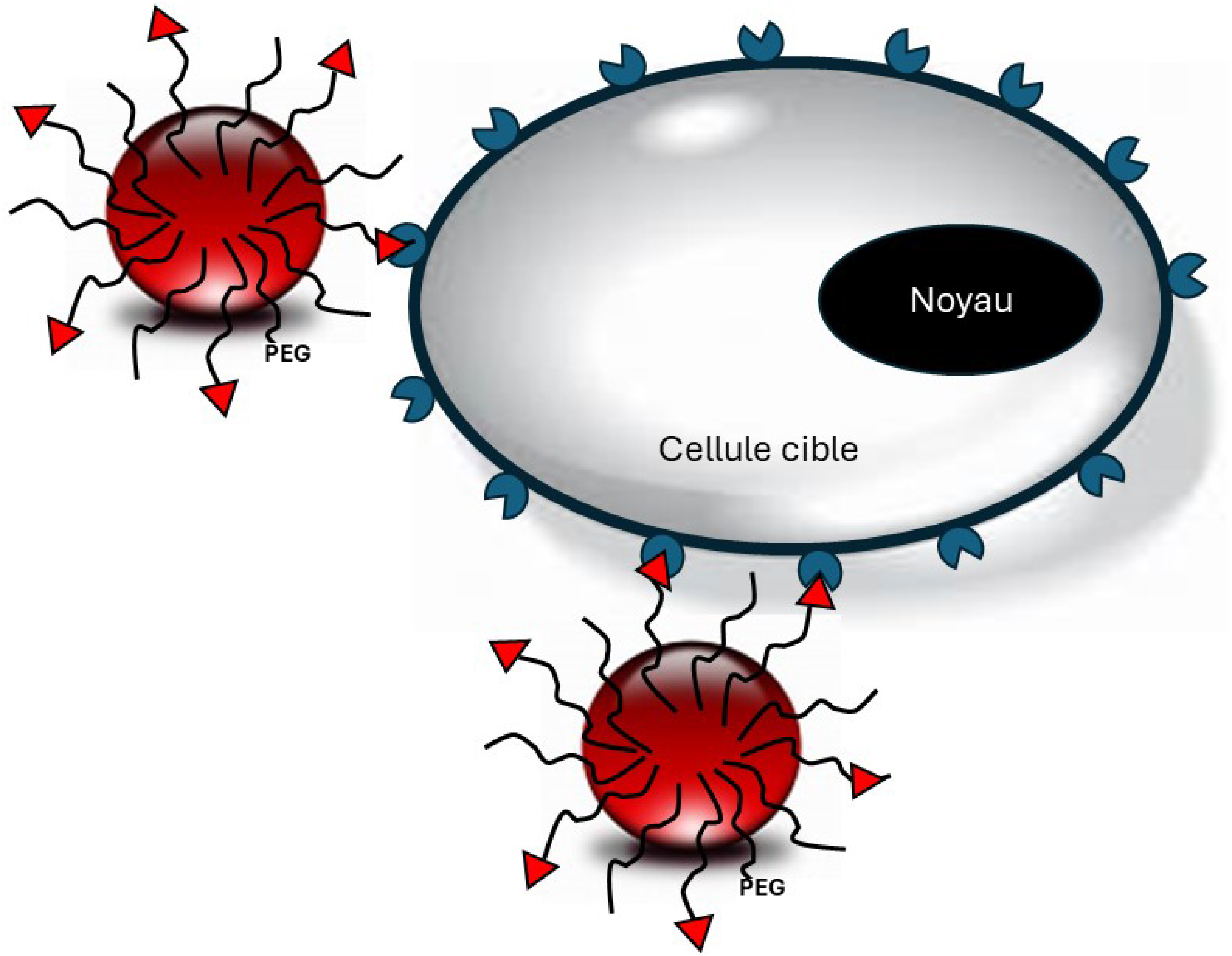
Cette stratégie de reconnaissance à l’échelle moléculaire a fait l’objet de nombreux travaux. Par exemple, le fragment Fab’ d’un anticorps dirigé contre le proto-oncogène HER2 a été conjugué à l’extrémité des chaînes PEG de liposomes (à base de phosphatidyléthanolamine-PEG) chargés en doxorubicine. Ces liposomes ciblés ont démontré une remarquable efficacité dans des modèles murins de cancer, notamment dans des xénogreffes de cellules mammaires humaines surexprimant l’antigène HER2 [21]. Un peu plus tard, l’acide folique a également été couplé à la surface de nanoparticules polymères via des chaînes de PEG. Ce nanovecteur fonctionnalisé reconnaît, avec une très grande affinité, les cellules tumorales exprimant le récepteur de l’acide folique [22]. De même, un aptamère a été couplé à la surface de nanoparticules d’acide poly(lactique-co-glycolique) afin de reconnaître le PSA (prostate specific antigen), un marqueur spécifique du cancer de la prostate [23]. Cependant, décorer la surface des nanoparticules à l’aide de ligands spécifiques constitue une opération complexe, car il est nécessaire de maîtriser l’orientation du ligand pour assurer sa disponibilité en vue de l’interaction avec son récepteur. Ainsi, la bioconjugaison d’un anticorps doit permettre la préservation du fragment Fab, nécessaire à la reconnaissance cellulaire. Contrôler avec précision la densité surfacique du ligand est encore plus difficile : une densité trop faible risque de compromettre l’interaction avec la cellule cible, tandis qu’une densité trop élevée peut entraîner une perte de la mobilité moléculaire des chaînes de PEG, nécessaire à la répulsion stérique des opsonines, déclenchant ainsi l’activation du complément. Garantir la reproductibilité du nombre de molécules de ligands exprimées à la surface des nanosystèmes est donc essentiel ; cela rend particulièrement complexe le développement pharmaceutique de ces nanomédicaments de troisième génération et explique leur absence sur le marché. C’est pourquoi nous avons proposé une approche de reconnaissance moléculaire plus simple, basée sur le concept de prodrogues lipidiques capables de s’autoassembler en nanoparticules [24]. Concrètement, des molécules pharmacologiquement actives ont été couplées au squalène, un lipide naturel et biocompatible, dont la conformation moléculaire compacte entraîne, en milieu aqueux, la formation d’édifices supramoléculaires de l’ordre d’une centaine de nanomètres [25]. Cette approche a permis de décupler l’activité des principes actifs transportés en oncologie [26], pour le traitement de certaines maladies neurologiques [27], de la douleur [28] et du choc septique [29]. Après administration intraveineuse, ces nanosystèmes lipidiques se désagrègent rapidement, libérant les prodrogues à l’échelle moléculaire. Le squalène, étant un précurseur de la biosynthèse du cholestérol, il favorise ensuite l’incorporation de la prodrogue dans les lipoprotéines transporteuses de cholestérol (les LDL chez l’homme), permettant ainsi le ciblage indirect des cellules cancéreuses qui surexpriment le récepteur des LDL [30]. Il s’agit d’une nouvelle approche de vectorisation utilisant une plateforme flexible et polyvalente exploitant les LDL endogènes comme vecteurs naturels « indirects ».
5. Nanoparticules de quatrième génération capables de répondre à un stimulus
Comme explicité ci-dessus, la vectorisation de molécules pharmacologiquement actives a montré des résultats prometteurs et un certain nombre de nanomédicaments sont, en effet, sur le marché. Cependant, la traduction en clinique de l’effet EPR (pour les nanovecteurs de deuxième génération) et de la reconnaissance à l’aide de ligands (pour les nanovecteurs de troisième génération), très bien documentés sur des modèles animaux pré-cliniques, se heurte encore à de nombreux obstacles : d’une part, la nature stochastique des interactions ligand/récepteur et, d’autre part, les difficultés à contrôler la libération du médicament à partir de ces nanovecteurs ciblés. En fait, la diffusion fickienne, qui régit la libération du principe actif, n’est pas spécifique, aux organes, aux tissus, aux cellules et encore moins aux compartiments intracellulaires cibles. Par conséquent, des stratégies de libération plus spécifiques et plus efficaces sont nécessaires. Une alternative consiste à développer des processus de libération dits « à la demande » ou encore « on » et « off » qui déclenchent la délivrance du médicament au bon moment et au bon endroit de l’organisme [31].
Cela a été rendu possible grâce aux progrès de la chimie des matériaux qui a conduit à la conception de systèmes sensibles à des stimuli endogènes. Par exemple, un pH interstitiel plus bas dans le microenvironnement tumoral ou au niveau de certaines zones inflammatoires peut être mis à profit pour déclencher la libération ciblée d’un médicament [32]. Au niveau cellulaire, la sensibilité au pH peut provoquer la libération du médicament dans les endosomes tardifs ou les lysosomes acides, ou au contraire permettre la translocation du principe actif nanotransporté des endosomes vers le cytoplasme cellulaire. Ainsi, le vaccin ARNm, récemment mis au point contre le virus du SARS-CoV-2, utilise des lipides ionisables caractérisés par un pKa compris entre 6,2 et 6,8 [33, 34], capables après internalisation cellulaire d’interagir, au pH acide des endosomes, avec les lipides de la membrane endosomale, selon un mécanisme qui n’est pas encore totalement élucidé. Celui-ci semble, cependant, résulter de la transition des phases lamellaires de la membrane endosomale vers des phases hexagonales, déclenché par l’interaction lipidique. Cela va alors engendrer des défauts dans la membrane endolysosomale et permettre l’échappement vers le cytoplasme de l’ARNm, codant pour la protéine S du virus (Figure 4). Toutefois, il n’y a pas encore de consensus concernant le mécanisme de l’échappement endolysosomal qui mériterait d’être mieux connu afin de pouvoir envisager d’autres applications [35], comme discuté dans les perspectives ci-dessous.
Illustration du mécanisme moléculaire permettant l’export de l’ARNm à partir des endolysosomes vers le cytoplasme cellulaire. A pH neutre, les lipides nanoparticulaires ionisables et les lipides de la membrane endosomale n’interagissent pas. Lorsque le pH endosomal devient acide, les lipides ionisables portent des charges positives et vont interagir avec les lipides anioniques, situés sur le feuillet interne de la membrane endosomale. Cette interaction produit un changement de la conformation membranaire vers une phase hexagonale qui permet la fuite de l’acide nucléique vers le cytoplasme cellulaire. Figure selon [35].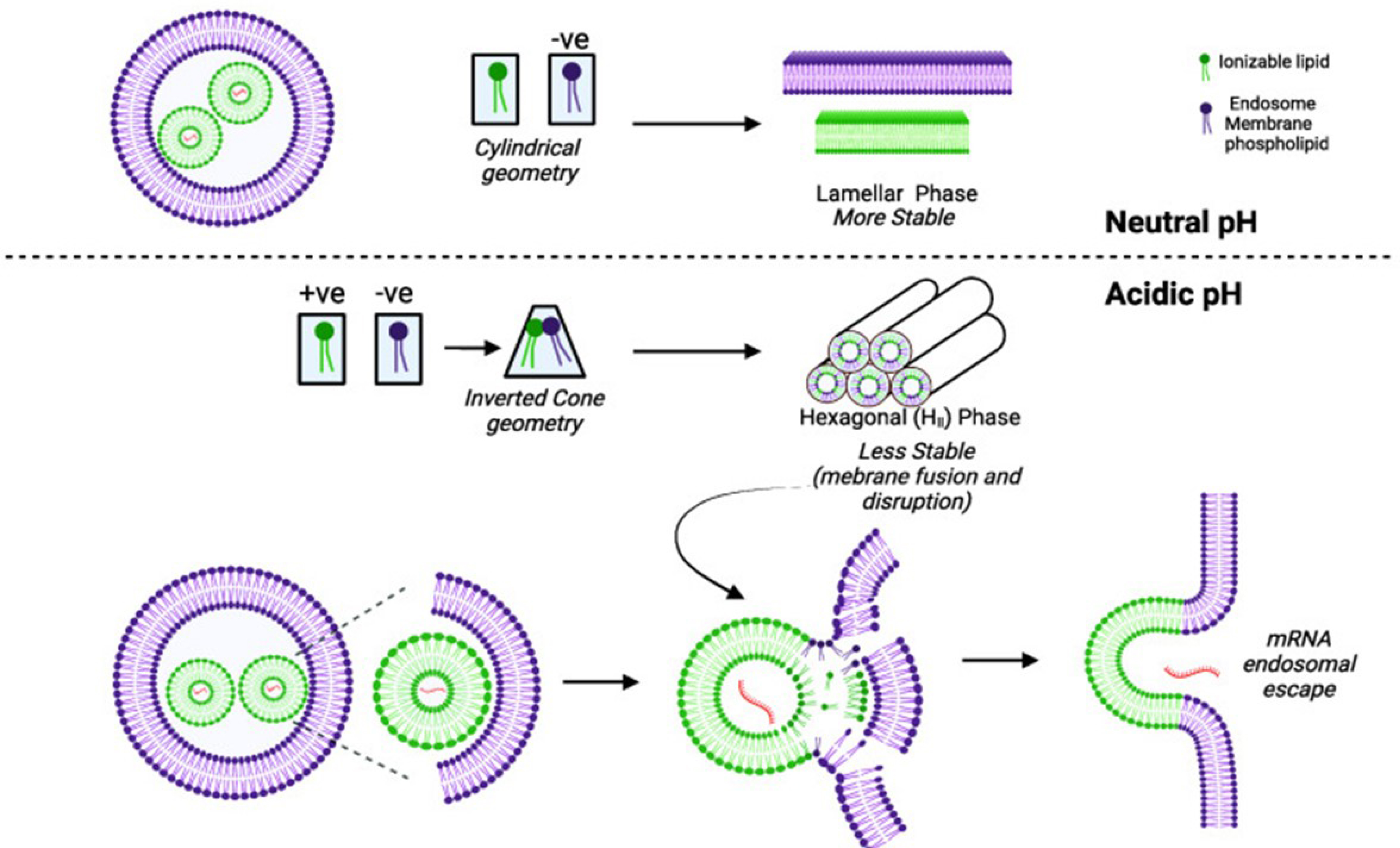
Un changement de potentiel rédox résultant d’une concentration accrue en glutathion dans l’environnement intracellulaire peut aussi être mis à profit pour libérer le principe actif à cet endroit. On peut aussi tirer parti de la présence d’enzymes spécifiques associés à un état physio-pathologique particulier, comme par exemple la présence de certaines métalloprotéinases au niveau tumoral ou permettre la libération ciblée d’antibiotiques en réponse à la présence de lipases bactériennes [36].
D’autres stratégies font appel à des nanomatériaux, capables de répondre à un stimulus exogène, généralement physique, comme un champ magnétique extracorporel pour provoquer une hyperthermie locale après injection de nanoparticules ultrafines d’oxyde de fer (USPIO), ou permettre le guidage magnétique de principes actifs attachés à ces nano-objets [37]. Une modification de température [38], une irradiation photonique ciblée [39], des ultrasons ou encore un courant électrique peuvent aussi servir pour la libération ciblée d’un médicament à partir d’un nanovecteur, en réponse à ces excitations physiques. Ces approches nécessitent l’utilisation de matériaux biocompatibles dits « intelligents », capables de subir une protonation spécifique, un clivage hydrolytique ou un changement conformationnel moléculaire ou supramoléculaire en réponse à un stimulus, ou sensibles à une impulsion physique spécifique.
Ce concept a été suggéré pour la première fois à la fin des années 70 avec l’utilisation de liposomes thermosensibles pour la libération locale de médicaments [40]. La thermosensibilité de ces liposomes résulte généralement de l’utilisation de lipides ayant une température de transition de phase aux alentours de 40 °C, induisant une modification de la conformation des bicouches lipidiques avec, comme conséquence, la libération du principe actif sous l’effet de la chaleur. Une autre approche utilise des liposomes avec insertion d’un peptide thermosensible qui se déplie sous l’effet de la chaleur [38]. Il existe aussi des liposomes thermosensibles générateurs de bulles. Le principe repose sur la création de défauts dans la bicouche lipidique à la suite de la génération de CO2 par la décomposition du bicarbonate d’ammonium en cas d’hyperthermie légère (∼42 °C). En raison des caractéristiques hyperéchogènes des bulles de CO2, ces vésicules liposomales permettent également de faire de l’imagerie par échographie en plus de la libération ciblée de la doxorubicine encapsulée [41]. Une stimulation cérébrale profonde peut aussi être obtenue à l’aide de nanoparticules de lanthanide injectées dans l’aire tegmentale ventrale du cerveau de la souris. Ces nanoparticules sont capables de convertir un faisceau de lumière infrarouge extracorporelle en une émission locale de lumière bleue et d’activer ainsi le canal de la rhodopsine exprimé dans des neurones dopaminergiques [39]. Ces quelques exemples illustrent la grande sensibilité de ces nanosystèmes à des stimuli endogènes ou exogènes pour une libération dite « à la demande ».
6. Considérations toxicologiques
La voie intraveineuse est la plus utilisée pour l’administration de nanomédicaments. D’un point de vue toxicologique, il est donc crucial de prêter une attention particulière aux risques d’effets secondaires liés à cette voie d’administration. En raison de leur petite taille, les nanomédicaments ne présentent, a priori, pas de risques thrombo-emboliques. Cependant, à la suite de leur interaction avec les composants sanguins, notamment les protéines plasmatiques ou les ions susceptibles de neutraliser leurs charges de surface, il est nécessaire de s’assurer qu’ils ne présentent pas de risques d’agrégation pouvant conduire à l’embolisation de certains vaisseaux.
D’autre part, en raison de leur forte capture cellulaire par les voies de la phagocytose ou de l’endocytose, il est important de vérifier qu’ils n’induisent pas de toxicité chronique due à leur accumulation intramacrophagique, pouvant conduire à des thésaurismoses intracellulaires. Cela peut être évité en utilisant uniquement des matériaux biodégradables pour leur préparation. Compte tenu de la biodistribution des nanomédicaments, de leur interaction avec les opsonines et de leur tropisme pour le tissu hépatique, il est également essentiel d’étudier de manière approfondie, dès le stade préclinique, leurs effets sur la fonction de clairance plasmatique par les cellules de Kupffer du foie [42]. La fonction hépatocytaire doit également faire l’objet d’investigations toxicologiques poussées en recherchant une éventuelle réaction inflammatoire (réversible) ou une insuffisance hépatique plus sévère [43]. Mais le recul clinique montre que le principal risque de toxicité après administration intraveineuse résulte de l’apparition d’une réaction pseudo-allergique, appelée aussi CARPA, l’acronyme anglo-saxon de « C activated related pseudo-allergy » [44]. Dépourvue de production d’IgE, cette réaction apparaît chez certains patients traités par des nanomédicaments. Elle résulte de l’activation de la voie alterne du complément avec, comme corollaire, l’activation des mastocytes et la libération de cytokines pro-inflammatoires. Cette réaction se caractérise, le plus souvent, par des manifestations cliniques bénignes (hypertension ou hypotension, sensation fébrile à l’injection, température, rash facial, etc.) mais peut aussi aboutir, dans de rares cas, à une pathologie cardio-pulmonaire mortelle, en particulier chez des patients cancéreux affaiblis par la maladie. Le CARPA n’est malheureusement pas un effet secondaire prévisible et la réaction inflammatoire est variable en termes de gravité et de fréquence, en fonction de la nature du nanomédicament et du patient ; c’est pourquoi, de nombreux travaux essayent de mettre au point un modèle prédictif chez l’animal. D’une manière générale, cette réaction pseudo-allergique dépend de la concentration en nanoparticules lors de l’injection intraveineuse. C’est la raison pour laquelle, il est conseillé d’injecter les nanomédicaments en perfusion lente et de prémédiquer les patients avec un médicament anti-inflammatoire.
A côté de la voie intraveineuse, d’autres voies d’administration ont été utilisées, notamment les voies orale et dermique ; elles sont moins intrusives. Dans les deux cas, de nombreuses barrières doivent, en effet, être franchies pour permettre l’absorption de nanoparticules médicamenteuses (couche de mucus et barrière épithéliale pour la voie orale et stratum corneum pour la voie dermique). L’absorption des nanoparticules par ces voies reste donc très faible, souvent même négligeable, avec toutefois quelque portes d’entrée étroites, comme les cellules M des plaques de Peyer de l’intestin [45] et les follicules pileux de la peau. L’administration de nanoparticules par voie pulmonaire permet, quant à elle, d’atteindre les macrophages pulmonaires via un processus d’opsonisation ou encore lorsque certaines particules sont fonctionnalisées avec un ligand spécifique comme le mannose ou l’acide hyaluronique [46]. Si les particules polymères ou lipidiques ayant un diamètre d’environ 100–200 nm ne sont pas capables de passer l’épithélium pulmonaire, certaines nanoparticules inorganiques de très petite taille (5 nm) peuvent, en revanche, la traverser, en particulier via la voie lymphatique. Il est par ailleurs reconnu que des nanoparticules inhalées en grande quantité peuvent induire des effets toxicologiques importants, en particulier des phénomènes inflammatoires en rapport avec l’activation des macrophages. Il va sans dire que lorsque les matériaux utilisés ne sont pas ou peu biodégradables, un défaut de clairance pulmonaire peut entrainer des fibroses, avec des effets mutagènes et carcinogènes bien documentés. Des symptômes cardiovasculaires ont également été décrits.
7. Perspectives
L’utilisation des nanotechnologies pour l’administration de molécules pharmacologiquement actives ou comme outils de diagnostic via l’imagerie fait aujourd’hui partie de l’arsenal thérapeutique et diagnostique dont nous disposons. Ces approches offrent des perspectives importantes pour le traitement de nombreuses pathologies. Dans le domaine de la vaccination, le développement d’un vaccin ARNm contre le Covid a montré que l’encapsulation dans des nanoparticules lipidiques pH-sensibles permettait d’amener l’acide nucléique au niveau du cytoplasme cellulaire et de déclencher sa traduction sous forme d’une protéine vaccinale. Cette plate-forme ouvre des perspectives non seulement pour développer des vaccins efficaces contre d’autres pathologies infectieuses mais aussi de produire des protéines médicaments pour le traitement de pathologies résultant de protéines manquantes ou non fonctionnelles, à la condition de mieux comprendre les différents mécanismes de l’échappement endosomal [35]. Les exemples sont nombreux : production de vasopressine pour le traitement du diabète insipide, d’érythropoiétine dans certaines anémies, d’une protéine du surfactant pulmonaire dans certaines maladies génétiques, de protéines pro-apoptotiques pour traiter certains cancers, du facteur IX pour l’hémophilie etc. ; il est aussi possible de produire des anticorps spécifiques pour le traitement de nombreux cancers ou maladies infectieuses.
L’utilisation de ces nanovecteurs ionisables permet aussi, après endocytose, d’adresser aux ribosomes cellulaires des petits ARN interférents (ARNi) qui, au contraire des ARNm, vont être capables d’inhiber l’expression de certains gènes, comme cela a été fait récemment avec la mise sur le marché du Patisiran, un ARNi nanoencapsulé qui inhibe l’expression de la transthyrétine, responsable d’une neuropathie invalidante [47]. D’autres développements sont en cours pour traiter certains cancers en inhibant l’expression d’oncogènes de fusion, ou encore pour le traitement de maladies neurologiques. L’application thérapeutique ou vaccinale de cette plate-forme nanoparticulaire ionisable pour le transport des ARNm ou des ARNi se heurte, néanmoins, à de nombreuses difficultés :
- Lorsqu’il s’agit d’administrer un ARNm pour la production d’une protéine thérapeutique, celle-ci doit l’être en quantité suffisante et perdurer dans l’organisme pendant un temps prolongé. Or, malgré l’utilisation de lipides ionisables, le rendement de l’export de l’acide nucléique du compartiment endosomal vers le cytoplasme cellulaire reste relativement limité (sans doute seulement quelques % des molécules d’ARNm internalisées par la cellule). Il convient donc d’encourager des recherches en vue de découvrir les meilleures compositions lipidiques afin d’accroitre la translocation cytoplasmique. Cela ne peut se faire qu’à partir d’une meilleure connaissance des mécanismes cellulaires et moléculaires de l’export (identification précise du pH endosomal de la cellule cible, mesure du rendement de l’export, compréhension des interactions lipides nanoparticulaires/lipides de la membrane endosomale, etc.). D’autre part, même produite en quantité suffisante, la protéine thérapeutique peut avoir une expression transitoire ou peu efficace, en raison d’un métabolisme rapide, d’une demi-vie plasmatique courte, ou d’un défaut au niveau de sa glycosylation.
- Concernant le développement d’acides nucléiques à visée thérapeutique (ARNi, ARNm ou encore ADN), contrairement aux applications vaccinales, il est nécessaire d’utiliser la voie intraveineuse en ayant recours à des nanovecteurs capables de délivrer ces molécules aux bons tissus et aux bonnes cellules. Actuellement, la plupart des approches concernent le traitement de pathologies pour lesquelles l’ARN doit être délivré au niveau hépatique, tissu dans lequel les nanoparticules s’accumulent spontanément. Induire l’expression ou l’inhibition d’une protéine cible dans un autre tissu est une opération plus complexe qui nécessite le recours à des vecteurs de troisième génération, fonctionnalisés mais aussi plus difficiles à développer, comme expliqué ci-dessus.
- Enfin, l’application de la plate-forme à d’autres vaccins n’est pas automatique car la protéine cible peut s’avérer insuffisamment immunogène ou muter trop rapidement, comme dans le cas du VIH. Des essais cliniques sont, néanmoins, en cours pour développer des vaccins ARNm contre la grippe saisonnière, permettant une production plus rapide et une meilleure adaptation aux souches circulantes chaque année. Des essais cliniques de vaccins ARNm contre le virus Zika sont également menés avec des réponses immunitaires robustes.
L’utilisation des nanotechnologies ouvrent aussi des perspectives dans l’édition du génome à l’aide des technologies de type CRISPR/Cas 9 [48]. En effet, la faible pénétration intracellulaire de l’acide nucléique et de sa nucléase ainsi que la fragilité de la protéine dans l’environnement enzymatique acidifié des lysosomes après endocytose/phagocytose réduisent fortement l’efficacité de l’édition génomique à partir de protéines. Le potentiel thérapeutique de ces approches dépend aussi de l’acheminement des protéines vers les cibles cellulaires appropriées. C’est la raison pour laquelle, il est évident que l’édition génique bénéficiera certainement, à l’avenir, de l’utilisation de nanovecteurs pour un adressage intracellulaire plus efficace de ces molécules complexes.
La capacité qu’ont les nanovecteurs d’agir sur les interactions entre cellules tumorales et cellules immunitaires offre également des perspectives nouvelles en oncologie, en particulier pour la reprogrammation des lymphocytes ou des macrophages tumoraux. L’environnement tumoral est, en effet, capable d’échapper à la surveillance immunitaire via l’action des protéines du point de contrôle immunitaire. Il a été montré que certains nanomédicaments sont maintenant capables de bloquer ces molécules du point de contrôle, de réactiver le système immunitaire et de conduire ainsi à l’inhibition de la croissance tumorale. Par exemple, l’interaction entre PD-1 porté par les cellules-T et le facteur PDL-1 tumoral, qui permet aux cellules tumorales d’échapper à la surveillance immunitaire, peut être empêchée grâce à l’action de nanoparticules fonctionnalisées à l’aide d’anticorps capables d’interagir avec l’une ou l’autre de ces deux cibles biologiques. Ainsi, il a été montré que l’administration de nanoparticules fonctionnalisées à l’aide d’un anticorps anti-PDL-1, encapsulant un agoniste desTLR7/8, favorisait l’infiltration de cellules T CD8+ dans des modèles précliniques de tumeurs expérimentales (MC38 et B16) [49].
Ce tour d’horizon des perspectives offertes par les nanotechnologies pour la délivrance de molécules pharmacologiquement actives ne serait pas complet si n’étaient pas mentionnées de nouvelles approches utilisant les vésicules extracellulaires comme nanovecteurs. Produites par les cellules et véhiculant des acides nucléiques, des protéines, des peptides ou encore des métabolites, les vésicules extracellulaires sont les médiateurs de la communication intercellulaire. De composition lipidique, elles peuvent être de nature variable (exosomes, microvésicules, ectosomes, corps apoptotiques, etc.). Elles sont essentiellement assemblées à partir de lipides, mais possèdent des protéines de surface qui leur assurent une capacité extraordinaire de reconnaissance cellulaire. Il n’est donc pas étonnant que ces vésicules endogènes puissent être utilisées comme transporteurs de médicaments. Riches en phospholipides, elles sont comparables à des liposomes qui seraient équipés de codes-barres de reconnaissance. Les nombreuses techniques d’isolement conduisent souvent à l’inclusion des contaminants et il n’est pas clairement démontré qu’elles soient actuellement plus efficaces que des liposomes ou des nanoparticules lipidiques [50]. Toutefois, les méthodes de préparation s’améliorent régulièrement et il n’est pas exclu que leur utilisation puisse avoir des applications intéressantes, notamment en oncologie.
8. Conclusion
Comme démontré dans cet article, les nanotechnologies confèrent à certaines molécules pharmacologiquement actives des propriétés inédites. L’encapsulation dans des nanovecteurs permet : (i) d’éviter la dégradation et la métabolisation de molécules fragiles telles que l’ARN, l’ADN, les peptides, les protéines et certaines petites molécules, (ii) d’assurer la pénétration intracellulaire de molécules qui, sous leur forme libre, sont incapables de diffuser à l’intérieur des cellules, (iii) de franchir certaines barrières biologiques, parfois en quantités limitées mais néanmoins significatives (barrière hémato-encéphalique, épithélium intestinal, follicules pileux cutanés, muqueuse pulmonaire), (iv) de modifier la pharmacocinétique des molécules biologiquement actives et d’en altérer la biodistribution tissulaire, cellulaire et même intracellulaire via un ciblage passif ou actif, et (v) de contrôler la libération du principe actif encapsulé dans le temps et dans l’espace. Les nanotechnologies améliorent également les techniques d’imagerie et la détection de biomarqueurs.
Les applications de ces technologies avancées obligent les chercheurs à réfléchir aux risques, conscients ou inconscients, qu’elles peuvent engendrer ainsi qu’aux problèmes éthiques qu’elles suscitent. Les nanotechnologies médicales correspondent, en effet, à la définition proposée par Korn et ses collaborateurs [51], décrivant une recherche duale comme susceptible de détournement à des fins illégitimes (mésusage) ou présentant un risque de conséquences inacceptables pour la santé humaine ou l’environnement.
Déclaration d’intérêts
Les auteurs ne travaillent pas, ne conseillent pas, ne possèdent pas de parts, ne reçoivent pas de fonds d’une organisation qui pourrait tirer profit de cet article, et n’ont déclaré aucune autre affiliation que leurs organismes de recherche.
Remerciement
L’auteur remercie le Dr Nils Braun du CNCB pour sa relecture de l’article.





 CC-BY 4.0
CC-BY 4.0