1 Introduction
Les hypophosphites des éléments alcalins sont préparés en traitant les solutions chaudes des hydroxydes alcalins par du phosphore blanc :
On obtient, de la même manière, les hypophosphites des éléments dont les hydroxydes sont suffisamment solubles, par exemple : Ca(H2PO2)2, Ba(H2PO2)2, etc. 〚1〛.
L’obtention de l’hypophosphite d’éléments (tels que les éléments d) dont l’hydroxyde n’est pas soluble est réalisée par une autre méthode, plus compliquée et plus coûteuse. Dans les articles précédents, on a souligné l’importance de l’étude physico-chimique des systèmes quaternaires réciproques A+, Mn2+/H2PO2–, X–//H2O (A = Na, K, NH4 ; X = NO3, Cl, Br), dont les résultats peuvent être utilisés afin de préparer de l’hypophosphite de manganèse en se basant sur la réaction d’échange 〚2–4〛.
Nous présentons dans cet article les résultats de l’étude du système quaternaire Na+,Mn2+/Cl–,(H2PO2)–//H2O à 25 °C.
2 Partie expérimentale
Pour la partie expérimentale de cette étude, nous avons utilisé les sels NaCl, MnCl2 et Mn(H2PO2)2, cristallisés deux fois. Nous avons également mesuré la viscosité et la densité du liquide en équilibre. La viscosité est mesurée par la méthode d’Ostwald et la densité par pycnométrie. La caractérisation des phases solides en équilibre est réalisée par la méthode des restes de Schreinemakers 〚5〛.
Les ions constituant le système étudié, parmi lesquels figurent Na+, Mn2+, Cl–, H2PO2–, sont dosés par les méthodes analytiques classiques 〚6, 7〛.
Nous avons étudié les deux systèmes ternaires Na2Cl2/MnCl2/H2O, MnCl2/Mn(H2PO2)2/H2O et la coupe diagonale Na2Cl2/Mn(H2PO2)2/H2O du système quaternaire Na+,Mn2+/Cl–,(H2PO2)–//H2O par la méthode isothermique, à 25 °C.
On constate, à partir des travaux effectués, que, pour le système Na2Cl2/MnCl2/H2O, le point invariant ternaire, où se trouvent en équilibre les phases solides NaCl et MnCl2·4 H2O, correspond à la composition suivante (% en masse) : NaCl 4,89, MnCl2 40,43 et H2O 54,68. En présence de MnCl2, la solubilité de NaCl diminue de 26,42 à 4,89% au point invariant ternaire (invariant isotherme-isobare).
Pour le système MnCl2/Mn(H2PO2)2/H2O, le point invariant ternaire, où se trouvent en équilibre les phases solides MnCl2·4 H2O et Mn(H2PO2)2·H2O, correspond à la composition suivante (% massique) : Mn(H2PO2)2 3,85, MnCl2 42,14 et H2O 54,01. En présence de MnCl2, la solubilité de Mn(H2PO2)2 diminue de 12,48 à 3,85% au point invariant ternaire (invariant isotherme-isobare).
Dans la section diagonale Na2Cl2/Mn(H2PO2)2/H2O, les seules phases solides en équilibre avec le liquide sont Mn(H2PO2)2·H2O et NaCl. Un point de double saturation en sels est observé, dont les coordonnées sont : NaCl 22,68, Mn(H2PO2)2 6,63 et H2O 70,69 (% massique). En présence de NaCl, la solubilité de l’hypophosphite de manganèse diminue de 12,48 à 6,63% au point invariant ternaire (invariant isotherme-isobare).
L’étude du système quaternaire Na+,Mn2+/Cl–,(H2PO2)–//H2O est réalisée de la manière suivante : un mélange, correspondant au point de double saturation en sels de chaque ternaire constitutif du système quaternaire étudié, est préparé. Ce mélange contient un excès de sels non dissous ; le quatrième constituant est alors ajouté jusqu’à saturation et apparition de celui-ci à l’état solide. Les résultats obtenus sont présentés dans le Tableau 1 et sur la Fig. 1.
Le système Na+,Mn2+/Cl–,(H2PO2)–//H2O à 25 °C.
| Phase liquide (% en masse) | d (kg m–3) | η (10–3 Pa s) | Phase liquide (% molaire de sels) | Phase solide (*) | ||||
| Na2Cl2 | MnCl2 | Mn(H2PO2)2 | Na2Cl2 | MnCl2 | Mn(H2PO2)2 | |||
| 26,42 | 0,00 | 0,00 | 1199 | 1,50 | 100 | 0,00 | 0,00 | A |
| 0,00 | 43,60 | 0,00 | 1491 | 8,38 | 0,00 | 0,00 | 100 | B |
| 0,00 | 0,00 | 12,48 | 1086 | 1,45 | 0,00 | 0,00 | 100 | C |
| 22,68 | 0,00 | 6,63 | 1247 | 2,08 | 84,41 | 0,00 | 15,59 | (A+C)** |
| 4,89 | 40,43 | 0,00 | 1509 | 15,75 | 11,53 | 88,47 | 0,00 | (A+B)** |
| 0,00 | 42,14 | 3,85 | 1516 | 12,91 | 0,00 | 94,15 | 5,85 | (B+C)** |
| 20,69 | 3,75 | 6,31 | 1262 | 2,80 | 73,46 | 12,33 | 14,21 | A+C |
| 18,59 | 8,26 | 5,91 | 1286 | 3,82 | 61,95 | 25,57 | 12,48 | A+C |
| 16,48 | 13,12 | 5,52 | 1314 | 5,12 | 51,25 | 37,89 | 10,86 | A+C |
| 14,17 | 17,83 | 4,95 | 1340 | 6,55 | 41,86 | 48,91 | 9,23 | A+C |
| 12,33 | 21,85 | 4,57 | 1368 | 8,31 | 34,74 | 57,12 | 8,14 | A+C |
| 10,38 | 26,31 | 4,02 | 1395 | 9,52 | 27,78 | 65,42 | 6,80 | A+C |
| 8,16 | 31,42 | 3,34 | 1433 | 11,83 | 20,69 | 73,94 | 5,37 | A+C |
| 6,42 | 35,46 | 2,78 | 1462 | 13,79 | 15,60 | 80,12 | 4,28 | A+C |
| 2,10 | 41,82 | 2,96 | 1519 | 14,53 | 4,92 | 90,71 | 4,37 | B+C |
| 4,12 | 41,50 | 2,06 | 1552 | 16,20 | 9,37 | 87,67 | 2,96 | (A+B+C)*** |
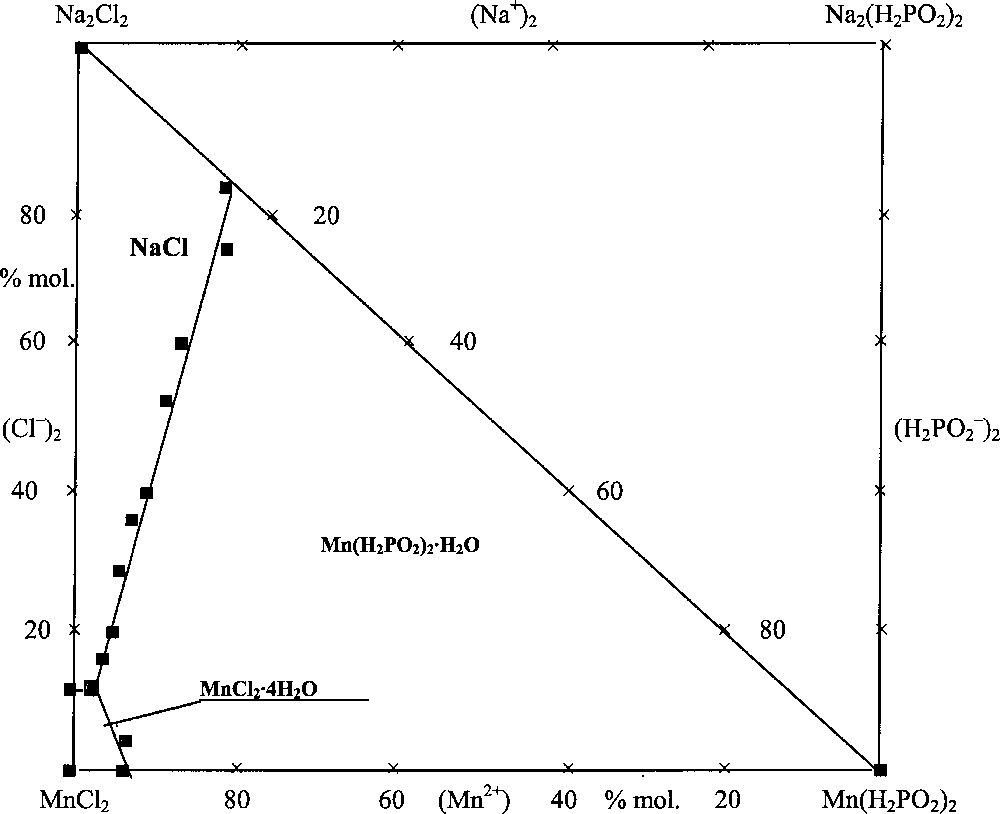
Le domaine de cristallisation du système Na+,Mn2+/Cl–,(H2PO2)–//H2O à 25 °C. Les compositions sont exprimées en pourcentage molaire de mélange salin.
On constate, à partir des travaux effectués, que, dans le système quaternaire Na+,Mn2+/Cl–,(H2PO2)–//H2O, les trois phases solides suivantes sont observées : NaCl, MnCl2·4 H2O et Mn(H2PO2)2·H2O. Le point invariant quaternaire dans lequel se trouvent en équilibre les phases solides indiquées ci-dessus correspond à la composition suivante (% massique) : NaCl 4,12, MnCl2 41,50, Mn(H2PO2)2 2,06 et H2O 52,32. La composition du même point invariant quaternaire peut être exprimée aussi en % molaire de sels : Na2Cl2 9,37, MnCl2 87,67 et Mn(H2PO2)2 2,96.
La viscosité et la masse volumique de la phase liquide en équilibre au point invariant quaternaire sont respectivement de 16,20 × 10–3 Pa s et 1522 kg m–3.
3 Conclusion
Un point invariant quaternaire est déterminé dans le système quaternaire considéré, dont la composition est la suivante (% en masse) : NaCl 4,12, MnCl2 41,50, Mn(H2PO2)2 2,06 et H2O 52,32%. Dans ce point invariant quaternaire, les trois phases solides suivantes se trouvent en équilibre avec la phase liquide : NaCl, MnCl2.4H2O et Mn(H2PO2)2.H2O.
En se basant sur les résultats obtenus, on peut déduire la conclusion suivante : dans le système quaternaire Na+, Mn2+/Cl–,(H2PO2)–//H2O, étudié à la température de 25 °C, l’hypophosphite de manganèse présente la plus petite solubilité de tous les constituants et le domaine de cristallisation de Mn(H2PO2)2.H2O sur le diagramme (Fig. 1) est égal à 82,9% de la surface totale.
Finalement, on peut dire que la préparation de l’hypophosphite de manganèse peut être réalisée en se basant sur la réaction d’échange entre l’hypophosphite de sodium et le chlorure de manganèse, car l’équilibre dans le système quaternaire réciproque considéré est déplacé dans le sens de formation de l’hypophosphite de manganèse.


