Les acides et esters arylboroniques sont utilisés comme intermédiaires réactionnels permettant l’accès à de nombreuses molécules. La réaction de Suzuki est une de celles qui suscitent le plus grand intérêt. Elle permet d’obtenir des biaryles non symétriques, composés dont la structure est fréquemment rencontrée dans des produits naturels, des molécules biologiquement actives, des cristaux liquides... à partir d’un acide arylboronique et d’un dérivé aromatique halogéné [1–5].
Si l’utilisation des acides et esters arylboroniques subit un essor croissant depuis ces vingt dernières années, leur méthode de synthèse, en revanche, se limite à la fonctionnalisation d’arylmagnésiens [6, 7] ou d’aryllithiens [8] par des trialkyl borates à basse température.
Nous avons examiné une nouvelle voie d’accès à ces composés, basée sur l’utilisation de méthodes électrochimiques. Nous avons axé nos recherches sur l’utilisation du procédé à anode consommable [9], qui peut être utilisé à l’échelle industrielle.
La réaction de couplage est basée sur l’électroréduction directe d’un dérivé aromatique halogéné en présence d’un agent boratant, comme un trialkyl borate, selon le schéma de la Fig. 1.
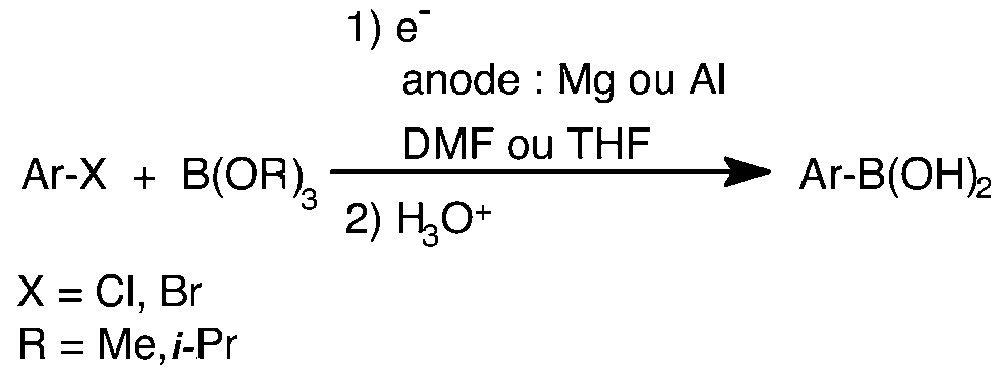
Réaction de couplage est basée sur l’électroréduction directe d’un dérivé aromatique halogéné en présence d’un agent boratant, comme un trialkyl borate.
Ce couplage électrochimique est réalisé dans une cellule monocompartimentée, munie d’une anode métallique en magnésium ou en aluminium et d’une cathode inerte en acier inoxydable ou en mousse de nickel.
Les réactions envisagées aux électrodes sont présentées dans la Fig. 2.
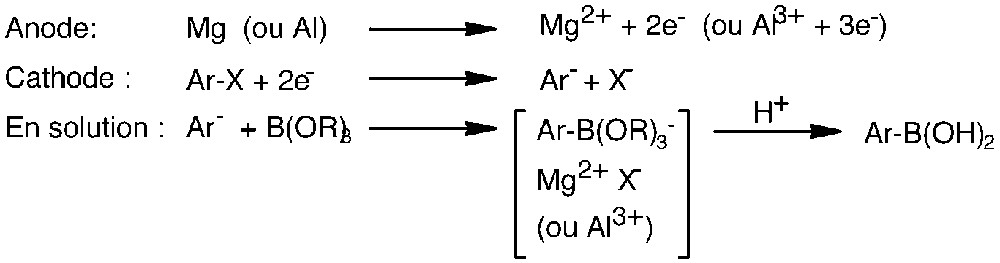
Réactions envisagées aux électrodes.
L’anode métallique est oxydée en ions correspondants (Mg2+, Al3+). Le dérivé aromatique halogéné est réduit à la cathode en anion Ar–, qui peut réagir avec l’agent boratant présent en solution.
Nos premières études ont porté sur l’électroréduction et la fonctionnalisation par des trialkyl borates de dérivés aromatiques (Tableau 1) et hétéroaromatiques [10] chlorés ou bromés. Nous avons examiné l’influence de divers paramètres, tels la nature du solvant, des électrodes, du substrat halogéné, du trialkyl borate, etc., sur les rendements.
Électrosynthèse d’acides et d’esters arylboroniques
| Entrée | Ar-X | Agent boratant | Solvant | Anode/cathode | F/mol ArX | Conversion de ArX (%) | Rendement en ArB(OR)2 (%)a |
| 1 | B(OMe)3 | DMF | Mg/inox | 2,0 | 82 | 45 | |
| 2 | B(OMe)3 | DMF | Mg/inox | 2,0 | 89 | 48 | |
| 3 | B(OMe)3 | DMF | Mg/inox | 2,0 | 78 | 40 | |
| 4 | B(OMe)3 | DMF | Mg/inox | 2,5 | 100 | 32 | |
| 5 | B(OiPr)3 | THF | Mg/inox | 4,0 | 100 | 44 | |
| 6 | B(OiPr)3 | THF | Mg/inox | 4,0 | 82 | 46 | |
| 7 | B(OMe)3 | THF | Mg/inox | 1,6 | 83 | 40 | |
| 8 | B(OMe)3 | DMF | Mg/inox | 4,3 | 100 | 36 | |
| 9 | B(OMe)3 | DMF | Mg/nickel | 5,1 | 100 | 36 | |
| 10 | B(OMe)3 | DMF | Al/nickel | 8,0 | 63 | 41 | |
| 11 | HBpin | THF | Mg/nickel | 6,0 | 77 | 69 | |
| 12 | HBpin | THF | Mg/nickel | 1,2 | 93 | 81 | |
| 13 | HBpin | THF | Mg/nickel | 2,0 | 100 | 78 | |
| 14 | HBpin | THF | Mg/nickel | 2,0 | 83 | 80 | |
| 15 | HBpin | THF | Mg/nickel | 2,0 | 83 | 89 |
Les électrolyses sont réalisées dans le DMF ou le THF à température ambiante et à intensité constante de courant. Le bromobenzène (0,05 M) électroréduit en présence de B(OMe)3 permet d’obtenir 45% d’acide phénylboronique pour 82% de conversion après 2 F mol–1 (entrée 1). Des résultats similaires sont obtenus pour divers dérivés aromatiques bromés plus ou moins substitués (entrées 2 à 5). La réaction peut être également réalisée avec un dérivé aromatique chloré, sans variation significative des rendements (entrées 6 à 10). Le triméthyl borate et le tri-iso-propylborate conduisent à des rendements similaires (entrées 6 et 7). La nature de la cathode influence peu la réaction (entrées 8 et 9) et le remplacement de l’anode en magnésium par une en aluminium permet d’obtenir 41% en acide 4-tolylboronique, mais le rendement faradique est faible (entrées 9 et 10).
Dans tous les cas, le principal sous-produit est ArH, issu de la réduction du dérivé aromatique halogéné, sans qu’il y ait eu couplage avec le trialkyl borate. Les autres sous-produits sont les phénols ArOH, qui se forment par oxydation de ArB(OH)2 lors de l’extraction, mais qui peuvent être facilement évités par un traitement acide sous atmosphère inerte. Pour les réactions réalisées dans le DMF, les aldéhydes ArCHO, issus de la formylation [9, 11] des noyaux aromatiques par le solvant sont aussi formés à 5–20%.
Afin d’améliorer les rendements, nous avons poursuivi nos recherches par l’utilisation de divers autres agents boratants, tels des trialkyl borates cycliques (ROBpin, pin = pinacol), des halogénodihalkoxyboranes (XB(OR)2, X = halogène), des trihalogénures de bore (BCl3, BBr3) ou des dialkoxyboranes (HB(OR)2). Toutefois, avec les dérivés de type XB(OR)2 ou BX3, les rendements en acide arylboronique ont été faibles, ne dépassant pas 26%. Le pinacolborane (HBpin, pin = tétraméthyl éthane diolate) s’est avéré être un des meilleurs agents boratants pour le type de réaction que nous avons développé. Ce dialkoxyborane permet d’obtenir directement des esters pinacolboroniques, composés présentant l’avantage d’être détectés par CPV et d’être facilement extraits et isolés par rapport à leurs homologues acides. Ils sont stables lors d’une hydrolyse acide douce, mais peuvent être convertis en acides arylboroniques par hydrolyse acide forte.
L’électrolyse de dérivés aromatiques chlorés ou bromés dans le THF avec le couple d’électrodes Mg/inox, à 30 mA, en présence de pinacolborane, permet d’obtenir des rendements en esters pinacoliques d’acides arylboroniques diversement substitués de 69 à 89% (entrées 11 à 15). Le seul sous-produit observé est ArH, qui est facilement éliminé.
Nous avons montré que l’électrosynthèse d’acides et d’esters arylboroniques était réalisable à partir de dérivés aromatiques bromés ou chlorés diversement substitués et de trialkyl borates ou de dialkoxyboranes. Les rendements sont compris entre 32 et 89%, en fonction des conditions opératoires. Nous travaillons activement dans ce domaine, afin d’améliorer les conditions et les rendements par l’utilisation de divers agents boratants et de divers substrats, ainsi que par l’étude du mécanisme réactionnel de ce nouveau type de couplage par voie électrochimique.
Remerciements
Nous remercions la société Rhodia Organique pour son support financier.


