1 Introduction
Les polyimides suscitent un intérêt particulier pour l’industrie des techniques de séparation des gaz. Par leur structure, ces matériaux peuvent apporter des solutions permettant de concilier l’exigence contradictoire de l’amélioration de la perméabilité et de la sélectivité. Ainsi, de nombreux travaux de la littérature s’attachent à étudier la relation entre la structure chimique du polymère et les propriétés perméamétriques de ces matériaux [1, 2].
Toutefois, les performances des membranes pour la séparation des gaz sont non seulement imputables aux propriétés intrinsèques des polymères, mais également aux conditions de leur élaboration. En effet, il est clair que le protocole d’étalement de la solution sur le substrat ainsi que le traitement thermique qui suit induisent des modifications notables des coefficients de perméabilité et de sélectivité, dues respectivement à un effet d’orientation du film [3] ou à la quantité de solvant résiduel [4]. En revanche, l’influence de la nature du solvant de mise en œuvre apparaît moins évidente. Khulbe et al. [5–7] ont démontré que le solvant de mise en œuvre affectait les performances de membranes de poly(2,6-diméthyl-1,4-phenylène oxyde), du fait de la cristallisation du polymère induite par le solvant. Dans le cas des polymères amorphes, les différences de propriétés perméamétriques en fonction de la nature du solvant restent soumises à différentes interprétations. D’après Yamasaki et al. [8], elles seraient imputables à la qualité du solvant vis-à-vis du poly(1-triméthylsilyl-propyne), alors que, d’après Joly et al. [4, 9], ces différences de coefficient de perméation résulteraient uniquement de la quantité de solvant résiduel, plus ou moins importante dans les membranes polyimides.
Étant donné ces contradictions et le peu de données bibliographiques, nous avons synthétisé un copolyimide et mis en œuvre ce polymère dans deux solvants différents. Le copolymère étudié est constitué d’une diamine fluorée, 2-trifluorométhyle-4,4′-di(phénylamine)éther (3FODA), alliée à la structure aromatique flexible de l’ODPA (diphényle éther-3,4,3′,4′-dianhydride) et à la structure alicyclique rigide du BCDA (bicyclo[2,2,2] oct-7-ène-2,3,5,6-dianhydride). Les deux solvants, le m-crésol et la N-méthylpyrrolidone (NMP), utilisés lors de la mise en œuvre solubilisent à température ambiante ce copolyimide. Les paramètres microstructuraux (densité, distance interchaînes moyenne (dspacing), indice de couleur (λ50%)) ainsi que les propriétés perméamétriques à quatre gaz simples (hélium, hydrogène, oxygène, azote) ont alors été évalués sur les films ainsi formés.
2 Partie expérimentale
2.1 Matériaux
Le copolyimide CF3ODA-20 a été synthétisé à partir des deux dianhydrides commerciaux, l’ODPA et le BCDA, respectivement à 80 et 20 % molaire, et d’une diamine fluorée 3FODA, élaborée au laboratoire (Fig. 1). Dans le but de contrôler les masses molaires du polymère, un monomère monofonctionnel, l’anhydride 4-tertiobutyle phtalique, synthétisé au laboratoire, a été utilisé. Les voies de synthèse des monomères et polymères et leurs caractérisations par IRTF et RMN (19F, 13C, 1H) ont préalablement été détaillées [10]. Le copolyimide de masse molaire moyenne en nombre de 20 200 ± 600 g mol–1 (déterminée par RMN 1H) a ensuite été mis en œuvre par la méthode associant la coulée d’une solution de polymère et un traitement thermique. Les solvants utilisés, le m-crésol (99 %) et la NMP (99,5 %), fournis par la société Merck, ont été utilisés sans purification supplémentaire. Initialement, des solutions à 10 % en masse de polymère, soit dans le m-crésol, soit dans la NMP, ont été préparées. Après dissolution du polymère, chaque solution a été filtrée sous pression (porosité des filtres de 5 μm), puis coulée sur une plaque de verre. L’épaisseur a été régulée à l’aide d’un filmographe. Le solvant a été ensuite évaporé selon le cycle thermique suivant : 1 h à 80 °C, 1 h à 150 °C, 1 h à 280 °C, avec une vitesse de montée entre chaque isotherme de 1 °C min–1. Les membranes ont été retirées de leur support par immersion dans l’eau à température ambiante. Leur épaisseur est homogène (± 0,2 μm) et varie dans la gamme 15–30 μm.
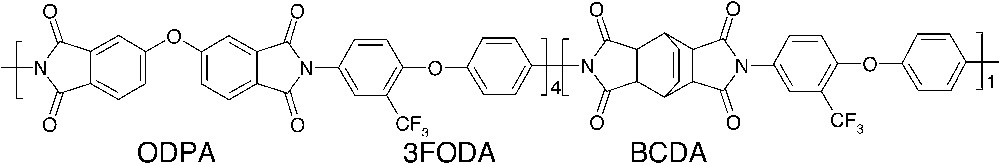
Structure chimique du copolymère ODACF3-20.
2.2 Techniques expérimentales
Les analyses thermogravimétriques (ATG) des solutions de copolyimides et des membranes ont été réalisées sous flux d’air afin, d’une part, de reproduire le cycle thermique d’évaporation du solvant et, d’autre part, de contrôler la quantité de solvant résiduel. La densité des films a été évaluée par flottation à 20 °C dans un mélange n-hexane/CCl4. La fraction de volume libre (FVL) a été calculée par la relation suivante :
| 1 |
| 2 |
Les analyses par diffraction de rayons X en réflexion ont été effectuées sur des films en rotation à température ambiante entre 3 et 50° (en 2θ), avec un pas angulaire de 0,02° pendant 4 s. Les spectres d’absorption en transmission ont été obtenus à température ambiante sur un spectrophotomètre UV/visible (Perkin Elmer, Lambda 11) sur une gamme de longueur d’onde variant de 200 à 900 nm. Après vérification de la loi de Beer–Lambert, l’indice de couleur, défini comme la longueur d’onde à 50 % de transmittance pour un échantillon de 20 μm d’épaisseur, a été évalué. Cet indice est relatif à la capacité des chaînes macromoléculaires à former des complexes par transfert de charge (CTC) au sein du polymère [12]. Les propriétés perméamétriques des membranes à l’hélium, l’hydrogène, l’oxygène et l’azote ont été déterminées à 25 °C avec une cellule de perméation, en utilisant la méthode de pression variable et volume constant. Une pression de 3 bar a été appliquée en amont de la membrane. L’évolution de la pression avale en fonction du temps est dès lors enregistrée. En régime pseudo-stationnaire, il est possible d’évaluer le coefficient de perméabilité (Pe) en considérant un processus de type fickien. La sélectivité idéale (αi/j) correspondant au rapport des coefficients de perméabilité des gaz purs peut être calculée à l’aide de la relation suivante :
| 3 |
L’extrapolation du régime stationnaire coupe l’axe des abscisses au temps θ, appelé temps de retard. D’après la deuxième loi de Fick, le coefficient de diffusion (D) peut dès lors être évalué selon la relation suivante :
| 4 |
3 Résultats. Discussion
3.1 Mise en œuvre
Les deux solvants de mise en œuvre, m-crésol et NMP, présentent des caractéristiques proches, comme la densité, la température d’ébullition et les paramètres de solubilité total et dispersif (Tableau 1). En revanche, ils se distinguent, d’une part, par leur volume molaire et, d’autre part, par leurs composantes polaire et hydrogène du paramètre de solubilité [13].
Caractéristiques des solvants organiques utilisés pour la mise en œuvre des films
| Composantes de Hildebrand (J1/2 cm–3/2) [13] | ||||||
| Solvants | Tébullition (°C) | Densité | M (g mol–1) | Polaire | Hydrogène | Dispersif |
| NMP | 202 | 1,03 | 99,13 | 5,1 | 12,9 | 18,8 |
| m-Crésol | 203 | 1,03 | 108,14 | 12,3 | 7,2 | 17,9 |
Le traitement thermique appliqué lors de la mise en œuvre du copolyimide sous forme de film a été initialement reproduit par analyse thermogravimétrique (Fig. 2). Les faibles vitesses de montée en température, ainsi que l’isotherme à 80 °C, permettent de réduire la vitesse d’évaporation du solvant. L’isotherme à 280 °C supérieure à la température de transition vitreuse (Tg = 261 °C) [10] et inférieure à la température de dégradation du copolyimide synthétisé (Td = 423 °C) [10], ainsi que la descente en température contrôlée à 1°C min–1 induisent à la fois une relaxation des chaînes après évaporation du solvant ainsi qu’une diminution des contraintes internes au sein du film. Il est à noter que l’évaporation du solvant NMP débute plus rapidement que celle du m-crésol (Fig. 2).
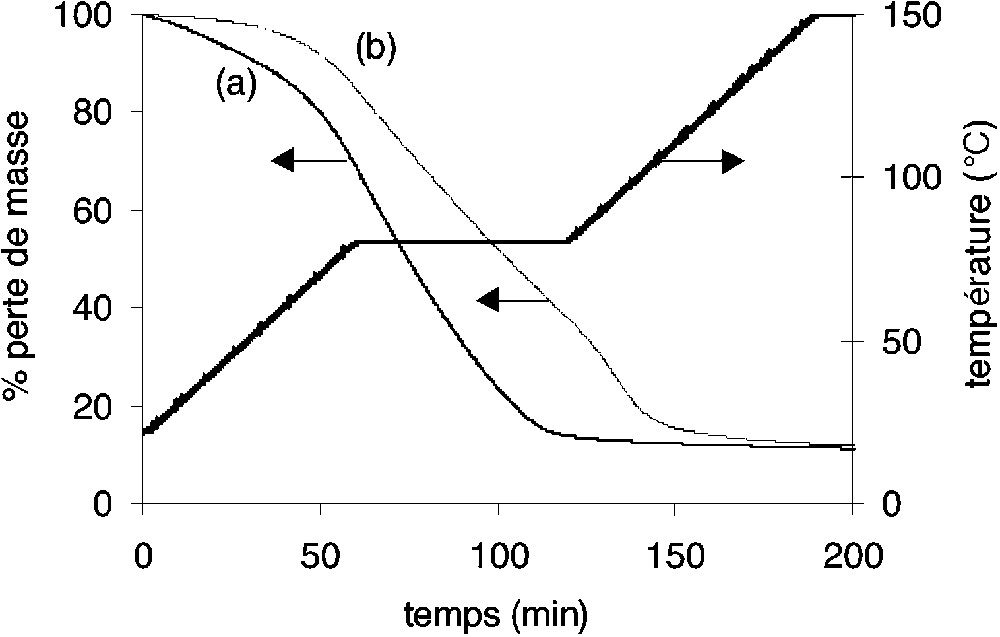
Suivi de l’évaporation de la NMP (a) et du m-crésol (b) au cours du cycle thermique des solutions à 10 % en poids de copolymère.
De plus, dans la limite de détection de l’appareillage, l’analyse par ATG sur les films n’a révélé aucune trace de solvant résiduel au sein de la membrane. Ce dernier résultat n’est pas surprenant, étant donné que le dernier isotherme du cycle thermique est non seulement supérieur à la température de transition vitreuse du polymère, mais également nettement supérieur à la température d’ébullition du solvant.
3.2 Paramètres microstructuraux
Les densités évaluées par flottation et les fractions de volume libre (FVL) déduites de ces mesures sont rapportées dans le Tableau 2. Élaborées à partir du même polymère sous forme de poudre, les deux types de membranes étudiées présentent des densités et, par voie de conséquence, des FVL différentes. Les différences observées seraient induites par la nature chimique du solvant de mise en œuvre : les chaînes macromoléculaires présenteraient alors des conformations différentes dans le solvant, et la membrane résultante conserverait la mémoire de ses conformations en solution. Une autre explication peut être donnée du fait de la différence entre les vitesses d’évaporation des deux solvants, qui peut conduire à des arrangements macromoléculaires distincts. Ainsi, l'évaporation plus rapide du solvant pourrait aboutir à un arrangement des macromolécules moindres, induisant une FVL plus grande.
Caractéristiques microstructurales des membranes étudiées
| Composition | CF3ODA-20/m-crésol | CF3ODA-20/NMP |
| Densité | 1,4229 ± 0,0002 | 1,3940 ± 0,0009 |
| FVL | 0,147 ± 0,001 | 0,164 ± 0,001 |
| dspacing (Å) | 5,0 ± 0,2 | 4,8 ± 0,1 |
| λ50% (nm) | 423 ± 1 | 415 ± 1 |
Les diffractogrammes obtenus par diffraction de rayons X en réflexion montrent que les membranes étudiées présentent les caractéristiques de structures amorphes. Les valeurs du dspacing correspondant à la distance interchaînes moyenne, obtenues à partir de la loi de Bragg et de l’angle au sommet de la bosse amorphe, sont rapportées dans le Tableau 2. Comme les différences entre ces deux valeurs se situent dans l’intervalle d’incertitude, il semble donc que la distance interchaînes moyenne soit peu influencée par le solvant de mise en œuvre.
En revanche, l’indice de couleur, déterminé à partir de la longueur d’onde à 50 % de transmittance pour un film de 20 μm d’épaisseur, varie de façon significative avec le solvant de mise en œuvre. Cet indice, relatif à la capacité des macromolécules à former des complexes par transfert de charge (CTC), est directement relié à l’arrangement des chaînes macromoléculaires. Ainsi, une augmentation de cet indice correspond à une organisation macromoléculaire plus compacte [14]. Ce résultat est cohérent avec les valeurs de densité obtenues, et par voie de conséquence, avec les FVL. Ainsi, les membranes mises en œuvre dans la NMP présentent un arrangement moins compact par rapport aux membranes mises en œuvre dans le m-crésol.
3.3 Propriétés perméamétriques
Les coefficients de perméabilité aux quatre gaz purs étudiés diminuent selon l’ordre suivant : He > H2 > O2 > N2 (Tableau 3). Cette évolution est qualitativement corrélée aux diamètres cinétiques des perméants, en accord avec la littérature [15–18], et ce quel que soit le solvant de mise en œuvre. Les coefficients de diffusion sont donnés dans le Tableau 3 pour l’oxygène et l’azote, les coefficients de diffusion pour l’hélium et l’hydrogène n’ayant pu être déterminés, étant donné le trop faible temps de retard de ces deux perméants. Par ailleurs, les coefficients de diffusion pour l’ensemble des gaz n’ont pu être quantifiés par les isothermes de sorption, les quantités de gaz absorbées étant trop faibles. Comme rapporté dans la littérature dans le cas des polyimides [16, 19], il semble que l’évolution du coefficient de perméabilité pour l’oxygène soit fortement influencée par celle du coefficient de diffusion. Ces résultats, conformes à ceux de la littérature, montrent que le transport des perméants de faible diamètre cinétique dépend fortement du transport diffusif dans le cas des polymères à l’état vitreux [16, 19]. Le coefficient de diffusion de l’azote, légèrement supérieur à celui de l’oxygène, n’est en revanche pas corrélé au coefficient de perméation de l’azote. La solubilité de l’azote (S = P/D) au sein du copolyimide semble donc être sensible aux modifications morphologiques du film [20]. Les coefficients de perméabilité entre les deux membranes sont globalement du même ordre de grandeur, bien que légèrement inférieurs pour les membranes mises en œuvre dans la NMP, excepté pour l’hélium. Les différences de perméabilité entre ces deux membranes sont d’autant plus importantes que le diamètre cinétique du perméant augmente (Fig. 3). Pour les gaz O2 et N2, ces différences entre membranes ne peuvent pas être imputables aux imprécisions de mesure. Il en résulte que plus le gaz est de taille importante, plus il est sensible à la morphologie de la membrane. Les membranes mises en œuvre dans la NMP présentent un coefficient de perméabilité à l’azote très inférieur et donc un pouvoir de séparation supérieur par rapport à celles mises en œuvre dans le m-crésol. Ainsi, ces dernières présentent à la fois une perméabilité moyenne par rapport à la famille des polyimides (Fig. 4) et un faible pouvoir de séparation, alors que les membranes mises en œuvre dans la NMP sont plus sélectives tout en étant globalement aussi perméables. L’utilisation de la NMP comme solvant de mise en œuvre permettrait ainsi une optimisation des propriétés de perméation (Fig. 4), conduisant à des membranes dont les propriétés pour le couple O2/N2 sont proches de la limite supérieure définie par Robeson [19] ainsi que de la zone d’intérêt commercial définie par Koros et Mahajam [21]. Malgré leur faible fraction de volume libre et leur indice de couleur élevé, les membranes mises en œuvre dans le m-crésol restent moins sélectives et plus perméables que celles mises en œuvre dans la NMP pour les perméants de diamètre cinétique important, comme l’oxygène et l’azote. Ces différences pourraient être induites, non pas par la quantité, mais par la distribution du volume libre au sein des membranes. Cette différence de morphologie des membranes résulte de la différence de conformation des macromolécules, qui peuvent, soit conserver la mémoire de leur conformation dans le solvant de mise en œuvre, soit présenter des conformations différentes du fait des différences de vitesse d’évaporation des solvants. Ces différences de morphologie pourraient également être induites par les différences d’hygroscopie entre les deux solvants de mise en œuvre utilisés. En effet, la N-méthylpyrrolidone est un solvant très hygroscopique, utilisé sans purification. Aussi, les molécules d’eau contenues dans ce solvant pourraient jouer le rôle de non-solvant, conduisant ainsi à des modifications nanostructurales.
Coefficients de perméabilité, de diffusion et de sélectivité mesurés à 25 °C, sous une pression de 3 bar
| CF3ODA20/m-crésol | CF3ODA20/NMP | ||
| Perméabilité (Barrer) | He (± 0,5) | 13,5 | 14,8 |
| H2 (± 0,5) | 12,3 | 11,9 | |
| O2 (± 0,01) | 1,13 | 0,82 | |
| N2 (± 0,01) | 0,59 | 0,09 | |
| Diffusion (108 cm2 s–1) | O2 (± 0,2) | 2,0 | 1,5 |
| N2 (± 0,4) | 3,1 | 3,9 | |
| Sélectivité | He/H2 | 1,10 | 1,24 |
| He/N2 | 22,9 | 163,3 | |
| He/O2 | 11,9 | 18,0 | |
| H2/N2 | 20,8 | 131,6 | |
| H2/O2 | 10,9 | 14,5 | |
| O2/N2 | 1,9 | 9,1 |
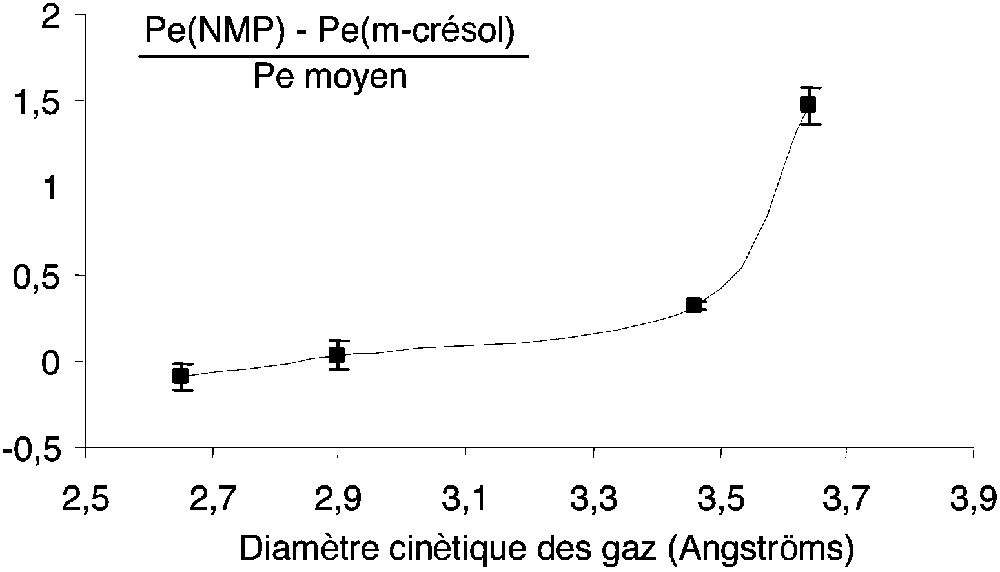
Différence relative du coefficient de perméation, selon la nature du solvant, en fonction du diamètre du perméant.

Sélectivité O2/N2 en fonction de la perméabilité à l’oxygène des polyimides de la littérature [1, 16, 18, 22–37] (×), du CF3ODA-20/NMP (•) et du CF3ODA-20/m-cresol (○). D’autres polymères (), intéressants pour la séparation des gaz [38], ont été ajoutés à titre de comparaison (A : silicone, B : poly(4-méthyl-1-pentène), C : poly(2,6-diméthyl-1,4-phenylène oxyde), D : tétrabromobisphénol A polycarbonate, E : polysulfone).
4 Conclusion
Le copolyimide CF3ODA-20 (80 ODPA et 20 % BCDA) a été mis en œuvre sous forme de films dans deux solvants différents : le m-crésol et la NMP. Ces membranes montrent des différences microstructurales significatives (FVL, indice de couleur), qui ne peuvent pas être attribuées à la présence de solvant résiduel et qui traduisent des changements au niveau de l’arrangement des chaînes macromoléculaires. Ces différences ont des conséquences sur les propriétés perméamétriques. Ainsi, le solvant de mise en œuvre peut conduire à une optimisation de ces propriétés, comme le pouvoir de séparation O2/N2.



