1 Introduction
Les métaux lourds sont régénérés par beaucoup d’industries et les différentes activités humaines. Ils sont introduits dans l’environnement marin par trois voies, à savoir les apports directs, fluviaux et atmosphériques. Contrairement aux autres polluants, ces éléments ne sont pas biodégradables, et sont donc concentrés par les organismes marins à travers la chaîne alimentaire ce qui représente un danger potentiel pour la faune et la flore.
Le zinc et le cuivre sont indispensables à la vie d’un grand nombre de végétaux et animaux marins mais leur excès devient nuisible. En revanche, le cadmium et le plomb ne sont connus que par leur rôle toxique [1, 2].
La détermination de la concentration totale de ces polluants métalliques est une information tronquée quant à leur impact sur l’écosystème marin. En effet, la toxicité des ces éléments est davantage liée à la fraction labile qu’à la concentration totale [3–11].
Ainsi, l’existence d’une méthode d’analyse capable de déterminer la concentration labile des métaux ci-dessus est indispensable. À cet égard, la redissolution anodique à impulsions différentielles est une technique qui se prête parfaitement à cette tache [12–14]. En effet, grâce à sa sensibilité, cette méthode ne nécessite pas d’étape de préconcentration, de même les sels dissous dans l’eau de mer jouent le rôle d’électrolyte support. Ceci permet de s’affranchir des problèmes de perte et de contamination de l’échantillon et de ne pas perturber les équilibres réels du milieu.
À noter que dans les conditions d’une expérience de DPASV, la fraction labile d’un métal n’est autre que sa forme électroactive, elle est définie comme étant la somme des concentrations du métal libre et de la portion dissociée des complexes labiles [15–17]. Le protocole expérimental adopté pour effectuer une mesure par cette méthode est constitué de trois étapes : la pré-électrolyse ou dépôt, le repos et la redissolution.
Malgré les grandes performances de la DPASV dans le domaine analytique, l’aspect théorique n’est pas toujours très explicite. À ce propos, la relation empirique suivante donnant le courant du pic est souvent applicable [18–21] :
On se propose dans ce travail d’étudier l’influence des principaux paramètres expérimentaux sur le courant de redissolution, à savoir le potentiel de pré-électrolyse, le temps de dépôt, la vitesse d’agitation de la solution et l’amplitude des impulsions. Le rayon de la goutte de mercure est maintenu constant pour toutes les mesures et la vitesse de balayage pendant la dernière étape est égale à 5 mV s–1. L’objectif est la détermination des conditions opératoires optimales pour chacun des ces paramètres afin de déterminer les concentrations labiles du cadmium, du cuivre, du plomb et du zinc dissous en milieu marin côtier.
2 Protocole expérimental
Le matériel utilisé pour les analyses en DPASV est un ensemble Radiometer, constitué d’un analyseur polarographique POL 150 et d’un stand MDE 150. L’ensemble est piloté par un micro-ordinateur, à l’aide du logiciel Trace Master 5. Les électrodes utilisées sont la goutte de mercure pendante comme électrode indicatrice, un fil de platine sert de contre-électrode, les potentiels sont exprimés par rapport à une électrode Ag/AgCl. Toutes les expériences ont été effectuées à 25 °C.
Les échantillons ont été prélevés à une profondeur de 1 m au moyen d’un échantillonneur en polyéthylène Azlon. Le site choisi est le littoral de la ville de Safi, plus particulièrement la zone où il y a évacuation des effluents industriels.
Les échantillons prélevés sont collectés dans des flacons en polyéthylène et mis dans une glacière portative jusqu’au laboratoire. Ils sont filtrés le jour même sur filtre de nitrate de cellulose, Sartorius, de porosité 0,45 μm, lavé au préalable avec HNO3 dilué, puis avec l’eau distillée. Une fois filtrée, l’eau de mer est analysée directement à pH normal. Dans ces conditions, seule la fraction labile des métaux est dosée [22–24].
3 Résultats expérimentaux et discussions
Nous avons identifié en premier lieu les pics d’oxydation des quatre métaux ; pour ce faire, nous avons étudié l’eau de mer filtrée à pH normal en imposant un potentiel initial égal à –1200 mV, le potentiel final est de 0 mV. Le temps de dépôt est de 600 s, le temps de repos est de 30 s, l’amplitude des impulsions est de 50 mV, la vitesse d’agitation est de 525 tr min–1 et le temps de dégazage est de 10 min. Le polarogramme obtenu est représenté sur la Fig. 1, les potentiels de pics sont : –990 mV, –615 mV, –430 mV et –190 mV respectivement pour le zinc, le cadmium, le plomb et le cuivre.
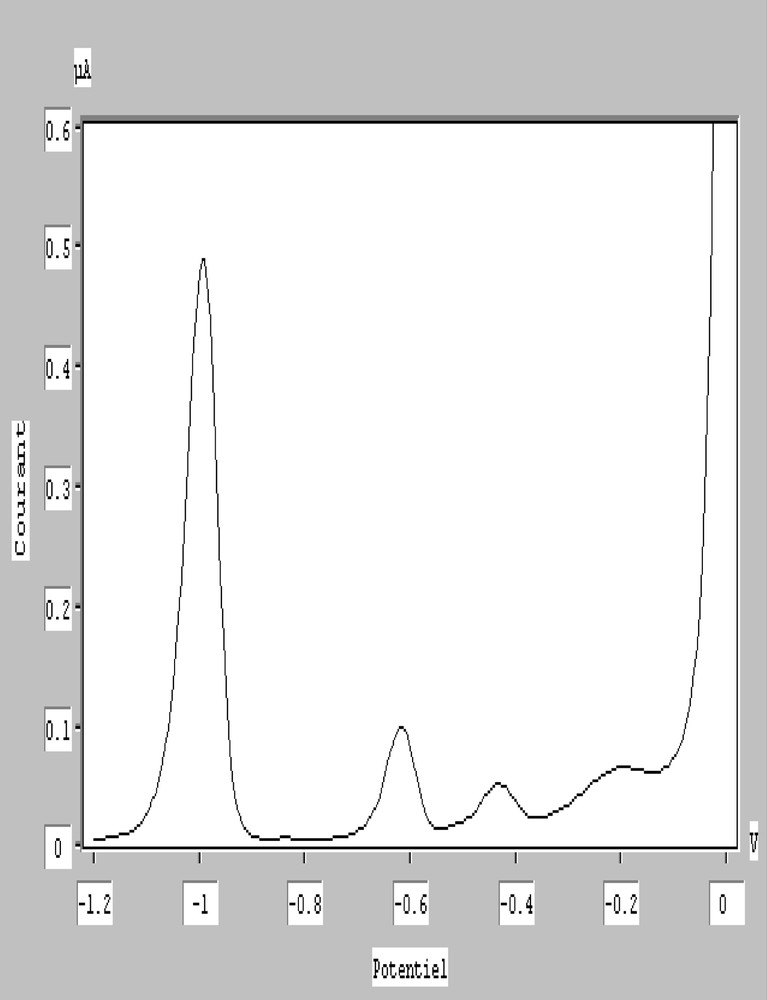
DPASV sur électrode de mercure pendante. Eau de mer filtrée sur 0,45 μm à pH normal. Ep = –1200 mV, u = 525 tr min–1, v = 5 mV s–1, td = 600 s, ΔE = 50 mV.
En deuxième lieu, et pour toutes conditions égales par ailleurs, on fait varier à chaque fois un paramètre donné et on regarde son effet sur le courant de redissolution de chaque métal.
3.1 Potentiel de pré-électrolyse
Comme on peut le voir sur la Fig. 2, les courants augmentent d’une manière notable pour les premiers potentiels imposés ; cet accroissement devient moins significatif pour les valeurs les plus négatives, et ce pour les quatre métaux. Pour le zinc, l’étude au-delà de –1500 mV est limitée par la réduction des ions H+, qui devient importante et qui peut masquer le signal correspondant à ce métal.
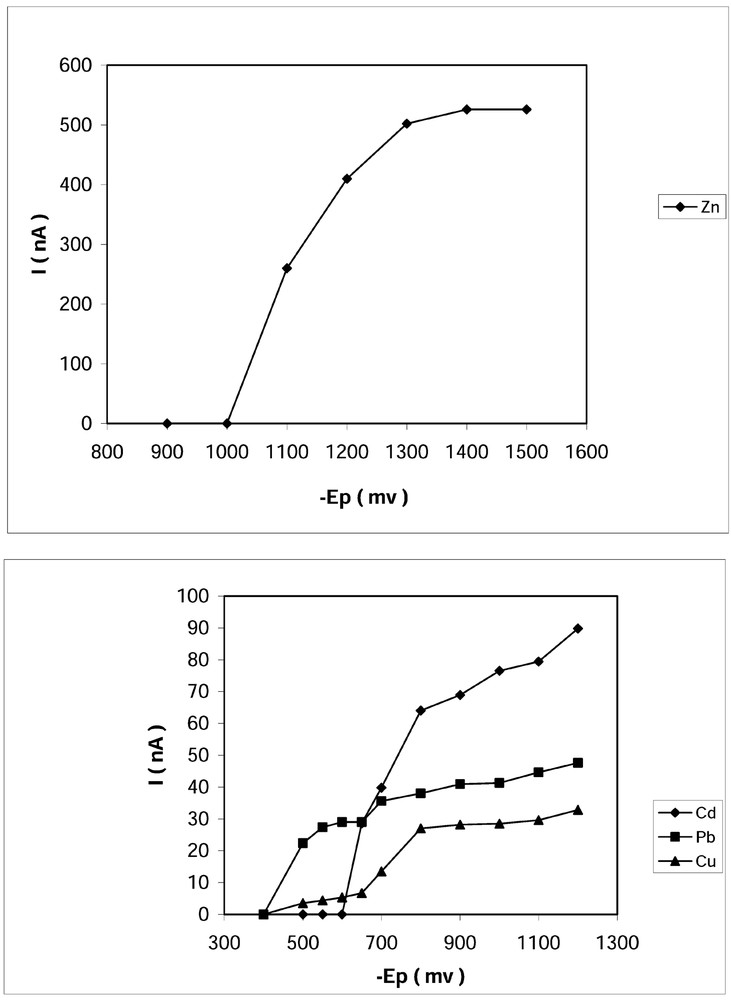
Effet du potentiel de pré-électrolyse. u = 525 tr min–1, v = 5 mV s–1, td = 600 s, ΔE = 50 mV.
En effet, plus le potentiel de dépôt est négatif, plus la quantité de métal déposée sur la goutte de mercure devient importante. Quand le potentiel de pré-électrolyse devient suffisamment négatif, on observe, en plus de la réduction de la fraction labile de l’élément étudié, celle de certains complexes qui se dissocient dans la double couche.
Ce résultat montre le rôle capital du potentiel de pré-électrolyse quant à l’analyse de la concentration labile d’un métal dissous en milieu marin. Ainsi, toute détermination de ce genre nécessite un choix judicieux de ce paramètre ; sinon, la méthode perd de sa spécificité.
Compte tenu de cette contrainte, il est donc indispensable de doser chaque métal séparément, en imposant un potentiel qui ne doit pas être trop négatif et qui donnera un pic dont les lignes de base sont suffisamment claires pour être exploités quantitativement. À ce propos, les potentiels suivants sont recommandés : –1200 mV pour le zinc, –800 mV pour le cadmium, –700 mV pour le plomb et –650 mV pour le cuivre.
3.2 Amplitude
L’effet de trois amplitudes d’impulsion sur les courants de pics a été réalisé. Pour les trois valeurs, la linéarité est vérifiée et les pics sont bien nets pour les quatre métaux (Fig. 3). Compte tenu de la faible teneur de ces métaux en milieu marin, en particulier en l’absence de pollution, l’amplitude de 50 mV a été choisie afin d’avoir une meilleure sensibilité.

Influence de l’amplitude des impulsions. u = 525 tr min–1, v = 5 mV s–1, td = 600 s, Ep = –1200 mV (Zn), –800 mV (Cd), –700 mV (Pb), –650 mV (Cu).
3.3 Temps de pré-électrolyse
L’effet du temps de dépôt sur les courants d’oxydation des quatre métaux a été étudié en imposant les potentiels cités précédemment (Fig. 4). Les courants sont proportionnels au temps de dépôt pour les faibles valeurs. En revanche, on observe un écart à la linéarité au fur et à mesure que les temps augmentent, et on assiste à une variation non consistante des courants. L’hypothèse la plus plausible est la diffusion des amalgames de ces éléments dans le mercure quand l’étape d’électrodéposition est prolongée. Il en résulte qu’une partie de l’amalgame ne peut être oxydée dans nos conditions opératoires, et que les courants d’oxydation augmentent moins que ne le prévoit la relation (1). Afin d’éviter ce risque, il est souhaitable de ne pas opter pour des temps de pré-électrolyse longs ; à cet égard, l’intervalle 10 à 15 min représente un bon compromis.

Variations des courants de pics pour différents temps de pré-électrolyse. u = 525 tr min–1, v = 5 mV s–1, ΔE = 50 mV, Ep = –1200 mV (Zn), –800 mV (Cd), –700 mV (Pb), –650 mV (Cu).
3.4 Vitesse d’agitation
Nous avons étudié l’influence de la vitesse d’agitation de la solution au cours de l’étape de dépôt sur les courants de pics. Les résultats obtenus pour des vitesses allant de 0 à 800 tr min–1 sont représentés sur la Fig. 5.
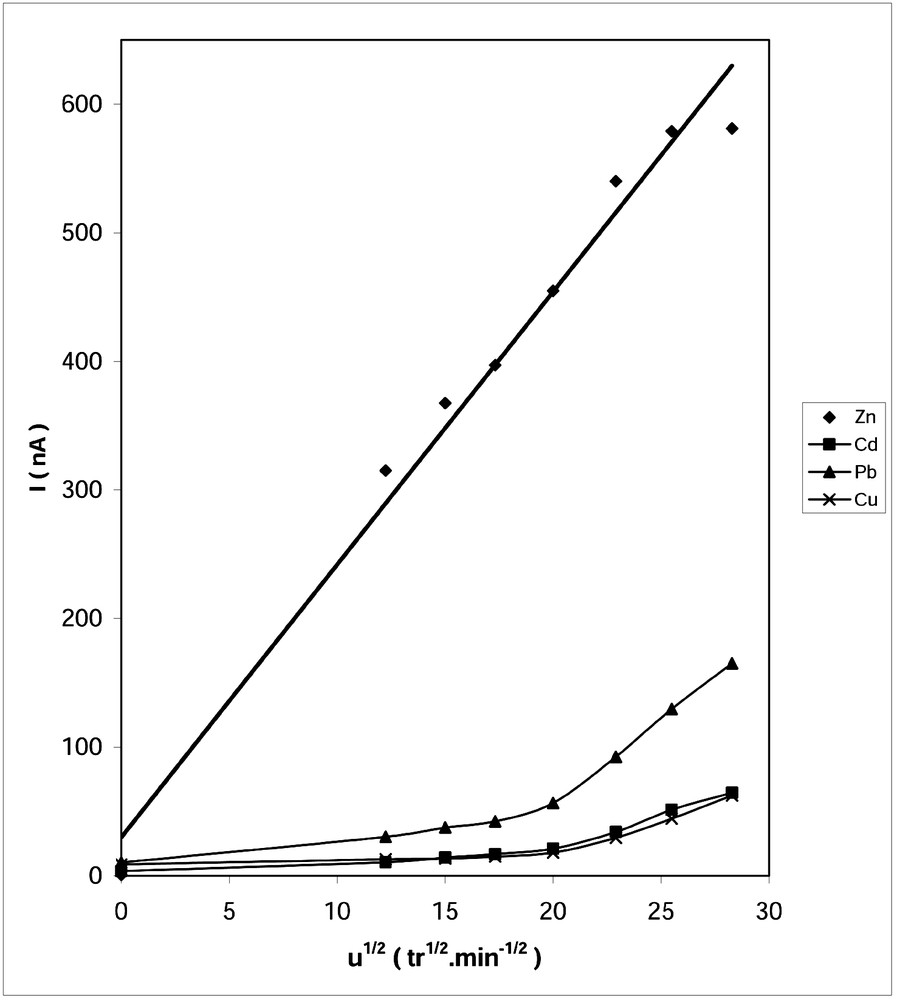
Effet de la vitesse d’agitation sur les courants de pic. v = 5 mV s–1, td = 600 s, ΔE = 50 mV, Ep = –1200 mV (Zn), –800 mV (Cd), –700 mV (Pb), –650 mV (Cu).
Nous constatons que le tracé des courants des pic en fonction de la racine carrée de la vitesse d’agitation est une droite pour le zinc, et ce pour toutes les vitesses choisies. Cependant, pour le cadmium, le plomb et le cuivre, on a deux portions de droite, avec un changement de pente pour 400 tr min–1. Aussi, il est intéressant de noter que les courants enregistrés en absence d’agitation sont négligeables.
Ce comportement traduit l’importance de ce paramètre. En effet, pendant la pré-électrolyse, l’apport du métal vers la goutte est assuré par la diffusion et la convection, ce qui agit sur le rendement du dépôt métallique. Ceci explique le gain de sensibilité observé pour les vitesses d’agitation supérieures à 400 tr min–1 pour les éléments à faible teneur, à savoir le cadmium, le plomb et le cuivre.
Pour les grandes vitesses d’agitation, on assiste parfois à la chute de la goutte et à la création de bulles d’air dans la solution, ce qui est gênant pour la reproductibilité des mesures. Ainsi, une vitesse d’agitation comprise entre 400 et 650 tr min–1 est conseillée.
4 Étude de la reproductibilité
Dans le but d’évaluer la reproductibilité de nos mesures, nous avons enregistré plusieurs fois la courbe courant–potentiel pour le même échantillon. Avant chaque mesure, on forme une nouvelle goutte de même taille, et on dégaze à l’azote pendant 10 min.
À cet égard, nous avons choisi les paramètres qui nous ont procuré les meilleures conditions de sensibilité et de reproductibilité. Les résultats obtenus sont très satisfaisants : en aucun cas, l’erreur ne dépassait 4 %.
5 Conclusion
Pour l’analyse de la fraction labile des métaux lourds dissous en milieu marin, les paramètres expérimentaux recommandés sont : un potentiel de pré-électrolyse de –1200 mV pour le zinc, –800 mV pour le cadmium, –700 mV pour le plomb et –650 mV pour le cuivre, une amplitude d’impulsion de 50 mV, un temps de pré-électrolyse de 10 à 15 min, une vitesse de balayage de 5 mV s–1 et une vitesse d’agitation allant de 400 à 650 tr min–1.
En plus de sa sensibilité, la redissolution anodique en mode pulsé sur électrode à goutte de mercure pendante présente l’avantage d’être rapide, reproductible, spécifique et ne demande pas d’installation spéciale.


