1 Introduction
L’idée de produire des produits similaires à ceux issus du pétrole à partir des huiles végétales, produits de base peu coûteux, a été étudié par Mailhe [1–4] au début du XXe siècle. Les travaux de Mailhe ont porté sur la pyrolyse catalytique d’huiles végétales (huiles de lin, de colza, d’arachide, de ricin), qui peuvent se décomposer en eau, acroléine, gaz non condensables, hydrocarbures lourds et légers et une petite quantité de coke. Après distillation fractionnée du liquide obtenu par pyrolyse et hydrogénation en présence de nickel, il obtient trois fractions : un liquide visqueux, composé d’hydrocarbures lourds et d’acides gras, pouvant être utilisé comme lubrifiant, un liquide jaune roux, de densité et de composition proches de celles du pétrole lampant, une fraction jaune, légère, de densité et de composition voisines de celles d’une essence.
La pyrolyse des esters d’acides gras fut beaucoup moins exploitée, car ces esters ne sont pas des produits naturels. Mais ils peuvent être obtenus facilement par transestérification des huiles (triglycérides). L’opération de transestérification est peu coûteuse, et les esters sont plus faciles d’utilisation que les huiles (viscosité et point d’ébullition plus bas). Des études menées quant à la pyrolyse catalytique et non catalytique des esters d’acides gras [5–8] ont permis d’établir les mécanismes de décomposition en fonction des conditions opératoires et d’obtenir, comme pour les huiles, des hydrocarbures, composés habituellement obtenus par la pétrochimie.
L’emploi de charbon lors de la pyrolyse aqueuse [5] du stéarate de phényle, à 330 °C, pendant 3 j, avec un rapport molaire charbon/charge égal à 16:1, permet d’obtenir environ 70% d’alcanes (l’alcane en C17 étant majoritaire), ainsi que du phénol et de l’acide octadécanoïque, qui provient de l’hydrolyse de l’ester. La présence de ces produits d’hydrolyse indique qu’ils sont des intermédiaires dans la synthèse des alcanes obtenus. En revanche, la même expérience, réalisée sans catalyseur, conduit essentiellement à du phénol et à de l’acide octadécanoïque ; on obtient seulement 3,4% d’alcane linéaire en C17.
La pyrolyse des esters en présence d’un gaz vecteur inerte (l’azote) évite l’hydrolyse des esters et permet d’obtenir des esters plus courts. Moulton et al. [6] ont employé un gel de silice et ont réalisé la pyrolyse d’esters lourds méthyliques non substitués tels que l’oléate de méthyle et le palmitate de méthyle. Ils ont obtenu des esters méthyliques légers, insaturés, du type CH2=CH–(CH2)n–COOCH3, et des hydrocarbures saturés et insaturés lourds. Les formations de CO2 (par décarboxylation), et d’hydrocarbures gazeux légers sont limitées, ainsi que les réactions de polymérisation et de carbonisation.
Pour étudier la valorisation chimique de l’huile de colza, nous avions pyrolysé des esters méthyliques directement formés par transestérification de l’huile, procédé mis au point par l’Institut français du pétrole. La principale utilisation des esters est actuellement le carburant (diester) ; nous avions essayé de les valoriser différemment, par pyrolyse non catalytique, afin de les transformer en produits à haute valeur ajoutée, pouvant servir d’intermédiaires de synthèse. Archambault et Billaud [9–13] ont étudié la pyrolyse de l’oléate de méthyle afin d’obtenir des alphaoléfines linéaires dans la coupe C10–C14 et des esters méthyliques insaturés dans la coupe C6:1–C12:1. L’étude paramétrique réalisée en présence d’azote a montré que les températures supérieures à 600 °C favorisaient la formation des hydrocarbures légers, et qu’il fallait se placer entre 550 et 600 °C pour obtenir les meilleures sélectivités et rendements en produits recherchés. Ils ont aussi remarqué que la conversion de l’oléate de méthyle était plus élevée en présence d’eau qu’en présence d’azote, mais que cette augmentation se faisait au profit des hydrocarbures légers en C1–C4 et au détriment des produits plus lourds. Pour obtenir les meilleurs rendements en produits recherchés, le point de fonctionnement idéal du procédé est une température de réaction de 600 °C et un temps de passage compris entre 500 et 600 ms. Le Tableau 1 résume les rendements en produits obtenus pour ce point de fonctionnement avec une dilution à l’azote et à l’eau.
Rendements en produits à 600 °C pour τ = 500–600 ms
| Diluant | Azote | Eau |
| Conversion | 13–19% | 37–49% |
| Hydrocarbures C1–C4 | 0,8–2,4% | 10–15% |
| Oléfines C5–C9 | 0,7–1,2% | 2,5–2,7% |
| Oléfines C10–C14 | 0,6–0,8% | 1–1,3% |
| Esters C6:1–C12:1 | 1,3% | 2,5–2,9% |
Dans ces conditions opératoires étudiées, les rendements obtenus en molécules à haute valeur ajoutée restent faibles, ce qui n’est pas envisageable en vue d’une adaptation future à l’échelle industrielle, d’où l’intérêt de travailler avec un catalyseur pour diminuer les températures de réaction et augmenter les sélectivités en produits recherchés.
L’oléate de méthyle utilisé est fourni par la société Robbe. Il s’agit du lot Estorob 201.21 (23 HZ 52), dont la composition est donnée dans le Tableau 2.
Composition de l’oléate de méthyle
| Ester | Symbole | % massique |
| Palmitate | C16:0 | 4,06 |
| Linoléate | C18:2 | 7,65 |
| Oléate | C18:1 | 82,1 |
| Stéarate | C18:0 | 4,24 |
| Gadoléate | C20:1 | 0,23 |
| Arachidate | C20:0 | 0,36 |
| Béhénate | C22:0 | 0,98 |
| Tétracosanoate | C24:0 | 0,38 |
L’étude paramétrique est réalisée avec trois types de catalyseurs : l’alumine activée, la silice alumine et la kaolinite. En changeant la masse de catalyseur ainsi que la température de la réaction et le débit de la charge, des variations de la conversion et de la distribution des produits formés sont observées. Le Tableau 3 présente les caractéristiques de ces trois différents catalyseurs : un catalyseur à base d’argile, la kaolinite (Alfa), une silice–alumine amorphe (Akzo Nobel) et une alumine activée (Alcan).
Caractéristiques de la kaolinite, de l’alumine activée et de la silice–alumine
| Nom du catalyseur (fabricant) | Kaolinite (Alfa) | Silice–alumine (Akzo Nobel) | Alumine activée–AA 200 (Alcan) |
| Formule | Al2O32 SiO22 H2O | SiO2–Al2O3 | Al2O3 |
| Composition (%) | Al2O3 21,2 ;SiO2 54,5 ;H2O 24,3 | Al2O3 81 ;SiO2 3–5 | Al2O3 95–97 ;H2O 3–5 |
| SiO2/Al2O3 (théorique) | 2 | 0,23 | — |
| Surface spécifique (m2 g–1) | 15–20 | 328 | 280–300 |
| Masse volumique (g cm–3) | 1,1 | — | 0,75 |
Au cours de la réaction de craquage, il y a formation de coke à la surface du catalyseur, ce qui rend le catalyseur moins actif. L’activité initiale du catalyseur est alors restaurée par combustion ménagée à 490 °C sous courant d’air pendant 1 à 2 h, jusqu’à la disparition complète de CO et de CO2.
Nous nous sommes limités à des catalyseurs amorphes, alors que la grande majorité des catalyseurs utilisés en craquage catalytique sont des zéolithes ; des essais faits avec une zéolithe X13 ont augmenté les rendements en produits gazeux, en coke et en produits aromatiques, ce qui nous éloignait des objectifs de l’étude.
2 Description du pilote
Le dispositif de craquage catalytique peut être divisé en quatre parties [14] :
- • l’injection de la charge (ester) et du diluant (azote ou eau) ; l’air comprimé est utilisé lors du décokage du catalyseur ;
- • le four dans lequel est placé le réacteur catalytique à lit fixe ;
- • le piégeage des produits et la séparation gaz/ liquide ;
- • l’analyse des effluents liquides et gazeux.
3 Résultats expérimentaux et discussion
3.1 Craquage thermique de l’oléate de méthyle
Le craquage thermique de l’oléate de méthyle sans catalyseur est réalisé à 600, 550, 500, 450 et 400 °C. Les résultats en produit organique liquide (POL), en produit gazeux (PG) et en coke (PC) sont donnés dans le Tableau 4.
Résultats expérimentaux du craquage thermique de l’oléate de méthyle
| Température de réaction | 600 °C | 550 °C | 500 °C | 450 °C | 400 °C |
| POL (% massique) | 16,8 | 32,8 | 21,4 | 8,0 | 3,6 |
| PG (% massique) | 41,7 | 16,8 | 6,5 | 3,2 | 1,3 |
| PC (% massique) | 5,6 | 2,6 | 0,6 | 0,7 | 0,6 |
| Conversion | 92 | 68,3 | 30,4 | 12 | 6 |
À partir de 500 °C, les conversions sont élevées pour un craquage sans catalyseur.
3.2 Études expérimentales avec l’alumine activée
Les résultats expérimentaux avec 40 g d’alumine activée à 400, 450 et 500 °C sont reportés dans le Tableau 5.
Résultats à 500, 450, 400 et 350 °C avec 40 g d’alumine activée
| Température de réaction | 500 °C | 450 °C | 400 °C |
| POL (% massique) | 63,6 | 70 | 68,9 |
| PG (% massique) | 16,7 | 14,1 | 9,9 |
| PC (% massique) | 1,7 | 1,3 | 1,7 |
| Conversion | 100 | 100 | 100 |
La conversion de l’oléate de méthyle est totale à 400, 450 et 500 °C, ce qui engendre la formation de nombreux produits. Les rendements en hydrocarbures de coupes C1–C4, C5–C9, C10–C14 et C15–C21 sont reportés sur les Figs. 1–4 . Les produits recherchés et à haute valeur ajoutée (les alphaoléfines en C10–C14 et les monoesters en C6:1–C12:1 font partie de la coupe d’hydrocarbures C10–C14.
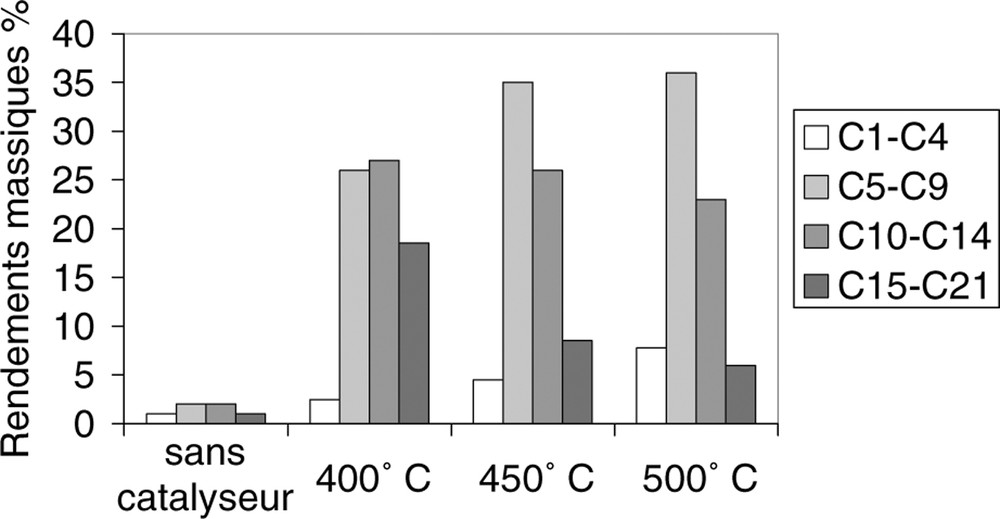
Rendements massiques des coupes C1–C4, C5–C9, C10–C14 et C15–C21 en fonction de la température.
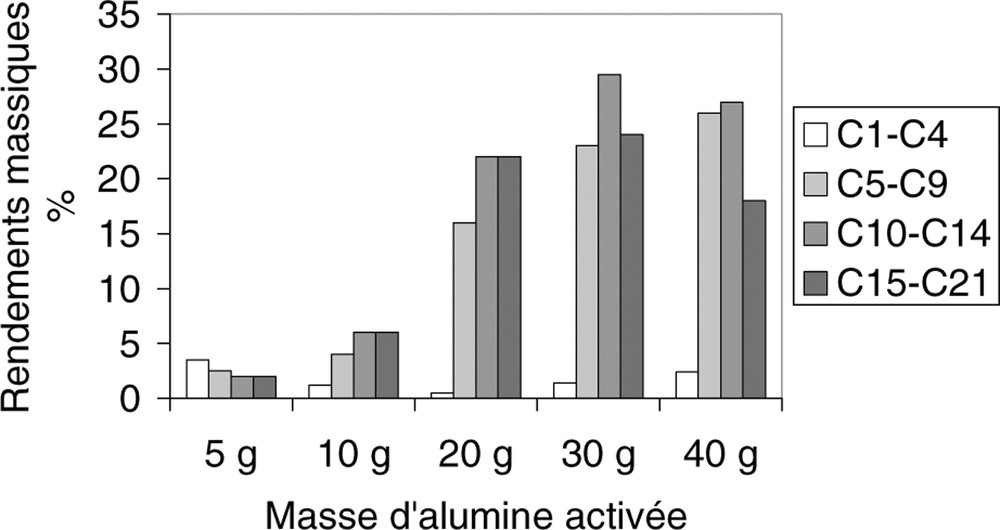
Rendements massiques des coupes C1–C4 , C5–C9, C10–C14 et C15–C21 en fonction de la masse de catalyseur.
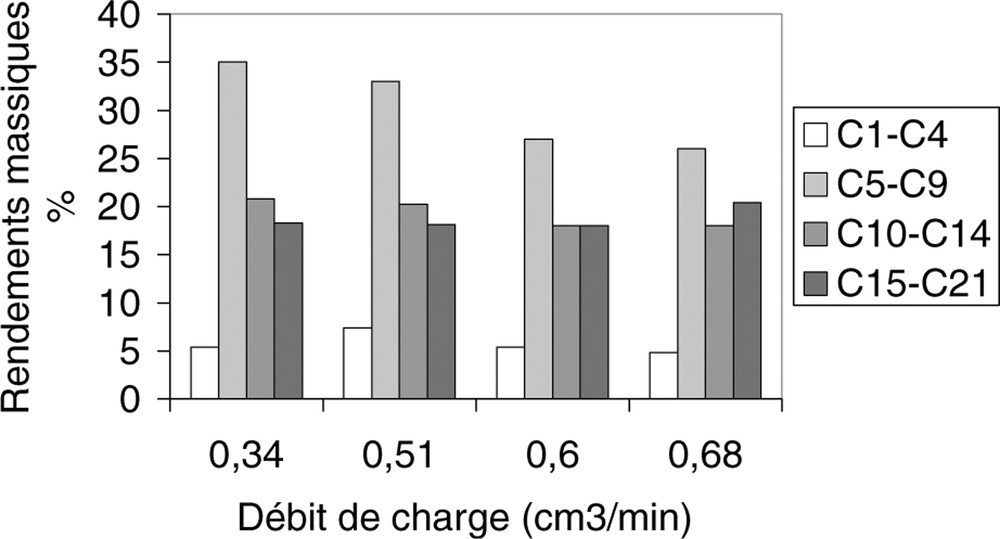
Rendements massiques des coupes C1–C4, C5–C9, C10–C14 et C15–C21 en fonction du débit de charge.
Les rendements des différentes coupes d’hydrocarbures avec et sans catalyseur sont reportés sur la Fig. 1.
À 400 °C, le rendement massique de la coupe d’hydrocarbures C10–C14 est le plus élevé mais les coupes C5–C9 et C15–C21 sont en quantités équivalentes. Les résultats expérimentaux de l’étude paramétrique à cette température et avec des masses d’alumine activée de 30, 20, 10 et 5 g sont répertoriés dans le Tableau 6.
Résultats expérimentaux à 400 °C avec 40, 30, 20, 10 et 5 g de catalyseur
| Masse de catalyseur | 40 g | 30 g | 20 g | 10 g | 5 g |
| POL (% massique) | 68,9 | 75,7 | 58,6 | 15,8 | 6,5 |
| PG (% massique) | 9,9 | 7,7 | 4,6 | 4,1 | 5,4 |
| PC (% massique) | 1,7 | 1,5 | 1,3 | 0,9 | 0,6 |
| Conversion | 100 | 100 | 88,4 | 31,9 | 19,3 |
La conversion de l’oléate de méthyle est totale à 400 °C, avec 40 et 30 g d’alumine activée. Avec 20 g de catalyseur, elle est de l’ordre de 90%, puis chute à 30% avec 10 g.
Les rendements en hydrocarbures de coupes C1–C4, C5–C9, C10–C14 et C15–C21 sont représentés sur la Fig. 2.
À 400 °C, avec 30 g d’alumine activée, le rendement de la coupe d’hydrocarbures C10–C14 est le plus important (environ 30%), mais les autres coupes C5–C9 et C15–C21 sont formées en quantité non négligeable (de l’ordre de 25%). Ces conditions opératoires ne permettent donc pas d’avoir une bonne sélectivité en une coupe d’hydrocarbures.
Les produits identifiés par GC/MS de la coupe d’hydrocarbures C10–C14 du POL sont les suivants : 1-décène, décane, 4-décène, 4-undécène, 5-undécène et undécane, 2-dodécène, 3-dodécène, 1-tridécène, tridécane, 1-tétradécène, tétradécane et 5-tétradécène. Les alphaoléfines en C10-C14 sont formées en faibles quantités.
3.3 Étude expérimentale avec la silice–alumine
L’étude est réalisée à 400°C avec 10 et 5 g de silice–alumine. Les résultats expérimentaux sont reportés dans le Tableau 7.
Résultats expérimentaux à 400 °C avec 10 et 5 g de silice–alumine
| Masse de catalyseur | 10 g | 5 g |
| POL (% massique) | 71,4 | 51,7 |
| PG (% massique) | 11,1 | 6,9 |
| PC (% massique) | 2,6 | 1,9 |
| Conversion | 97 | 76,4 |
La conversion avec 10 g de catalyseur à 400 °C est de 97%, soit trois fois celle obtenue dans les mêmes conditions avec l’alumine activée. La coupe d’hydrocarbures C5–C9 est formée en quantité majoritaire de l’ordre de 35% suivie des coupes C10–C14 et C15–C21 (20%). La silice–alumine, plus acide que l’alumine activée, va donc favoriser les réactions de craquage et conduire à des espèces moléculaires plus petites que dans le cas de l’alumine activée.
En faisant varier le débit de charge de 0,34 à 0,68 cm3 min–1, à 400 °C et avec 10 g de silice–alumine, on obtient les résultats expérimentaux reportés dans le Tableau 8.
Résultats à 400 °C avec 10 g de silice alumine
| Débit de la charge (cm3 min–1) | 0,68 | 0,6 | 0,51 | 0,34 |
| POL (% massique) | 64,9 | 62,4 | 68,8 | 71,4 |
| PG (% massique) | 7,2 | 8,6 | 12,9 | 11,1 |
| PC (% massique) | 2,1 | 2,2 | 2,6 | 2,6 |
| Conversion | 82,9 | 84,7 | 93,8 | 97 |
La conversion reste élevée lorsqu’on double le débit de la charge : elle est de l’ordre de 80% à un débit de 0,68 cm3 min–1. Les rendements en hydrocarbures de coupes C1–C4, C5–C9, C10–C14 et C15–C21 sont représentés sur la Fig. 3.
En augmentant le débit de charge, le rendement massique de la coupe d’hydrocarbures C10-C14 diminue alors que celui de la coupe d’hydrocarbures C15-C21 augmente.
En multipliant par 2 le débit de diluant (0,1 l min–1 d’azote) et en travaillant à 400 °C avec 10 g de silice–alumine, la conversion de l’oléate de méthyle est de l’ordre de 92%. La coupe d’hydrocarbures C5–C9 est formée en quantité prédominante (31% en rendement massique).
3.4 Étude expérimentale avec la kaolinite
À 400 °C avec 10 g de catalyseur, le Tableau 9 permet de comparer les résultats obtenus avec la kaolinite et les deux catalyseurs étudiés précédemment (silice–alumine et l’alumine activée).
Résultats expérimentaux avec la kaolinite, alumine activée et silice-alumine à 400 °C pour 10 g de catalyseur
| Nature du catalyseur | Kaolinite | Alumine activée | Silice–alumine |
| POL (% massique) | 20,9 | 15,8 | 71,4 |
| PG (% massique) | 5,3 | 4,1 | 11,1 |
| PC (% massique) | 1,2 | 0,9 | 2,6 |
| Conversion | 31,5 | 31,9 | 97 |
Les résultats obtenus avec la kaolinite sont semblables à ceux obtenus avec l’alumine activée : la conversion est du même ordre de grandeur et la répartition des coupes d’hydrocarbures formés est identique, ce qui s’explique par l’acidité comparable de la kaolinite et de l’alumine activée.
4 Conclusion
L’étude paramétrique du craquage catalytique de l’oléate de méthyle a été réalisée avec trois types de catalyseurs : l’alumine activée, la kaolinite et la silice–alumine. Les meilleurs conversions et rendements en coupe d’hydrocarbures C10–C14 sont obtenus avec l’alumine activée à 400°C pour 30 g de catalyseur. Cependant, les autres coupes C5–C9 et C15–C21 sont formées chacune en grandes proportions (plus de 25%) dans ces conditions opératoires. La silice–alumine favorise la formation de la coupe C5–C9.
Cette étude peut être étendue à d’autres composés plus réactifs que les esters, comme les triglycérides ou les acides gras, pour valoriser par exemple les boues grasses ou les déchets lipidiques de l’industrie agroalimentaire.


