1 Introduction
Le cortex visuel des primates, situé dans le lobe occipital, est divisé en différentes aires fonctionnelles, qui possèdent des propriétés distinctes, fonction des populations neuronales qui les composent. Certaines de ces aires sont plus spécifiquement sensibles au mouvement, aux formes ou à la perception des couleurs [1]. Les mécanismes de traitement de l'information rétinienne par l'ensemble des aires fonctionnelles sont encore mal élucidés. Pour explorer, au cours d'une expérience cognitive, comment le cortex visuel réalise ce traitement distribué et comment il exploite des indices spécifiques locaux ou globaux pour permettre la reconnaissance d'une scène, il faut au préalable savoir localiser précisément les aires visuelles. Ces dernières présentent une grande variabilité inter-individuelle quant à leur forme et à leur position, et les indices anatomiques sont peu informatifs [2,3].
Sur la base de la rétinotopie, une propriété spécifique des aires visuelles primaires, et en utilisant l'IRM fonctionnelle (IRMf), nous allons montrer comment délinéer les frontières entre ces aires [4]. Cette délinéation nécessite (1) de générer des stimuli visuels qui parcourent le champ visuel de façon périodique, (2) de détecter les activations cérébrales produites, (3) de segmenter puis déplier le cortex cérébral pour respecter sa topologie essentiellement bidimensionnelle, (4) de projeter les activations sur cette surface dépliée, puis (5) de délinéer les aires visuelles à partir de l'alternance du signe du champ visuel. Une fois ces cartes individuelles établies, l'implication de certaines aires visuelles, lors d'une tâche cognitive particulière, pourra être mise en évidence par projection des activations correspondantes sur cette surface annotée. Toutes ces étapes de traitement (voir Fig. 1) sont rassemblées dans un environnement logiciel, dénommé Brain à la carte (BALC), développé à l'U594 [5], qui fédère de façon des outils originaux et des outils réutilisés, en provenance principalement de SPM [6], ensemble de fonctions de traitement d'images fonctionnelles largement utilisées dans la communauté neuroscientifique. Nous détaillons ici notre méthodologie, rapportons des résultats obtenus à 1,5 T, puis discutons brièvement les perspectives de ce travail.
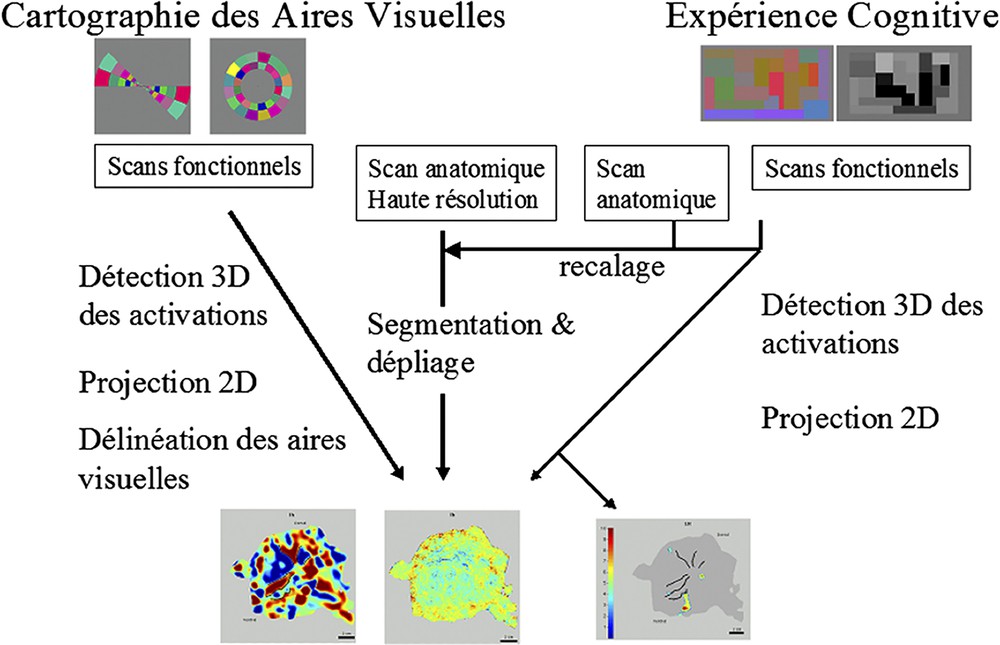
Schéma méthodologique. Pour la cartographie des aires visuelles primaires, des images fonctionnelles sont acquises lors de la présentation de stimuli encodant l'angle polaire et l'excentricité dans le champ visuel. Une image anatomique haute résolution est segmentée puis dépliée. Après détection des activations dans les images fonctionnelles par analyse de Fourier, les phases des réponses sont projetées sur la surface anatomique reconstruite. Sur la base de l'alternance du signe du champ visuel, les aires sont ensuite délinées. Lors d'une expérience cognitive (dans l'exemple présenté ici, lors de la perception de motifs chromatiques ou achromatiques), les images fonctionnelles et anatomiques seront recalées sur une image anatomique de haute résolution. Les activations détectées sont ensuite projetées sur la carte dépliée. Les aires visuelles primaires activées seront alors proprement identifiées (ici, l'aire V4, connue pour être sensible à la couleur).
2 Méthode
2.1 La propriété de rétinotopie
Les aires visuelles primaires, qui réalisent les premières étapes de traitement de l'information visuelle en provenance de la rétine, puis des corps genouillés latéraux, sont rétinotopiques. Une aire corticale est dite rétinotopique si une partie de la rétine, donc du champ visuel, est représentée en son sein de façon ordonnée. Il y a alors une relation univoque entre un point dans le champ visuel et sa représentation corticale dans cette aire. Ainsi, la rétinotopie crée localement un système de coordonnées (r,α) dans la surface corticale, où r est l'excentricité par rapport au centre du regard et α l'angle polaire, par exemple par rapport au méridien vertical inférieur. La coordonnée d'excentricité est encodée sur le cortex dans la direction antéro-postérieure et forme avec la coordonnée d'angle polaire un système local de coordonnées orthogonales. Au sein d'aires adjacentes, l'angle polaire a une représentation inversée. Cette inversion de l'image corticale du champ visuel est mise à profit pour délinéer les aires. L'orientation des coordonnées (r,α) dans la surface corticale est exprimée par le jacobien des fonctions (r(u,v), α(u,v)), où (u,v,n) forment un trièdre direct, n étant la normale à la surface corticale orientée. Ce jacobien représente le rapport entre les surfaces orientées dans le champ visuel (coordonnées (r,α)) et sur le cortex (coordonnées (u,v)), et est dénommé « rapport du champ visuel » (RCV). L'inversion du signe du RCV signale le changement d'aire : un RCV négatif (resp. positif) indique une représentation corticale miroir (resp. identique) du champ visuel. Suivant la notation de Zéki [7], les aires rétinotopiques primaires sont : V1, située autour du sillon calcarin et qui contient une représentation de l'hémi-champ contra-latéral avec un RCV négatif ; V2, qui contient une représentation du quart-champ contra-latéral supérieur (resp. inférieur) dans sa partie ventrale (resp. dorsale), avec un RCV positif ; V3, qui est de type quart-champ, contra-latéral supérieur (resp. inférieur) dans sa partie ventrale (resp. dorsale) avec un RCV négatif ; V3A et V4, qui sont de type demi-champ, avec un RCV positif (cf. Fig. 2).

Segmentation et dépliage. Illustration d'une partie de la chaîne de traitement : (a) image anatomique haute résolution, (b) segmentation de l'interface matière blanche–matière grise, (c) modèle de la surface reconstruite et (d) dépliage de l'hémisphère gauche. Les couleurs (en d) représentent les distorsions surfaciques induites par le dépliage, sous la forme du rapport entre les surfaces élémentaires du modèle en représentation 2D par rapport à leur surface en représentation 3D. Le rectangle rouge (en b) indique la partie du lobe occipital dépliée et reconstruite (convention radiologique : l'hémisphère gauche est à droite).
2.2 L'imagerie anatomique et l'imagerie fonctionnelle par effet BOLD
L'imagerie anatomique du cerveau, utile pour la reconstruction de la surface corticale, est réalisée avec une antenne « crâne », selon une séquence en écho de gradient de type 3D FLASH et pondérée T1 (TR/TE/α = 28 ms/7 ms/28°, matrice = 256 × 256, voxels de 1 mm3).
Par ailleurs, nous pouvons aussi acquérir des images fonctionnelles, qui nous informent sur l'activité cérébrale. En effet, lors d'une activation cérébrale, la demande métabolique s'accroît, générant des réponses cérébro-vasculaires (augmentations locales des volume et débit sanguins cérébraux). L'augmentation locale du débit sanguin cérébral excède celle de la consommation d'oxygène par les populations neuronales activées. Ceci engendre une augmentation de l'oxyhémoglobine (HbO2) en aval de ces populations neuronales et une diminution concomitante de la concentration en déoxyhémoglobine (dHb). L'oxyhémoglobine est diamagnétique et la déoxyhémoglobine est paramagnétique. La présence de cette dernière a pour effet d'induire des perturbations de champ magnétique autour des vaisseaux. Entre phases d'activation et de repos, le rapport HbO2/dHb dans le sang veineux augmente, entraînant une diminution des inhomogénéités locales de champ magnétique. Ces modifications peuvent être détectées à l'aide de séquences RMN adaptées, pondérées en T2*. Pour ces séquences, le signal RMN mesuré augmente avec l'activité cérébrale : on parle d'effet BOLD (Blood Oxygen Level Dependent) – voir détails dans [8]. Ce signal représente une mesure de l'activité neuronale non invasive et indirecte, puisque obtenue sur la base des répercutions hémodynamiques engendrées (couplage neuro-vasculaire). Nous utilisons des séquences 3D PRESTO (TR/TE/α = 28 ms/40 ms/14°, matrice = 64 × 64 × 12, voxels de 3 × 3 × 4 mm3) [9], acquises avec une antenne de surface placée sous le lobe occipital. Les distorsions géométriques sont réduites avec ce type de séquence, comparativement aux séquences de type EPI, grâce à l'utilisation d'un temps de mesure plus court. L'antenne de surface permet d'augmenter le rapport signal sur bruit dans la zone explorée, soit, ici, dans le lobe occipital.
2.3 Les stimuli visuels
Les stimuli sont des anneaux en expansion ou en contraction, qui codent des régions à iso-excentricité par rapport au point de fixation, et des secteurs en rotation parcourant le champ visuel dans les deux sens, qui codent des régions à angle polaire constant (voir Fig. 1). Ces stimuli balayent périodiquement le champ visuel. Ils provoquent des ondes d'activation neuronale à la fréquence des stimuli, dont les phases dépendent des coordonnées polaires correspondantes dans le champ visuel. Nous réalisons ainsi un codage de la position par le décours temporel spécifique des activations neuronales correspondantes. Les mesures RMN réalisées sont en fait le reflet de la réponse neuronale convoluée par la fonction de réponse hémodynamique (effet BOLD). Pour nous affranchir du délai de cette réponse (≈○6○s), nous combinons les réponses à des stimuli parcourant le champ visuel en sens opposés [5].
2.4 Segmentation et dépliage du ruban cortical
Une projection des données fonctionnelles sur les coupes anatomiques permet de visualiser l'emplacement anatomique des sites d'activation, mais impose de parcourir de nombreuses coupes pour avoir une vision d'ensemble. Par ailleurs, ce type de visualisation ne permet pas d'analyser des variations de la phase des réponses fonctionnelles dans la surface corticale. Une projection sur la surface anatomique tridimensionnelle permet ce type d'analyse et facilite la visualisation globale des activations sur une seule image, mais masque parfois leur localisation exacte, étant donné le repliement important de la surface corticale. Une manière élégante de visualiser et d'analyser les cartes fonctionnelles consiste dès lors en une mise à plat (dépliage) de la matière grise [9]. Pour cela, nous réalisons une segmentation du cerveau en trois tissus : matière grise (MG), matière blanche (MB) et liquide céphalo-rachidien (LCR). L'inhomogénéité de la sensibilité de détection et les effets de volume partiel sont les facteurs principaux qui rendent la segmentation automatique difficile. Une intervention manuelle est alors nécessaire pour corriger, notamment, les erreurs topologiques engendrées.
La partie à déplier est ensuite sélectionnée manuellement et triangulée par un algorithme de type marching cube. Le dépliage de l'interface entre les volumes MG et MB est basé sur une méthode statistique par analyse en composantes curvilinéaires [10].
2.5 Analyse et projection des activations, délinéation des aires
L'analyse des réponses corticales en termes de phase et d'amplitude est réalisée, voxel par voxel, par transformée de Fourier, à la fréquence fondamentale du stimulus. L'amplitude des harmoniques varie d'un sujet à l'autre, mais reste généralement très basse et n'est donc pas considérée. Les cartes d'amplitude fournissent les régions activées. Les cartes de phase traduisent les décalages temporels entre activations. Elles relient les positions dans le champ visuel, exprimées en coordonnées polaires, et leurs représentations sur le cortex. La déviation standard sur la phase est estimée par l'inverse du rapport signal sur bruit (RSB) des réponses en amplitude [5]. Le bruit est estimé pour chaque voxel indépendamment, comme la déviation standard du spectre sur une gamme de fréquence excluant les basses fréquences et les harmoniques de la fréquence de stimulation. Les contributions de chaque voxel détectées en 3D sont ensuite projetées en chaque nœud de la surface. La stratégie adoptée consiste à déterminer, pour chaque voxel actif, le poids de sa contribution à chaque nœud de la surface en fonction de sa distance et de la fiabilité de sa réponse. Ainsi, les contraintes suivantes sont adoptées : (1) la phase moyenne en un point de la surface est la somme des phases individuelles de chaque voxel attribuable à ce point, pondérées par leurs incertitudes, (2) les voxels de RSB faible (< 2) et, compte tenu de l'épaisseur du cortex, les voxels éloignés de plus de 2,5 mm du nœud le plus proche sont exclus. De plus, la représentation de la rétinotopie est supposée lisse dans la surface. Un filtre gaussien est donc appliqué dans la surface pour augmenter le RSB. Il est calculé localement, pour chaque nœud et chaque voxel, à partir de la distance géodésique entre ce nœud et le nœud le plus proche du voxel considéré. Un rayon de coupure permet de limiter les distances à considérer.
Les représentations alternativement inversées du champ visuel au sein d'aires adjacentes sont identifiées par le calcul du gradient de la phase dans le système de coordonnées surfaciques (u,v,n), puis du RCV. L'étiquetage automatique des aires s'appuie sur des connaissances fonctionnelles : V1 est la plus grande région de RCV négatif, V2 borde V1 avec un RCV positif, etc. La détermination des gradients de phase est très sensible aux fréquences spatiales élevées présentes dans les données. Nous utilisons des filtres gaussiens sur les données d'angles polaires et d'excentricité (3,5 mm et 7 mm, respectivement). Pour le calcul des gradients de phase, la phase est modélisée comme une fonction linéaire locale des coordonnées surfaciques des plus proches voisins.
3 Résultats
La durée totale d'un examen de délinéation est d'environ une heure (acquisition de l'image anatomique haute résolution = 30 min, quatre expériences fonctionnelles = 28 min). La sensibilité de la séquence utilisée a conduit à une estimation des phases avec une déviation standard moyenne de 12°. Les Figs. 2 et 3 montrent les résultats obtenus pour un sujet à 1,5 T. Sur la Fig. 2, les étapes de segmentation et de dépliage d'un hémisphère sont illustrées. Sur la Fig. 3, les résultats des expériences rétinotopiques ont été projetés sur l'hémisphère gauche déplié. Les frontières indiquées sont délinéées automatiquement. La délinéation des aires au-delà de V3 reste problématique à 1,5 T.
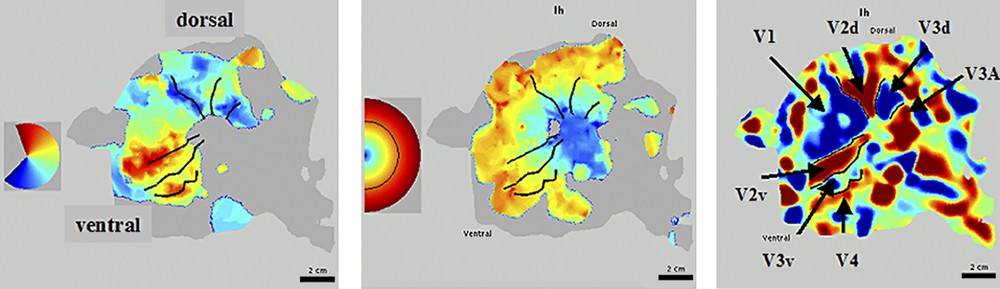
Représentation plane des aires visuelles d'un hémisphère gauche. À gauche sont reportées les activations pour des angles polaires différents, au centre celles pour des excentricités différentes. Le code des couleurs est indiqué dans l'encart à gauche de chaque figure. À droite, les alternances du signe du rapport du champ visuel sont reportées, base d'appui à la délinéation automatique des aires visuelles. La partie ventrale est vers le bas (l'indice v est accolé aux aires correspondantes), la partie dorsale est vers le haut (l'indice d est accolé aux aires correspondantes). Échelle : le segment en noir représente 2 cm.
4 Discussion
Nous avons mis en place une chaîne d'acquisition et de traitement, dont la bonne reproductibilité a été démontrée sur plusieurs sujets [5]. Les frontières sont plus précises pour la partie dorsale que ventrale, probablement du fait de l'utilisation d'une antenne de surface. Une précision moyenne de ±0,5 mm est obtenue. La confrontation avec les limites obtenues par une autre technique reste à réaliser pour apprécier les erreurs systématiques de la méthode. Actuellement, une interaction manuelle est nécessaire pour corriger les défauts topologiques présents après l'étape de segmentation de l'image anatomique. Nous cherchons donc à améliorer cette étape cruciale [11,12]. L'acquisition d'images à haut champ (3 T) nous permettra d'améliorer le RSB des cartes de phases obtenues et donc de mieux délinéer les aires au-delà de V3. Les problèmes liés aux distorsions géométriques différentes des images fonctionnelles et des images anatomiques devront être au préalable résolus. Le nombre N d'anneaux ou de secteurs dans le stimulus détermine la correspondance entre la phase mesurée et la position dans le champ visuel. La précision des cartes obtenues pourrait être augmentée avec N, en introduisant cependant des informations a priori nécessaires pour relier de façon adéquate position et angle polaire.
L'intérêt d'une délinéation robuste des aires visuelles primaires est multiple. Elle est un pré-requis à de nombreuses études cognitives sur le système visuel où l'implication de ces aires est recherchée. Elle peut faciliter des études de groupe par focalisation des traitements statistiques aux activations dans les aires fonctionnelles d'intérêt. Ces informations peuvent aussi servir d'amers pour des algorithmes de recalage hybrides, mixant connaissances anatomiques et fonctionnelles.


