1 Introduction
L'un des plus importants problèmes contemporains réside dans la protection de l'environnement. Les déchets de fabrication, les rejets des installations énergétiques et les transports entraînent une pollution considérable de celui-ci [1–3]. Les éléments toxiques contenus dans les rejets gazeux qui agissent le plus rapidement sont les oxydes d'azote. La concentration limite et permise du NO dans l'air est de 0,1 mg m–3 [4]. Pour diminuer la concentration du NO dans les rejets gazeux, on utilise plusieurs méthodes. La plus simple parmi elles et très bien mise en valeur industriellement est la décomposition–réduction catalytique de l'oxyde d'azote. Cette réaction est attrayante, car elle donne des éléments non toxiques, qui sont N2 et O2. Parmi les réducteurs, le monoxyde de carbone (CO) occupe une place de choix. Le CO est également un composé toxique. La réduction du NO par le CO permet d'éliminer en même temps deux éléments toxiques, NOx et CO.
Les catalyseurs de la réaction de décomposition et de réduction des oxydes d'azote étaient d'abord les oxydes des métaux précieux et les oxydes des systèmes complexes [5,6]. Leur faible stabilité mécanique, leur composition variable et leur coût élevé ont favorisé la mise en place de catalyseurs à base de composés d'oxydes cuivriques. La baisse avec le temps de l'activité des catalyseurs à base d'oxydes cuivriques dans le procédé nous a incités à rechercher d'autres catalyseurs, plus efficaces. Pour la décomposition–réduction catalytique des oxydes d'azote, le système à composés cuivriques modifiés des zéolites à concentration en silice de 1,5% en masse présente un grand intérêt et se distingue par une plus grande stabilité et une bonne activité dans le procédé de décomposition et de réduction des oxydes d'azote. Il possède, en outre, une grande résistance mécanique. Il est enfin de préparation simple.
Il existe sept sortes d'oxydes d'azote : N2O, NO, NO2, N2O3, N2O4, NO3 et N2O6. À pression atmosphérique et à une température de 100 à 500 °C peuvent exister seulement trois oxydes dans la phase gazeuse : N2O, NO, NO2, qui serviront comme matières premières à cette étude.
L'objectif fixé est triple :
- • (1) l'élaboration d'une nouvelle génération de catalyseur d'épuration gazeuse que sont les systèmes à composés cuivriques modifiés de zéolites à concentration en silice de 1,5% en masse ;
- • (2) l'étude de ses propriétés catalytiques dans les réactions de décomposition et de réduction des oxydes d'azote, l'établissement du mécanisme de ces réactions ;
- • (3) la mise en évidence d'une possibilité d'utilisation pratique du système.
2 Matériels et méthodes
Les réactions de décomposition et de réduction catalytiques des oxydes d'azote sont étudiées au laboratoire avec des réacteurs en quartz (20 mm de diamètre et 180 mm de long). L'analyse de la matière première et des produits des réactions est faite avec un chromatographe de marque LXM-8MD, muni d'un détecteur de conductibilité thermique. Deux colonnes chromatographiques ont été utilisées pour l'analyse. La première (de 3 mm de diamètre et 1 m de long) servant à l'analyse de O2, N2, NO et CO est remplie de zéolites de marque CaA (fraction 0,25–0,5 mm). L'activation des adsorbants est faite à une température de 400 à 450 °C pendant 4 h à l'air et ensuite dans un bain d'hélium pendant une heure à 250 °C. La deuxième colonne (3 mm de diamètre et 2 m de long) utilisée pour l'analyse de N2O, NO2 et CO2 est, en revanche, remplie de charbon activé de marque SKT (fraction 0,25–0,5 mm). L'activation des adsorbants est faite à 250 °C pendant 5 h à l'air et ensuite dans un bain d'hélium pendant 3 h à la même température.
Les deux colonnes sont thermostatées à 70 °C. La vitesse du gaz vecteur (He) dans les deux colonnes est de 50 m3 min–1. La sensibilité de l'analyse est de 0,01 mol%. La méthode de synthèse du catalyseur est celle décrite par Chadrin et al. [6]. Pour l'analyse radiographique aux rayons X du catalyseur, la source de lumière est un tube à anode en cuivre (Kα = 1,54 Å). L'analyse par spectroscopie infrarouge du catalyseur est réalisée à l'aide d'un spectrophotomètre UR-20 dans le domaine de longueur d'onde 1300–3300 cm–1.
3 Résultats
3.1 Étude physico-chimique du catalyseur
L'étude est réalisée à l'aide d'un catalyseur de type CuZSM-5 à composés d'oxydes cuivriques modifiés des zéolites à concentration en silice de 1,5 % en masse.
Pour préparer le catalyseur, on a utilisé la forme sodique de ZSM-5. Le rapport SiO2/Al2O3 est de 66 dans la zéolite. Cette zéolite possède une structure monoclinique [7,8]. La concentration du CuO dans l'échantillon est de 1 % en masse. La Fig. 1 (analyse spectroscopique infrarouge) donne des informations sur la situation de H2O dans le catalyseur). Il existe une raie engloutie à la fréquence de 1600 cm–1 et d'autres séries de raies dans le domaine 3400–3700 cm–1, occasionnées par les différentes déformations des molécules d'eau. Dans le processus de déshydratation et de réduction on constate une élimination totale de H2O. La surface spécifique du catalyseur est égale à 37 m2 g–1. L'analyse aux rayons X (Fig. 2) et celle par spectroscopie infrarouge (Fig. 1) suggèrent que la structure du catalyseur n'a pas changé durant le séjour de celui-ci dans le réacteur.
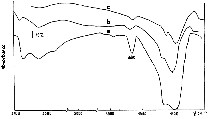
Spectre infrarouge du catalyseur CuZSM-5 (a) Après calcination à 500 °C ; (b) après son utilisation ; (c) après réduction par le CO.
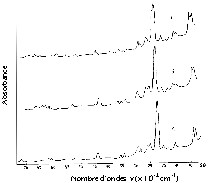
Diffractogrammes du catalyseur CuZSM-5 (a) Après calcination à 500 °C ; (b) après son utilisation ; (c) après réduction par le CO.
3.2 Réaction du N2O avec le CO
Tous les gaz utilisés pour la présente étude sont obtenus par la méthode décrite par Chadrin et al. [9] et Mehandjiev et al. [10].
N2O est obtenu à l'aide de la réaction :
Les résultats de la réaction du N2O avec le CO sont reportés dans le Tableau 1. Cette réaction commence dès la température de 200 °C. La conversion du N2O à cette température est de 22%. La transformation totale du N2O est atteinte à 400 °C.
Concentration des réactifs et produits de la réaction de N2O avec le CO à la sortie du réacteur (mol%) ; 1 g CuZSM-5 ; concentration dans l'impulsion : N2O = 2,20 mol% et CO = 2,25 mol% ; volume de l'impulsion = 0,1 cm3
| Température (°C) | 100–150 | 200 | 250 | 300 | 350 | 400 | 500 |
| N2O | 2,20 | 1,70 | 1,45 | 0,70 | 0,30 | 0 | 0 |
| CO | 2,25 | 1,70 | 1,45 | 0,65 | 0,25 | 0 | 0 |
| N2 | 0 | 0,50 | 0,75 | 1,50 | 1,90 | 2,20 | 2,20 |
| CO2 | 0 | 0,55 | 0,80 | 1,60 | 2,00 | 2,25 | 2,25 |
Pour la comparaison, il a été étudié l'activité catalytique du catalyseur d'oxydes cuivriques CuO/γ-Al2O3 non modifiés. Les résultats obtenus sont reportés dans le Tableau 2. Comme on peut le constater, la conversion du N2O est de 5% à 300 °C. La réduction intense du N2O est observée entre 300 et 500 °C. La réduction complète du N2O est atteinte à 600 °C.
Concentration des réactifs et produits de la réaction du N2O avec le CO à la sortie du réacteur (mol%) ; 1 g CuO/γ-Al2O3 ; volume de l'impulsion = 0,1 cm3 ; concentration dans l'impulsion : N2O = 2,20 mol% et CO = 2,25 mol%
| Température (°C) | 100-250 | 300 | 400 | 500 | 600 |
| N2O | 2,20 | 2,10 | 1,70 | 1,45 | 0 |
| CO | 2,25 | 1,75 | 0,95 | 0,75 | 0 |
| N2 | 0 | 0,10 | 0,50 | 0,75 | 2,20 |
| CO2 | 0 | 0,50 | 1,15 | 1,50 | 2,25 |
3.3 Réaction du NO avec le CO
Le mono-oxyde d'azote est obtenu à l'aide de la réaction:
La réaction du NO avec le CO a été étudiée en utilisant les catalyseurs CuZSM-5 et CuO/γ-Al2O3. Les résultats obtenus sont reportés dans les Tableaux 3 et 4. On remarque dans le Tableau 3 qu'à 100 °C le CO est entièrement consommé dans la réaction. Le produit de la réaction du NO avec le CO est N2. La courbe de formation du N2O passe par un maximum à 150 °C (0,10 mol%) ; à 200 °C, N2O ne se forme pas. La réduction du CuO est observée à toutes les températures de l'expérience. Avec l'augmentation de la température de 200 à 250 °C, la vitesse de la réaction du NO diminue. L'augmentation ultérieure de la température à 500 °C n'entraîne pas l'augmentation de la vitesse de la réaction. À cette température, on n'observe, ni la consommation du NO, ni la formation du N2. Les valeurs du NO et de N2 restent pratiquement constantes.
Concentration des réactifs et produits de la réaction du NO avec le CO à la sortie du réacteur (mol%) ; 1 g CuZSM-5 ; volume de l'impulsion = 0,1 cm3 ; concentration dans l'impulsion : NO = 2,20 mol% et CO = 2,25 mol%
| Température (°C) | 100 | 150 | 200 | 250 | 300-500 |
| NO | 1,22 | 0,82 | 0,92 | 1,02 | 1,02 |
| CO | 0 | 0 | 0 | 0 | 0 |
| N2 | 0,50 | 0,60 | 0,65 | 0,60 | 0,60 |
| N2O | < 0,1 | 0,10 | 0 | 0 | 0 |
| CO2 | 2,23 | 2,00 | 2,13 | 2,23 | 2,23 |
Concentration des réactifs et produits de la réaction du NO avec le CO à la sortie du réacteur (mol%) avec le catalyseur d'oxydes cuivriques non modifié. 1 g CuO/γ-Al2O3 ; volume de l'impulsion = 0,1 cm3 ; concentration dans l'impulsion : NO = 2,20 mol%, CO = 2,25 mol% et avec 0,5 à 1,5% en masse du CuO dans le catalyseur
| Concentration du CuO dans le catalyseur (mol%) | Réactifs et produits | Température (°C) | |||
| 200 | 300 | 400 | 500 | ||
| 0,5 | NO | 2,10 | 1,58 | 1,42 | 1,22 |
| CO | 2,08 | 1,53 | 1,03 | 0,83 | |
| N2 | 0,05 | 0,25 | 0,40 | 0,50 | |
| N2O | < 0,01 | 0,07 | 0 | 0 | |
| CO2 | 0,15 | 0,70 | 1,20 | 1,40 | |
| 1,0 | NO | 1,97 | 0,82 | 1,32 | 1,02 |
| CO | 1,93 | 1,73 | 1,23 | 0,73 | |
| N2 | 0,10 | 0,20 | 0,45 | 0,60 | |
| N2O | 0,03 | 0 | 0 | 0 | |
| CO2 | 0,30 | 0,50 | 1,00 | 1,50 | |
| 1,5 | NO | 1,92 | 1,72 | 1,22 | 0,72 |
| CO | 1,93 | 1,53 | 0,73 | 0,23 | |
| N2 | 0,10 | 0,25 | 0,50 | 0,75 | |
| N2O | 0,05 | 0 | 0 | 0 | |
| CO2 | 0,30 | 0,70 | 1,50 | 2,00 |
Les résultats de l'étude de la réaction du NO avec le catalyseur CuO/γ-Al2O3 non modifié sont présentés dans le Tableau 4. L'augmentation du CuO dans le catalyseur de 0,5 à 1,5% en masse provoque l'augmentation de l'activité du catalyseur. Cependant, ce n'est qu'avec un intervalle de température de 200 à 500 °C que l'on constate une réduction progressive du CO.
3.4 Réaction du NO2 avec le CO
NO2 est obtenu en additionnant les quantités stœchiométriques de NO et O2. On sait que l'existence du NO2 est limitée par la réaction thermodynamique : NO2 ↔ NO + 0,5 O2, raison pour laquelle en laissant passer le mélange gazeux (NO2 + CO) à travers le catalyseur ; à la sortie du réacteur, on peut obtenir, à part NO2 et CO, NO et O2 (Tableau 5). Les produits (N2 et CO2) de la réaction se forment dès la température de 100 °C. On constate également la consommation de NO2, O2 et du CO dans la réaction. La quantité du CO2 formée (0,40 mol%) correspond à la consommation de 0,2 mol% de NO2 et 0,2 mol% de O2. Ces résultats témoignent du déroulement en même temps de deux réactions :
Concentration des réactifs et produits de la réaction du NO2 avec le CO à la sortie du réacteur (mol%) ; 1 g CuZSM-5 ; volume de l'impulsion = 0,1 cm3 ; concentration dans l'impulsion : NO2 = 2,20 mol% ; CO = 2,25 mol%
| Température (°C) | 100 | 200 | 300 | 350 | 400–650 |
| NO2 | 0,80 | 0,50 | 0,10 | 0 | 0 |
| NO | 1,10 | 1,10 | 1,00 | 0 | 0 |
| O2 | 0,20 | 0 | 0 | 0 | 0 |
| CO | 1,45 | 0,85 | 0 | 0 | 0 |
| N2 | 1,10 | 0,25 | 0,45 | 0,70 | 1,05 |
| CO2 | 0,40 | 1,00 | 1,85 | 1,85 | 1,85 |
Ainsi, on peut remarquer que, NO ayant une concentration de 1,10 mol% dans le mélange gazeux, il ne se réduit pas aux températures inférieures ou égales à 200 °C. Mais à 300 °C, sa consommation reste significative (0,10 mol%). La conversion totale du NO2 est atteinte à 400 °C. De même, comme pour les réactions de réduction de N2O et NO par le CO, le catalyseur garde son activité pendant et après la réaction du NO2 avec le CO, même à 650 °C.
4 Discussion et conclusion
Parmi les oxydes N2O, NO et NO2, l'oxyde N2O est le seul à se décomposer en N2 et O2. Toutes les trois réactions (N2O + CO, NO + CO et NO2 + CO) se déroulent dans un intervalle de température de 100 à 450 °C. Le produit de la réaction du NO avec le CO est uniquement N2. Au cours du processus catalytique du NO2 avec le CO, à la sortie du réacteur et à des températures de 100 à 300 °C, il se forme O2, NO, N2 et CO2. Il est possible que l'apparition de O2 et NO dans le mélange gazeux soit due à la dissociation du NO2.
L'activité du catalyseur CuZSM-5 par rapport à la réaction de réduction des oxydes d'azote diminue suivant l'ordre : N2O + CO > NO + CO ≥ NO2 + CO.
Les résultats de la réduction catalytique de N2O, NO et NO2 par le CO avec les catalyseurs CuZSM-5 et CuO/γ-Al2O3 sont présentés sur la Fig. 3. Il est intéressant de comparer la vitesse de réduction catalytique des oxydes d'azote par les catalyseurs CuZSM-5 et CuO/γ-Al2O3.
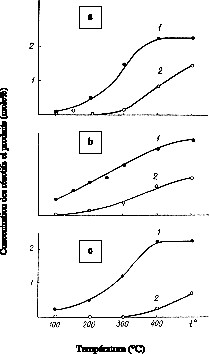
Vitesse de réduction catalytique de N2O (a), NO (b) et NO2 (c) par CO avec les catalyseurs ; courbes 1 : CuZSM-5 ; courbes 2 : CuO/γ-Al2O3.
On constate que les vitesses des trois réactions avec le catalyseur CuZSM-5 modifié sont plus élevées que celles avec le catalyseur CuO/γ-Al2O3 non modifié. Le catalyseur d'oxydes cuivriques non modifiés n'est pas stable et, au contact du CO, il se réduit intensivement (Tableau 4).
En comparant les activités catalytiques des catalyseurs CuZSM-5 et CuO/γ-Al2O3 , on peut dire que CuZSM-5 est le plus actif.
En se basant sur les résultats obtenus des trois réactions N2O + CO, NO + CO et NO2 + CO de décomposition et de réduction catalytiques des oxydes d'azote, nous pouvons dire que le catalyseur CuZSM-5 d'oxydes cuivriques modifiés de zéolites à concentration en silice de 1,5% en masse se distingue par une plus grande stabilité et une bonne activité dans le processus de réduction des oxydes d'azote ; on peut donc le recommander pour l'épuration des rejets gazeux des oxydes d'azote.


