1 Introduction
Le gonflement est la propriété la plus importante des polymères superabsorbants. Il résulte de l'affinité du polymère pour l'eau. Placés dans un excès d'eau, les polymères superabsorbants composés de polyélectrolytes réticulés gonflent et forment des hydrogels. Ils peuvent absorber jusqu'à 1000 fois leur poids d'eau, mais ils ne se dissolvent pas en raison des liaisons interchaînes. Le degré de réticulation du réseau polymérique a un effet considérable sur la quantité d'eau absorbée [1]. Par ailleurs, certains travaux [2–4] montrent que sous l'influence de paramètres extérieurs tels que la température, le pH, la force ionique et la composition de la solution dans laquelle est plongé le gel, celui-ci peut subir des changements de volumes importants. Compte tenu de ces propriétés, ces polymères ont connu un champ d'application très vaste [5,6]. Il sont utilisés, entre autres, dans le domaine de l'hygiène (féminine–enfantine), dans l'emballage et la déshydratation de solvants organiques. Ils trouvent également leur application dans le domaine de l'agriculture où ils sont utilisés pour stabiliser l'eau dans les sols.
En ce qui nous concerne, l'importance de ces gels réside principalement dans l'aptitude que possèdent les ligands localisés sur leur réseau macromoléculaire à capter des ions métalliques de valences différentes, à partir de solutions aqueuses diluées. En effet, la fixation de cations métalliques sur les sites fonctionnels provoque un dégonflement du gel par neutralisation des charges et/ou par autoréticulation [7,8].
La consultation des données bibliographiques montre que la complexation des cations métalliques par des gels polyélectrolytes a fait l'objet de plusieurs travaux [9–15]. La récupération des éléments nocifs pour la protection de l'environnement, telle que la complexation du cuivre par des gels d'acide polyméthacrylique [16] ou l'extraction de l'uranium à partir des solutions aqueuses par des gels échangeurs d'ions [10], comme l'acide polyacrylique–polyacrylate de sodium utilisé dans notre travail, constitue un champ important d'application de ces gels.
Dans nos travaux précédents nous nous sommes intéressés à l'extraction de métaux lourds divalents (Pb2+, Cu2+, Cd2+, Zn2+, Ni2+ et Co2+) à partir des solutions aqueuses diluées par des gels superabsorbants d'acide polyacrylique [17,18]. Notre étude concernait également le traitement des mélanges contenant Cs+, Sr2+ et Eu3+ par les mêmes matrices polymériques [19]. Les résultats obtenus ont montré que la sélectivité suit l'ordre suivant :
2 Partie expérimentale
2.1 Polymères
Les polymères d'acide polyacrylique–polyacrylate de sodium utilisés dans ce travail, sont des polymères superabsorbants, préparés par la société Norsolor-Atochem Co (France). Ils se présentent sous forme de poudre dont le diamètre des grains est voisin de 0,5 mm. Les caractéristiques de nos échantillons sont :
- • taux d'ionisation α = 80 % ;
- • taux de réticulation r = 1 % ;
- • 10 mmol de sites –COO(H,Na)/g de polymère.
2.2 Préparation des gels
Le premier problème rencontré dans l'utilisation des polymères d'acide polyacrylique–polyacrylate de sodium réside dans la pesée des échantillons. En effet, ces polymères ont l'inconvénient d'absorber spontanément l'humidité de l'air, ce qui pose un problème évident de stabilité de pesée, surtout à de très faibles quantités de polymère sec. Pour pallier à cette difficulté et pouvoir utiliser de faibles quantités de polymère (généralement 2 mg), nous avons procédé directement à l'utilisation des gels gonflés d'eau distillée. Les gels sont préparés de la manière suivante : une masse de polymère sec (0,1 g), relativement importante et permettant une pesée correcte, est placée dans un excès d'eau distillée (200 ml) pendant quatre heures, temps largement suffisant pour atteindre l'équilibre de gonflement. Le gel ainsi obtenu est séparé du liquide surnageant par filtration, puis pesé. Le taux de gonflement du gel (masse du gel/masse du polymère sec) est de l'ordre de 470. Connaissant le taux de gonflement, on peut prélever la quantité de gel correspondant à la masse du polymère sec utilisée.
2.3 Préparation de la phase aqueuse
Les solutions d'argent sont préparées par dissolution du nitrate d'argent AgNO3 (Fluka) dans l'eau distillée. Toutes ces solutions sont conservées à l'abri de la lumière pour éviter la réaction photochimique de l'argent. Le pH de chacune des solutions est ajusté à l'aide de l'acide nitrique concentré.
2.4 Technique d'extraction de l'argent et méthode d'analyse
Une quantité de gel de masse égale à 0,94 g, correspondant à 2 mg de polymère sec soit 2,25 × 10–5 mol de sites –COO(H, Na) est placée dans une cellule thermorégulée à 25 °C contenant 100 ml d'une solution aqueuse de nitrate d'argent. La cellule est munie d'un thermomètre de contrôle, d'une électrode de verre combinée à un pH mètre et d'un agitateur magnétique. Afin d'éviter de casser les grains formant le gel par le barreau aimanté durant l'agitation de la solution aqueuse métallique, l'échantillon du gel utilisé a été préalablement introduit dans un sachet de gaze de dimensions d'environ 3 cm × 2 cm. Cette procédure nous permet également d'effectuer facilement des prélèvements dans la solution métallique sans problème d'entraînement de grains de gel dans les échantillons à doser. Après équilibre d'extraction, l'argent en solution est dosé par spectrométrie d'émission atomique à plasma induit par haute fréquence (ICP) sur un spectromètre Perkin-Elmer modèle 6500.
La quantité d'argent extraite par le gel est déterminée de deux manières différentes. Par le bilan de masses ou par dosage après désextraction de l'argent retenu par le gel dans un volume connu de HNO3 0,1 M.
2.5 Technique d'élimination des ions chlorures
La première étape consiste d'abord à charger le copolymère d'acide polyacrylique–polyacrylate de sodium en argent. Pour ce faire, une masse de polymère sec, assez importante et permettant une pesée correcte (environ 10 mg) est mise au contact de 100 ml d'une solution de nitrate d'argent de concentration égale à 2 × 10−3 M. Pour éviter de casser les billes de gel, la solution a été agitée par dessus au moyen d'un moteur synchrone Heidolph RZR 2000. L'expérience a été réalisée à 25 °C et durant trois heures, temps largement suffisant pour que le gel puisse s'équilibrer avec la solution d'argent. La solution aqueuse est filtrée sur un verre fritté de porosité 2. Le filtrat ainsi obtenu est dosé en ICP pour déterminer la concentration du métal en solution et par conséquent le nombre de moles d'Ag+ retenu par le gel. Le gel chargé en argent est alors récupéré dans le verre fritté sur lequel on fait couler, lentement, goutte à goutte 100 ml d'une solution de NaCl de concentration en Cl– connue. Le dosage des ions Cl– avant et après l'expérience est effectué par chromatographie ionique Dionex 4500 i.
3 Résultats et discussion
3.1 Cinétique d'extraction de l'argent
La cinétique d'extraction de l'argent par un gel d'acide polyacrylique–polyacrylate de sodium a été étudiée en effectuant des prélèvements en fonction du temps dans la solution surnageante. À chaque prélèvement, le pH de la solution a été mesuré. L'étude a été réalisée à différents pH de la solution aqueuse. La concentration du métal dans la phase aqueuse a été fixée à 10–4 M.
Les courbes cinétiques correspondant aux variations du taux de rétention métallique R du gel en fonction du temps à différents pH sont montrées sur la Fig. 1.

Cinétique d'extraction de l'argent par un gel d'acide polyacrylique–polyacrylate de sodium en fonction du pH final de la solution surnageante.
Phase aqueuse : V = 100 ml, [Ag+]i = 10-4 M, T = 25° C ; gel : r = 1 %, α = 80 %, nt = 2,25 × 10–5 mol COO(H,Na).
Le Tableau 1 donne le temps au bout duquel le gel s'équilibre avec la solution métallique (teq), le pH mesuré à l'équilibre d'extraction (pHf) pour chaque système, le taux de gonflement (Q) du gel, obtenu en plongeant 7,5 mg de polymère sec dans 100 ml de la solution aqueuse à différents pH ainsi que la capacité d'extraction (R) du gel en argent.
Capacité de fixation d'Ag+ par le gel en fonction du pH de la solution surnageante
| pH initial | 3,62 | 3,85 | 4,00 | 5,55 |
| pH final | 3,88 | 4,31 | 4,78 | 6,93 |
| teq (mn) | 10 | 20 | 30 | 100 |
| Q | 68 | 80 | 90 | 255 |
| R | 0,02 | 0,04 | 0,09 | 0,20 |
Nous constatons, d'après ces résultats expérimentaux que l'équilibre d'extraction est d'autant plus rapide que le pH de la solution surnageante est faible. À pH = 3,88, par exemple, teq est presque dix fois plus petit que celui correspondant à pH = 6,93. Cet écart peut s'expliquer par la différence entre les taux de gonflement du gel à deux pH différents comme le montre le Tableau 1. En effet, lorsque le gel est moins gonflé, le chemin parcouru par les cations métalliques à l'intérieur de celui-ci est court, ce qui accélère de ce fait le mouvement des espèces diffusantes au cours de l'extraction.
Par ailleurs, la quantité d'argent retenue par le gel augmente au fur et à mesure que le pH de la solution aqueuse augmente. Ainsi, la capacité d'extraction du gel est multipliée par un facteur de 10 en passant de pH = 3,88 à pH = 6,93.
Il est intéressant de signaler aussi que le pH à l'équilibre d'extraction, mesuré pour chaque système, est supérieur à pH initial. Ceci est dû au réarrangement acidobasique du gel avec la solution surnageante. En effet, le gel s'équilibre avec la solution aqueuse en captant des protons.
3.2 Saturation du gel en argent
Pour déterminer la charge maximale du gel en argent, nous avons étudié la saturation du gel en mesurant le taux de rétention métallique R du gel en fonction de la concentration initiale de l'argent dans la solution aqueuse à pH = 5,55. Le choix de ce pH est justifié par le fait qu'avec ce dernier nous avons obtenu une meilleure extraction de l'argent. La courbe de saturation R = f ([Ag+]i) est présentée sur la Fig. 2.
- • Pour [Ag+]i < 7 × 10–4 M : on observe une augmentation progressive des valeurs de R lorsque [Ag+]i augmente.
- • Pour [Ag+]i > 7 × 10–4 M : un effet de saturation est atteint. Le palier ainsi obtenu donne la charge maximale du gel en argent Rmax = 0,75. Cette valeur est loin de la valeur théorique qui est égale à 1. Ce résultat peut être expliqué d'une part, par la difficulté de deux cations Ag+ à atteindre deux sites carboxyliques voisins à cause des répulsions électrostatiques ou par la fixation simultanée des ions Ag+ et H+ sur les fonctions carboxylates selon les réactions suivantes :
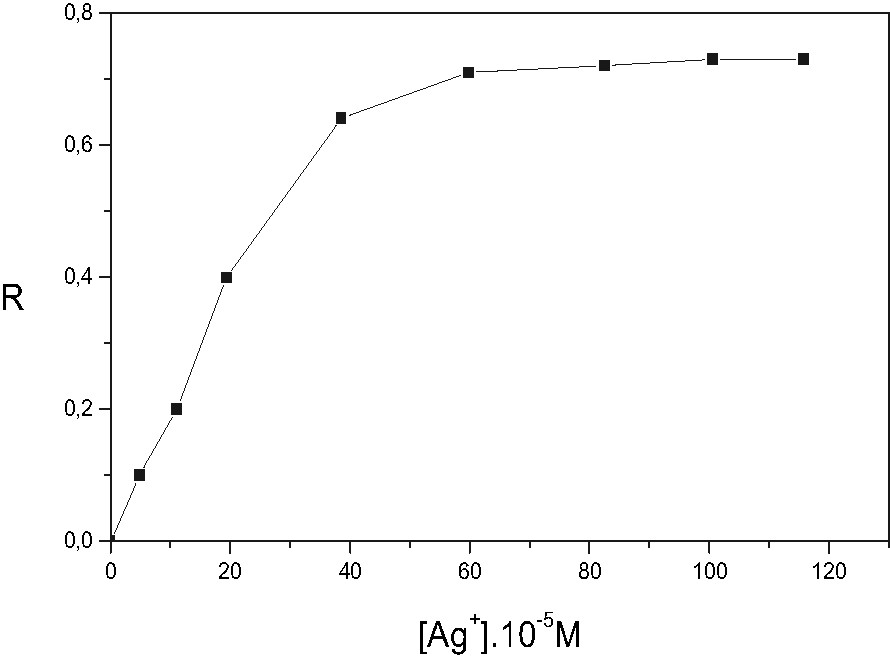
Saturation du gel d'acide polyacrylique–polyacrylate de sodium par Ag+ : R = f([Ag+]i).
Phase aqueuse : V = 100 ml ; T = 25 °C ; pHi = 5,55 ; gel : r = 1 % ; α = 80 % ; nt = 2,25 × 10–5 mol COO(H,Na).
La saturation du même gel, dans les mêmes conditions expérimentales, par un autre cation monovalent à savoir Cs+ en milieu nitrate donne une valeur de Rmax égale à 0,50 [18]. Dans ce cas, les entités formées dans le gel sont de la forme (–COO)2 (H,Cs). Avec les ions divalents M2+ (Cu2+, Cd2+, Sr2+, Pb2+), Rmax est égal à 0,50, ce qui montre que deux fonctions carboxylates sont attachées au cation métallique pour former des complexes dans le gel de type [(–COO)2M]n [17].
La même valeur de saturation (Rmax = 0,50) est obtenue dans le cas de l'extraction d'un ion trivalent Eu3+ à partir du milieu nitrate. Dans ce cas, les ions nitrates participent à la formation des complexes du type (–COO)2 Eu NO3 [18] dans le gel.
3.3 Élimination des ions chlorures au moyen des gels chargés en argent
Notre objectif est la récupération des ions Cl– à partir des solutions aqueuses diluées par utilisation des gels d'acide polyacrylique–polyacrylate de sodium ayant préalablement complexé l'argent.
Plusieurs expériences ont été réalisées en faisant varier la concentration initiale de Cl–. Sur la Fig. 3 nous avons représenté les variations du nombre de moles de Cl– (nCl–) retenu par le gel, contenant initialement 7,5.10–5 mol d'Ag+, en fonction de la concentration initiale en Cl– ([Cl–]0) dans la solution surnageante. Les résultats obtenus montrent que nCl– augmente lorsque [Cl–]0 augmente avant d'atteindre un plateau, qui correspond à la saturation du gel chargé en ions Cl–, où nCl– est égal à 7,2.10–5 mol. Ceci montre que la capacité de fixation des ions Cl– par le gel chargé en Ag+ est de l'ordre de 96%.
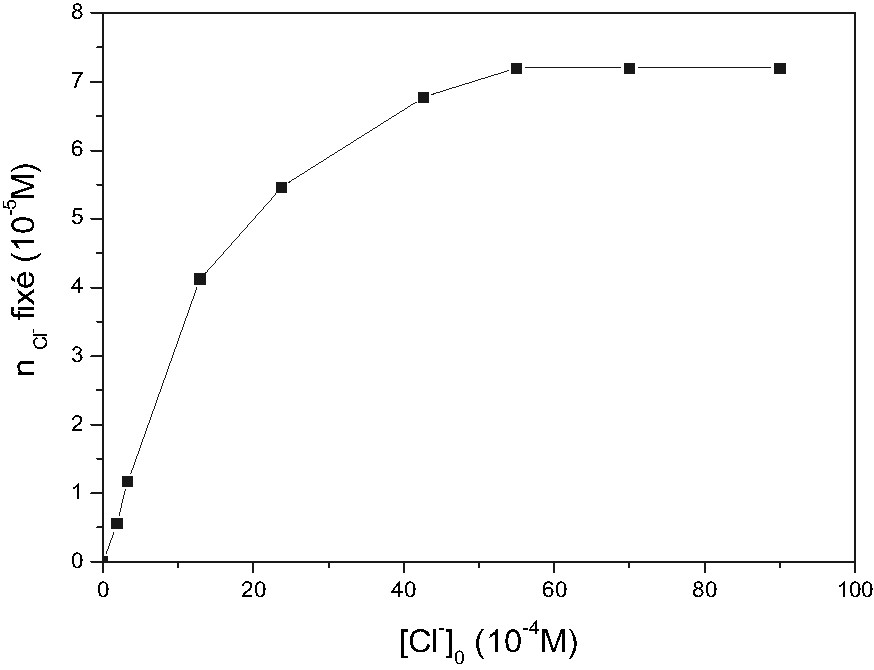
Élimination des ions Cl- par des gels préalablement chargés en argent à partir de solutions aqueuses diluées.
4 Conclusion
Les gels extractants hydrophiles sont obtenus de façon simple et rapide, puisqu'il suffit de plonger le polymère réticulé d'acide polyacrylique–polyacrylate de sodium dans un excès d'eau distillée.
L'étude cinétique d'extraction de l'argent par ces hydrogels montre que l'équilibre d'extraction dépend du pH de la solution aqueuse. L'équilibre est d'autant plus rapide que le pH est faible.
Les ions H+ et Ag+ entrent en compétition pour se fixer sur les sites carboxylates, ce qui entraîne une augmentation du pH de la solution surnageante au cours de l'extraction.
La capacité de fixation du gel en argent : R (moles d'Ag+ fixé / moles de –COO(H, Na)) dépend du pH de la solution aqueuse : R augmente lorsque le pH augmente. Aux fortes concentrations en métal, un effet de saturation est atteint à R = 0,75.
Les gels chargés en argent ont été mis au contact des solutions de NaCl à différentes concentrations. Les résultats obtenus montrent que le nombre de moles d'ions Cl– retenus par le gel chargé est voisin du nombre de moles d'Ag+ contenu dans le gel. La capacité de fixation du gel en ions Cl– dépasse 95 %.


