1 Introduction
Les composés de type « pyrochlore » attirent énormément l'attention des chercheurs en raison de leurs diverses performances technologiques. Leurs propriétés physiques et chimiques permettent des applications dans les domaines de l'électronique, du magnétisme, de la catalyse etc. [1].
Le pyrochlore est un minéral naturel répondant à la formule (Na,Ca,U)2(Nb,Ta)2O6(OH,F) [JCPDS/13-254]. Il a été le premier d'une famille de formulation A2B2X6X′. Les pyrochlores au bismuth connaissent des applications technologiques variées liées, d'une part, à leurs conductivités électronique et ionique intéressantes et, d'autre part, à leurs températures de synthèse relativement basses [2]. Parmi ces applications, on peut citer les domaines de la microélectronique (miniaturisation des circuits électroniques) [3], de la communication (micro-ondes) et la possibilité d'utiliser ces matériaux dans les systèmes électroniques passifs et actifs [4]. Le caractère de conduction électrique a été largement étudié. Ainsi, Brixner [5] trouve pour les composés Ln2Ti2O7 un caractère isolant ou semi-conducteur. Les composés au mercure sont des semi-conducteurs, avec une basse énergie d'activation [6]. Le composé Cd2Nb2O7 est un ferroélectrique [7,8]. Donohue et al. [9] mettent en évidence un caractère métallique dans le composé Cd2Re2O7. Les pyrochlores non stœchiométriques tels que Pb2B2O7–x (x ≈ 1, B = Ru, Re et Ir) sont aussi des conducteurs métalliques [10]. Longo et al. [10], après investigations des caractères électrique et magnétique, ont conclu que les pyrochlores [11] ressemblent aux pérovskites [12].
Ces dernières années de nouveaux composés de type (AA′)2(B′B″)2O7+δ ont été synthétisés [13–15]. On peut citer, à titre d'exemple, le composé Dy2MnTa1,25O7,675 [16] dans lequel l'excès d'oxygène est bien marqué.
Lors de travaux antérieurs [17], dans lesquels nous avons entrepris d'étudier la substitution du bismuth par l'antimoine dans le composé Bi2CuO4 [18], nous avons obtenu, dans le système Bi2–xSbxCuO4, pour x = 1, une composition de formule chimique Bi2Sb2Cu2O10 contenant une phase majoritaire de symétrie cubique et l'oxyde de cuivre CuO, que nous avons réussi à l'éliminer selon la formule Bi2Sb2Cu2–zO10–z, de sorte qu'à z = 0,75, nous avons obtenu un composé pur, de formule chimique théorique Bi2Sb2Cu1,25O9,25 [19].
Dans ce travail, nous nous proposons de faire une synthèse directe de ce nouveau composé et d'en faire une résolution structurale par la méthode de Rietveld [20].
2 Expérience
Le composé polycristallin Bi2Sb2Cu1,25O9,25 a été synthétisé par la méthode classique de réaction solide des oxydes Sb2O3 (99 %), Bi2O3 (99,9 %) et CuO (99 %) (Aldrich Chemical Company Ltd).
Les trois oxydes, pesés selon les proportions stœchiométriques requises, ont été intimement mélangés par un broyage minutieux pendant environ 1 h dans un mortier en agate jusqu'à l'obtention d'un mélange parfaitement homogène. Ce dernier a ensuite été versé dans un creuset en alumine frittée, puis porté au four à une température de 700 °C pendant deux jours. Cette opération de broyage–chauffage a été renouvelée une deuxième fois, avec toutefois une durée de chauffage de trois jours. Le mélange a finalement subit un dernier broyage très fin avant d'être pressé à 400 kgf/cm2 pour être confectionné sous forme de pastilles de 13 mm de diamètre et de 2 mm d'épaisseur, lesquelles ont été frittées à la température de 850 °C pendant cinq jours. Un dernier frittage à 1000 °C pendant une nuit permet l'obtention de phase pure.
Le dosage chimique des éléments formant le composé a été réalisé à l'aide d'un spectromètre ICP–OES (Inductive Coupled Plasma–Optical Emission Spectroscopy) du type 3580Bfa. ARL.
La caractérisation des échantillons par diffraction des rayons X a été réalisée à l'aide d'un diffractomètre automatique de type Siemens D5000 opérant en géométrie focalisante de type Bragg-Brentano (θ/2θ) et utilisant la longueur d'onde Kα du cuivre.
Les mesures électriques ont été effectuées par la méthode des quatre pointes à température ambiante.
Les mesures de susceptibilité magnétique ont été réalisées à l'aide d'une balance de Faraday, dans une gamme de température comprise entre 300 et 800 K.
3 Résultats et discussion
3.1 Spectrométrie ICP–OES
La masse de l'échantillon analysé est de 9,2040(5) mg. Les résultats de l'analyse sont reportés dans le Tableau 1.
| Bi | Sb | Cu | |
| Pourcentage massique | 46,27 | 25,57 | 8,87 |
| Nombre de moles (× 10–3) | 0,02037 | 0,01922 | 0,0128 |
D'où la formule chimique globale Bi2,03Sb1,92Cu1,28O9,16, dans laquelle le nombre d'atomes d'oxygène a été déterminé par différence en tenant compte de la neutralité des charges électriques, le dosage de l'oxygène étant impossible en présence de l'antimoine.
3.2 Diffraction des rayons X
Les spectres de diffraction théorique, calculé et différence sont donnés sur la Fig. 1. La bonne concordance des spectres indique que la composition est celle d'une phase pyrochlore.
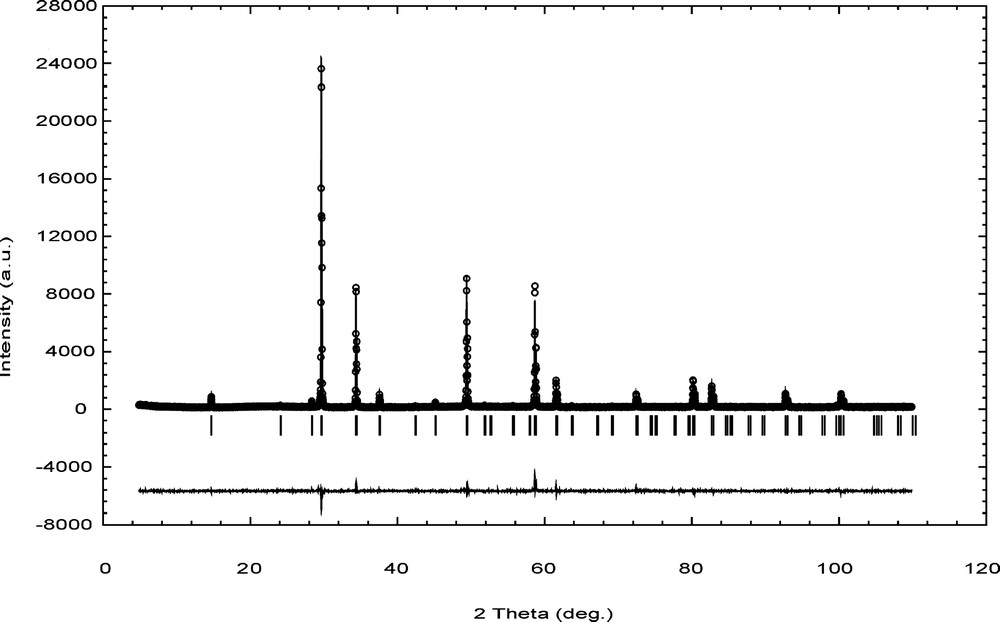
Spectres de diffraction théorique, calculé et différence du composé.
L'indexation des raies constituant une étape préliminaire, tous les pics du diffractogramme obtenu ont été indexés dans le système cubique à faces centrées (Tableau 2).
| N | ICal | IObs | dCal | h | k | l |
| 1 | 45,8 | 48,2 | 6,0217 | 1 | 1 | 1 |
| 2 | 1,2 | 6,8 | 3,6875 | 2 | 2 | 0 |
| 3 | 23,2 | 26,6 | 3,1447 | 3 | 3 | 1 |
| 4 | 1890,9 | 1823,9 | 3,0108 | 2 | 2 | 2 |
| 5 | 630,4 | 655,4 | 2,6075 | 4 | 0 | 0 |
| 6 | 73,1 | 70,9 | 2,3928 | 3 | 3 | 1 |
| 7 | 3,4 | 3,7 | 2,1290 | 4 | 2 | 2 |
| 8 | 6,1 | 6,2 | 2,0072 | 3 | 3 | 3 |
| 9 | 17,3 | 17,5 | 2,0072 | 5 | 1 | 1 |
| 10 | 755,1 | 780,8 | 1,8437 | 4 | 4 | 0 |
| 11 | 12,3 | 7,7 | 1,7629 | 5 | 3 | 1 |
| 12 | 1,9 | 1,7 | 1,7383 | 4 | 4 | 2 |
| 13 | 8,1 | 4,5 | 1,6491 | 6 | 2 | 0 |
| 14 | 0,6 | 3,0 | 1,5905 | 5 | 3 | 3 |
| 15 | 664,8 | 780,3 | 1,5723 | 6 | 2 | 2 |
| 16 | 164,0 | 176,7 | 1,5054 | 4 | 4 | 4 |
| 17 | 3,4 | 3,2 | 1,4604 | 5 | 5 | 1 |
| 18 | 2,9 | 2,8 | 1,4604 | 7 | 1 | 1 |
| 19 | 0,1 | 0,8 | 1,3937 | 6 | 4 | 2 |
| 20 | 1,6 | 1,4 | 1,3578 | 5 | 5 | 3 |
| 21 | 2,1 | 1,9 | 1,3578 | 7 | 3 | 1 |
| 22 | 92,3 | 105,9 | 1,3037 | 8 | 0 | 0 |
| 23 | 1,2 | 0,2 | 1,2742 | 7 | 3 | 3 |
| 24 | 0,6 | 1,2 | 1,2648 | 6 | 4 | 4 |
| 25 | 0,3 | 0 | 1,2291 | 6 | 6 | 0 |
| 26 | 3,7 | 0,4 | 1,2291 | 8 | 2 | 2 |
| 27 | 0 | 0 | 1,2043 | 5 | 5 | 5 |
| 28 | 1,6 | 3,4 | 1,2043 | 7 | 5 | 1 |
| 29 | 225,0 | 224,1 | 1,1964 | 6 | 6 | 2 |
| 30 | 184,6 | 182,6 | 1,1661 | 8 | 4 | 0 |
| 31 | 2,5 | 3,4 | 1,1448 | 7 | 5 | 3 |
| 32 | 0,3 | 0,4 | 1,4484 | 9 | 1 | 1 |
| 33 | 2,3 | 4,8 | 1,1380 | 8 | 4 | 1 |
| 34 | 5,7 | 2,8 | 1,1118 | 6 | 6 | 4 |
| 35 | 0,2 | 0,1 | 1,0933 | 9 | 3 | 1 |
| 36 | 150,6 | 133,3 | 1,0645 | 8 | 4 | 4 |
| 37 | 0 | 0 | 1,0482 | 7 | 5 | 5 |
| 38 | 0 | 0 | 1,0482 | 7 | 7 | 1 |
| 39 | 1,8 | 2,1 | 1,0482 | 9 | 3 | 3 |
| 40 | 0 | 0 | 1,0227 | 8 | 6 | 2 |
| 41 | 0,3 | 0 | 1,0227 | 10 | 2 | 0 |
| 42 | 8,3 | 17,1 | 1,0083 | 7 | 7 | 3 |
| 43 | 1,1 | 2,3 | 1,0083 | 9 | 5 | 1 |
| 44 | 43,6 | 39,5 | 1,0083 | 6 | 6 | 6 |
| 45 | 125,7 | 114,1 | 1,0036 | 10 | 2 | 2 |
| 46 | 0,2 | 1,8 | 0,9726 | 9 | 5 | 3 |
| 47 | 1,7 | 1,4 | 0,9684 | 8 | 6 | 4 |
| 48 | 2,3 | 3,4 | 0,9521 | 10 | 4 | 2 |
Les conditions d'enregistrement et le résultat de l'affinement de Rietveld sont regroupés dans le Tableau 3.
| Conditions d'enregistrement | |
| Diffractomètre | Siemens D 5000 |
| Longueurs d'ondes | 1,54056 et 1,54430 Å |
| 2 θ (°) | 5–110 |
| Pas (2 θ) | 0,0200 |
| Temps (pas/s) | 60 |
| Résultats de l'affinement de Rietveld | |
| Formule globale | Bi12,192Cu7,616Sb12,192O56 |
| Masse de la formule | 5412,20 |
| Système cristallin | Cubique |
| Groupe d'espace | Fdm (N° 227) |
| Paramètre de maille | a = 10,430(1) Å |
| Volume de la maille | 1134,63 (19) Å3 |
| Densité calculée | 7,920 g/cm3 |
| Séquence de Wyckoff | fdcb |
| Nombre de réflexions | 5251 |
| Nombre de paramètres affinés | 66 |
| Point zéro (2 θ) | 0,1332 (0,0011) |
| Profil de fonction | Pseudo-Voigt |
| Paramètres de demi-largeur | U = 0,01649 (0,00139) |
| V = –0,01323 (0,00138) | |
| W = 0,00689 (0,0037) | |
| Paramètres asymétriques | |
| 0,2308 (0,00818) | |
| 0,01899 (0,00208) | |
| 0,00000 (0,00000) | |
| 0.00000 (0.00000) | |
| Rwp | 9,28 |
| Rp | 7,10 |
| RBragg | 6,62 |
| Rf | 7,74 |
| X2 (Rwp/Rexp)2 | 3,031 |
Le Tableau 4 regroupe les coordonnés atomiques et les facteurs d'agitation thermique isotropiques B.
| Atome | Site | Occ. | x | y | z | B (Å2) |
| Bi (1) | 16d | 0,762 | 1/2 | 1/2 | 1/2 | 3,514(4) |
| Cu (1) | 16d | 0,238 | 1/2 | 1/2 | 1/2 | 3,514(4) |
| Sb (2) | 16c | 0,762 | 0 | 0 | 0 | 0,976(8) |
| Cu (2) | 16c | 0,238 | 0 | 0 | 0 | 0,976(8) |
| O (1) | 48f | 1 | 0,3213(1) | 1/8 | 1/8 | 0,845(3) |
| O (2) | 8b | 1 | 3/8 | 3/8 | 3/8 | 0,845(3) |
Le Tableau 5 regroupe les valeurs des facteurs d'agitation thermique anisotrope Bij.
| Atome | B11 | B22 | B33 | B12 | B13 | B23 |
| Bi (1) | 0,0080(2) | 0,0080(2) | 0,0080(2) | –0,0024(0) | –0,0024(0) | –0,0024(0) |
| Cu (1) | 0,0080(2) | 0,0080(2) | 0,0080(2) | –0,0024(0) | –0,0024(0) | –0,0024(0) |
| Sb (2) | 0 | 0 | 0 | 0 | 0 | 0 |
| Cu (2) | 0 | 0 | 0 | 0 | 0 | 0 |
| O (1) | 0 | 0 | 0 | 0 | 0 | 0 |
| O (2) | 0 | 0 | 0 | 0 | 0 | 0 |
Le Tableau 6 donne les distances interatomiques.
| Bi/Cu (1) − O(2) | 2x | 2,258(1) |
| Bi/Cu (1) − O(1) | 6x | 2,622(1) |
| Sb/Cu (2) − O(1) | 6x | 1,988(1) |
| Sb/Cu (2) − Sb/Cu (2) | 6x | 3,688(1) |
Les résultats d'affinement obtenus nous permettent de confirmer la composition initiale, à savoir Bi2Sb2Cu1,25O9,25, qui s'écrirait plutôt (Bi1,524Cu0,476)(Sb1,524Cu0,476)O7,048, où le cuivre occuperait dans les mêmes proportions les deux sites cationiques A et B. Cette composition est proche de celle rapportée par Caillault [21] en l'occurrence (Bi1,5Cu0,5)(Sb1,5Cu0,5)O7, à la différence que, dans notre cas, le rapport Bi/Cu (ou Sb/Cu) vaut 3,2 au lieu de 3, conduisant à une composition légèrement excédentaire en oxygène afin de préserver la neutralité électrique du composé. Dans le but de confirmer l'existence de notre composé, nous avons synthétisé une nouvelle solution solide de formule (Bi1,5+xCu0,5–x)(Sb1,5+xCu0,5–x)O7+δ avec 0 ≤ x ≤ 0,035, comprenant notre composé pour x = 0,024 et l'autre composé pour x = 0. L'analyse des échantillons par diffraction des rayons X montre que la solution solide est pure. L'affinement réalisé à l'aide du programme AFMPOU4 révèle une augmentation continue du paramètre de maille, certainement du à la différence de taille entre le bismuth et le cuivre (Fig. 2).
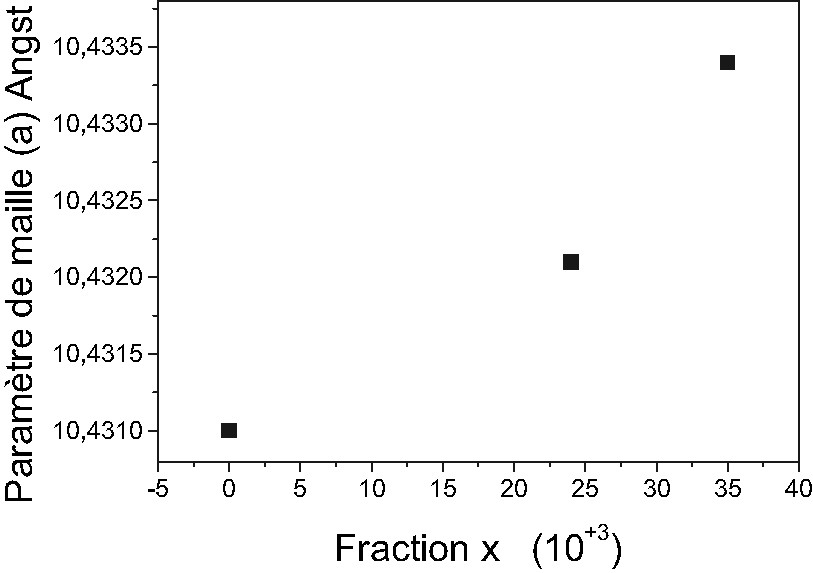
Variation du paramètre de maille a en fonction de x de la solution solide (Bi1,5+xCu0,5–x)(Sb1,5+xCu0,5–x)O7+δ.
Par ailleurs, des mesures de susceptibilité magnétique dans une gamme de température comprise entre 300 et 800 K réalisées sur les deux composés correspondant respectivement à x = 0 et x = 0,024 (Fig. 3) révèlent une différence entre les valeurs des moments effectifs respectifs de 2,20 μβ et 2,27 μβ.
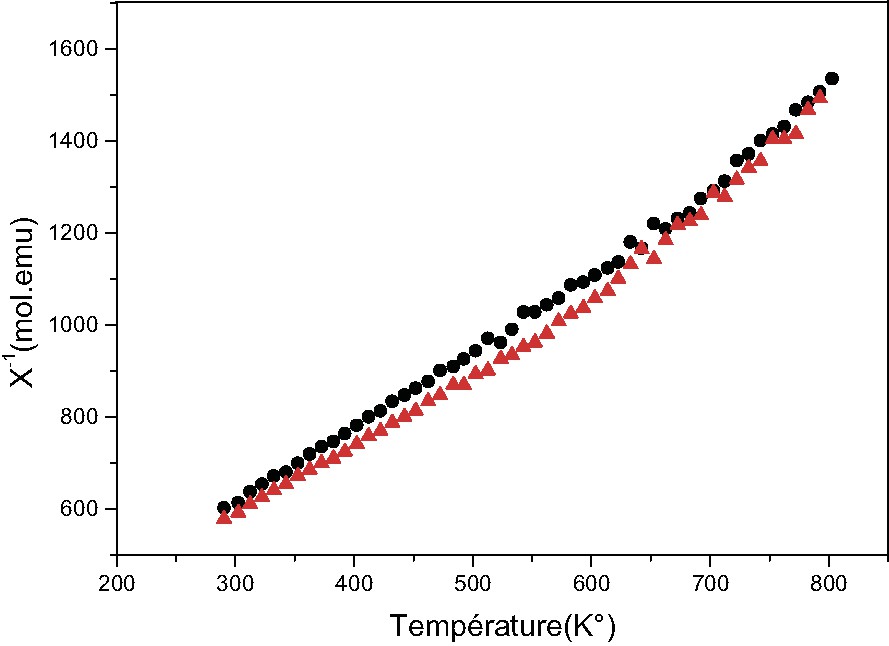
Inverse de la susceptibilité magnétique en fonction de la température (● x = 0, ▲ x = 0,024).
Nous avons attribué cette différence à l'excès d'oxygène lequel est probablement du à une oxydation partielle du cuivre dans notre composé pour x = 0,024. Il est à noter que l'excès en oxygène a déjà été rencontré dans quelques composés de type pyrochlore, comme par exemple Pr2Ce0,2Zr1,8O7+δ, dans lequel les auteurs ont décelé cet excès par la présence d'une vibration supplémentaire dans le spectre Raman provenant du dopant (vibration de Ce−O6) [22].
Des sept atomes d'oxygène, un seulement est séparé de l'octaèdre BO6, pour être lié au cation A, localisé dans le vide entre les octaèdres BO6. La structure peut être donc envisageable comme un arrangement tridimensionnel des réseaux octaédriques BO6, avec le sous-réseau (AO4) tétraédrique dans les interstices [23].
La coordonnée x = 0,3213(1) de l'oxygène O(1) est proche de la coordonnée standard 0,3125 [24], indiquant que l'octaèdre BO6 est régulier. Il est donc fort probable que celui-ci provoque une déformation du site A, que l'on pourrait décrire comme un hexagone gauche « bicappé » par deux anions d'oxygène de O(2) (Fig. 4).
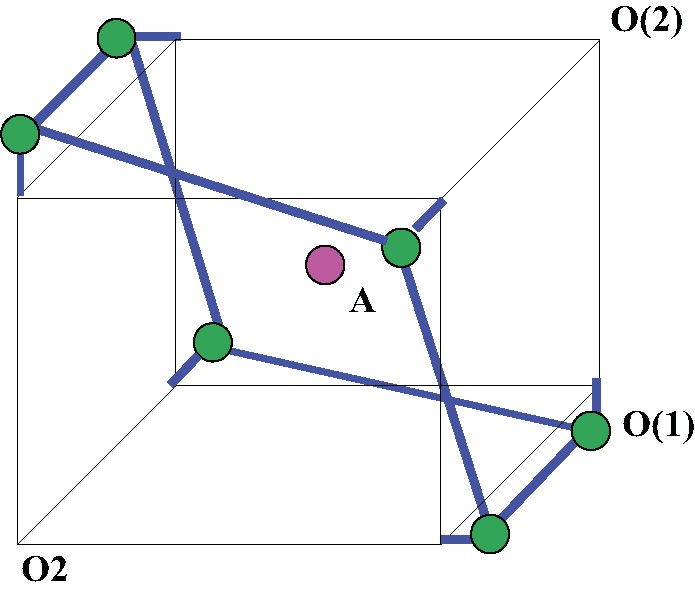
Environnement du site A.
Les mesures électriques à température ambiante par la méthode des quatre pointes réalisées sur des pastilles frittées mettent en évidence une résistivité électrique du composé de l'ordre de 105 Ω cm.
4 Conclusion
Dans ce travail, un nouveau composé, de formule chimique (Bi1,524Cu0,476)(Sb1,524Cu0,476)O7+δ, a été synthétisé. Il s'est avéré être issu de la solution solide (Bi1,5+xCu0,5–x)(Sb1,5+xCu0,5–x)O7+δ, avec x = 0,024, dont nous avons confirmé l'existence dans le domaine 0 ≤ x ≤ 0,035. La résolution structurale sur poudre par la méthode de Rietveld montre que le composé est de type « pyrochlore, A2B2O7 », le cuivre étant distribué entre les deux sites A et B. Le composé est caractérisé par une résistivité électrique de l'ordre 105 Ω cm, avec un comportement paramagnétique de moment effectif μeff = 2,27 μβ.
Des substitutions dans les sites A et B sont en cours de réalisation et feront l'objet d'une prochaine publication.
Remerciements
Les auteurs remercient vivement M.O. Mentre de l'École nationale supérieure de chimie de Lille (France), Mme N. Nguyen du Laboratoire Crismat de l'École nationale supérieure d'ingénieurs de Caen (France) et Mme B. Jeachke de l'institut Max-Planck de recherche sur les matériaux solides (équipe Pr. Jansen) de Stuttgart (Allemagne) pour la caractérisation des échantillons.


