1 Introduction
Les méthodes de séparation à membranes peuvent être classées, de manière exhaustive, en fonction du gradient de potentiel chimique appliqué et du type de membrane (Tableau 1). Trois types de membranes sont considérés : les membranes poreuses, les membranes denses et les membranes ionophores (ou chargées).
Classification des techniques utilisant des membranes (transferts isothermes)
| Type de membrane | Ionophores | Poreuses | Denses |
| Variables de contraintes | |||
| Gradient de concentration (ΔC) | Dialyse ionique | Dialyse moléculaire (hémodialyse) | Osmose |
| Gradient de potentiel électrique (Δφ) | Électrodialyse | Electro-ultrafiltration | Électro-osmose |
| Gradient de pression (ΔP) | Piézodialyse | Micro-, ultra-, nanofiltration | Osmose inverse |
La membrane de filtration se comporte comme une interface sélective vis-à-vis d'un mélange de soluté noyé dans un solvant. Le transfert de matière qui s'opère est fonction des propriétés physicochimiques du matériau de filtration (taille des pores, symétrie ou asymétrie, nature chimique du matériau, etc.) et des contraintes appliquées (gradient de concentration ΔC, gradient de pression ΔP, gradient de potentiel électrique Δφ). Ces contraintes ont pour seul but de maintenir la membrane en déséquilibre afin d'accélérer le processus de séparation.
Les membranes poreuses ont une sélectivité basée sur la taille et donc de nature physique. La sélectivité observée sur les membranes denses est, en revanche, essentiellement de nature chimique, la membrane jouant le rôle d'un solvant hydro-organique. Enfin les membranes chargées (denses ou poreuses) ont une sélectivité liée à la nature de leur charge intrinsèque.
Ainsi, les membranes d'ultrafiltration (UF) (membranes de tailles de pores comprises entre 2 et 100 nm) permettent de séparer des molécules et/ou ions de petite taille selon un mécanisme d'exclusion par la taille [1,2], alors qu'un mécanisme d'exclusion chimique par solubilisation–diffusion opère en osmose inverse [3]. Il est également possible de rencontrer les deux mécanismes combinés, notamment en nanofiltration, où la prédominance d'un mécanisme par rapport à un autre dépend fortement des conditions opératoires (pression transmembranaire, taux de conversion, effet de polarisation de concentration, force ionique, etc.) mises en œuvre [2,4–7].
Les membranes sont utilisées pour la purification des fluides biologiques (dialyse, filtration des leucocytes ou oxygénation du sang) ou pour la séparation des biomolécules, et l'utilisation des membranes modifiées par immobilisation de biomacromolécules est en plein essor dans le domaine des biotechnologies.
Le présent travail fait suite à une étude préliminaire menée en 2003 au musée de la Mer de Biarritz (France) [8–10]. Il s'agissait de comparer les techniques d'osmose inverse (OI) et de nanofiltration (NF) pour la préparation de solutions salines à destination des centres de thalassothérapie, et ce à partir de la seule ressource eau de mer (salinité totale d'environ 35 g/l) et sans ajout d'aucun produit chimique.
Le procédé de NF s'est avéré plus performant que celui d'OI. Toutefois il a été nécessaire de mettre en œuvre plusieurs étages de séparation, en particulier lors de la préparation d'eaux isotoniques (salinité totale : 9 g/l), et cela en raison d'une trop faible sélectivité des membranes commerciales. La présente étude a le même objectif final, mais au lieu de partir directement de membranes de NF ou d'OI, très serrées en terme de diamètre de pores, nous avons choisi une membrane d'UF, plus ouverte, de seuil de coupure 20 kDa (1 Da = 1 g/mol), et qui possède un caractère ionophore (présence de groupements –SO3–).
Cette membrane de dialyse, communément appelée AN69, a alors été modifiée en surface avec un polyélectrolyte cationique dans le but de diminuer sa sélectivité, que nous évaluerons par la suite en termes de diminution du seuil de coupure et à travers la modification dans les ordres de transfert des anions Li+, Na+, K+, Ca2+ et Mg2+.
L'objectif ultime de ces travaux est de mettre au point des membranes à sélectivité variable, afin d'élaborer, à la demande, par simple dialyse, des solutions de compositions variables, les pressions de travail nettement plus faibles en UF qu'en NF contribuant à l'abaissement important du coût énergétique de l'opération.
Les modifications physicochimiques de la membrane AN69 avant et après modification sont suivies par la détermination du nombre de transport de Li+ à partir de mesures de potentiels de diffusion, par des mesures directes de flux de diffusion de plusieurs solutions d'électrolytes (LiCl, NaCl, KCl, CaCl2 et MgCl2), par des mesures de perméabilité hydraulique et enfin par des mesures de potentiel d'écoulement, réalisées à l'aide d'une cellule de mesure mise au point spécialement pour l'étude et détaillée dans la suite de l'article.
2 Théorie
2.1 Nombre de transports des ions
Lorsqu'une membrane établit une jonction entre deux solutions ioniques à des concentrations différentes, les ions diffusent de la solution la plus concentrée vers la solution la plus diluée à travers la membrane. La diffusion des ions à travers la membrane crée un potentiel de membrane que l'on peut mesurer en employant des électrodes impolarisables (électrodes au calomel saturées, ECS). Cette mesure permet de calculer le nombre de transport des ions et d'en déduire la densité de charge de surface de la membrane [11]. Nous rappelons que le nombre de transport ti de l'espèce i dans une solution homogène est la fraction du courant total transportée par cette espèce.
À pression et température constantes, il existe une différence de potentiel de membrane, notée Δφ, qui est la somme d'un potentiel de diffusion provoqué par le gradient de concentration de l'électrolyte et d'un potentiel de Donnan de chaque interface membrane/solution dû aux co-ions exclus de la membrane. En l'absence de potentiel de Donnan, en considérant comme constants le coefficient d'activité des ions et leurs nombres de transports dans la membrane, le potentiel de diffusion pour deux solutions à des concentrations différentes C1 et C2 (C1 > C2), s'exprime par :(1)
2.2 Flux de diffusion
Pour une membrane donnée, le transfert de matière est le résultat des couplages entre les phénomènes de diffusion, de convection forcée et de migration. Ce transfert de matière peut être aussi dû à un déséquilbre thermodynamique comme l'ont montré Kedem et Katchalsky [12]. La loi principale régissant le transfert de matière est la loi de Fick. Le flux de diffusion Js de l'espèce S s'écrit :(2)
Lors de la mesure du flux de diffusion il est possible de suivre, dans le compartiment dilué, par une simple mesure de conductivité la fuite d'un électrolyte de concentration judicieusement choisie, conformément aux travaux de Auclair et al. [13]. Dans le domaine des concentrations observées (concentrations inférieures dans tous les cas à 10–3 mol/L), la conductivité X varie de façon linéaire avec la concentration :(3)
La concentration C2 de la solution située dans le compartiment dilué évolue linéairement avec le temps, comme le montre l'équation (4) :(4)
Cette évolution est suivie par des mesures de conductivité χ (en μS/cm), dans un domaine de concentration inférieur à 10–3 mol/L. Le facteur de proportionnalité a s'écrit :(5)
L'expression du flux de diffusion devient alors :(6)
2.3 Perméabilité hydraulique
La perméabilité transmembranaire permet de visualiser l'évolution du flux de solvant J (en m/s) en fonction de la pression transmembranaire ΔP en Pa, conformément à la loi de Hagen–Poiseuille, valable pour un régime d'écoulement laminaire au travers d'un milieu poreux et énoncée comme suit :(7)
Expérimentalement, la perméabilité est obtenue par la mesure du flux transmembranaire (en L/m2/h) en fonction de la différence de pression transmembranaire ΔP (en bar). Ce paramètre est évalué à partir d'une eau ultrapure (UP), de conductivité inférieure à 1 μS/cm, de pH 5,6 et à une température de 20 °C. Lors de ces mesures, nous suivons les instructions données par la norme Afnor [14].
D'après l'équation (7), la perméabilité Lp (en L/m2/h/bar) est proportionnelle au diamètre des pores au carré. Le rapport des perméabilités avant (Lpv) et après (Lpa) adsorption donne donc accès à la diminution du diamètre de pores si l'on admet que la rugosité de la membrane et son épaisseur restent identiques au cours de la modification. En considérant que le diamètre moyen de pore initial (dpv) est égal à 3 ± 1,0 nm, on en déduit le diamètre moyen des pores après adsorption de PDADMA (dpa) :(8)
2.4 Potentiel d'écoulement
La relation d'Helmholtz–Smoluchovsky énoncée ci-dessous met en évidence la proportionnalité existant entre la variation de pression transmembranaire appliquée (ΔP) et la différence de potentiel résultante (Δφ) :(9)
3 Matériel et méthodes utilisés
3.1 La membrane étudiée et le polyélectrolyte adsorbé
La membrane d'ultrafiltration utilisée est une membrane symétrique, de dénomination commerciale AN69. Il s'agit d'un copolymère : poly(acrylonitrile-co-methallyl sulfonate), de charge globale négative (Fig. 1). Cette membrane possède un seuil de coupure de 20 kDa.
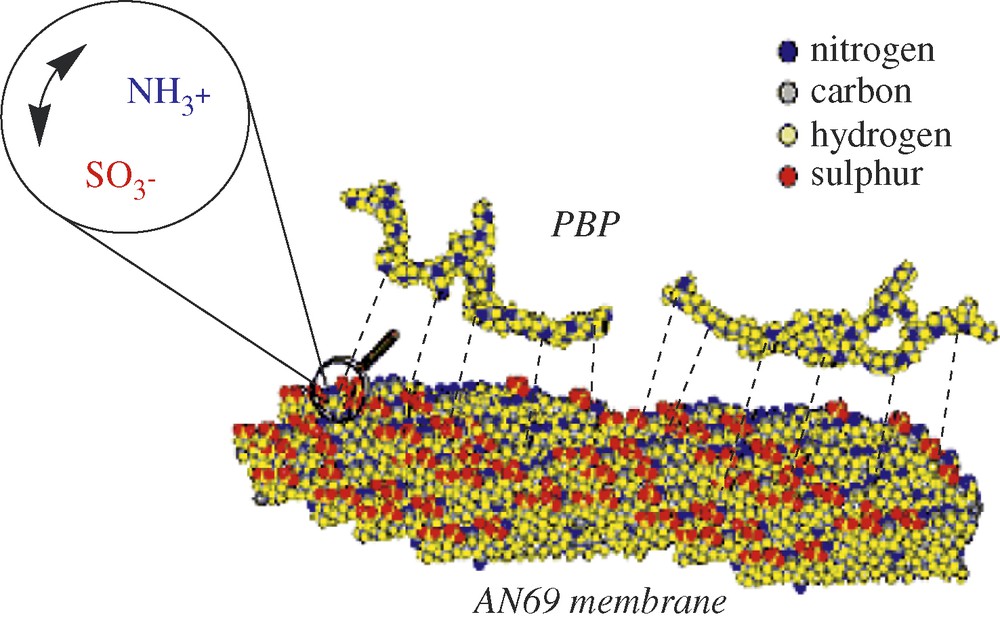
Représentation de la membrane AN69.
Le PDADMA est un polymère chargé positivement comme indiqué sur la Fig. 2.

PDADMA polymère cationique.
Ce chlorure de poly(diallyldiméthylammonium) (noté PDADMA) est employé, pour modifier la membrane AN69. Il s'agit d'un polyélectrolyte cationique de masse molaire d'environ 400 kDa. Lorsqu'il est employé pour l'imprégnation, il est dilué 250 fois dans une solution aqueuse de NaCl à 0,5 mol/L.
3.2 Préparation des membranes
Les membranes de filtration organiques, qu'elles soient commerciales ou réalisées en laboratoire, nécessitent une étape de conditionnement nécessaire à leur conservation. Ceci nécessite la mise au point d'un déconditionnement préalable à leur utilisation afin d'éliminer les produits chimiques pouvant provenir des étapes de fabrication ou bien d'éliminer les produits de conditionnement, par exemple la glycérine. Pour ce faire, la membrane est immergée dans de l'eau UP pendant une nuit. On réalise ensuite des circulations d'eau UP à travers la membrane à une pression fixe de 2 bar jusqu'à l'obtention d'une conductivité constante dans le perméat, proche de celle de l'eau UP (< 1 μS/cm).
3.3 Protocoles expérimentaux
3.3.1 Méthode du nombre de transport par la mesure du potentiel de diffusion (Δφ)
Le principe de la méthode de mesure du potentiel de membrane employée dans ce travail consiste à évaluer la différence de potentiel entre deux solutions d'activités différentes, séparées par une membrane échangeuse d'ions et d'en déduire par calcul le nombre de transport du contre-ion, conformément à la relation (1). La membrane à étudier est maintenue entre deux demi-cellules, équipées chacune d'une allonge contenant une solution de NaNO3 à 0,1 mol/L, dans laquelle plonge une ECS, de telle sorte que la partie active de la membrane se trouve toujours du côté du compartiment le plus concentré (C1) (Fig. 3). Chacun des compartiments 1 et 2 de la cellule est d'une capacité de 50 ml. Le compartiment 2 contient une solution saline à la concentration de 10–3 mol/L. Le compartiment 1 contient une solution saline du même sel, à des concentrations variant de 10–3 à 10–2 mol/L. Les deux compartiments de la cellule électrochimique sont thermostatés à 22,0 ± 0,1° C grâce à un thermostat de type VFP GRANT Instruments (USA). Après un lavage à l'eau (UP), la membrane à étudier est insérée entre les deux cellules. Ces dernières sont assemblées à l'aide d'une grosse pince à vis, qui permet de serrer les deux demi-cellules afin d'éviter toute fuite d'électrolyte. Les bulles d'air éventuellement contenues dans la cellule sont soigneusement chassées.

Chaîne électrochimique permettant la détermination des nombres de transport.
Une agitation continue des solutions est assurée par des barreaux magnétiques afin de limiter le phénomène de polarisation de concentration, susceptible d'apparaître à la surface de la membrane. Dès la mise en contact des deux solutions, une double couche électrochimique d'épaisseur extrêmement faible se forme à la surface de la couche active et les ions diffusent de la solution la plus concentrée vers la moins concentrée.
La cellule de mesure utilisée pour déterminer les potentiels de membrane peut être assimilée à une chaîne électrochimique dont le schéma simplifié est décrit sur la Fig. 3.
La force électromotrice globale E de la pile ainsi formée s'écrit :(10)
Lorsque la valeur affichée par le millivoltmètre (millivoltmètre à haute impédance d'entrée, supérieure à 10 MΩ, Bioblock, France) devient stable, ce qui nécessite environ 15 min, la valeur du potentiel de diffusion Δφ à travers la membrane est relevée. Avant chaque série de mesures, le potentiel d'asymétrie entre les deux électrodes est relevé.
3.3.2 Mesure du flux de diffusion dans la solution (C2)
Par ailleurs, nous suivons, de façon continue, la diffusion de l'électrolyte à travers la membrane d'UF. Cette membrane sépare une solution concentrée et de l'eau UP (Millipore, France) de conductivité inférieure à 1 μS/cm. La température a été maintenue, comme précédemment, à 22,0 ± 0,1°C. Le montage expérimental est semblable à celui utilisé précédemment pour les mesures du nombre de transports de Li+. Pour suivre l'évolution de la concentration dans le compartiment dilué, nous avons utilisé une cellule conductimétrique à plaques (Bioblock, France). La détermination des concentrations à partir des mesures de conductivité nécessite la connaissance exacte du volume du compartiment dilué (50 ml). Les deux compartiments sont séparés par la membrane, l'un (C1) est rempli d'une solution de chlorure de lithium de concentration 0,3 mol/L, l'autre (C2) est rempli d'eau UP. On mesure alors la conductivité de la solution du compartiment C2 au cours du temps à l'aide d'un conductimètre de type CONSORT C 830, associé à une cellule conductimétrique. Les mesures ont été faites sur un intervalle de temps de 3 h.
3.3.3 Mesure de la perméabilité hydraulique
La cellule utilisée est une microcellule de filtration fournie par la société AMICON® et associée à une balance électronique, comme illustré sur la Fig. 4. La membrane se situe sous le réservoir et le perméat est récupéré à la base du montage dans un récipient. La pression voulue est appliquée au-dessus de la membrane grâce à une bouteille d'N2 et régulée par une vanne et un manomètre. La filtration est frontale. La perméabilité s'obtient en mesurant le débit de perméat en fonction de la pression transmembranaire lors de la filtration d'une solution UP. Nous avons fait varier la pression de 0,5 à 3 bar, le temps restant fixé à 30 min. À la fin des 30 min, la masse d'eau est pesée, puis le volume d'eau filtré est calculé.
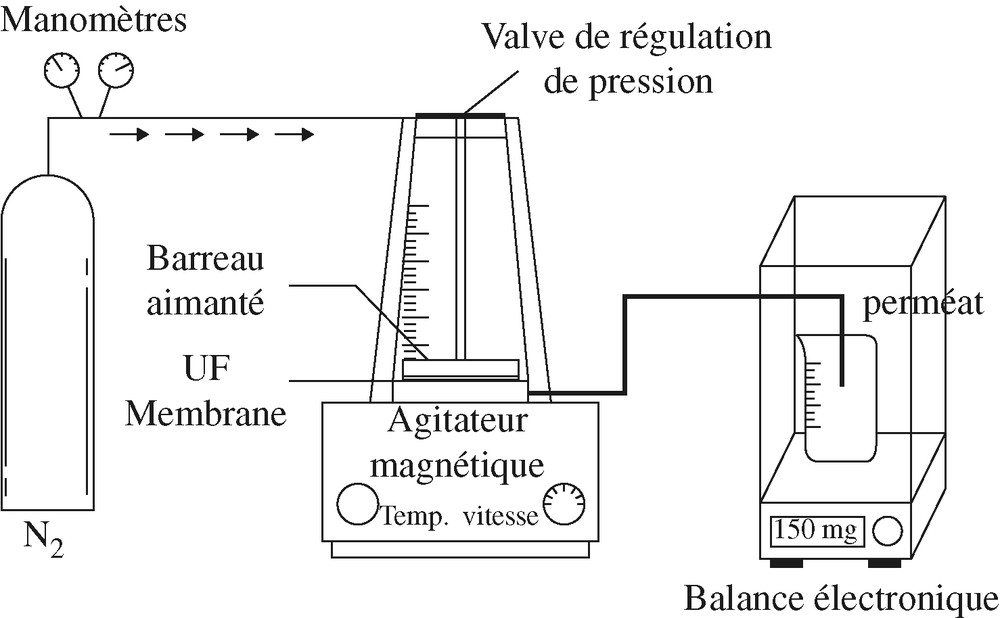
Schéma du montage pour les mesures de perméabilité hydraulique.
3.3.4 Les mesures de potentiel d'écoulement : mise au point d'une nouvelle cellule de mesure du potentiel d'écoulement
Pour les mesures de potentiel d'écoulement, on fait appel au même montage que celui utilisé précédemment (Fig. 4) pour les mesures de perméabilité hydraulique. Toutefois, au circuit hydraulique est raccordé un circuit électrique par l'intermédiaire de deux électrodes Ag/AgCl et d'un millivoltmètre à haute impédance d'entrée, comme illustré sur la Fig. 5.

Nouveau banc de mesures du potentiel d'écoulement.
L'une des électrodes plonge dans la solution d'alimentation et l'autre dans un bécher, côté perméat. Ainsi les deux électrodes sont placées de part et d'autre de la membrane, comme rapporté ailleurs [15–18].
Les membranes de filtration poreuses et chargées sont le siège de phénomènes électrocinétiques. La mesure du potentiel d'écoulement permet d'apprécier l'état de charge de surface des matériaux de filtration. Les mesures de potentiel d'écoulement sont réalisées à 20° C en utilisant des solutions de KCl à 10–3 mol/L.
Ces mesures permettent d'apprécier toute modification qui s'opère au niveau des charges électriques des parois des pores membranaires.
Une fois les caractérisations physicochimiques de nombres de transports de Li+, de flux de diffusion de différentes solutions d'électrolytes, de perméabilité hydraulique et de potentiel d'écoulement effectués, nous avons procédé à l'étude de la stabilité du film de PDADMA dans l'eau UP et dans deux solutions de chlorure de sodium de concentration 0,6 mol/L et 2 mol/L. Cette opération consiste à tremper successivement la membrane AN69 modifiée 18 h dans le PDADMA dans les différentes solutions suivantes :
- • l'eau UP pendant une nuit ;
- • une solution de NaCl 0,6 M pendant 18 h ;
- • une solution de NaCl 2 M pendant 18 h.
3.3.5 Mise en œuvre de l'AFM
La microscopie à force atomique (AFM) est mise en œuvre sur des échantillons de membranes humides. Les échantillons sont fixés à l'aide d'un ruban adhésif et la surface de la membrane est analysée. L'appareillage est un Nanoscope IIIA de fabrication Digital Instruments (multimode). Tous les échantillons sont analysés en mode tapping et par contraste de phase afin de déterminer la topographie des échantillons et mesurer leur rugosité moyenne de surface (Rms).
3.3.6 Procédure de modification de la membrane
La membrane a subi différentes modifications dans le PDADMA. Tout d'abord, le temps de contact a été changé jusqu'à ce qu'on n'observe plus aucune variation des propriétés physicochimiques de la membrane. Cette opération a consisté à tremper la membrane dans la solution de PDADMA durant 15, 30 min et 18 h. Ensuite elle a été retirée de la solution et rincée abondamment à l'eau UP.
Après l'imprégnation, la membrane ainsi modifiée est rincée à l'eau UP, puis conservée dans une solution fraîche d'eau UP, au frigo. La solution de conservation est régulièrement remplacée pour éviter tout développement de microorganismes.
4 Résultats et discussion
L'étude physicochimique qui suit est consacrée à la modification par adsorption d'un polyélectrolyte cationique de la membrane de dialyse AN69 et à ses caractérisations physicochimiques grâce à la détermination du nombre de transport de Li+, des flux de diffusion de différentes solutions d'électrolytes, de perméabilité hydraulique et de potentiel d'écoulement.
4.1 İmprégnation de la membrane AN69 par le PDADMA et caractérisation topographique par AFM
Comme cela a été détaillé dans la partie Matériel et méthodes, le PDADMA est déposé par simple mise en contact de la membrane AN69 dans la solution du polyélectrolyte. Cette méthode de modification porte aussi le nom de modification par imprégnation, comme cela a été proposé récemment par Nguyen et al. [19].
Le mécanisme de dépôt est basé sur le remplacement des contre-ions de la membrane vierge chargée par le polyélectrolyte ; ce dernier se fixe par affinité électrostatique (voir Fig. 6). Dans le même temps, les contre-ions sont éliminés et remplacés par le PDADMA ; ce dernier se déforme avant de subir un confinement à la surface de l'AN69.
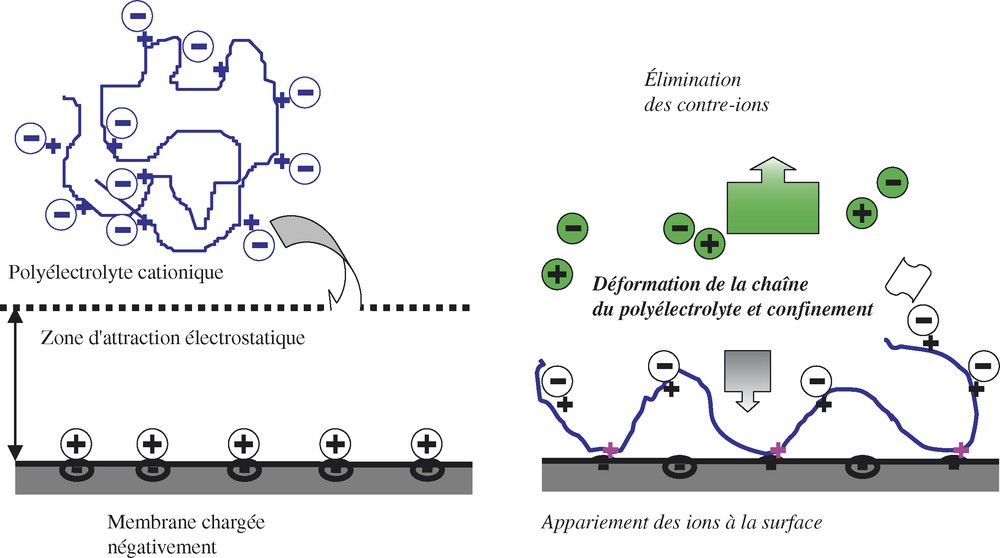
Principe de l'imprégnation de l'AN69 par le PDADMA.
L'analyse des données issues de la Fig. 7 permet de déterminer la rugosité moyenne de surface de la membrane initiale, qui est de 32,6 ± 12,7 nm. Après imprégnation par le PDADMA 18 h, la Rms obtenue est de 28,9 ± 16,9 nm, soit une diminution de 11 %. Même si les résultats de Rms peuvent être discutables (compte tenu des valeurs des incertitudes rapportées), ils montrent une tendance au lissage de la surface de l'AN69, consécutive à l'imprégnation par le PDADMA.
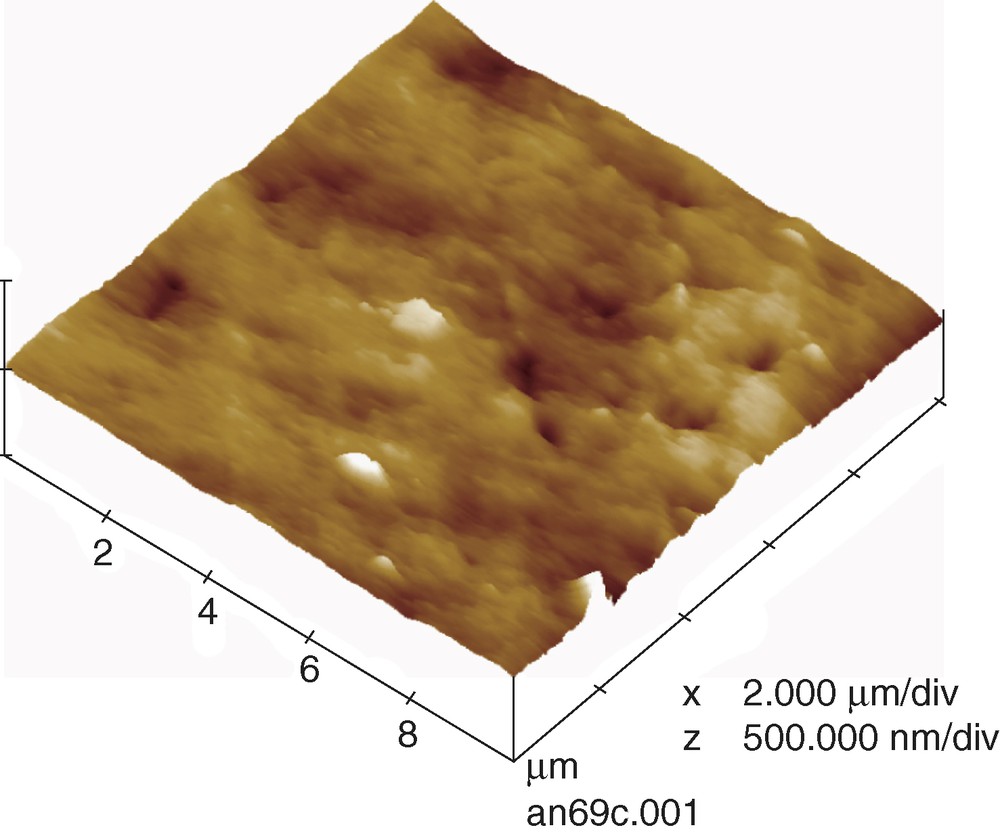
İmage topographique 3D obtenue par AFM de la membrane AN69.
4.2 Détermination des nombres de transport de Li+
La Fig. 8 et le Tableau 2 présentent les résultats de nombres de transport de Li+ et Cl– obtenus par la méthode du potentiel de diffusion pour l'AN69 non modifiée et modifiée par adsorption de PDADMA pour des temps de trempage de 15, 30 min et 18 h.

Variation des potentiels de diffusion pour la membrane AN69 non modifiée, modifiée par trempage dans le PDADMA 15 pendant 30 min et après 18 h (pH 6,6, C2 = 10–3 M et C1 varie entre 10–3 et 10–2 mol/L).
Nombre de transport de Li+ pour l'AN69 initiale et l'AN69 modifiée
| Types de membrane | Nombre de transport de Li+ tLi+ (± 0,02) |
| t+Li+ en diffusion libre | 0,33 |
| AN69 non modifiée | 0,44 |
| AN69/PDADMAC (15 min) | 0,40 |
| AN69/PDADMAC (30 min) | 0,39 |
| AN69/PDADMAC (18 h) | 0,20 |
Les droites observées montrent une bonne adéquation entre le potentiel de diffusion et le logarithme du rapport C1/C2. L'évolution du nombre de transport de l'ion Li+ déduite des pentes des droites obtenues, conformément à la relation (1), évolue avec le temps de mise en contact de la membrane AN69 dans le PDADMA.
On constate qu'après adsorption du polymère, la pente de la droite change de signe, ce qui montre que la membrane a bien été modifiée et qu'en particulier sa charge a été inversée.
Par ailleurs, plus le temps de contact augmente, plus le changement de pente s'accentue, jusqu'à se stabiliser après 18 h de trempage. À ce stade, il est possible de considérer que tous les sites susceptibles d'être modifiés l'ont été.
Le Tableau 2 présente les valeurs des nombres de transport pour l'ion Li+ déduites de l'analyse de la Fig. 8, grâce à la relation (1).
Il apparaît très nettement dans ce tableau que le nombre de transport de Li+, initialement de 0,44, traduisant effectivement le caractère échangeur de cation initial de l'AN69 sulfonatée, change après imprégnation car, petit à petit, les charges négatives sont recouvertes par les charges positives du PDADMA. Après 18 h de trempage, la membrane modifiée est devenue échangeuse d'anions.
Pour la comparaison, une membrane échangeuse d'anion pure présente un nombre de transport de Li+ très proche de 0. C'est ce que l'on observe habituellement avec les membranes commerciales greffées ammoniums quaternaires. En revanche, ces dernières ne possèdent pas (ou très peu) de porosité intrinsèque, contrairement à la membrane AN69, qui en possède une initialement et qui la conserve après modification par le PDADMA, comme l'illustrent par les résultats de perméabilité hydraulique présentés dans la suite.
4.3 Détermination des potentiels d'écoulement
Sur la Fig. 9 est représentée l'évolution de la différence de potentiel transmembranaire mesurée entre les deux électrodes Ag/AgCl suite à l'application d'une différence de pression appliquée. Conformément à la relation (9), les deux paramètres sont liés linéairement.
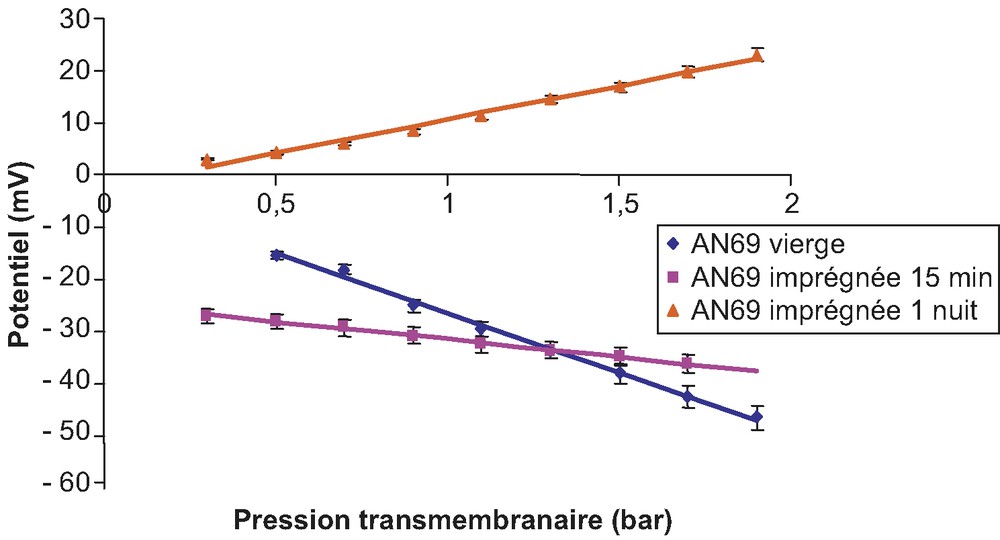
Évolution du potentiel d'écoulement de la membrane AN69 avant et après modification par le PDADMA (solution de KCl 10–3 M, pH = 6,8).
Si l'on analyse les résultats des pentes qui représentent les modifications du potentiel d'écoulement de la membrane, il apparaît qu'au bout d'une nuit de trempage dans le PDADMA, la charge de la membrane AN69 s'inverse ; initialement chargée positivement en raison de la présence en excès des groupements acides forts cette charge est inversée après adsorption du polyélectrolyte cationique. L'information supplémentaire que ces mesures apportent par rapport aux mesures de nombre de transport de Li+ constitue la preuve que la membrane n'est pas seulement modifiée en surface, mais également en profondeur.
Des variations d'ordonnées à l'origine apparaissent ; elles sont attribuables aux variations du potentiel d'asymétrie de la membrane qui apparaît lorsqu'elle subit la modification par le PDADMA.
4.4 Détermination des flux de diffusion
L'eau de mer, de salinité moyenne 35 g/l, est assimilée, en termes de concentration en NaCl, à une solution de chlorure de sodium à 0,6 mol/L. La variation de la conductivité de solutions d'électrolytes à une concentration de 0,6 mol/L en fonction du temps est mesurée sur les membranes AN69 vierge et modifiée.
La Fig. 10 présente à titre d'exemple le cas d'une solution de chlorure de lithium. La linéarité observée est en bonne adéquation avec la relation (4). Les flux de diffusion sont ensuite calculés à partir des pentes de ces droites, conformément à la relation (6). Les valeurs des flux pour les différents électrolytes testés sont rapportées dans le Tableau 3.
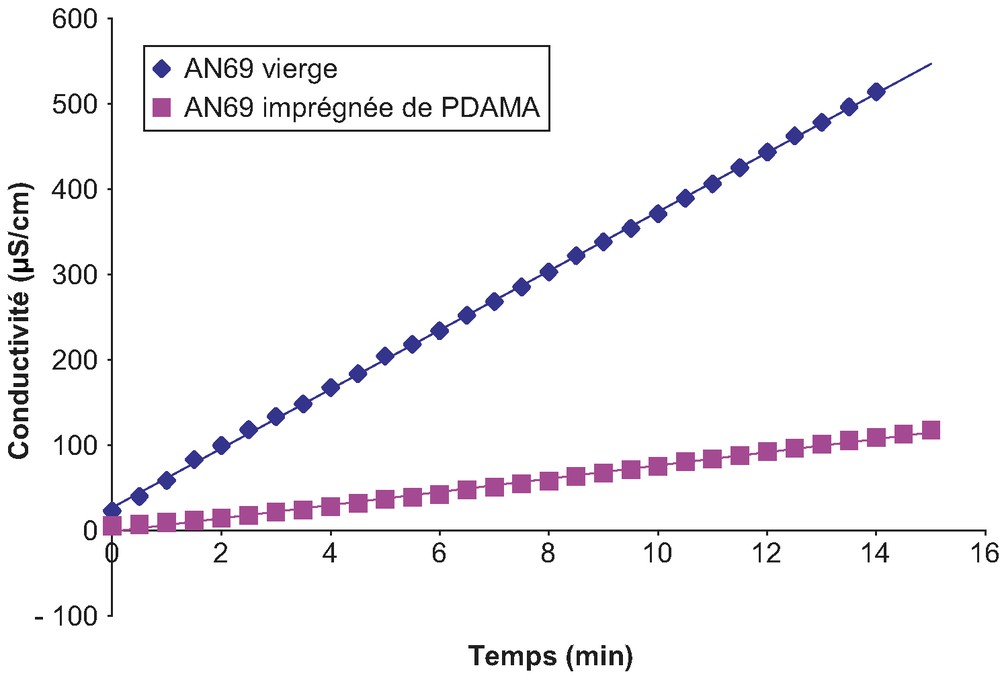
Évolution de la conductivité d'une solution de chlorure de lithium (LiCl à 0,6 mol/L–1, pH 5,65) avec le temps pour la membrane AN69 avant et après modification pendant 18 h.
Résultats des mesures de flux de diffusion pour les membranes AN69 non modifiée et modifiée avec les électrolytes NaCl, KCl, LiCl, CaCl2 et MgCl2 (concentration des électrolytes dans le compartiment le plus concentré initialement : 0,6 mol/L)
| Sel | pH | Membrane | Flux de diffusion J (10–7mol/m2/s) | Diminution du flux de diffusion (%) |
| NaCl | 6,1 | AN69 vierge | 34,7 ± 0,2 | |
| AN69 imprégnée | 12,8 ± 0,2 | 63,1 | ||
| KCl | 5,70 | AN69 vierge | 32,0 ± 0,2 | |
| AN69 imprégnée | 29,9 ± 0,2 | 6,8 | ||
| LiCl | 5,65 | AN69 vierge | 29,2 ± 0,2 | |
| AN69 imprégnée | 6,5 ± 0,2 | 77,6 | ||
| CaCl2 | 9,45 | AN69 vierge | 37,2 ± 0,2 | |
| AN69 imprégnée | 24,2 ± 0,2 | 34,9 | ||
| MgCl2 | 5,68 | AN69 vierge | 36,1 ± 0,2 | |
| AN69 imprégnée | 3,9 ± 0,2 | 89,3 |
La diminution de pente observée à la suite de l'adsorption du PDADMA complète les résultats de nombres de transports obtenus précédemment. Il s'agit ici de caractériser la sélectivité des membranes non modifiée et modifiée vis-à-vis de plusieurs électrolytes de type 1-1 et 2-1.
Ainsi, l'AN69 vierge fait apparaître l'ordre décroissant suivant des flux de diffusion :
En revanche, au sein des familles d'ions monovalents et divalents, l'hydratation semble jouer un rôle non négligeable. En effet, les ions Li+ et Mg2+ apparaissent les mieux retenus ; or il s'agit des ions les plus hydratés dans leur catégorie. Si l'on rapporte l'ordre des énergies d'hydratation [20], l'ordre décroissant est le suivant :
Cette analyse de nos résultats montre bien la difficulté d'apporter une explication tranchée à l'ordre des flux de diffusion observé, car trois phénomènes interviennent simultanément (la mésoporosité, la charge et l'hydratation) sur la sélectivité observée.
En ce qui concerne l'AN69 imprégnée de PDADMA, l'ordre précédent est changé, il devient :
Il est intéressant de noter le passage facilité de l'ion K+. Cet ion, connu pour son activité biologique (transfert membranaire facilité au travers des membranes biologiques grâce à la présence de transporteurs spécifiques) pourrait être enrichi par dialyse dans les solutions isotoniques préparées pour les centres de thalassothérapie et la santé humaine.
4.5 Détermination de la perméabilité hydraulique
De manière à compléter les mesures précédentes, des mesures de perméabilité hydraulique sont réalisées sur l'AN69 vierge et celle imprégnée de PDADMA (Fig. 11). Conformément à la loi de Hagen–Poiseuille (équation (7)) il y a bien linéarité entre les deux grandeurs, ce qui prouve que le régime d'écoulement dans la membrane est de type laminaire. Les pentes fournissent les perméabilités hydrauliques ; celles-ci sont de 16 ± 0,5 L/m2/heure/bar pour la membrane vierge et de 12 ± 0,5 L/m2/heure/bar pour la membrane modifiée après 18 h de trempage, soit une diminution de 26%.

Perméabilité hydraulique de l'AN69 vierge et modifiée (l/m2/h/bar).
La proportionnalité existant entre la perméabilité hydraulique et le diamètre moyen des pores membranaires est illustré dans l'équation (8) et permet d'estimer le diamètre moyen des pores de la membrane modifiée (dpf en nm) à partir du rapport des perméabilités hydrauliques initiale (Lpi) et finale (Lpf).
L'équation (8) fournit une valeur du diamètre de pore après adsorption de l'ordre de dpf = 2,4 ± 0,5 nm, alors qu'initialement il était de 3 ± 1 nm.
L'analyse de l'ensemble des résultats précédents laisse apparaître le fait que l'adsorption du polyélectrolyte cationique PDADMA sur la membrane AN69 diminue le nombre de transport de 54 %, le flux de diffusion de LiCl de 30 %, inverse le potentiel d'écoulement et la perméabilité hydraulique diminue de 26 % après 18 heures d'imprégnation. Les mesures concernant la variation du nombre de transport de Li+ en fonction du temps (15 min, 30 min, 18 h) montrent que l'adsorption est lente et progressive. Il en découle une diminution du nombre de transport de Li+ due aux interactions électrostatiques, les ions Li+ traversant alors de plus en plus difficilement la membrane chargée positivement. Les mesures de potentiel d'écoulement confirment l'inversion de charge et complètent cette observation par la description d'une modification en profondeur (au niveau des parois des pores) de la charge de la membrane.
La diminution assez importante de la perméabilité hydraulique suppose que l'adsorption se fait beaucoup plus en profondeur sur la membrane AN69, mais les résultats sur le calcul du diamètre des pores après imprégnation de PDADMA montrent le contraire. En effet, on trouve un diamètre de pore après adsorption de dpv = 2,4 nm, soit une diminution du diamètre de pore de la membrane de seulement 18%. L'adsorption du polymère est seulement physique, comme l'ont relevé Nguyen et al. [19] : il se forme en réalité des nanocouches sur la surface des membranes [21], obstruant ou diminuant le diamètre des pores. Néanmoins, l'adsorption du PDADMA augmente la sélectivité de la membrane.
4.6 Stabilité de la membrane AN69 modifiée
La dernière étape de cette étude consiste en une appréciation de la stabilité de la membrane modifiée. Pour ce faire, des mesures de nombre de transport de Li+ et de perméabilité hydraulique sont réalisées après stockage dans une solution d'eau UP et également en solution dans le NaCl à deux concentrations : 0,6 et 2 mol/L. Les résultats sont consignés dans le Tableau 4.
Récapitulatif des nombres de transport de Li+ des mesures de potentiel d'écoulement et des perméabilités hydrauliques sur l'AN69 vierge et modifiée
| Membrane | Nombre de transport tLi+ (± 0,02) | Perméabilité hydraulique en L/m2 h–1 bar–1 (± 2) |
|
| AN69 vierge | 0,44 | 16 | –23,0 |
| AN69/PDADMA | 0,20 | 12 | +13,0 |
| AN69/PDADMA dans l'eau UP | 0,22 | non déterminé | +13,0 |
| AN69/PDADMA dans NaCl 0,6 M | 0,27 | 13 | +12,0 |
| AN69/PDADMA dans NaCl 2 M | 0,43 | 17 | –22,0 |
On observe que le stockage dans l'eau UP n'a pratiquement aucun effet sur le PDADMA adsorbé i, le film élaboré est donc stable en solution aqueuse diluée. Le trempage dans une solution de chlorure de sodium a, en revanche, un effet quantifiable, ce qui n'est pas toujours le cas dans ce type d'étude, où les quantités mises en jeu sont en général tellement faibles que le phénomène de désorption est très difficile à voir. Dans notre cas, il semble que l'immersion dans le NaCl permette de retrouver la membrane initiale. En effet, les résultats du Tableau 4 montrent que, dans une solution à 0,6 mol/L de NaCl, le nombre de transport augmente de 26% et que, dans une solution de NaCl à 2 mol/L, l'augmentation est de 53%. De plus, le stockage dans la solution de NaCl à 2 mol/L permet de retrouver, au bout d'un certain temps, l'ensemble des propriétés de la membrane AN69 initiale et en particulier sa charge de surface, mise en évidence grâce aux mesures de potentiel d'écoulement. Pour être sûr d'enlever totalement le PDADMA, il faut utiliser des solutions de chlorure de sodium plus concentrées (> 4 mol/L).
5 Conclusion
Les résultats de l'immersion de la membrane AN69 dans une solution du polyélectrolyte cationique PDADMA montrent un recouvrement limite après 18 h d'immersion. À ce stade, l'ensemble des sites modifiables l'a été. En conséquence, les analyses physicochimiques ont permis de montrer que la membrane, qui était initialement chargée négativement, voit sa charge s'inverser. Ce changement a pu être quantifié par la diminution du nombre de transport de Li+ et aussi par la modification de l'ordre de sélectivité entre les ions monovalents et divalents. La membrane ainsi modifiée voit sa sélectivité changer. Ainsi pour la membrane AN69 initiale, l'ordre de passage des ions étudié était :, alors qu'après imprégnation pendant 18 h dans le PDADMA, cet ordre est devenu :.
En effet, le passage des différents ions, notamment Li+, devient difficile à cause de la conjonction de la répulsion électrostatique due à la charge positive, de la diminution de la taille des pores et du changement des propriétés d'hydratation de la membrane.
Par ailleurs, nous avons mis au point un protocole qui permet d'éliminer facilement un film adsorbé de PDADMA ayant vieilli et ouvert la possibilité de le renouveler très facilement par un film frais, sans changement du support constitué par l'AN69. Cette nouvelle approche de la modification (non permanente) des surfaces de membranes de dialyse ouvre de grandes possibilités pour la réalisation de modifications ayant pour vocation une meilleure adaptabilité des matériaux de filtration au milieu d'étude. Enfin, la bonne tenue de cette membrane modifiée à des solutions salines à 0,6 mol/L, comparable à la concentration de l'eau de mer, offre également la possibilité de son utilisation pour la mise en œuvre d'opérations de dialyse (dialyse ionique, électrodialyse ou piézodialyse) pour la préparation de solutions salines de compositions variables à destination des centres de thalassothérapie ou utilisables pour la santé humaine.
Appendix A. Liste des symboles
C1 concentration du soluté dans le compartiment 1 (mol/m3)
C2 concentration du soluté dans le compartiment 2 (mol/m3)
ΔC2 variation de concentration molaire dans le compartiment 2 (mol/m3)
ti nombre de transport de l'espèce i dans la solution
t–m nombre de transport de l'anion
t+m nombre de transport du cation
Δφ différence de potentiel (mV)
F constante de Faraday (C/mol)
R constante des gaz parfaits (J/K/mol)
t temps (s)
Δt variation du temps (s)
T température absolue (K)
k constante de cellule (μS/cm/mol/m3)
Js flux de diffusion du soluté (mol/m2/s)
Jsolvant flux de solvant (mol/m2/s)
B perméabilité de la membrane au soluté
K perméabilité hydraulique de la membrane
ΔP différence de pression de part et d'autre de la membrane
χ conductivité (μS/cm)
Δχ variation de la conductivité (μS/cm)
S surface géométrique de membrane (m2) soumise au transfert
V volume du compartiment dilué (m3)
ΔEref potentiel d'asymétrie des électrodes
∑Ej somme des potentiels de jonction
ɛ constante diélectrique de l'eau
ζ potentiel zêta de la membrane (V)
μ viscosité de la solution de KCl 10–3 M (Pa.s)
Rms rugosité moyenne de surface, c'est l'écart moyen arithmétique, il représente l'écart moyen de l'amplitude par rapport au plan de hauteur moyenne. La rugosité moyenne de surface est calculée par :
avec Lx et Ly : dimensions de la surface considérée, z(x,y) : hauteur de la surface par rapport au plan moyen au point (x, y).


