1 Introduction
La réaction d'époxydation des oléfines présente un grand intérêt car les époxydes sont des intermédiaires très utiles en synthèse organique. Ils peuvent, par ouverture du cycle, être transformés très facilement en composés bifonctionnels possédant deux nouveaux centres chiraux.
Les réactifs les plus généraux pour la conversion des alcènes en époxydes sont les acides peroxycarboxyliques [1]. Parmi eux, les plus souvent utilisés sont l'acide m-chloroperoxy-benzoïque (MCPBA) et le sel de magnésium de l'acide monoperoxyphtalique [2] (MPPM). L'acide peroxyacétique, l'acide peroxybenzoïque et l'acide peroxytrifluoroacétique ont été également fréquemment utilisés pour l'époxydation.
Il a été démontré que, dans cette réaction, le peroxyacide joue le rôle d'électrophile et qu'une réactivité très faible est observée pour les doubles liaisons conjuguées avec des substituants fortement électroattracteurs. Ceci montre que, pour l'époxydation des alcènes déficitaires en électrons, il faut envisager un autre type d'oxydation impliquant une addition nucléophile.
Il existe dans la littérature une grande variété de réactifs nucléophiles qui peuvent conduire à la formation du cycle oxyrane. Le Tableau 1 rassemble quelques méthodes utilisées pour époxyder la double liaison carbone–carbone [3].
Méthodes usuelles pour l'époxydation de la double liaison C–C
| Agent époxydant | ||
| 1. | H2O2 + Cat. |
|
| 2. | ROOH + Cat. |
|
| 3. | NaOCl + Cat. | Cat. = Mn(III) porphyrine, Mn(III) salen, Al2O3 |
| 4. | NaIO4 + Cat. | Cat. = RuCl3/bipyridine, Mn(III) salen |
| 5. | Oxone + Cat. | Cat. = RCOR, Mn(III) salen |
| 6. | O2 + Cat. |
|
| 7. | Enzymes | Pseudomonas oleovorans, corynebacterium equi IFO 3730, Nocardia corallina B-276 |
| 8. | Autres | Na2CrO4, KMnO4, O3, NaBO3 |
Parmi ces réactifs, le complexe RuCl3–bipiridine–NaIO4, développé par Balavoine et al. [4], s'avère être un système oxydant très puissant et qui permet l'époxydation d'une grande variété d'alcènes non fonctionnalisés. Ces conditions opératoires ont permis l'époxydation des alcènes mixtes fluorocarbonées–hydrocarbonées aliphatiques ou aromatiques, de type RFCH2CH=CHRH avec des rendements supérieurs à 90 % [5].
La méthode est très sélective et le rôle de l'oxydant est essentiel. De plus, la présence du ligand azoté semble être essentielle pour l'efficacité du système, aucune réaction n'ayant lieu en absence de bipyridine. La réaction est aussi sélective, elle ne se poursuit pas jusqu'à l'obtention de cétones ou d'acides carboxyliques.
L'objectif principal de cette étude est de montrer quel est le rôle de la bipyridine ainsi que l'influence de la nature des substituants et de leur positionnement sur le cycle pyridinique.
Pour cela, nous nous sommes intéressés à l'époxydation du RMN3, alcène mixte fluoré–hydrogéné dont le mode de synthèse a déjà été décrit au laboratoire [6] et qui a été développé à l'échelle industrielle par l'entreprise Baush and Lamb, dans une formulation (Oxan HD) destinée à traiter les décollements de rétine. De par l'effet élecroattracteur de la chaîne fluorocarbonée, la double liaison est pauvre en électrons et par conséquent présente une réactivité réduite vis-à-vis de la plupart des agents époxydants.
La méthode utilisée implique la formation d'un complexe bipyridyl de ruthénium [7], généré in situ à partir du RuCl3, une bipyridine et le NaIO4 comme oxydant. La réaction a lieu à température ambiante pendant 48 h.
Afin d'étudier l'influence de la nature du ligand azoté sur la formation du complexe responsable de l'époxydation du RMN3, nous avons étudié plusieurs composés, tous dérivés de la 2,2′-bipyridine. Nous avons fait varier la nature du substituant au niveau des noyaux aromatiques, de la chaîne fluorée ou hydrogénée, ainsi que la position du substituant sur la bipyridine.
Les bipyridines fluorées Bipy 1 et Bipy 2 et le composé Bipy 3 nous ont été fournis par Pozzi, alors que les bipyridines hydrogénés Bipy 4 et Bipy 5 ont été synthétisés au laboratoire par Matondo [8,9].
Le Tableau 2 regroupe les résultats obtenus lors de l'époxydation du RMN3, selon le schéma réactionnel présenté ci-dessous (Schéma 1).
Influence de la bipyridine sur l'époxydation du RMN3
| No | Bipyridine | Structure de la bipyridine | Rdt a | Angle dièdre b | |
| s-cis | s-trans | ||||
| 1 | Bipy | 90 % | 13° | 180° | |
| 2 | Bipy 1 | 50 % | 12° | 180° | |
| 3 | Bipy 2 | 42 % | 18° | 179° | |
| 4 | Bipy 3 | 22 % | 13° | 179° | |
| 5 | Bipy 4 | traces | 60° | 132° | |
| 6 | Bipy 5 | traces | 56° | 134° | |
| 7 | Bipy 6 | 41 % | 19° | 178° |
a Rendement en oxyde du RMN3, déterminé par CPG en présence du o-dichlorbenzène comme standard interne.
b Angle dièdre (N1C2C2′N1′) entre les plans des noyaux aromatiques, déterminés par modélisation moléculaire sur les deux structures de plus basse énergie.
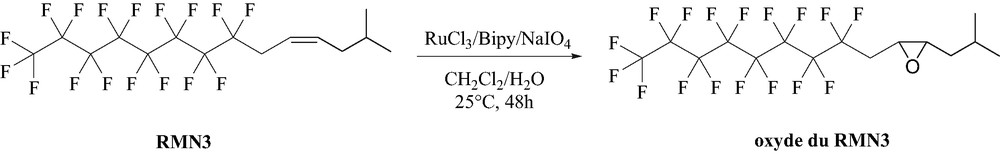
Époxydation du RMN3.
De plus, nous avons effectué une étude par modélisation moléculaire de façon à voir quelles sont les conformations préférentielles des bipyridines et ainsi déterminer l'orientation spatiale des atomes d'azote correspondant à ces arrangements particuliers.
La modélisation moléculaire a été réalisée à l'aide du logiciel « Insight II : Discover 3 ; Molecular Modeling System », en utilisant le champ de force CVFF qui permet les calculs d'énergie, l'analyse conformationnelle et l'optimisation des molécules, en tenant compte des longueurs et des angles de liaison, des torsions de cycle et des énergies coulombiennes et de van der Waals pour tous les atomes mis en jeu.
Les résultats montrent que les bipyridines substituées en positions 3 et 3′ avec des chaînes O-alkyle hydrogénées ne conduisent qu'à la formation de traces d'époxydes (Tableau 2, lignes 5,6). Ce faible rendement pourrait être expliqué par la difficulté de formation du complexe du ruthénium, due à la non-planéité de la bipyridine substituée résultant de la gêne stérique entre les deux chaînes hydrocarbonées. Par conséquent, les atomes d'azote se trouvent trop éloignés dans l'espace et le complexe de ruthénium ne peut pas se faire correctement. En effet, la modélisation moléculaires des composés Bipy 4 et Bipy 5 nous indique des angles dièdres (NCCN) d'environ 60 ou 130° entre les atomes d'azote des deux cycles.
Pour toutes les autres bipyridines, substituées ou non, fluorées ou hydrogénées, les angles dièdres correspondants aux conformations les plus favorables sont approximativement les mêmes, environ 15° pour l'angle le plus petit et 180° pour la position où les atomes d'azote se trouvent d'un côté et d'autre par rapport au plan perpendiculaire aux noyaux aromatiques.
Les rendements réactionnels varient entre 20 et 50%, pour les bipyridines substituées, que ce soit en positions 4,4′ ou 6,6′. Toutefois, le meilleur résultat est obtenu en utilisant la bipyridine non substituée. Ces résultats sont probablement liés à l'influence d'autres facteurs, comme la solubilité du ligand dans le milieu réactionnel ou encore à des phénomènes d'agrégation qui pourraient avoir lieu dans le dichlorométhane, en raison du caractère amphiphile des bipyridines à longues chaînes hydrophobes, qui pourraient gêner la complexation du ruthénium. Des travaux sont en cours pour identifier ces phénomènes d'agrégation.
Nous avons montré dans le cadre de cette étude que la nature de la bipyridine joue un rôle déterminant pour le rendement de la réaction.
2 Partie expérimentale
2.1 Époxydation par RuCl3–bipyridine–NaIO4. Procédure générale
Dans un ballon de 10 mL on introduit une solution de 0,0177 mmol (4,8 mg) de RuCl3·3,5 H2O dans 1 ml d'eau et 0,0885 mmol de bipyridine. Le mélange hétérogène est agité vigoureusement à température ambiante pendant 15 min. On rajoute 0,177 mmol d'alcène dans 1 ml de CH2Cl2 et, tout de suite après, 0,719 mmol (153,9 mg) de NaIO4. Le mélange réactionnel est maintenu sous agitation à température ambiante pendant 48 h.
En fin de réaction, 10 ml de CH2Cl2 sont rajoutés pour diluer le milieu suivi par 20 ml d'une solution à 10% de Na2SO3, qui sert à réduire le NaIO4 n'ayant pas réagi. La phase organique est séparée et lavée successivement avec 20 ml d'une solution à 10% de soude puis à l'eau, jusqu'à ce que le pH de la phase aqueuse soit neutre. La phase organique est ensuite séchée sur MgSO4. Après évaporation du solvant, le résidu obtenu est analysé par CPG.
L'époxyde peut être purifié par distillation à pression réduite (~ 0,3 mbar).
2.1.1 1-(perfluorooctyl)-5-méthyl-hex-2-ène
- • Rendement : 74 % (huile incolore) ; Téb = 40 °C/10–3 mm Hg ; Z/E = 98/2 (GC-MS) ;
- • RMN 1H (200 MHz, CDCl3), δ ppm : 0,9 (d, 6H, CH3) ; 1,6 (m, 1H, CH) ; 1,9 (t, 2H, CH2) ; 2,8 (td, 2H, CH2CF2) ; 5,4 (dt, 1H, CHCH2CF2) ; 5,7 (dt, 1H, CH–iBu) ;
- • RMN 13C (50 MHz, CDCl3), δ ppm : 22,55 et 22,75 (CH3) ; 26,75 (CH) ; 31,10 (t, CH2CF2) ; 36,54 (CH2) ; 48,99 (CHCH2CF2) ; 54,90 (CH–iBu) ;
- • RMN 19F (376 MHz, CDCl3), δ ppm : –49,7 (2F, m, CF2 en α de CF3) ; –46,6 (2F, m, CF2 en β de CF3) ; –46,2 (2F, m, CF2 en ɛ de CH2) ; –45,4 (4F, m, CF2 en γ, δ de CH2) ; –45,2 (2F, m, CF2 en β de CH2) ; –36,6 (2F, m, CF2 en α de CH2) ; –4,6(3F, t, CF3).
2.1.2 2-(2,2,3,3,4,4,5,5,6,6,7,7,8,8,9,9,9-heptadécafluoro-nonyl)-3-isobutyl-oxyrane
- • Rendement : 50% (huile incolore) ; Téb = 65 °C/0,3 mbar ;
- • RMN 1H (200 MHz, CDCl3), δ ppm : 1,0 (d, 3H, CH3) ; 1,1 (d, 3H, CH3) 1,3 (m, 1H, –OCH–CH2–CH–) ; 1,5 (m, 1H, –CH–CH2–CH–) ; 1,8 (m, 1H, –CH–(CH3)2) ; 2,3 (td, 2H, –CH2–CF2) ; 3,0 (dt, 1H, –OCH–CH2–CH–) ; 3,2 (dt, 1H, –CF2–CH2–CHO–) ;
- • RMN 13C (50 MHz, CDCl3), δ ppm : 22,8 et 23,0 (CH3) ; 27,1 (–CH–(CH3)2) ; 31,5 (t, –CH2–CF2) ; 36,9 (–OCH–CH2–CH–) ; 49,2 (t, –CF2–CH2–CHO–); 55,1 (–OCH–CH2–CH–) ; 108–122 (CF2 et CF3) ;
- • RMN 19F (376 MHz, CDCl3), δ ppm/δCFCl3 : –126,2 (m, 2F, CF2 en α du CF3) ; –123,4 (m, 2F, CF2 en β du CF3) ; –122,9 (m, 2F, CF2 en ɛ du CH2) ; –122,0 (m, 4F, CF2 en γ, δ du CH2) ; –121,8 (m, 2F, CF2 en β du CH2) ; –112,7 (m, 2F, CF2 en α du CH2) ; –81,4 (m, 3F, CF3) ;
- • analyse élémentaire du C15H13F17O (532,24): % calculé C 33,85 ; H 2,64 ; F 60,68 ; % exp. C 32,74 ; H 2,44 ; F 59,98.
Remerciements
Les auteurs remercient Dr Gianluca Pozzi (collaboration dans le cadre du réseau européen RTN « Fluorous Phase ») pour le don gracieux des bipyridines Bipy 2 et 3 (CNR-Istituto di Scienze e Tecnologie Molecolari, Milan, Italie).



