1 Introduction
Le 5-fluoro-uracile (5-FU) est un produit antitumoral très utilisé dans le traitement de plusieurs types de cancer et plus particulièrement de ceux qui siègent dans le tube digestif, tels que les cancers du colon et du rectum [1,2].
Des variations intra- et interindividuelles dans la capacité métabolique du 5-FU sont observées. Afin de prévenir les effets toxiques du 5-fluoro-uracile et d'optimiser son efficacité thérapeutique, la détermination des paramètres pharmacocinétiques chez les sujets traités est le plus souvent nécessaire. Elle permet, en effet, compte tenu du polymorphisme métabolique observé, d'adapter la posologie du médicament. L'accès à ces paramètres pharmacocinétiques repose essentiellement sur une quantification précise de la concentration plasmatique du 5-fluoro-uracile pendant le traitement.
Les investigations concernant les principales études pharmacocinétiques menées dans ce cadre, par plusieurs laboratoires à travers le monde font appel pour la plupart, à des méthodes analytiques fondées sur l'extraction liquide–liquide du plasma suivie d'une analyse par chromatographie liquide haute performance [3–6].
Néanmoins, l'extraction liquide–liquide utilisée n'est pas d'une grande spécificité. D'autres produits endogènes sont également extraits et peuvent interférer, au moins partiellement, avec le 5-fluoro-uracile, affectant ainsi la sensibilité et la précision du dosage par cette méthode.
Dans ce travail, nous avons proposé une nouvelle technique permettant de réduire, voire de supprimer sélectivement ces produits interférents.
Il s'agit d'associer à l'extraction liquide–liquide une deuxième extraction par adsorption sur phase solide avant de procéder à une analyse par HPLC.
Cette méthode offre plusieurs avantages. Elle est beaucoup plus sensible dans la mesure où les limites de détection et de quantification du 5-fluoro-uracile sont très abaissées. Elle permet en outre d'augmenter la précision des dosages effectués.
Elle offre ainsi la possibilité d'obtenir une meilleure quantification des paramètres pharmacocinétiques chez les sujets traités par cet antitumoral afin de prévenir ses effets toxiques et d'optimiser son efficacité thérapeutique.
2 Matériels et méthodes
2.1 Appareillage
L'analyse chromatographique est effectuée sur un appareil HPLC de type HP 1050 équipé d'un détecteur UV et d'une colonne de type VYDAC remplie de gel de silice greffée d'octadécyle (C18) de longueur 250 mm et de diamètre intérieur 4,6 mm.
Les colonnes SPE utilisées sont de type silice (Waters).
2.2 Réactifs
Eau ultra-pure (Chromanorm), isopropanol à 99,7 % (Chromanorm), acétate d'éthyle à 99,8 % (Chromanorm), méthanol (Chromanorm), KH2PO4 à 99,0 % (Sigma), 5-fluoro-uracile (5-FU) (Sigma), 5-Chloro-uracile (5-CU) (Sigma), (NH4)2 SO4.
2.3 Préparation des solutions étalons
Les diverses solutions étalons, utilisées dans ce travail, ont été préparées par dilution des solutions mères dans l'eau ultra-pure :
- • solution mère de 5-FU : 1 mg ml–1 ;
- • solution mère de 5-CU (standard interne) : 1 mg/5 ml.
Nous avons préparé cinq solutions de 5-fluoro-uracile (5-FU) de différentes concentrations, dans une gamme de 2,5 à 100 ng/50 μl (2,5–5–25–50 et 100 ng/50 μl) et une solution standard de 5-chloro-uracile (5-CU) de concentration 125 ng/50 μl.
2.4 Conditions chromatographiques
La séparation par chromatographie liquide haute performance à polarité de phase inversée du 5-fluoro-uracile (5-FU) sur une colonne C18 nécessite une phase mobile de composition 100 % tampon phosphate KH2PO4, 0,05 M avec un pH égal à 3,2.
- • Conditions opératoires.
| Colonne | C18:250 mm × 4,6 mm |
| Température de la colonne | 33 °C |
| Phase mobile | 100 % tampon KH2PO4 0,05 M, pH = 3,2 |
| Longueur d'onde | 268 nm |
| Débit | 0,7 ml min–1 |
| Injection | 20 μl |
2.5 Procédure d'extraction plasmatique de 5-FU
La complexité du milieu plasmatique dans lequel se trouve le 5-FU rend toute analyse immédiate impossible. Il est donc nécessaire de procéder préalablement à une extraction plasmatique du 5-FU avant d'effectuer l'analyse chromatographique.
Les procédés d'extraction plasmatique du 5-FU, décrites au travers des données bibliographiques, utilisent tous une méthode d'extraction liquide–liquide [7–9].
Dans le but d'optimiser la sensibilité et la précision du dosage plasmatique du 5-FU, nous avons mis au point une méthode d'extraction sur phase solide (SPE) [10–12], qui, associée à la technique habituelle d'extraction liquide–liquide, permet d'obtenir de meilleurs résultats.
2.5.1 Extraction liquide–liquide
Dans un tube en polypropylène contenant 1 ml de plasma, on ajoute 50 μl du standard 5-CU (125 ng/50 μl) et 50 μl d'une solution de 5-FU de concentration bien déterminée, puis on agite 5 s au Vortex. L'addition de 600 mg de sulfate d'ammonium (NH4)2SO4, suivie d'une agitation pendant 1 min, permet la précipitation des protéines contenues dans le volume plasmatique [6,7].
Le solvant d'extraction est un mélange formé d'isopropanol et d'acétate d'éthyle (15–85 %). Dans ces conditions, le rendement d'extraction obtenu est optimal [6]. Pour cela, 2,5 ml de ce solvant d'extraction sont ajoutés au volume plasmatique. Après une agitation pendant 2 min au Vortex, l'échantillon est centrifugé à 6000 tr min–1 pendant 15 min.
2 ml de la phase organique (supérieure) sont alors collectés dans un tube en polypropylène. On prélève 0,5 ml de cette phase organique collectée, qu'on évapore à sec à 60 °C. Le résidu obtenu est repris par 50 μl de la phase mobile (tampon phosphate, pH = 3,2). 20 μl de ce volume récupéré sont alors injectés dans la colonne séparative.
2.5.2 Extraction liquide–solide
L'extraction liquide–liquide décrite précédemment est une méthode sans spécificité totale. Plusieurs autres produits plasmatiques passent, en effet, dans la phase organique utilisée. De tels produits pourraient interférer, au moins partiellement, lors des analyses chromatographiques avec la substance à doser et le standard interne, affectant ainsi la sensibilité et également la précision de la méthode de dosage du 5-fluoro-uracile.
Dans ce cadre, nous avons développé une nouvelle méthode d'extraction, offrant l'avantage de remédier aux inconvénients de la méthode d'extraction liquide–liquide. Il s'agit d'associer à celle-ci une deuxième extraction sur phase solide.
L'extraction liquide–solide (SPE) consiste à faire passer 0,5 ml de la phase organique récupérée lors de l'extraction liquide-liquide sur une cartouche de silice (Waters, type classique), préalablement activée par les passages successifs de 2 ml d'eau et de 2 ml de méthanol.
L'élution de l'échantillon est réalisée à l'aide de 1 ml de méthanol, en maintenant un débit faible, de l'ordre de 1 ml min–1.
Le solvant éluant récupéré est évaporé à sec à 60 °C. Le résidu obtenu est repris dans 50 μl de la phase mobile, afin de subir l'analyse chromatographique.
3 Résultats et discussions
3.1 Analyses chromatographiques du plasma
En comparant les deux chromatogrammes représentés sur la Fig. 1, relatif à un témoin contenant le 5-chloro-uracile comme standard (tr = 8,35 min) et qui a subi une extraction liquide–liquide (Fig. 1a) et une extraction liquide–solide (Fig. 1b), nous constatons que les produits interférents élués avant et avec le 5-fluoro-uracile (tr = 5,56 min) sont pratiquement éliminés lorsque l'extraction sur phase solide est utilisée. Cela permet donc d'améliorer la détection et la précision du dosage, d'autant plus que le produit interférent avec le 5-CU est également éliminé.
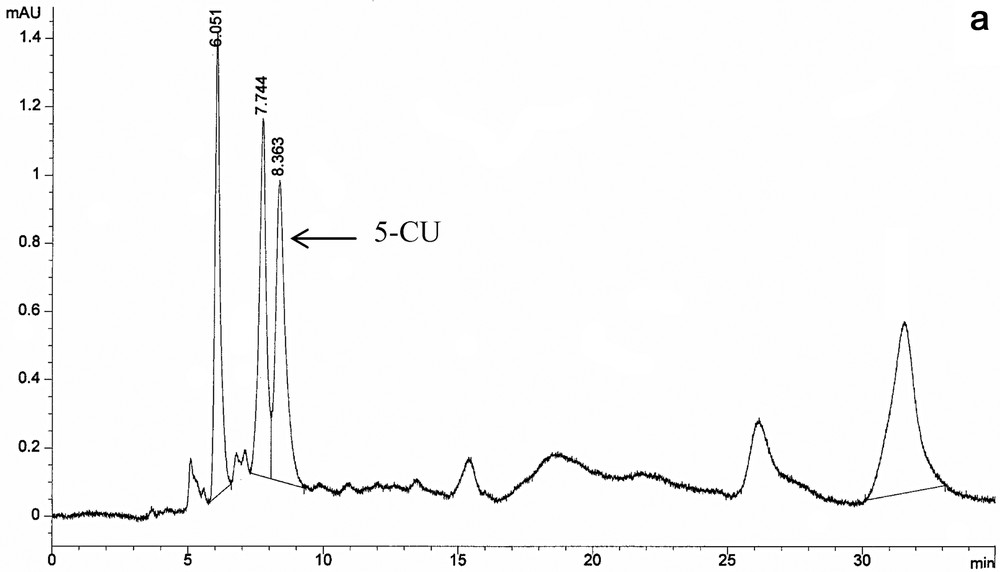
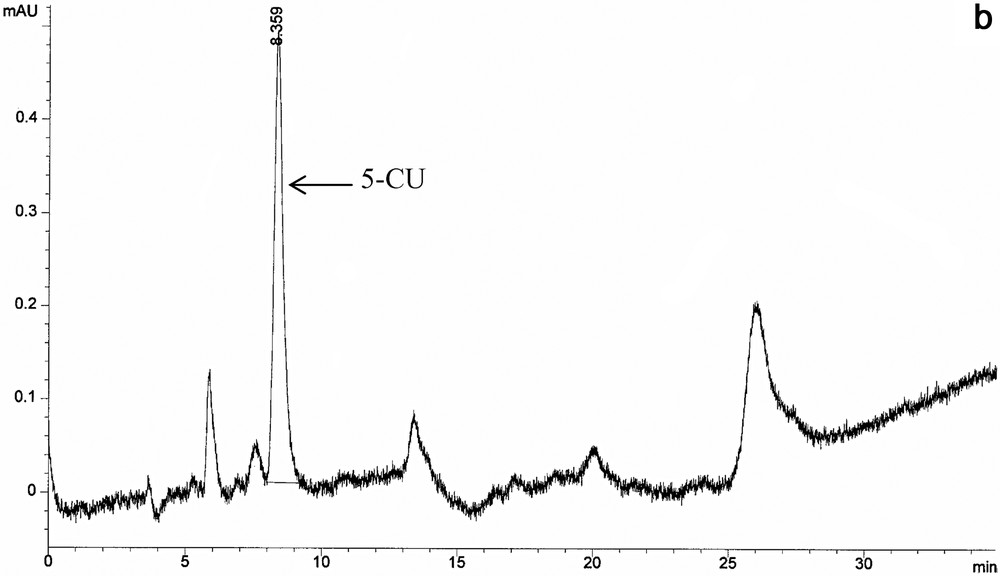
(a) Chromatogramme d'un témoin de 0,5 ml d'extrait évaporé et provenant de 2 ml d'extrait plasmatique (1 ml de plasma : 125 ng 5-CU) après une extraction liquide–liquide. (tr = 8,36 min) : 5-CU ; (6,05–7,74 et 31,57) : pics provenant du plasma. (b) Chromatogramme d'un témoin de 0,5 ml d'extrait évaporé et provenant de 2 ml d'extrait plasmatique (1ml de plasma : 125 ng 5-CU) après une extraction liquide–solide. (tr = 8,35 min) : 5-CU.
On constate également la disparition ou la diminution d'autres pics, tels que ceux qui apparaissent vers 6,05 et 31,57 min. En particulier, la disparition du pic (tr = 31,57 min) permet de raccourcir le temps d'analyse.
Ces produits endogènes, qui peuvent interférer, au moins partiellement, avec le 5-fluoro-uracile, affectant ainsi la sensibilité et la précision du dosage, sont retenus dans la cartouche de silice ; le 5-FU et le 5-CU sont élués en premier lieu pratiquement seuls.
Les chromatogrammes obtenus après extraction du plasma sur phase solide montrent que la nouvelle technique d'extraction proposée dans ce travail est beaucoup plus sensible, dans la mesure où les limites de détection et de quantification du 5-FU sont très abaissées par rapport aux résultats d'autres chercheurs (la limite de quantification du 5-FU est de 12,5 ng ml–1 pour Zufia et al. [13] et de 40 ng ml–1 pour Maring et al.) [14]. Même avec 2,5 ng, on observe nettement le pic du 5-FU (Fig. 2), ce qui permet la détection de quantités inférieures au nanogramme. Elle nous permet d'avoir donc une bonne séparation chromatographique du 5-FU ainsi qu'une meilleure quantification.


(a) Chromatogramme de 0,5 ml d'extrait évaporé et provenant de 2 ml d'extrait plasmatique (1 ml de plasma : 2,5 ng 5-FU et 125 ng 5-CU) après une extraction liquide–liquide. (tr = 5,56 min) : 5-FU ; (8,36 min) : 5-CU ; (6,05–7,74 et 31,82) : pics provenant du plasma. (b) Chromatogramme de 0,5 ml d'extrait évaporé et provenant de 2 ml d'extrait plasmatique (1 ml de plasma : 2,5 ng 5-FU et 125 ng 5-CU) après une extraction liquide–solide. (tr = 5,56 min) : 5-FU ; (8,38 min) : 5-CU.
3.2 Validation analytique
3.2.1 Linéarité
La courbe de calibration donnant le rapport des aires des pics en fonction du rapport des concentrations est tracée sur une gamme de cinq concentrations de 5-FU allant de 2,5 ng à 100 ng (2,5–5–25–50 et 100 ng ml–1 de plasma).
Le coefficient de corrélation r de la courbe est acceptable. Il est de 0,998.
3.2.2 Précision
Les coefficients de variation, calculés au cours de l'étude, de la répétabilité et la reproductibilité sont bien inférieurs à 5%.
3.2.3 Exactitude
L'écart entre la valeur initiale et la valeur mesurée nous renseigne sur l'exactitude de l'analyse ; cet écart est exprimé en pourcent et il est identifié comme étant le recouvrement Y [15] L'extactitude de la procédure est jugée satisfaisante compte tenu des résultats obtenus (Tableau 1).
Exactitude de l'analyse
| Quantité initiale (ng) | Quantité mesurée (ng) |
|
| 25 | 24 | 96 |
3.2.4 Limite de détection
La concentration du 5-FU donnant un signal égal à trois fois le bruit de fond [16] a été déterminée en réalisant des injections successives de 20 μl d'extrait de 1 ml de plasma contenant du 5-FU de concentration de plus en plus faible. Le seuil de détection ainsi obtenu est inférieur au ng ml–1 de plasma.
4 Conclusion
Dans le cadre de ce travail, nous avons développé une nouvelle méthode de dosage plasmatique du 5-fluoro-uracile fondée sur une double extraction en phase liquide et en phase solide, suivie d'une analyse chromatographique par HPLC.
L'extraction sur phase solide a permis d'éliminer la quasi-totalité des substances endogènes plasmatiques extraits lors de l'extraction liquide-liquide, et plus particulièrement les produits dont les temps de rétention sont très proches de ceux du 5-fluoro-uracile et du standard interne utilisé, le 5-chloro-uracile.
L'absence de pics interférents lors de l'analyse chromatographique de l'extrait plasmatique ainsi obtenu a permis :
- • l'amélioration de la sensibilité de la méthode analytique utilisée, avec une limite de détection inférieure au ng ml–1 de plasma ;
- • l'amélioration de la précision du dosage du 5-fluoro-uracile plasmatique ;
- • de maintenir une linéarité de dosage incluant les faibles concentrations plasmatiques. De ce fait, la limite inférieure de quantification obtenue correspond à 2,5 ng ml–1 de plasma. Ce seuil de quantification est beaucoup plus faible que ceux obtenus par une simple extraction liquide–liquide, dont les valeurs sont situées habituellement entre 20 et 50 ng ml–1.
La méthode de dosage du 5-FU plasmatique développée est donc très sensible et surtout très précise lorsqu'il s'agit de quantifier les concentrations plasmatiques, surtout les plus faibles d'entres elles. L'écart entre la valeur initiale et la valeur mesurée nous renseigne sur l'exactitude de la méthode utilisée (le recouvrement Y obtenu correspond à 96 %).
Elle offre ainsi la possibilité de mener des études biologiques afin d'obtenir une meilleure quantification des paramètres pharmacocinétiques chez les sujets traités par le 5-FU, afin de prévenir ses effets toxiques et d'optimiser son efficacité thérapeutique.


